2.1.2影响化学反应速率的因素(课件)(共35张PPT)高二化学(苏教版2019选择性必修第一册)
文档属性
| 名称 | 2.1.2影响化学反应速率的因素(课件)(共35张PPT)高二化学(苏教版2019选择性必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 17:02:36 | ||
图片预览






文档简介
(共35张PPT)
第一节 化学反应速率
课时2 影响化学反应速率的因素
第二章 化学反应速率与化学平衡
授课人:
学习目标
1.通过实验,从宏观上认识外界因素影响化学反应速率的规律,并能从活化分子的有效碰撞等微观的角度进行分析解释。
2.建立分析探究外界因素影响化学反应速率的思维模型,即“实验现象→影响规律→理论解释”,强化“证据推理”核心素养的认知意识。3.通过定性与定量研究影响化学反应速率的因素,提高设计探究方案、进行实验探究的能力。
课程导入
能否人为控制化学反应速率?
食物为何放入冰箱?
灯泡为何抽成真空?
矿石为何粉碎?
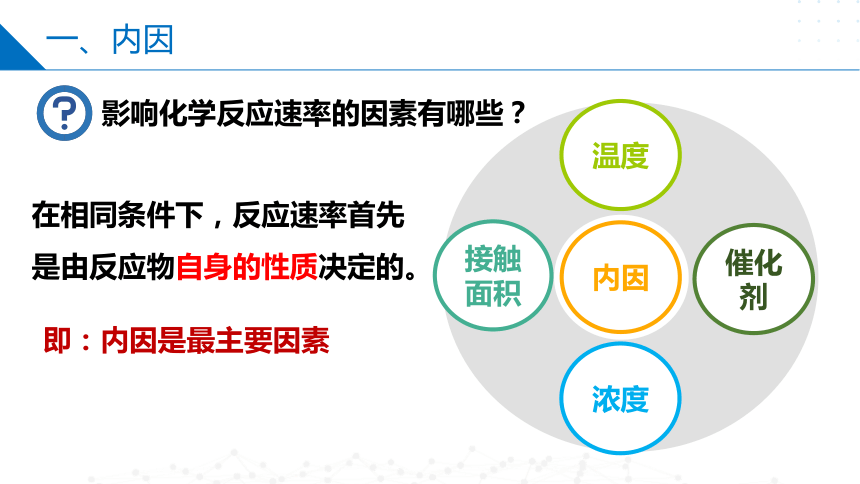
一、内因
接触面积
浓度
内因
催化剂
温度
影响化学反应速率的因素有哪些?
在相同条件下,反应速率首先是由反应物自身的性质决定的。
即:内因是最主要因素
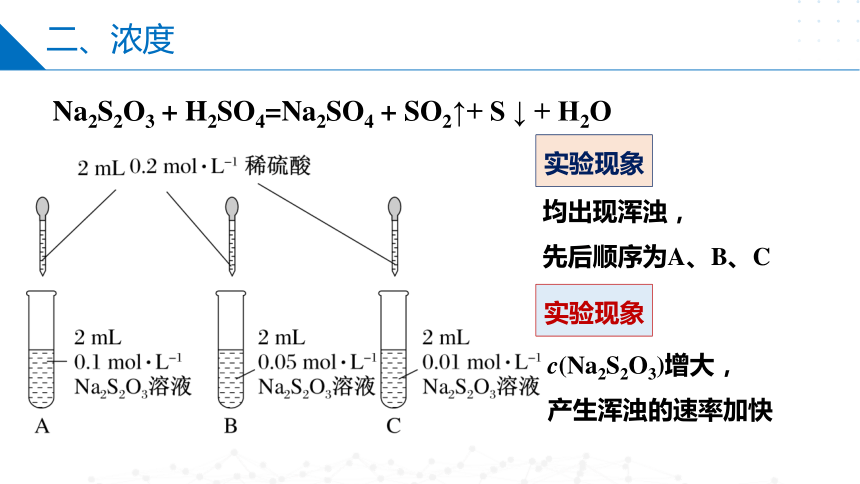
二、浓度
Na2S2O3 + H2SO4=Na2SO4 + SO2↑+ S ↓ + H2O
均出现浑浊,
先后顺序为A、B、C
实验现象
c(Na2S2O3)增大,
产生浑浊的速率加快
实验现象
二、浓度
理论和实验研究表明:
其他条件相同时,增大反应物的浓度,反应速率增大;
减小反应物的浓度,反应速率减小。
浓度对反应速率的影响,微观怎么解释?
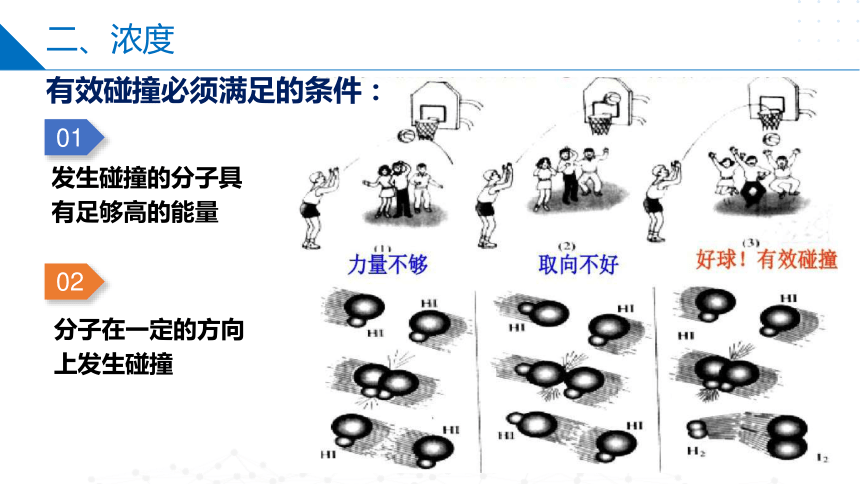
碰撞理论
碰撞理论是一种较直观的反应速率理论。该理论认为,反应物分子间必须相互碰撞才有可能发生反应,反应速率的大小与单位时间内反应物分子间的碰撞次数成正比。但是,不是每次碰撞都能发生反应。
能发生反应的碰撞称为有效碰撞。
二、浓度
01
发生碰撞的分子具有足够高的能量
02
分子在一定的方向上发生碰撞
有效碰撞必须满足的条件:
二、浓度
化学反应中,能量较高、有可能发生有效碰撞的分子
活化分子的平均能量与所有分子的平均能量之差
活化分子
活化能
反应物分子
平均能量
能量
活化分子
E2
反应过程
ΔH
E1
生成物
反应物
O
反应的
活化能
二、浓度
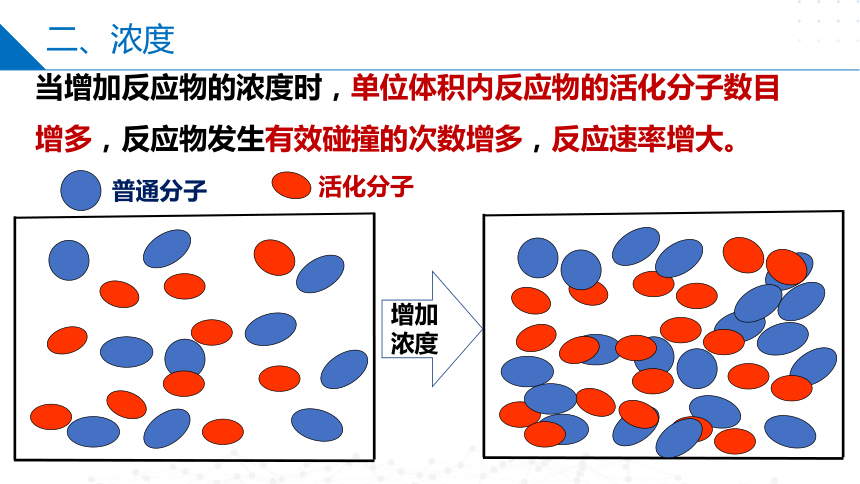
当增加反应物的浓度时,单位体积内反应物的活化分子数目增多,反应物发生有效碰撞的次数增多,反应速率增大。
增加浓度
活化分子
普通分子
二、浓度
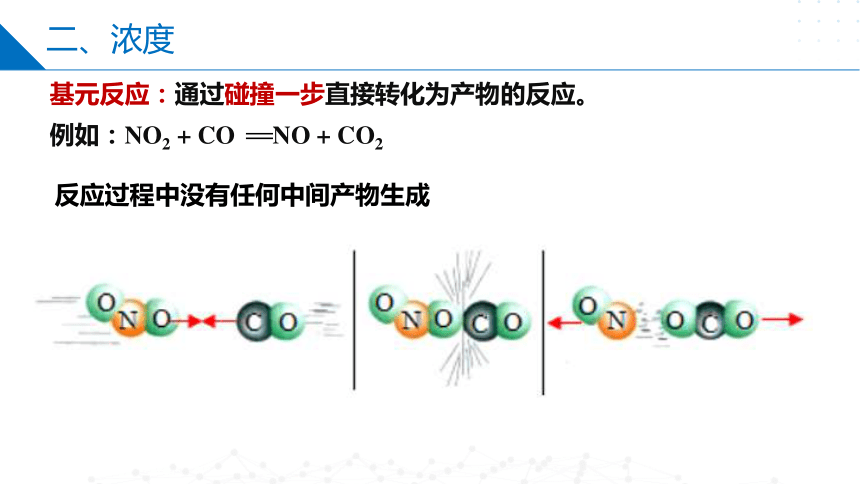
基元反应:通过碰撞一步直接转化为产物的反应。
例如:NO2 + CO NO + CO2
反应过程中没有任何中间产物生成
二、浓度
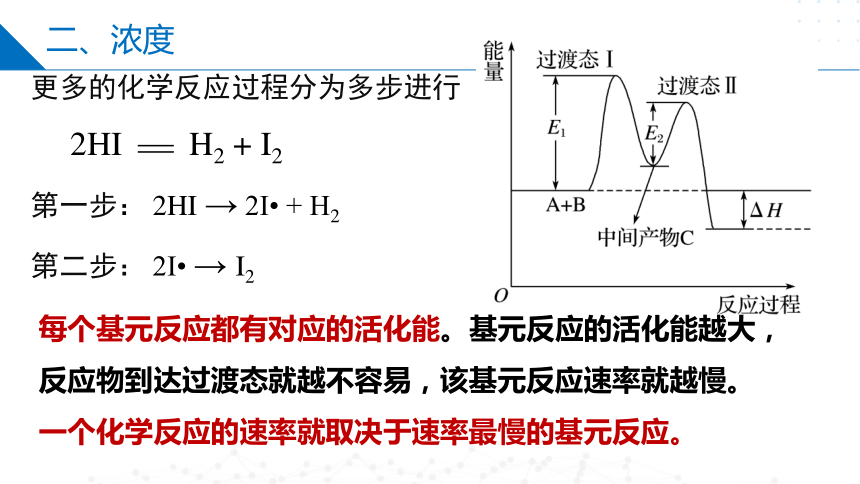
更多的化学反应过程分为多步进行
2HI H2 + I2
第一步: 2HI → 2I + H2
第二步: 2I → I2
每个基元反应都有对应的活化能。基元反应的活化能越大,反应物到达过渡态就越不容易,该基元反应速率就越慢。
一个化学反应的速率就取决于速率最慢的基元反应。
二、浓度
三、压强
压强增大,
体积减小,
反应物浓度增大,
反应速率增大
加压
减压
有气体参加的反应,压强改变,化学反应速率如何变化?
压强减小,
体积增大,
反应物浓度减小,
反应速率减小
反之,反应速率减慢。
增大压强
气体体积缩小
反应物浓度增大
单位体积内活化分子数目增多
单位时间内有效碰撞几率增加
反应速率加快
三、压强
是数目,非百分率
三、压强
(2)压强变化实质为浓度变化,即压强改变 物质浓度改变 反应速率改变。若压强变化,物质浓度不变,反应速率不变。
(1)压强只针对有气体参加或生成的反应;若没有气体参加或生成,压强不影响反应速率。
三、压强
如果容器体积不变,充入惰性气体使压强增大,
化学反应速率如何改变?
思考
容器体积不变,
充入惰性气体,压强增大,
反应物浓度不变,
反应速率不变
压强的改变必须引起浓度的改变,才能影响化学反应速率。
恒容:充入惰性气体―→总压增大―→反应物浓度不变―→反应速率不变。
三、压强
保持容器内气体压强不变,向其中充入稀有气体,
反应速率如何变化?
思考
容器气体压强不变,
充入惰性气体,
容器的体积增大,
反应物浓度减小,
反应速率减小
恒压:充入惰性气体―→体积增大―→反应物浓度减小―→反应速率减小。
四、温度
2KMnO4 + 5H2C2O4 + 3H2SO4=K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
溶液紫红色褪去所需时间长短:
甲>丙>乙
反应物的温度越高,反应速率越快
科学研究表明,对于许多反应而言,一般温度每升高10 K,其反应速率可增加2~4倍。在实验室或工业生产中,常采用加热的方法使化学反应在较高的温度下进行,以提高反应速率。
对吸热反应、放热反应都适用,且不受反应物状态的限制。
温度对反应速率的影响规律:
四、温度
其他条件相同时,升高温度→单位体积内活化分子数目增多→单位体积内活化分子百分数增多→单位时间内有效碰撞次数增多→化学反应速率增大。
简单碰撞理论解释温度对化学反应速率的影响
四、温度
四、温度
②对于可逆反应,升高温度,正、逆反应速率都增大,降低温度,正、逆反应速率都减小。
①温度对反应速率的影响适用于任何反应,无论是放热反应还是吸热反应,升高温度,反应速率都增大,降低温度,反应速率都减小。
催化剂对H2O2分解化学反应速率的影响
较高浓度的H2O2在避光条件下的分解速率
2H2O2 2H2O + O2↑
温度 30℃ 50℃
分解速率 每年1% 每年2%
2H2O2 2H2O + O2↑
FeCl3
五、催化剂
过渡态理论:
反应物分子并不只是通过简单的碰撞直接形成产物,而是必须经过一个形成活化络合物的过渡状态,并且达到这个过渡状态需要一定的活化能。
五、催化剂
这与爬山类似,山的最高点便是过渡态。
有催化剂参与的反应,活化能(Ea1)较小,则反应速率较大;
而没有催化剂参与的反应,活化能(Ea2)较大,则反应速率较小。
五、催化剂
当其他条件相同时,使用催化剂,改变反应历程
→活化能降低
→活化分子百分数增多
→单位体积、单位时间内有效碰撞次数增多
→化学反应速率增大
五、催化剂
2、催化剂有选择性,不同的化学反应的催化剂不相同,催化剂具有一定的活化温度。
注意
1、催化剂对可逆反应的正、逆反应的速率影响相同。
催化剂用于汽车尾气的净化
五、催化剂
3、催化剂是改变化学反应速率最有效的手段之一。
据统计,90%以上的化学工业涉及的化学反应都使用催化剂,使用催化剂可以带来巨大的经济效益。
酶的催化作用
酶催化原理示意图
高效的催化活性
高度的选择性
特殊的温度效应
01
02
03
五、催化剂
外界条件对活化分子、活化能的影响
条件变化 活化能 单位体积内 活化分子百分数 单位时间内有效碰撞的次数 化学反应
速率
分子总数 活化分子数 浓度 增大 不变 增多 增多 不变 增多 增大
减小 不变 减少 减少 不变 减少 减小
压强 增大(减小容器容积) 不变 增多 增多 不变 增多 增大
减小(增大容器容积) 不变 减少 减少 不变 减少 减小
条件变化 活化能 单位体积内 活化分子百分数 单位时间内有效碰撞的次数 化学反应速率
分子总数 活化分子数 温度 升高 不变 不变 增多 增大 增多 增大
降低 不变 不变 减少 减小 减少 减小
使用催化剂 减小 不变 增多 增大 增多 增大
外界条件对活化分子、活化能的影响
还有哪些影响化学反应速率的因素?
· 粗锌制氢气
·药物研制中使用特定溶剂
· 次氯酸的分解
光照
原电池
溶剂
电磁波、超声波
·工业生产
六、其他因素
课堂小结
内因
外因
不良反应
决定性因素
浓度
温度
压强
催化剂
随堂练习
1、下列有关说法不正确的是( )
A.加入适宜的催化剂,则活化分子百分数增大
B.升高温度,使反应物分子中活化分子百分数增大
C.对有气体参加的化学反应,增加反应物浓度,使反应物分子中的活化分子百分数增大,化学反应速率加快
D.对有气体参加的化学反应,减小容器体积,使体系压强增大,可使单位体积内活化分子数目增大,化学反应速率加快
C
随堂练习
2、炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化二氧化硫。下列说法正确的是( )
A.每活化一个氧分子吸收0.29 eV的能量
B.水可使氧分子活化反应的活化能降低0.42 eV
C.氧分子的活化是O—O键的断裂与C—O键的生成过程
D.炭黑颗粒不是大气中二氧化硫转化为三氧化硫的催化剂
C
谢谢观看
THANKS
第一节 化学反应速率
课时2 影响化学反应速率的因素
第二章 化学反应速率与化学平衡
授课人:
学习目标
1.通过实验,从宏观上认识外界因素影响化学反应速率的规律,并能从活化分子的有效碰撞等微观的角度进行分析解释。
2.建立分析探究外界因素影响化学反应速率的思维模型,即“实验现象→影响规律→理论解释”,强化“证据推理”核心素养的认知意识。3.通过定性与定量研究影响化学反应速率的因素,提高设计探究方案、进行实验探究的能力。
课程导入
能否人为控制化学反应速率?
食物为何放入冰箱?
灯泡为何抽成真空?
矿石为何粉碎?
一、内因
接触面积
浓度
内因
催化剂
温度
影响化学反应速率的因素有哪些?
在相同条件下,反应速率首先是由反应物自身的性质决定的。
即:内因是最主要因素
二、浓度
Na2S2O3 + H2SO4=Na2SO4 + SO2↑+ S ↓ + H2O
均出现浑浊,
先后顺序为A、B、C
实验现象
c(Na2S2O3)增大,
产生浑浊的速率加快
实验现象
二、浓度
理论和实验研究表明:
其他条件相同时,增大反应物的浓度,反应速率增大;
减小反应物的浓度,反应速率减小。
浓度对反应速率的影响,微观怎么解释?
碰撞理论
碰撞理论是一种较直观的反应速率理论。该理论认为,反应物分子间必须相互碰撞才有可能发生反应,反应速率的大小与单位时间内反应物分子间的碰撞次数成正比。但是,不是每次碰撞都能发生反应。
能发生反应的碰撞称为有效碰撞。
二、浓度
01
发生碰撞的分子具有足够高的能量
02
分子在一定的方向上发生碰撞
有效碰撞必须满足的条件:
二、浓度
化学反应中,能量较高、有可能发生有效碰撞的分子
活化分子的平均能量与所有分子的平均能量之差
活化分子
活化能
反应物分子
平均能量
能量
活化分子
E2
反应过程
ΔH
E1
生成物
反应物
O
反应的
活化能
二、浓度
当增加反应物的浓度时,单位体积内反应物的活化分子数目增多,反应物发生有效碰撞的次数增多,反应速率增大。
增加浓度
活化分子
普通分子
二、浓度
基元反应:通过碰撞一步直接转化为产物的反应。
例如:NO2 + CO NO + CO2
反应过程中没有任何中间产物生成
二、浓度
更多的化学反应过程分为多步进行
2HI H2 + I2
第一步: 2HI → 2I + H2
第二步: 2I → I2
每个基元反应都有对应的活化能。基元反应的活化能越大,反应物到达过渡态就越不容易,该基元反应速率就越慢。
一个化学反应的速率就取决于速率最慢的基元反应。
二、浓度
三、压强
压强增大,
体积减小,
反应物浓度增大,
反应速率增大
加压
减压
有气体参加的反应,压强改变,化学反应速率如何变化?
压强减小,
体积增大,
反应物浓度减小,
反应速率减小
反之,反应速率减慢。
增大压强
气体体积缩小
反应物浓度增大
单位体积内活化分子数目增多
单位时间内有效碰撞几率增加
反应速率加快
三、压强
是数目,非百分率
三、压强
(2)压强变化实质为浓度变化,即压强改变 物质浓度改变 反应速率改变。若压强变化,物质浓度不变,反应速率不变。
(1)压强只针对有气体参加或生成的反应;若没有气体参加或生成,压强不影响反应速率。
三、压强
如果容器体积不变,充入惰性气体使压强增大,
化学反应速率如何改变?
思考
容器体积不变,
充入惰性气体,压强增大,
反应物浓度不变,
反应速率不变
压强的改变必须引起浓度的改变,才能影响化学反应速率。
恒容:充入惰性气体―→总压增大―→反应物浓度不变―→反应速率不变。
三、压强
保持容器内气体压强不变,向其中充入稀有气体,
反应速率如何变化?
思考
容器气体压强不变,
充入惰性气体,
容器的体积增大,
反应物浓度减小,
反应速率减小
恒压:充入惰性气体―→体积增大―→反应物浓度减小―→反应速率减小。
四、温度
2KMnO4 + 5H2C2O4 + 3H2SO4=K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
溶液紫红色褪去所需时间长短:
甲>丙>乙
反应物的温度越高,反应速率越快
科学研究表明,对于许多反应而言,一般温度每升高10 K,其反应速率可增加2~4倍。在实验室或工业生产中,常采用加热的方法使化学反应在较高的温度下进行,以提高反应速率。
对吸热反应、放热反应都适用,且不受反应物状态的限制。
温度对反应速率的影响规律:
四、温度
其他条件相同时,升高温度→单位体积内活化分子数目增多→单位体积内活化分子百分数增多→单位时间内有效碰撞次数增多→化学反应速率增大。
简单碰撞理论解释温度对化学反应速率的影响
四、温度
四、温度
②对于可逆反应,升高温度,正、逆反应速率都增大,降低温度,正、逆反应速率都减小。
①温度对反应速率的影响适用于任何反应,无论是放热反应还是吸热反应,升高温度,反应速率都增大,降低温度,反应速率都减小。
催化剂对H2O2分解化学反应速率的影响
较高浓度的H2O2在避光条件下的分解速率
2H2O2 2H2O + O2↑
温度 30℃ 50℃
分解速率 每年1% 每年2%
2H2O2 2H2O + O2↑
FeCl3
五、催化剂
过渡态理论:
反应物分子并不只是通过简单的碰撞直接形成产物,而是必须经过一个形成活化络合物的过渡状态,并且达到这个过渡状态需要一定的活化能。
五、催化剂
这与爬山类似,山的最高点便是过渡态。
有催化剂参与的反应,活化能(Ea1)较小,则反应速率较大;
而没有催化剂参与的反应,活化能(Ea2)较大,则反应速率较小。
五、催化剂
当其他条件相同时,使用催化剂,改变反应历程
→活化能降低
→活化分子百分数增多
→单位体积、单位时间内有效碰撞次数增多
→化学反应速率增大
五、催化剂
2、催化剂有选择性,不同的化学反应的催化剂不相同,催化剂具有一定的活化温度。
注意
1、催化剂对可逆反应的正、逆反应的速率影响相同。
催化剂用于汽车尾气的净化
五、催化剂
3、催化剂是改变化学反应速率最有效的手段之一。
据统计,90%以上的化学工业涉及的化学反应都使用催化剂,使用催化剂可以带来巨大的经济效益。
酶的催化作用
酶催化原理示意图
高效的催化活性
高度的选择性
特殊的温度效应
01
02
03
五、催化剂
外界条件对活化分子、活化能的影响
条件变化 活化能 单位体积内 活化分子百分数 单位时间内有效碰撞的次数 化学反应
速率
分子总数 活化分子数 浓度 增大 不变 增多 增多 不变 增多 增大
减小 不变 减少 减少 不变 减少 减小
压强 增大(减小容器容积) 不变 增多 增多 不变 增多 增大
减小(增大容器容积) 不变 减少 减少 不变 减少 减小
条件变化 活化能 单位体积内 活化分子百分数 单位时间内有效碰撞的次数 化学反应速率
分子总数 活化分子数 温度 升高 不变 不变 增多 增大 增多 增大
降低 不变 不变 减少 减小 减少 减小
使用催化剂 减小 不变 增多 增大 增多 增大
外界条件对活化分子、活化能的影响
还有哪些影响化学反应速率的因素?
· 粗锌制氢气
·药物研制中使用特定溶剂
· 次氯酸的分解
光照
原电池
溶剂
电磁波、超声波
·工业生产
六、其他因素
课堂小结
内因
外因
不良反应
决定性因素
浓度
温度
压强
催化剂
随堂练习
1、下列有关说法不正确的是( )
A.加入适宜的催化剂,则活化分子百分数增大
B.升高温度,使反应物分子中活化分子百分数增大
C.对有气体参加的化学反应,增加反应物浓度,使反应物分子中的活化分子百分数增大,化学反应速率加快
D.对有气体参加的化学反应,减小容器体积,使体系压强增大,可使单位体积内活化分子数目增大,化学反应速率加快
C
随堂练习
2、炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化二氧化硫。下列说法正确的是( )
A.每活化一个氧分子吸收0.29 eV的能量
B.水可使氧分子活化反应的活化能降低0.42 eV
C.氧分子的活化是O—O键的断裂与C—O键的生成过程
D.炭黑颗粒不是大气中二氧化硫转化为三氧化硫的催化剂
C
谢谢观看
THANKS
