陕西省西安市长安区2023-2024学年高一上学期期中考试化学试题(含答案)
文档属性
| 名称 | 陕西省西安市长安区2023-2024学年高一上学期期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 999.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 21:41:56 | ||
图片预览


文档简介
西安市长安区2023-2024学年高一上学期期中考试
化学试题
总分:100分 时间:75分钟
Ⅰ卷 客观题(50分)
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5 Fe:56 Cu:64
一、单项选择题(共10小题,3分/题,共30分。每小题只有一项是符合题目要求的)
1.下列分析描述错误的是( )
A.、互为同素异形体
B.按照酸的定义,在水溶液中可以电离出,故其属于酸
C.意大利科学家阿伏伽德罗、英国科学家道尔顿分别创立分子、原子学说
D.明代李时珍的《本草纲目》、宋应星的《天工开物》等著作中蕴含着丰富的化学知识
2.下列分析描述正确的是( )
A.盐酸能导电,故盐酸属于电解质
B.溶液、胶体的本质区别是胶体可以发生丁达尔效应而溶液不能
C.纯硫酸不电离,但其溶于水形成水溶液时,可以电离出离子而导电
D.难溶于水,其水溶液几乎不导电,和相似,为弱电解质
3.下列离子组,在给定浓度溶液中能大量共存的是( )
A.溶液中:、、、
B.溶液中:、、、
C.溶液:、、、
D.溶液中:、、、
4.下列反应的离子方程式书写错误的是( )
A.与稀硝酸反应:
B.酸性介质中氧化:
C.碱性溶液与反应:
D.向溶液加过量氢氧化钠溶液:
5.科学家指出,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的价砷类物质在维生素C的作用下,能够转化为有毒的价砷类化合物。下列有关说法中,错误是( )
A.维生素C具有还原性 B.上述过程中砷元素发生还原反应
C.上述过程中价砷类物质为氧化剂 D.上述过程中价砷类化合物是氧化产物
6.某温度下,将氯气通入溶液中,反应后得到、、的混合溶液。由资料知道,一定温度下和溶液,能发生反应:,。经测定反应后溶液中与数目之比为1:2,则与溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为( )
A.1:3 B.4:1 C.3:11 D.11:3
7.下列关于和两种物质有关性质,说法错误的是( )
A.向和溶液中,滴入酚酞后溶液均变红
B.固体中含有少量,可用加热的方法除去
C.向等质量的和固体中分别加入足量稀盐酸,产生的气体较多
D.分别向盛有少量和固体的试管中滴加少量水,完全溶解后用温度计测量,溶液温度高于溶液
8.探究是培养创新精神和实践能力的手段。用如下装置制备并探究氯气的性质,图中3支试管口均放置浸有溶液的棉花。下列对实验现象的分析错误的是( )
A.①中淀粉试纸变蓝,说明氯气的氧化性强于碘
B.②中产生白色沉淀,说明氯气与水反应生成
C.③中的溶液变为棕黄色,说明氯气有氧化性
D.④中的溶液先变红后褪色,说明氯水有酸性和漂白性
9.为阿伏加德罗常数,下列说法错误的是( )
A.7.8g中所含阴阳离子总数为
B.1.4g与的混合气体中,含氢原子数为
C.100g质量分数为46%的乙醇()水溶液中,含有O原子数为
D.2.3g Na与足量完全反应生成和混合物,转移电子数为
10.现有甲烷(),测得分子中共含有氢原子个数为b,则阿伏加德罗常数的数值可表示为( )
A. B. C. D.
二、单项选择题(共5小题,4分/题,共20分。每小题只有一项是符合题目要求的)
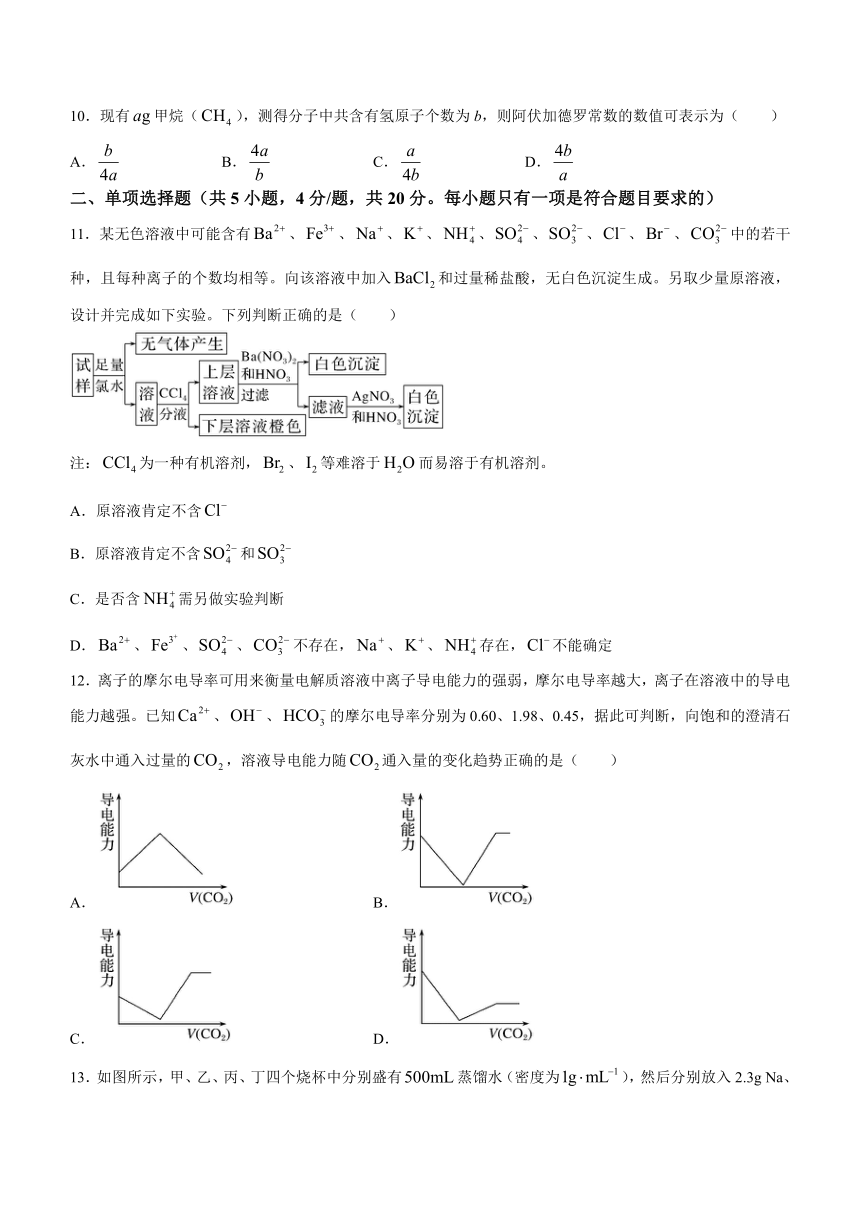
11.某无色溶液中可能含有、、、、、、、、、中的若干种,且每种离子的个数均相等。向该溶液中加入和过量稀盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
注:为一种有机溶剂,、等难溶于而易溶于有机溶剂。
A.原溶液肯定不含
B.原溶液肯定不含和
C.是否含需另做实验判断
D.、、、不存在,、、存在,不能确定
12.离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知、、的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的,溶液导电能力随通入量的变化趋势正确的是( )
A. B.
C. D.
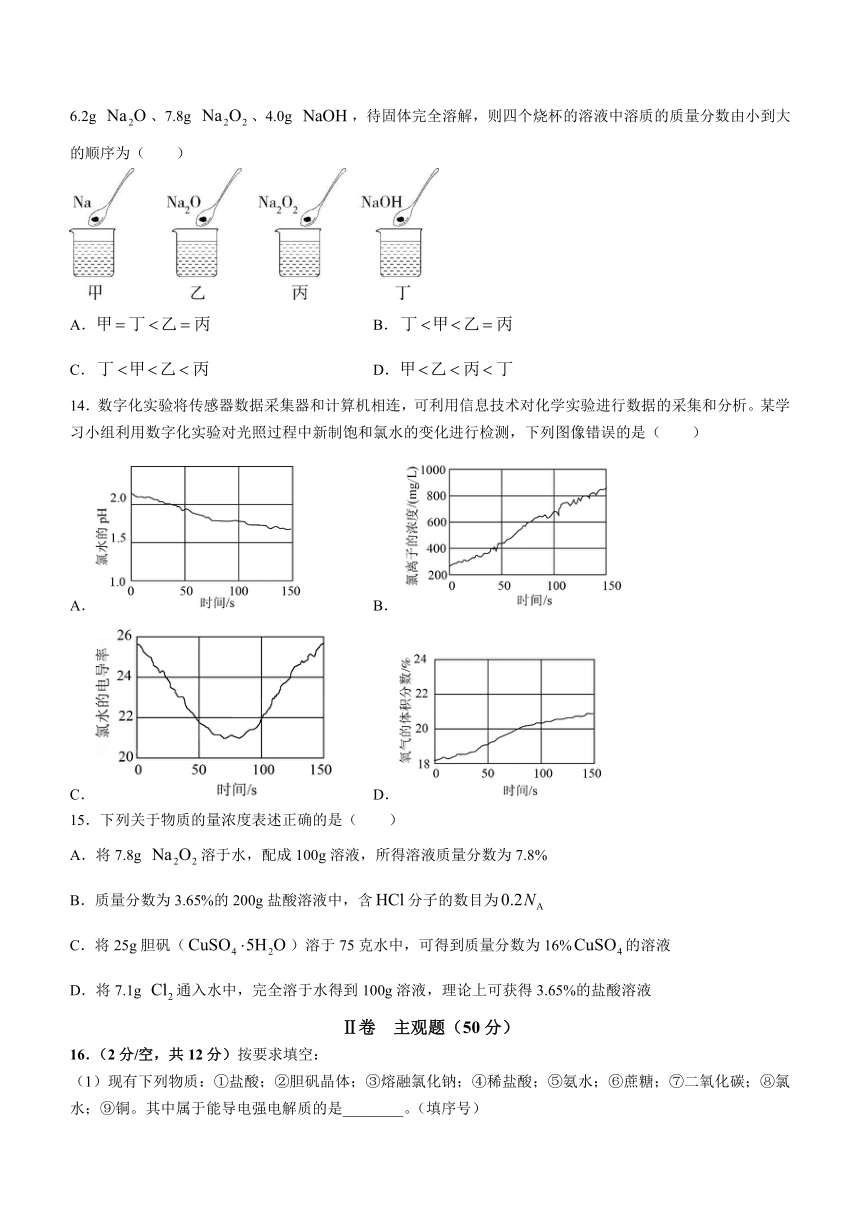
13.如图所示,甲、乙、丙、丁四个烧杯中分别盛有蒸馏水(密度为),然后分别放入2.3g Na、6.2g 、7.8g 、4.0g ,待固体完全溶解,则四个烧杯的溶液中溶质的质量分数由小到大的顺序为( )
A. B.
C. D.
14.数字化实验将传感器数据采集器和计算机相连,可利用信息技术对化学实验进行数据的采集和分析。某学习小组利用数字化实验对光照过程中新制饱和氯水的变化进行检测,下列图像错误的是( )
A. B.
C. D.
15.下列关于物质的量浓度表述正确的是( )
A.将7.8g 溶于水,配成100g溶液,所得溶液质量分数为7.8%
B.质量分数为3.65%的200g盐酸溶液中,含分子的数目为
C.将25g胆矾()溶于75克水中,可得到质量分数为16%的溶液
D.将7.1g 通入水中,完全溶于水得到100g溶液,理论上可获得3.65%的盐酸溶液
Ⅱ卷 主观题(50分)
16.(2分/空,共12分)按要求填空:
(1)现有下列物质:①盐酸;②胆矾晶体;③熔融氯化钠;④稀盐酸;⑤氨水;⑥蔗糖;⑦二氧化碳;⑧氯水;⑨铜。其中属于能导电强电解质的是________。(填序号)
(2)已知在太阳光作用下,植物体内的叶绿素能将水、转化为葡萄糖。如图为海水吸收并进行碳循环的原理示意图。其中“钙化”过程中发生的化学反应方程式为:
①_________________________________;②_________________________________。
(3)硫化氢()是一种有毒、有害的不良气体。处理某废气中的,是将废气与空气混合通入、、的混合液中,其转化的流程如图所示。
其中过程Ⅲ中发生反应的离子方程式为______________________________________。
(4)某课外活动小组设计了如图所示装置,验证与反应时需要与水接触。
其中②中试剂为__________,⑤中发生的主要反应化学方程式为_______________。
17.(2分/空,共12分)
含氯化合物在生产生活中具有重要用途,不同价态的含氯化合物在适当条件下可以相互转化。回答下列问题:
(1)氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(、和)等。
①氯胺作饮用水消毒剂是因为其与水反应生成了具有强烈杀菌作用的物质A。该物质(A)属于________(填“强酸”或“弱酸”);其中二氯胺与水反应的化学方程式为_________________________________________。
②将通入足量溶液中,被氧化为,则反应中转移电子的数目为________。
(2)有强氧化性,在强碱性介质中,与反应生成紫红色高铁酸钾()溶液,是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为________。
(3)把溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为________________________________________________。
(4)二氧化氯()气体是高效低毒的消毒剂。的稳定性差,因此常将其制成固体便于运输和贮存,其制备方法:将通入含的溶液中。该反应的化学方程式_________________。
18.(2分/空,共12分)
某化学兴趣小组设计了如图装置,该装置能制取,并进行相关性质实验,且可利用装置G储存多余的氯气。
注:溶解性(1:500)、(1:700)。溶解性比较大的气体,通过玻璃导管直接通入中,容易发生倒吸现象。
(1)A中发生反应的离子方程式为________________________________________。
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①在装置D中能看到的实验现象是__________________________________________________________。
②在装置E的硬质玻璃管内盛有炭粉,发生氧化还原反应,产物为和,则E中发生反应的化学方程式为________________________________________________________________。
③装置F中球形干燥管的作用是________________________________________________________________。
(3)储气瓶b内盛放的试剂是________________________________________________________________。
(4)装置B中被氧化为,反应的离子方程式为_____________________________________。
19.(1分/空,共14分)
Ⅰ.物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图为钠及其化合物的“价-类”二维图,请回答下列问题:
(1)物质①与水反应的离子方程式为________________________________________。
(2)淡黄色固体②与水反应的化学方程式为__________________________________。
(3)从核心元素价态的视角分析:中H元素的化合价为________,在化学反应中,常用作_________________。(填“氧化剂”或“还原剂”)
(4)投入中,发生反应的化学方程式为______________________________。反应若生0.5克,则反应中转移电子数目为________。
Ⅱ.现有一不纯的小苏打样品(含杂质、),为测定的质量分数,设计如图所示的实验装置(夹持仪器未画出)。
说明:碱石灰为、的混合物,常用作干燥剂,也可以吸收气体。
实验步骤如下:
①按图组装好实验装置并检查气密性。
②称取一定质量的样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞、,关闭,缓缓鼓入空气数分钟。
④关闭活塞、,打开,点燃酒精灯加热至不再产生气体。
⑤打开活塞,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
回答下列问题:
(1)仪器E的名称是___________,其中盛放的药品是___________;若无该装置,则会导致测得的的质量分数__________。(填“偏大”“偏小”或“无影响”)
(2)步骤③的目的是_____________________________________________________。
(3)装置B中发生反应的化学方程式为___________________,________________。
(4)若实验中称取样品的质量为50.0g,反应后C、D装置增加的质量分别为12.6g、8.8g,则混合物中的质量分数为________,杂质的质量为________g。
西安市长安区2023-2024学年高一上学期期中考试
(化学参考答案)
一、单项选择题(10小题,3分/题,共30分)
1.B 2.C 3.A 4.A 5.D 6.D 7.C 8.B 9.A 10.D
二、不定项选择题(5小题,4分/题,共20分)
11.A 12.D 13.B 14.C 15.C
三、主观题(共50分)
16.(2分/空,共12分)
(1)③
(2)
(3)
(4)饱和溶液(无“饱和”扣1分) (多写与水的反应,不扣分)
17.(2分/空,共12分)
(1)①弱酸 (写成不扣分)
②0.06
(2)2:3
(3)
(4)
18.(2分/空,共12分)
(1)
(2)①溶液先变红色,后褪色 ② ③防止倒吸
(3)饱和食盐水
(4)
19.(1分/空,共14分)
Ⅰ.(1)
(2)
(3) 还原剂
(4) 0.25
Ⅱ.(1)(球形)干燥管 碱石灰 偏大
(2)除去装置A、B中的水蒸气和二氧化碳(写排出B中空气也给分)
(3)
(4)67.2% 14.3
化学试题
总分:100分 时间:75分钟
Ⅰ卷 客观题(50分)
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5 Fe:56 Cu:64
一、单项选择题(共10小题,3分/题,共30分。每小题只有一项是符合题目要求的)
1.下列分析描述错误的是( )
A.、互为同素异形体
B.按照酸的定义,在水溶液中可以电离出,故其属于酸
C.意大利科学家阿伏伽德罗、英国科学家道尔顿分别创立分子、原子学说
D.明代李时珍的《本草纲目》、宋应星的《天工开物》等著作中蕴含着丰富的化学知识
2.下列分析描述正确的是( )
A.盐酸能导电,故盐酸属于电解质
B.溶液、胶体的本质区别是胶体可以发生丁达尔效应而溶液不能
C.纯硫酸不电离,但其溶于水形成水溶液时,可以电离出离子而导电
D.难溶于水,其水溶液几乎不导电,和相似,为弱电解质
3.下列离子组,在给定浓度溶液中能大量共存的是( )
A.溶液中:、、、
B.溶液中:、、、
C.溶液:、、、
D.溶液中:、、、
4.下列反应的离子方程式书写错误的是( )
A.与稀硝酸反应:
B.酸性介质中氧化:
C.碱性溶液与反应:
D.向溶液加过量氢氧化钠溶液:
5.科学家指出,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的价砷类物质在维生素C的作用下,能够转化为有毒的价砷类化合物。下列有关说法中,错误是( )
A.维生素C具有还原性 B.上述过程中砷元素发生还原反应
C.上述过程中价砷类物质为氧化剂 D.上述过程中价砷类化合物是氧化产物
6.某温度下,将氯气通入溶液中,反应后得到、、的混合溶液。由资料知道,一定温度下和溶液,能发生反应:,。经测定反应后溶液中与数目之比为1:2,则与溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为( )
A.1:3 B.4:1 C.3:11 D.11:3
7.下列关于和两种物质有关性质,说法错误的是( )
A.向和溶液中,滴入酚酞后溶液均变红
B.固体中含有少量,可用加热的方法除去
C.向等质量的和固体中分别加入足量稀盐酸,产生的气体较多
D.分别向盛有少量和固体的试管中滴加少量水,完全溶解后用温度计测量,溶液温度高于溶液
8.探究是培养创新精神和实践能力的手段。用如下装置制备并探究氯气的性质,图中3支试管口均放置浸有溶液的棉花。下列对实验现象的分析错误的是( )
A.①中淀粉试纸变蓝,说明氯气的氧化性强于碘
B.②中产生白色沉淀,说明氯气与水反应生成
C.③中的溶液变为棕黄色,说明氯气有氧化性
D.④中的溶液先变红后褪色,说明氯水有酸性和漂白性
9.为阿伏加德罗常数,下列说法错误的是( )
A.7.8g中所含阴阳离子总数为
B.1.4g与的混合气体中,含氢原子数为
C.100g质量分数为46%的乙醇()水溶液中,含有O原子数为
D.2.3g Na与足量完全反应生成和混合物,转移电子数为
10.现有甲烷(),测得分子中共含有氢原子个数为b,则阿伏加德罗常数的数值可表示为( )
A. B. C. D.
二、单项选择题(共5小题,4分/题,共20分。每小题只有一项是符合题目要求的)
11.某无色溶液中可能含有、、、、、、、、、中的若干种,且每种离子的个数均相等。向该溶液中加入和过量稀盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
注:为一种有机溶剂,、等难溶于而易溶于有机溶剂。
A.原溶液肯定不含
B.原溶液肯定不含和
C.是否含需另做实验判断
D.、、、不存在,、、存在,不能确定
12.离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知、、的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的,溶液导电能力随通入量的变化趋势正确的是( )
A. B.
C. D.
13.如图所示,甲、乙、丙、丁四个烧杯中分别盛有蒸馏水(密度为),然后分别放入2.3g Na、6.2g 、7.8g 、4.0g ,待固体完全溶解,则四个烧杯的溶液中溶质的质量分数由小到大的顺序为( )
A. B.
C. D.
14.数字化实验将传感器数据采集器和计算机相连,可利用信息技术对化学实验进行数据的采集和分析。某学习小组利用数字化实验对光照过程中新制饱和氯水的变化进行检测,下列图像错误的是( )
A. B.
C. D.
15.下列关于物质的量浓度表述正确的是( )
A.将7.8g 溶于水,配成100g溶液,所得溶液质量分数为7.8%
B.质量分数为3.65%的200g盐酸溶液中,含分子的数目为
C.将25g胆矾()溶于75克水中,可得到质量分数为16%的溶液
D.将7.1g 通入水中,完全溶于水得到100g溶液,理论上可获得3.65%的盐酸溶液
Ⅱ卷 主观题(50分)
16.(2分/空,共12分)按要求填空:
(1)现有下列物质:①盐酸;②胆矾晶体;③熔融氯化钠;④稀盐酸;⑤氨水;⑥蔗糖;⑦二氧化碳;⑧氯水;⑨铜。其中属于能导电强电解质的是________。(填序号)
(2)已知在太阳光作用下,植物体内的叶绿素能将水、转化为葡萄糖。如图为海水吸收并进行碳循环的原理示意图。其中“钙化”过程中发生的化学反应方程式为:
①_________________________________;②_________________________________。
(3)硫化氢()是一种有毒、有害的不良气体。处理某废气中的,是将废气与空气混合通入、、的混合液中,其转化的流程如图所示。
其中过程Ⅲ中发生反应的离子方程式为______________________________________。
(4)某课外活动小组设计了如图所示装置,验证与反应时需要与水接触。
其中②中试剂为__________,⑤中发生的主要反应化学方程式为_______________。
17.(2分/空,共12分)
含氯化合物在生产生活中具有重要用途,不同价态的含氯化合物在适当条件下可以相互转化。回答下列问题:
(1)氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(、和)等。
①氯胺作饮用水消毒剂是因为其与水反应生成了具有强烈杀菌作用的物质A。该物质(A)属于________(填“强酸”或“弱酸”);其中二氯胺与水反应的化学方程式为_________________________________________。
②将通入足量溶液中,被氧化为,则反应中转移电子的数目为________。
(2)有强氧化性,在强碱性介质中,与反应生成紫红色高铁酸钾()溶液,是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为________。
(3)把溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为________________________________________________。
(4)二氧化氯()气体是高效低毒的消毒剂。的稳定性差,因此常将其制成固体便于运输和贮存,其制备方法:将通入含的溶液中。该反应的化学方程式_________________。
18.(2分/空,共12分)
某化学兴趣小组设计了如图装置,该装置能制取,并进行相关性质实验,且可利用装置G储存多余的氯气。
注:溶解性(1:500)、(1:700)。溶解性比较大的气体,通过玻璃导管直接通入中,容易发生倒吸现象。
(1)A中发生反应的离子方程式为________________________________________。
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①在装置D中能看到的实验现象是__________________________________________________________。
②在装置E的硬质玻璃管内盛有炭粉,发生氧化还原反应,产物为和,则E中发生反应的化学方程式为________________________________________________________________。
③装置F中球形干燥管的作用是________________________________________________________________。
(3)储气瓶b内盛放的试剂是________________________________________________________________。
(4)装置B中被氧化为,反应的离子方程式为_____________________________________。
19.(1分/空,共14分)
Ⅰ.物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图为钠及其化合物的“价-类”二维图,请回答下列问题:
(1)物质①与水反应的离子方程式为________________________________________。
(2)淡黄色固体②与水反应的化学方程式为__________________________________。
(3)从核心元素价态的视角分析:中H元素的化合价为________,在化学反应中,常用作_________________。(填“氧化剂”或“还原剂”)
(4)投入中,发生反应的化学方程式为______________________________。反应若生0.5克,则反应中转移电子数目为________。
Ⅱ.现有一不纯的小苏打样品(含杂质、),为测定的质量分数,设计如图所示的实验装置(夹持仪器未画出)。
说明:碱石灰为、的混合物,常用作干燥剂,也可以吸收气体。
实验步骤如下:
①按图组装好实验装置并检查气密性。
②称取一定质量的样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞、,关闭,缓缓鼓入空气数分钟。
④关闭活塞、,打开,点燃酒精灯加热至不再产生气体。
⑤打开活塞,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
回答下列问题:
(1)仪器E的名称是___________,其中盛放的药品是___________;若无该装置,则会导致测得的的质量分数__________。(填“偏大”“偏小”或“无影响”)
(2)步骤③的目的是_____________________________________________________。
(3)装置B中发生反应的化学方程式为___________________,________________。
(4)若实验中称取样品的质量为50.0g,反应后C、D装置增加的质量分别为12.6g、8.8g,则混合物中的质量分数为________,杂质的质量为________g。
西安市长安区2023-2024学年高一上学期期中考试
(化学参考答案)
一、单项选择题(10小题,3分/题,共30分)
1.B 2.C 3.A 4.A 5.D 6.D 7.C 8.B 9.A 10.D
二、不定项选择题(5小题,4分/题,共20分)
11.A 12.D 13.B 14.C 15.C
三、主观题(共50分)
16.(2分/空,共12分)
(1)③
(2)
(3)
(4)饱和溶液(无“饱和”扣1分) (多写与水的反应,不扣分)
17.(2分/空,共12分)
(1)①弱酸 (写成不扣分)
②0.06
(2)2:3
(3)
(4)
18.(2分/空,共12分)
(1)
(2)①溶液先变红色,后褪色 ② ③防止倒吸
(3)饱和食盐水
(4)
19.(1分/空,共14分)
Ⅰ.(1)
(2)
(3) 还原剂
(4) 0.25
Ⅱ.(1)(球形)干燥管 碱石灰 偏大
(2)除去装置A、B中的水蒸气和二氧化碳(写排出B中空气也给分)
(3)
(4)67.2% 14.3
同课章节目录
