专题1 物质的分类及计量 单元检测题(含解析) 2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题1 物质的分类及计量 单元检测题(含解析) 2023-2024学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 306.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 22:24:41 | ||
图片预览




文档简介
专题1《物质的分类及计量》单元检测题
一、单选题(共20题)
1.央视曝光,少数不法厂家向液化石油气中掺入了会对液化气罐的配件造成腐蚀的二甲醚(C2H6O),下列关于二甲醚的说法错误的是
A.属于氧化物
B.每个分子中含有9个原子
C.碳、氢、氧元素的质量比为12:3:8
D.二甲醚分子由碳原子、氢原子和氧原子构成
2.下列物质组,按强电解质、弱电解质、非电解质的顺序排列的是
A.硫酸氢钠、NH3、乙醇 B.硫酸铵、碳酸、SO2
C.氯酸钾、醋酸、铜 D.烧碱、纯碱、熟石灰
3.设NA表示阿伏加 德罗常数的值,下列说法中正确的是( )
A.46 gC2H5OH含共价键数目为9NA
B.0.1 mol FeCl3·6H2O加入沸水中完全反应生成胶体的粒子数为0.1NA
C.100mL18mol·L-1浓硫酸与足量Cu粉加热反应,产生SO2分子数为0.9NA
D.反应中,生成3mol氯气时转移5NA个电子
4.金属钠的摩尔质量为
A.23 B.23g C.23mol D.23g/mol
5.反应2SO2+O22SO3属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
6.下列说法正确的是 ( )
A.H2O和H2O2组成元素相同,所以二者为同素异形体
B.在水溶液中能电离出H+的化合物叫做酸
C.O2转化为O3的过程为物理变化
D.CuSO4属于纯净物、化合物、盐、强电解质
7.下列叙述正确的是
A.能电离出氢离子的化合物叫做酸 B.能电离出氢氧根离子的化合物叫做碱
C.能电离出酸根离子的化合物叫做盐 D.由金属离子和酸根离子组成的化合物属于盐
8.已知1.6g某气体所含分子数目约为3.01×1022,此气体摩尔质量为( )
A.32g B.32g·mol-1 C.64mol D.64g·mol-1
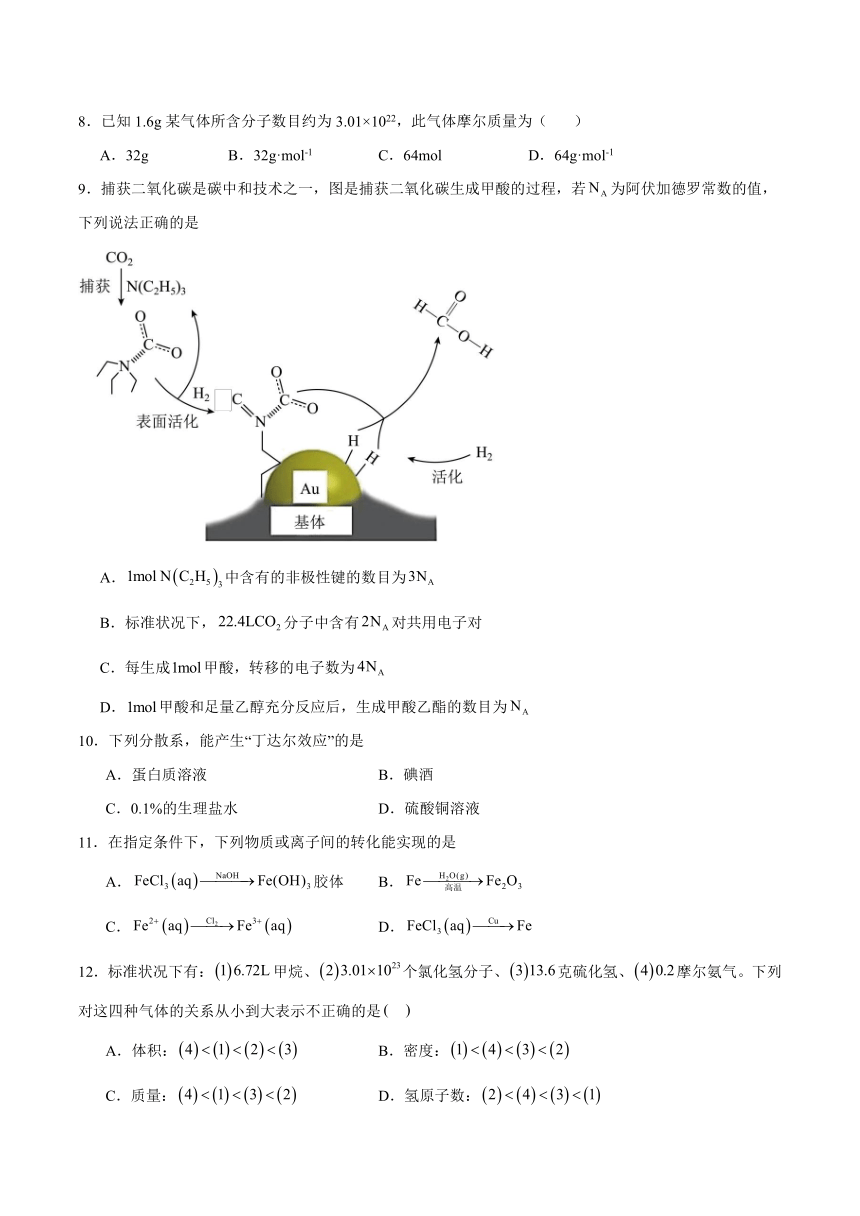
9.捕获二氧化碳是碳中和技术之一,图是捕获二氧化碳生成甲酸的过程,若为阿伏加德罗常数的值,下列说法正确的是
A.中含有的非极性键的数目为
B.标准状况下,分子中含有对共用电子对
C.每生成甲酸,转移的电子数为
D.甲酸和足量乙醇充分反应后,生成甲酸乙酯的数目为
10.下列分散系,能产生“丁达尔效应”的是
A.蛋白质溶液 B.碘酒
C.0.1%的生理盐水 D.硫酸铜溶液
11.在指定条件下,下列物质或离子间的转化能实现的是
A.胶体 B.
C. D.
12.标准状况下有:甲烷、个氯化氢分子、克硫化氢、摩尔氨气。下列对这四种气体的关系从小到大表示不正确的是
A.体积: B.密度:
C.质量: D.氢原子数:
13.用NA表示阿伏加德罗常数的值。下列说法正确的是
A.1 mol OH-中含有的电子数目为NA
B.标准状况下,11.2 L氢氟酸中含有的HF分子数目为0.5NA
C.8.8 g CO2中含有的共用电子对数目为0.4NA
D.常温常压下,14 g CO和N2的混合气体中,含有的原子数目为NA
14.下列说法中正确的是
A.摩尔质量在数值上等于该物质的相对分子(原子)质量
B.2molH2O的摩尔质量是36g·mol-1
C.CO2的摩尔质量是44g
D.SO的摩尔质量是96g·mol-1
15.设NA表示阿伏加 德罗常数的值,下列叙述中正确的是
A.1.8 g的中含有的电子数为1.1NA
B.0.1 mol/L的MgCl2溶液中,所含Cl-的数目为0.2NA
C.42 g N2中含有的分子数为1.5NA
D.标准状况下,2.24 L四氯化碳(CCl4)中含有的分子数为0.1NA
16.在标准状况下,所占体积最大的是( )
A.18 g H2O B.6.02×1023个氮分子
C.4.48 L HCl D.6 g氢气
17.若NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,1 mol H2O的体积为22.4 L
B.1molNa2SO4中含有Na+数为2NA
C.0.5 mol H2所占体积为11.2 L
D.32g氧气所含原子数目为NA
18.25℃时,在100g质量分数为10%的X溶液中加入5gX(无水盐)后,恰好达到饱和,则25℃时X的溶解度为( )
A.10.0g B.15.0g C.16.7g D.18.8g
19.用NA表示阿伏加德罗常数,下列说法正确的是
A.12g金刚石与石墨所含的碳原子数均为NA
B.1mol HCl气体溶于水,该盐酸中含NA个氯化氢分子
C.4.48L N2含有的原子数为0.4NA
D.标准状况下,2.24L稀有气体所含原子数为0.2 NA
20.设NA为阿伏加德罗常数的值。下列说法正确的是
A.1molCl2完全溶解于水时与水反应转移电子数目为NA
B.1molNaOH中,所具有共价键的数目为2NA
C.14g由N2与CO组成的混合气体含有的原子数目为NA
D.7.8gNa2O2与水充分反应转移的电子数目为0.2NA
二、非选择题(共5题)
21.(1)无机化合物可以根据其组成和性质进行分类:
上图所示的物质分类方法名称是 。
(2)现有以下物质:①NaCl晶体 ②液态SO3③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔融的K2SO4 ⑨纯水。请回答下列问题(用序号):
以上物质中能导电的是 属于电解质的是 属于非电解质的是
22.写出下列有关反应的离子方程式
①Na2CO3溶液与稀硫酸混合: 。
②浓NH4NO3溶液中加入浓NaOH溶液: 。
23.同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为 ,物质的量之比为 ,原子总数之比为 ,质量之比为 ,密度之比为 。
24.给下图中①~⑤选择适当的物质,使有连线的两物质能发生反应。供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉。
(1)请推断它们的化学式分别为① ;
② ;③ ;④ ;⑤ 。
(2)写出下列序号之间的化学方程式:
①和②: ;
②和④: ;
②和⑤: ;
③和④: 。
25.如图所示,A、B、C、D、E各代表水、锌、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质(已知C是氢氧化钡溶液,B是硫酸铜溶液).常温下,相连环物质间能发生反应,不相连环物质间不能发生反应,且A的相对分子(或原子)质量大于D,请填空:
(1)写出下列物质的化学式:A 、D 、E .
(2)写出B与C反应的化学方程式: .
(3)以B为原料,制备CuO,写出具体的化学方程式 .
(4)相连环物质间发生的反应中,属于置换反应的是(写出具体化学方程式) .
参考答案:
1.A
A.氧化物是指化合物中含有两种元素,其中一种元素为氧元素,二甲醚含有三种元素,不属于氧化物,故A错误,符合题意;
B.每个分子有9个原子,故B正确,不符合题意;
C. 碳、氢、氧元素的质量比为12×2:1×6:16=12:3:8,故C正确,不符合题意;
D.分子有碳原子和氧原子和氢原子构成,故D正确,不符合题意。
故选A。
2.B
强电解质在水溶液中(几乎)完全发生电离的电解质,一般包含强酸、强碱、大部分盐和金属氧化物;弱电解质在水溶液中不完全(少部分)电离的电解质,一般包含弱酸、弱碱,水和少部分盐;非电解质在水溶液里和熔融状态下都不能导电的化合物,根据以上概念分析。
A.硫酸氢钠是可溶性盐,属于强电解质,NH3属于非电解质,乙醇是非电解质,A不符合题意;
B.硫酸铵是可溶性盐,属于强电解质,碳酸是弱酸,属于弱电解质,SO2属于非电解质,B符合题意;
C.氯酸钾是可溶性盐,属于强电解质,醋酸是弱酸,属于弱电解质,铜是单质,既不是电解质也不是弱电解质,C不符合题意;
D.烧碱是强碱,属于强电解质,纯碱是可溶性盐,属于强电解质,熟石灰是强碱,属于强电解质,D不符合题意;
故答案为:B。
3.D
A. 46 gC2H5OH的物质的量为=1mol,1个C2H5OH中含有8个共价键,46 gC2H5OH含共价键数目为8NA,故A错误;
B. 胶粒是由若干个氢氧化铁分子聚集在一起形成的,Fe3+水解也是不完全的,所以0.1mol FeCl3·6H2O滴入沸水形成的胶体粒子少于0.1NA,故B错误;
C. 铜只能与浓硫酸反应生成二氧化硫,一但硫酸变稀,则反应停止,故100mL 18mol L-1 的浓硫酸不能完全反应,则生成的二氧化硫的物质的量小于0.9NA,故C错误;
D. 反应KClO3+6HCl=KCl+3Cl2↑+3H2O转移5mol电子,故当反应生成3mol氯气转移5NA个电子,故D正确;
正确答案是D。
4.D
Na原子的相对原子质量为23,摩尔质量的单位为g/mol,所以金属钠的摩尔质量为23g/mol;
故答案为D。
5.A
多个物质反应后生成一种物质,属于化合反应,故选A。
6.D
A.同素异形体是由同一元素组成的不同性质的单质,H2O和H2O2组成元素相同,但二者是化合物,不属于单质,A错误;
B.在水溶液中电离出的阳离子全部是氢离子的化合物叫做酸,在水溶液中能电离出氢离子的化合物不一定是酸,如NaHSO4等,B错误;
C.O2、O3是不同分子组成的不同物质,因此O2转化为O3的过程为化学变化,C错误;
D.CuSO4的构成微粒只有一种,因此属于纯净物,由于含有多种元素,所以该物质属于化合物,该化合物电离产生金属阳离子和酸根离子,因此该化合物属于盐,该盐溶于水时完全电离产生离子,因此属于强电解质,D正确;
答案为D。
7.D
A.电离出的阳离子全部是氢离子的化合物称为酸,因某些化合物电离时也有H+离子产生,如NaHSO4,但它属于盐,A错误;
B. 电离出的阴离子全部是氢氧根离子的化合物称为碱,某些化合物电离时也会产生一定量的OH-离子,但不是碱,例如MgOHCl,属于盐,B错误;
C. 能电离出酸根离子的化合物可能是盐(如NaCl、CuSO4等),也可能不是盐(如H2SO4),错误;
D.由金属离子和酸根离子结合的化合物一定是盐,D正确。
故选D。
8.B
答案选B。
【点睛】考查物质的量的相关计算,利用公式n=解答。
9.A
A.是三个乙基与氮相连,因此1mol 中含有的非极性键的数目为,故A正确;
B.标准状况下,CO2的结构式为O=C=O,即1molCO2分子中含有对共用电子对,故B错误;
C.整个过程是CO2+H2HCOOH,因此每生成甲酸,转移的电子数为,故C错误;
D.甲酸和乙醇在浓硫酸加热条件下可逆反应生成甲酸乙酯,因此甲酸和足量乙醇充分反应后,生成甲酸乙酯的数目小于,故D错误。
综上所述,答案为A。
10.A
“丁达尔效应”为胶体特有性质,碘酒、0.1%的生理盐水、硫酸铜溶液均为溶液,不具有丁达尔效应,蛋白质溶液为胶体,能产生“丁达尔效应”;
故答案为A。
11.C
A.FeCl3溶液和NaOH溶液反应得到沉淀,不能得到胶体,故A错误;
B.Fe和水蒸气在高温下反应生成Fe3O4,故B错误;
C.Fe2+能够被Cl2氧化为Fe3+,故C正确;
D.FeCl3和Cu反应生成FeCl2和CuCl2,故D错误;
故选C。
12.A
标况下,气体摩尔体积相等,甲烷的物质的量,,,,
A.根据知,其体积大小与物质的量成正比,所以其体积从小到大顺序是:,故A错误;
B.根据知,气体密度与摩尔质量成正比,甲烷摩尔质量是16g/mol、HCl摩尔质量是36.5g/mol、硫化氢摩尔质量是34g/mol、氨气摩尔质量为17g/mol,所以其密度顺序为:,故B正确;
C.甲烷质量=16g/mol×0.3mol=4.8g,硫化氢质量为13.6g,HCl质量=0.5mol×36.5g/mol=18.25g,氨气质量=0.2mol×17g/mol=3.4g,所以其质量顺序为:,故C正确;
D.根据知,其分子个数之比等于其物质的量之比,甲烷中H原子个数为1.2NA,HCl中H原子个数为0.5NA,硫化氢中H原子个数为0.8NA,氨气中H原子个数为0.6NA,所以氢原子数:,故D正确;
故选:A。
13.D
A.1个OH-中含有10个电子,则1 mol OH-中含有的电子数目为10NA,A错误;
B.氢氟酸在标准状况下呈液态,不能使用气体摩尔体积计算微粒的数目,B错误;
C.8.8 g CO2的物质的量是0.2 mol,由于在1个CO2分子中含有4对共用电子对,则0.2 mol CO2中含有的共用电子对数目为0.8NA,C错误;
D.CO和N2的相对分子质量都是28,常温常压下,14 g CO和N2的混合气体的物质的量是0.5 mol,故其中含有的原子的物质的量是1 mol,则含有的原子数目为NA,D正确;
故合理选项是D。
14.D
A.当摩尔质量以g/mol为单位时,摩尔质量在数值上等于该物质的相对分子(原子)质量,故A错误;
B.摩尔质量是单位物质的量的物质所具有的质量,H2O的摩尔质量是18 g·mol-1,故B错误;
C.摩尔质量的单位是g·mol-1,CO2的摩尔质量是44 g·mol-1,故C错误;
D.SO的摩尔质量是96g·mol-1,故D正确;
选D。
15.C
A.1.8 g的的物质的量是n()==0.1 mol,由于1个中含有10个电子,则0.1 mol中含有的电子数为1.0NA,A错误;
B.只有溶液浓度,缺少溶液的体积,不能计算微粒的数目,B错误;
C.42 g N2的物质的量是n(N2)==1.5 mol,所以其中含有的N2分子数为1.5NA,C正确;
D.在标准状况下四氯化碳呈液态,不能使用气体摩尔体积计算,D错误;
故合理选项是C。
16.D
在标准状况下,气体的物质的量越多,其体积就越大。
A. n(H2O)==1 mol,H2O在标准状况下不是气体;
B. n(N2)==1 mol;
C. n(HCl)==0.2 mol;
D. n(H2)==3 mol;
在上述三种气体中H2的物质的量最多,故根据V=n·Vm可知:气体的物质的量也大,其在标准状况下体积也最大,故合理选项是D。
17.B
A.标准状况下,水不是气体,不能计算其体积,故A错误;
B. 1molNa2SO4中含有Na+的物质的量为2mol,即数目为2NA,故B正确;
C.没有说明是标准状况,无法计算体积,故C错误;
D.32g氧气的物质的量为1mol,所含原子数目为2mol,即氧原子数目为2NA,故D错误;
故选B。
18.C
溶解度即在100g水中达到饱和时所能溶解的溶质的质量。
在100g质量分数为10%的X溶液中,溶质的质量m=100g×10%=10.0g,则溶剂的质量m=100g-10g=90g,当加入5g溶质X后,溶液即达饱和,故当90g水中溶解(10g+5g)即15g溶质时即饱和,设此温度下X的溶解度为ag,则有,解得a=16.7g。
答案为C。
19.A
A.12g金刚石与石墨所含的碳原子为=1mol,碳原子数为NA,故A正确;
B.盐酸中不存在氯化氢分子,故B错误;
C.未告知温度和压强,无法计算4.48L N2的物质的量,故C错误;
D.标准状况下,2.24L稀有气体的物质的量为=0.1mol,稀有气体为单原子分子,所含原子数为0.1 NA,故D错误;
故选A。
20.C
A.氯气和水反应是可逆反应,因此1mol Cl2完全溶解于水时与水反应转移电子数目小于NA,故A错误;
B.氢氧根中含有共价键,因此1mol NaOH中,所具有共价键的数目为NA,故B错误;
C.N2与CO的摩尔质量都为28 g mol 1且都为双原子分子,因此14g由N2与CO组成的混合气体物质的量为0.5mol,则含有的原子数目为NA,故C正确;
D.2 Na2O2+2H2O=4NaOH+O2↑,2mol Na2O2转移2mol电子,则7.8gNa2O2(物质的量为0.1mol)与水充分反应转移的电子数目为0.1NA,故D错误。
综上所述,答案为C。
21. 树状分类法 ④⑤ ①⑤⑧⑨ ②⑥⑦
(1)图示方法将无机化合物分成酸、碱、盐、氧化物、氢化物等,按照层次,符合树状分类的特点,属于树状分类,故答案为树状分类法;
(2)①NaCl晶体不能导电,在水溶液中能导电,是电解质;②液态SO3不能导电,是非电解质;③液态的醋酸属于酸,在水溶液中能导电,是电解质;④汞是金属单质,能导电,既不是电解质也不是非电解质;⑤BaSO4固体是盐,熔融状态下能导电,是电解质;⑥蔗糖(C12H22O11)是有机物,在水溶液和熔融状态下都不导电,是非电解质;⑦酒精(C2H5OH)是有机物,在水溶液和熔融状态下都不导电,是非电解质;⑧熔融的K2SO4是盐,可以导电,是电解质;⑨纯水是电解质,不能导电;以上物质中能导电的是④⑤;属于电解质的是①⑤⑧⑨;属于非电解质的是②⑥⑦。
【点睛】本题考查物质的导电性的判断,电解质、非电解质概念的辨析,难度不大.解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件。
22. CO+2H+=CO2↑+H2O NH+OH-=NH3↑+H2O
①Na2CO3溶液与稀硫酸混合反应生成硫酸钠溶液、CO2气体和H2O,离子方程式:CO+2H+=CO2↑+H2O。
②浓NH4NO3溶液中加入浓NaOH溶液反应生成硝酸钠溶液、NH3和H2O,离子方程式: NH+OH-=NH3↑+H2O
23.1:1 1:1 5:3 4:11 4:11
根据阿伏伽德罗定律,同温同压下,气体的体积之比等于其物质的量之比,同温同压下,气体的密度之比等于摩尔质量之比,据此分析解答。
同温同压下,同体积的CH4和CO2具有相同数目的分子,分子的物质的量也相等,即甲烷(CH4)和二氧化碳分子数之比为1∶1,物质的量之比为1∶1,原子总数之比为1×5∶1×3=5∶3,质量之比为1×16∶1×44=4∶11;同温同压下,气体的密度之比等于摩尔质量之比=16∶44=4∶11,故答案为1∶1;1∶1;5∶3;4∶11;4∶11。
24. Fe H2SO4 CO2 CaO Na2CO3 Fe+H2SO4FeSO4+H2↑ CaO+H2SO4CaSO4+H2O H2SO4+Na2CO3Na2SO4+H2O+CO2↑ CO2+CaOCaCO3
根据可供选择的试剂(稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉)可知,其中属于酸的只有硫酸,能与硫酸反应的单质是铁片,能与硫酸反应的盐和氧化物分别为纯碱和生石灰,能与生石灰反应的氧化物为二氧化碳。
(1) 由分析可知,属于酸的只有硫酸,能与硫酸反应的单质是铁片,能与硫酸反应的盐和氧化物分别为纯碱和生石灰,能与生石灰反应的氧化物为二氧化碳。因此,它们的化学式分别为①Fe;②H2SO4;③CO2;④CaO;⑤Na2CO3。
(2)①和②之间的化学方程式为Fe+H2SO4FeSO4+H2↑;
②和④之间的化学方程式为CaO+H2SO4CaSO4+H2O;
②和⑤之间的化学方程式为H2SO4+Na2CO3Na2SO4+H2O+CO2↑;
③和④之间的化学方程式为CO2+CaOCaCO3。
25.(1) Zn
(2)
(3)
(4)
水、锌、二氧化碳、硫酸铜溶液、氢氧化钡溶液中,能与其它四种中的两种反应的是二氧化碳、硫酸铜溶液、氢氧化钡溶液,对应BCD;水、锌为AE,则B、D是二氧化碳或硫酸铜溶液;结合A的相对分子(或原子)质量大于D,推断A是锌,B是硫酸铜溶液,C是氢氧化钡溶液,D是二氧化碳,E是水。
(1)据分析,A为Zn、D为、E为。
(2)B与C反应即硫酸铜溶液与氢氧化钡溶液反应,化学方程式:。
(3)以硫酸铜溶液为原料,可用铁还原硫酸铜得到铜单质后,与氧气加热反应制得CuO,具体的化学方程:、。
(4)相连环物质间发生的反应中,锌与硫酸铜溶液发生置换反应,化学方程式为:
一、单选题(共20题)
1.央视曝光,少数不法厂家向液化石油气中掺入了会对液化气罐的配件造成腐蚀的二甲醚(C2H6O),下列关于二甲醚的说法错误的是
A.属于氧化物
B.每个分子中含有9个原子
C.碳、氢、氧元素的质量比为12:3:8
D.二甲醚分子由碳原子、氢原子和氧原子构成
2.下列物质组,按强电解质、弱电解质、非电解质的顺序排列的是
A.硫酸氢钠、NH3、乙醇 B.硫酸铵、碳酸、SO2
C.氯酸钾、醋酸、铜 D.烧碱、纯碱、熟石灰
3.设NA表示阿伏加 德罗常数的值,下列说法中正确的是( )
A.46 gC2H5OH含共价键数目为9NA
B.0.1 mol FeCl3·6H2O加入沸水中完全反应生成胶体的粒子数为0.1NA
C.100mL18mol·L-1浓硫酸与足量Cu粉加热反应,产生SO2分子数为0.9NA
D.反应中,生成3mol氯气时转移5NA个电子
4.金属钠的摩尔质量为
A.23 B.23g C.23mol D.23g/mol
5.反应2SO2+O22SO3属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
6.下列说法正确的是 ( )
A.H2O和H2O2组成元素相同,所以二者为同素异形体
B.在水溶液中能电离出H+的化合物叫做酸
C.O2转化为O3的过程为物理变化
D.CuSO4属于纯净物、化合物、盐、强电解质
7.下列叙述正确的是
A.能电离出氢离子的化合物叫做酸 B.能电离出氢氧根离子的化合物叫做碱
C.能电离出酸根离子的化合物叫做盐 D.由金属离子和酸根离子组成的化合物属于盐
8.已知1.6g某气体所含分子数目约为3.01×1022,此气体摩尔质量为( )
A.32g B.32g·mol-1 C.64mol D.64g·mol-1
9.捕获二氧化碳是碳中和技术之一,图是捕获二氧化碳生成甲酸的过程,若为阿伏加德罗常数的值,下列说法正确的是
A.中含有的非极性键的数目为
B.标准状况下,分子中含有对共用电子对
C.每生成甲酸,转移的电子数为
D.甲酸和足量乙醇充分反应后,生成甲酸乙酯的数目为
10.下列分散系,能产生“丁达尔效应”的是
A.蛋白质溶液 B.碘酒
C.0.1%的生理盐水 D.硫酸铜溶液
11.在指定条件下,下列物质或离子间的转化能实现的是
A.胶体 B.
C. D.
12.标准状况下有:甲烷、个氯化氢分子、克硫化氢、摩尔氨气。下列对这四种气体的关系从小到大表示不正确的是
A.体积: B.密度:
C.质量: D.氢原子数:
13.用NA表示阿伏加德罗常数的值。下列说法正确的是
A.1 mol OH-中含有的电子数目为NA
B.标准状况下,11.2 L氢氟酸中含有的HF分子数目为0.5NA
C.8.8 g CO2中含有的共用电子对数目为0.4NA
D.常温常压下,14 g CO和N2的混合气体中,含有的原子数目为NA
14.下列说法中正确的是
A.摩尔质量在数值上等于该物质的相对分子(原子)质量
B.2molH2O的摩尔质量是36g·mol-1
C.CO2的摩尔质量是44g
D.SO的摩尔质量是96g·mol-1
15.设NA表示阿伏加 德罗常数的值,下列叙述中正确的是
A.1.8 g的中含有的电子数为1.1NA
B.0.1 mol/L的MgCl2溶液中,所含Cl-的数目为0.2NA
C.42 g N2中含有的分子数为1.5NA
D.标准状况下,2.24 L四氯化碳(CCl4)中含有的分子数为0.1NA
16.在标准状况下,所占体积最大的是( )
A.18 g H2O B.6.02×1023个氮分子
C.4.48 L HCl D.6 g氢气
17.若NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,1 mol H2O的体积为22.4 L
B.1molNa2SO4中含有Na+数为2NA
C.0.5 mol H2所占体积为11.2 L
D.32g氧气所含原子数目为NA
18.25℃时,在100g质量分数为10%的X溶液中加入5gX(无水盐)后,恰好达到饱和,则25℃时X的溶解度为( )
A.10.0g B.15.0g C.16.7g D.18.8g
19.用NA表示阿伏加德罗常数,下列说法正确的是
A.12g金刚石与石墨所含的碳原子数均为NA
B.1mol HCl气体溶于水,该盐酸中含NA个氯化氢分子
C.4.48L N2含有的原子数为0.4NA
D.标准状况下,2.24L稀有气体所含原子数为0.2 NA
20.设NA为阿伏加德罗常数的值。下列说法正确的是
A.1molCl2完全溶解于水时与水反应转移电子数目为NA
B.1molNaOH中,所具有共价键的数目为2NA
C.14g由N2与CO组成的混合气体含有的原子数目为NA
D.7.8gNa2O2与水充分反应转移的电子数目为0.2NA
二、非选择题(共5题)
21.(1)无机化合物可以根据其组成和性质进行分类:
上图所示的物质分类方法名称是 。
(2)现有以下物质:①NaCl晶体 ②液态SO3③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔融的K2SO4 ⑨纯水。请回答下列问题(用序号):
以上物质中能导电的是 属于电解质的是 属于非电解质的是
22.写出下列有关反应的离子方程式
①Na2CO3溶液与稀硫酸混合: 。
②浓NH4NO3溶液中加入浓NaOH溶液: 。
23.同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为 ,物质的量之比为 ,原子总数之比为 ,质量之比为 ,密度之比为 。
24.给下图中①~⑤选择适当的物质,使有连线的两物质能发生反应。供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉。
(1)请推断它们的化学式分别为① ;
② ;③ ;④ ;⑤ 。
(2)写出下列序号之间的化学方程式:
①和②: ;
②和④: ;
②和⑤: ;
③和④: 。
25.如图所示,A、B、C、D、E各代表水、锌、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质(已知C是氢氧化钡溶液,B是硫酸铜溶液).常温下,相连环物质间能发生反应,不相连环物质间不能发生反应,且A的相对分子(或原子)质量大于D,请填空:
(1)写出下列物质的化学式:A 、D 、E .
(2)写出B与C反应的化学方程式: .
(3)以B为原料,制备CuO,写出具体的化学方程式 .
(4)相连环物质间发生的反应中,属于置换反应的是(写出具体化学方程式) .
参考答案:
1.A
A.氧化物是指化合物中含有两种元素,其中一种元素为氧元素,二甲醚含有三种元素,不属于氧化物,故A错误,符合题意;
B.每个分子有9个原子,故B正确,不符合题意;
C. 碳、氢、氧元素的质量比为12×2:1×6:16=12:3:8,故C正确,不符合题意;
D.分子有碳原子和氧原子和氢原子构成,故D正确,不符合题意。
故选A。
2.B
强电解质在水溶液中(几乎)完全发生电离的电解质,一般包含强酸、强碱、大部分盐和金属氧化物;弱电解质在水溶液中不完全(少部分)电离的电解质,一般包含弱酸、弱碱,水和少部分盐;非电解质在水溶液里和熔融状态下都不能导电的化合物,根据以上概念分析。
A.硫酸氢钠是可溶性盐,属于强电解质,NH3属于非电解质,乙醇是非电解质,A不符合题意;
B.硫酸铵是可溶性盐,属于强电解质,碳酸是弱酸,属于弱电解质,SO2属于非电解质,B符合题意;
C.氯酸钾是可溶性盐,属于强电解质,醋酸是弱酸,属于弱电解质,铜是单质,既不是电解质也不是弱电解质,C不符合题意;
D.烧碱是强碱,属于强电解质,纯碱是可溶性盐,属于强电解质,熟石灰是强碱,属于强电解质,D不符合题意;
故答案为:B。
3.D
A. 46 gC2H5OH的物质的量为=1mol,1个C2H5OH中含有8个共价键,46 gC2H5OH含共价键数目为8NA,故A错误;
B. 胶粒是由若干个氢氧化铁分子聚集在一起形成的,Fe3+水解也是不完全的,所以0.1mol FeCl3·6H2O滴入沸水形成的胶体粒子少于0.1NA,故B错误;
C. 铜只能与浓硫酸反应生成二氧化硫,一但硫酸变稀,则反应停止,故100mL 18mol L-1 的浓硫酸不能完全反应,则生成的二氧化硫的物质的量小于0.9NA,故C错误;
D. 反应KClO3+6HCl=KCl+3Cl2↑+3H2O转移5mol电子,故当反应生成3mol氯气转移5NA个电子,故D正确;
正确答案是D。
4.D
Na原子的相对原子质量为23,摩尔质量的单位为g/mol,所以金属钠的摩尔质量为23g/mol;
故答案为D。
5.A
多个物质反应后生成一种物质,属于化合反应,故选A。
6.D
A.同素异形体是由同一元素组成的不同性质的单质,H2O和H2O2组成元素相同,但二者是化合物,不属于单质,A错误;
B.在水溶液中电离出的阳离子全部是氢离子的化合物叫做酸,在水溶液中能电离出氢离子的化合物不一定是酸,如NaHSO4等,B错误;
C.O2、O3是不同分子组成的不同物质,因此O2转化为O3的过程为化学变化,C错误;
D.CuSO4的构成微粒只有一种,因此属于纯净物,由于含有多种元素,所以该物质属于化合物,该化合物电离产生金属阳离子和酸根离子,因此该化合物属于盐,该盐溶于水时完全电离产生离子,因此属于强电解质,D正确;
答案为D。
7.D
A.电离出的阳离子全部是氢离子的化合物称为酸,因某些化合物电离时也有H+离子产生,如NaHSO4,但它属于盐,A错误;
B. 电离出的阴离子全部是氢氧根离子的化合物称为碱,某些化合物电离时也会产生一定量的OH-离子,但不是碱,例如MgOHCl,属于盐,B错误;
C. 能电离出酸根离子的化合物可能是盐(如NaCl、CuSO4等),也可能不是盐(如H2SO4),错误;
D.由金属离子和酸根离子结合的化合物一定是盐,D正确。
故选D。
8.B
答案选B。
【点睛】考查物质的量的相关计算,利用公式n=解答。
9.A
A.是三个乙基与氮相连,因此1mol 中含有的非极性键的数目为,故A正确;
B.标准状况下,CO2的结构式为O=C=O,即1molCO2分子中含有对共用电子对,故B错误;
C.整个过程是CO2+H2HCOOH,因此每生成甲酸,转移的电子数为,故C错误;
D.甲酸和乙醇在浓硫酸加热条件下可逆反应生成甲酸乙酯,因此甲酸和足量乙醇充分反应后,生成甲酸乙酯的数目小于,故D错误。
综上所述,答案为A。
10.A
“丁达尔效应”为胶体特有性质,碘酒、0.1%的生理盐水、硫酸铜溶液均为溶液,不具有丁达尔效应,蛋白质溶液为胶体,能产生“丁达尔效应”;
故答案为A。
11.C
A.FeCl3溶液和NaOH溶液反应得到沉淀,不能得到胶体,故A错误;
B.Fe和水蒸气在高温下反应生成Fe3O4,故B错误;
C.Fe2+能够被Cl2氧化为Fe3+,故C正确;
D.FeCl3和Cu反应生成FeCl2和CuCl2,故D错误;
故选C。
12.A
标况下,气体摩尔体积相等,甲烷的物质的量,,,,
A.根据知,其体积大小与物质的量成正比,所以其体积从小到大顺序是:,故A错误;
B.根据知,气体密度与摩尔质量成正比,甲烷摩尔质量是16g/mol、HCl摩尔质量是36.5g/mol、硫化氢摩尔质量是34g/mol、氨气摩尔质量为17g/mol,所以其密度顺序为:,故B正确;
C.甲烷质量=16g/mol×0.3mol=4.8g,硫化氢质量为13.6g,HCl质量=0.5mol×36.5g/mol=18.25g,氨气质量=0.2mol×17g/mol=3.4g,所以其质量顺序为:,故C正确;
D.根据知,其分子个数之比等于其物质的量之比,甲烷中H原子个数为1.2NA,HCl中H原子个数为0.5NA,硫化氢中H原子个数为0.8NA,氨气中H原子个数为0.6NA,所以氢原子数:,故D正确;
故选:A。
13.D
A.1个OH-中含有10个电子,则1 mol OH-中含有的电子数目为10NA,A错误;
B.氢氟酸在标准状况下呈液态,不能使用气体摩尔体积计算微粒的数目,B错误;
C.8.8 g CO2的物质的量是0.2 mol,由于在1个CO2分子中含有4对共用电子对,则0.2 mol CO2中含有的共用电子对数目为0.8NA,C错误;
D.CO和N2的相对分子质量都是28,常温常压下,14 g CO和N2的混合气体的物质的量是0.5 mol,故其中含有的原子的物质的量是1 mol,则含有的原子数目为NA,D正确;
故合理选项是D。
14.D
A.当摩尔质量以g/mol为单位时,摩尔质量在数值上等于该物质的相对分子(原子)质量,故A错误;
B.摩尔质量是单位物质的量的物质所具有的质量,H2O的摩尔质量是18 g·mol-1,故B错误;
C.摩尔质量的单位是g·mol-1,CO2的摩尔质量是44 g·mol-1,故C错误;
D.SO的摩尔质量是96g·mol-1,故D正确;
选D。
15.C
A.1.8 g的的物质的量是n()==0.1 mol,由于1个中含有10个电子,则0.1 mol中含有的电子数为1.0NA,A错误;
B.只有溶液浓度,缺少溶液的体积,不能计算微粒的数目,B错误;
C.42 g N2的物质的量是n(N2)==1.5 mol,所以其中含有的N2分子数为1.5NA,C正确;
D.在标准状况下四氯化碳呈液态,不能使用气体摩尔体积计算,D错误;
故合理选项是C。
16.D
在标准状况下,气体的物质的量越多,其体积就越大。
A. n(H2O)==1 mol,H2O在标准状况下不是气体;
B. n(N2)==1 mol;
C. n(HCl)==0.2 mol;
D. n(H2)==3 mol;
在上述三种气体中H2的物质的量最多,故根据V=n·Vm可知:气体的物质的量也大,其在标准状况下体积也最大,故合理选项是D。
17.B
A.标准状况下,水不是气体,不能计算其体积,故A错误;
B. 1molNa2SO4中含有Na+的物质的量为2mol,即数目为2NA,故B正确;
C.没有说明是标准状况,无法计算体积,故C错误;
D.32g氧气的物质的量为1mol,所含原子数目为2mol,即氧原子数目为2NA,故D错误;
故选B。
18.C
溶解度即在100g水中达到饱和时所能溶解的溶质的质量。
在100g质量分数为10%的X溶液中,溶质的质量m=100g×10%=10.0g,则溶剂的质量m=100g-10g=90g,当加入5g溶质X后,溶液即达饱和,故当90g水中溶解(10g+5g)即15g溶质时即饱和,设此温度下X的溶解度为ag,则有,解得a=16.7g。
答案为C。
19.A
A.12g金刚石与石墨所含的碳原子为=1mol,碳原子数为NA,故A正确;
B.盐酸中不存在氯化氢分子,故B错误;
C.未告知温度和压强,无法计算4.48L N2的物质的量,故C错误;
D.标准状况下,2.24L稀有气体的物质的量为=0.1mol,稀有气体为单原子分子,所含原子数为0.1 NA,故D错误;
故选A。
20.C
A.氯气和水反应是可逆反应,因此1mol Cl2完全溶解于水时与水反应转移电子数目小于NA,故A错误;
B.氢氧根中含有共价键,因此1mol NaOH中,所具有共价键的数目为NA,故B错误;
C.N2与CO的摩尔质量都为28 g mol 1且都为双原子分子,因此14g由N2与CO组成的混合气体物质的量为0.5mol,则含有的原子数目为NA,故C正确;
D.2 Na2O2+2H2O=4NaOH+O2↑,2mol Na2O2转移2mol电子,则7.8gNa2O2(物质的量为0.1mol)与水充分反应转移的电子数目为0.1NA,故D错误。
综上所述,答案为C。
21. 树状分类法 ④⑤ ①⑤⑧⑨ ②⑥⑦
(1)图示方法将无机化合物分成酸、碱、盐、氧化物、氢化物等,按照层次,符合树状分类的特点,属于树状分类,故答案为树状分类法;
(2)①NaCl晶体不能导电,在水溶液中能导电,是电解质;②液态SO3不能导电,是非电解质;③液态的醋酸属于酸,在水溶液中能导电,是电解质;④汞是金属单质,能导电,既不是电解质也不是非电解质;⑤BaSO4固体是盐,熔融状态下能导电,是电解质;⑥蔗糖(C12H22O11)是有机物,在水溶液和熔融状态下都不导电,是非电解质;⑦酒精(C2H5OH)是有机物,在水溶液和熔融状态下都不导电,是非电解质;⑧熔融的K2SO4是盐,可以导电,是电解质;⑨纯水是电解质,不能导电;以上物质中能导电的是④⑤;属于电解质的是①⑤⑧⑨;属于非电解质的是②⑥⑦。
【点睛】本题考查物质的导电性的判断,电解质、非电解质概念的辨析,难度不大.解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件。
22. CO+2H+=CO2↑+H2O NH+OH-=NH3↑+H2O
①Na2CO3溶液与稀硫酸混合反应生成硫酸钠溶液、CO2气体和H2O,离子方程式:CO+2H+=CO2↑+H2O。
②浓NH4NO3溶液中加入浓NaOH溶液反应生成硝酸钠溶液、NH3和H2O,离子方程式: NH+OH-=NH3↑+H2O
23.1:1 1:1 5:3 4:11 4:11
根据阿伏伽德罗定律,同温同压下,气体的体积之比等于其物质的量之比,同温同压下,气体的密度之比等于摩尔质量之比,据此分析解答。
同温同压下,同体积的CH4和CO2具有相同数目的分子,分子的物质的量也相等,即甲烷(CH4)和二氧化碳分子数之比为1∶1,物质的量之比为1∶1,原子总数之比为1×5∶1×3=5∶3,质量之比为1×16∶1×44=4∶11;同温同压下,气体的密度之比等于摩尔质量之比=16∶44=4∶11,故答案为1∶1;1∶1;5∶3;4∶11;4∶11。
24. Fe H2SO4 CO2 CaO Na2CO3 Fe+H2SO4FeSO4+H2↑ CaO+H2SO4CaSO4+H2O H2SO4+Na2CO3Na2SO4+H2O+CO2↑ CO2+CaOCaCO3
根据可供选择的试剂(稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉)可知,其中属于酸的只有硫酸,能与硫酸反应的单质是铁片,能与硫酸反应的盐和氧化物分别为纯碱和生石灰,能与生石灰反应的氧化物为二氧化碳。
(1) 由分析可知,属于酸的只有硫酸,能与硫酸反应的单质是铁片,能与硫酸反应的盐和氧化物分别为纯碱和生石灰,能与生石灰反应的氧化物为二氧化碳。因此,它们的化学式分别为①Fe;②H2SO4;③CO2;④CaO;⑤Na2CO3。
(2)①和②之间的化学方程式为Fe+H2SO4FeSO4+H2↑;
②和④之间的化学方程式为CaO+H2SO4CaSO4+H2O;
②和⑤之间的化学方程式为H2SO4+Na2CO3Na2SO4+H2O+CO2↑;
③和④之间的化学方程式为CO2+CaOCaCO3。
25.(1) Zn
(2)
(3)
(4)
水、锌、二氧化碳、硫酸铜溶液、氢氧化钡溶液中,能与其它四种中的两种反应的是二氧化碳、硫酸铜溶液、氢氧化钡溶液,对应BCD;水、锌为AE,则B、D是二氧化碳或硫酸铜溶液;结合A的相对分子(或原子)质量大于D,推断A是锌,B是硫酸铜溶液,C是氢氧化钡溶液,D是二氧化碳,E是水。
(1)据分析,A为Zn、D为、E为。
(2)B与C反应即硫酸铜溶液与氢氧化钡溶液反应,化学方程式:。
(3)以硫酸铜溶液为原料,可用铁还原硫酸铜得到铜单质后,与氧气加热反应制得CuO,具体的化学方程:、。
(4)相连环物质间发生的反应中,锌与硫酸铜溶液发生置换反应,化学方程式为:
