1.2 离子反应 课件(46张PPT)
文档属性
| 名称 | 1.2 离子反应 课件(46张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 09:24:27 | ||
图片预览







文档简介
(共46张PPT)
离子反应(第一课时)
高中化学
NaCl溶液能导电
湿手不要摸电器 干燥绝缘要牢记
高中化学
活动1 设计实验证明NaCl溶液能导电
高中化学
物质 实验现象
导电性
NaCl溶液 灯泡亮
能够导电
活动1 设计实验证明NaCl溶液能导电
高中化学
猜想1:水能导电 +
猜想2: NaCl能导电 NaCl 猜想3:水和NaCl共同作用能导电
物质 实验现象
导电性
NaCl溶液 灯泡亮
能够导电
活动2 探 究NaCl溶液能导电的原因
NaCl 溶液
→
高中化学
水
实验 序号 物质 实验现象
导电性
1 NaCl溶润 2 蒸馏水 3 NaCl固体
活动2 探究NaCl溶液能导电的原因
高中化学
实验 序号 物质 实验现象
导电性
1 NaCl溶液 灯泡亮
能够导电
2 蒸馏水 灯泡不亮
不能导电
3 NaCl固体 灯泡不亮
不能导电
猜想3:水和NaCl共同作用能导电
高中化学
活动2 探究NaCl溶液能导电的原因
电流是由 带电荷的粒子 按一定方向移 动而形成的
活动2 探究NaCl溶液能导电的原因
高中化学
活动2 探究NaCl溶液能导电的原因
猜想4: NaCl溶液中有自由移动的带电粒子
高中化学
实验 序号 物质 实验现象
导电性
1 NaCl溶液 灯泡亮
能够导电
2 蒸馏水 灯泡不亮
不能导电
3 NaCl固体 灯泡不亮
不能导电
4 熔融NaCl 灯泡亮
能够导电
活动2 探 究NaCl溶液能导电的原因
高中化学
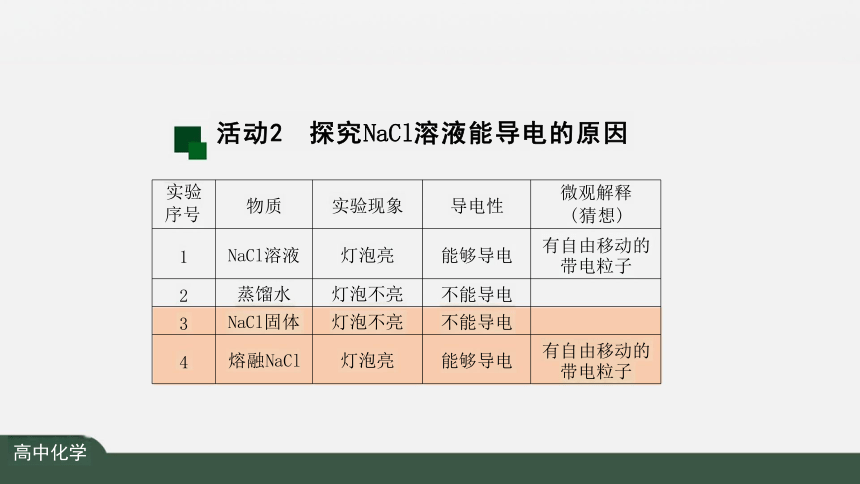
实验 序号 物质 实验现象 导电性
微观解释
(猜想)
1 NaCl溶液 灯泡亮 能够导电
有自由移动的 带电粒子
4 熔融NaCl 灯泡亮 能够导电
有自由移动的 带电粒子
活动2 探究NaCl溶液能导电的原因
高中化学
实验 序号 物质 实验现象 导电性
微观解释
(猜想)
1 NaCl溶液 灯泡亮 能够导电
有自由移动的 带电粒子
2 蒸馏水 灯泡不亮 不能导电
3 NaCl固体 灯泡不亮 不能导电
4 熔融NaCl 灯泡亮 能够导电
有自由移动的 带电粒子
活动2 探究NaCl溶液能导电的原因
高中化学
实验 序号 物质 实验现象 导电性
微观解释
(猜想)
3 NaCl固体 灯泡不亮 不能导电
有带电粒子, 不能自由移动
4 熔融NaCl 灯泡亮 能够导电
有自由移动的 带电粒子
活动2 探 究NaCl溶液能导电的原因
高中化学
活动2 探 究NaCl溶液能导电的原因
能够导电
熔融
NaCl
Na+ 和Cl
能
自由移动
不能导电
NaCl
固体
Na+和Cl
不能
自由移动
加热熔化
高中化学
微观
宏观
活动2 探究NaCl溶液能导电的原因
NaCl晶体及其结构模型
高中化学
Na+ CI
+ -A=
一 +- -
+ 一+ 一 -
一)+--
+ ( 一 + - -
干燥的NaCl固体不导电
熔融的NaCl能够导电
与电 源负 —极相 连的 电极
与电 源正 极相 连的 电极
与电源负极 相连的电极
与电源正极 相连的电极
高中化学
Na+
CI
实验 序号 物质 实验现象 导电性
微观解释
(猜想)
1 NaCl溶液 灯泡亮 能够导电
有自由移动的 带电粒子
2 蒸馏水 灯泡不亮 不能导电
无大量带电粒子
3 NaCl固体 灯泡不亮 不能导电
有带电粒子,
不能自由移动
4 熔融NaCl 灯泡亮 能够导电
有自由移动的 带电粒子
活动2 探究NaCl溶液能导电的原因
高中化学
实验 序号 物质 实验现象 导电性
微观解释
(猜想)
1 NaCl溶液 灯泡亮 能够导电
有自由移动的 带电粒子
2 蒸馏水 灯泡不亮 不能导电
无大量带电粒子
3 NaCl固体 灯泡不亮 不能导电
有带电粒子, 不能自由移动
4 熔融NaCl 灯泡亮 能够导电
有自由移动的 带电粒子
活动2 探究NaCl溶液能导电的原因
高中化学
宏观
微观
高中化学
活动2 探究NaCl溶液能导电的原因
能够导电
NaCl
溶液
Na+ 和Cl
能
自由移动
不能导电
NaCl
固体
Na+和Cl
不能
自由移动
加水溶解,
NaCl
宏观
完全溶解
均一稳定
微观
Na+ 和Cl- 进入水中
Na+ 和Cl-自 由 移 动
活动2 探究NaCl溶液能导电的原因
高中化学
H O-
Na -
将NaCl固体加入水中 水分子与NaCl固体作用 NaCl固体溶解并形成水合离子
NaCl固体在水中的溶解和形成水合离子示意图
高中化学
NaCl溶液导电示意图
与电源负极 相连的电极
与电源正极 相连的电极
高中化学
CI H O
Na+
实验 序号 物质 实验 现象 导电 性
微观解释
1 NaCI 溶液 灯泡 亮 能够 导电
有自由移动的 带电粒子
2 蒸馏水 灯泡 不亮 不能 导电
无大量
带电粒子
3 NaCl 固体 灯泡 不亮 不能 导电
有带电粒子, 不能自由移动
4 熔融 NaCl 灯泡 亮 能够 导电
有自由移动的 带电粒子
湿手不要摸电器 干燥绝缘要牢记
高中化学
能够导电
NaCl 溶 液
熔 融NaCl
加水溶解
加热熔化
Na+和Cl
不能
自由移动
Na+ 和Cl
能
自由移动
不能导电
NaCl固 体
高中化学
微观
电离
宏观
电解质溶于水或受热熔化时,
形成自由移动的离子的过程。
电离
高中化学
加水溶解
或
加热熔化
电解质 溶液
熔融 电解质
形成
自由移动的离子
能导电
电解质
高中化学
电离
微观
宏观
电解质
在水溶液里或熔融状态下能够
导电的化合物叫做电解质。
高中化学
思考
结合初中做过的物质导电性实验, 列举电解质。
HCl、NaOH、KNO 等都是电解质
高中化学
加水溶解
或
加热熔化
电解质 溶液
熔融 电解质
形成
自由移动的离子
微观
符号
电离
能导电
电解质
高中化学
宏观
3.NaCl==Na++Cl-
活动3 用化学用语表示NaCl的电离
Na++Cl-
Na++Cl-
1.NaC|
2.NaC|
水
熔融
高中化学
活动3 用化学用语表示NaCl的电离
NaCl的电离方程式:
NaCl=—Na++Cl-
高中化学
微观
符号
高中化学
形成
自由移动的离子
电离方程式 NaCl——Na++Cl-
加水溶解
或
加热熔化
电解质 溶液
熔融 电解质
电离
能导电
电解质
宏观
任务一
分析BaS0 在水中的主要存在形式
资料1 25 ℃时,BaSO 的溶解度为2.38×10-4 g
资料2 (25 ℃)
蒸馏水
饱和BaSO 溶液
电导率 (S/m) 1.52×10-4
4.58×10-4
高中化学
任务一
分析BaSO 在水中的主要存在形式
A同学: BaSO 难溶→ BaSO 固体
B同学: BaSO 属于盐→在水中电离→
2-
自由移动的 Ba +和SO
高中化学
BaSO 在水中的变化过程
BaSO
在水中的主要存在形式
大多数BaSO 不溶解 极少数BaSO 溶解
大量BaSO 固体
任务 一
分析BaSO 在水中的主要存在形式
资料1 25 ℃时,BaSO 的溶解度为2.38×10-4 g
高中化学
任务一
分析BaS0 在水中的主要存在形式
资料125 ℃时, BaSO 的溶解度为2.38×10-4 g
资料2 (25 ℃)
蒸馏水
饱和BaSO 溶液
电导率 (S/m) 1.52×10-4
4.58×10-4
高中化学
BaSO 在水中的变化过程
BaSO
在水中的主要存在形式
大多数BaSO 不溶解 极少数BaSO 溶解
大量BaSO 固体
溶解的BaSO 发生电离
极少量自由移动的
2-
Ba +、SO
任务一
分析BaSO 在水中的主要存在形式
高中化学
任务一
分析BaSO 在水中的主要存在形式
A同学: BaSO 难溶→ BaSO 固体
B同学: BaSO 是电解质→在水中电离→
2-
自由移动的 Ba2+和SO
C同学:主要以BaSO 固体形式存在,
2-
极少量的自由移动的 Ba +和SO
高中化学
物 质 物质在水中的变化过程
物质在水中的 主要存在形式
宏观 微观 NaCl 溶解 电离
自由移动的Na+、Cl-
BaSO 大多数 不溶解 极少数溶解 的发生电离
大量BaSO 固体,
极少量自由移动的 Ba 、SO
物质在水中的主要存在形式
高中化学
是否溶解
(宏观)
是
业
能否电离 (微观)
碳酸钙固体在水中的主要存在形式
物质
在水中的 存在形式
物质
在水中的 变化过程
自由移动 的离子
否 能
固体形式
高中化学
任务二
从电离的角度认识溶液,书写电离方程式
第一组: HCl、H SO 、HNO
第 二 组 :NaOH 、KOH 、Ba(OH)
第三组: KCl、Na CO 、CuSO
高中化学
第 一 组 :HCI、H SO 、HNO
酸
HCI= H+ +CI-
2-
H SO = 2H+ +SO
HNO = H+ +NO
任务二
从电离的角度认识溶液,书写电离方程式
酸
电离时生成的 阳离子全部是 H+的化合物。
高中化学
第 二 组 :NaOH、KOH、Ba(OH)
碱
Na0H=Na++OH
KOH =K++OH-
Ba(OH) =Ba ++20H
任务二
从电离的角度认识溶液,书写电离方程式
碱
电离时生成的 阴离子全部是 OH-的化合物。
高中化学
任务二
从电离的角度认识溶液,书写电离方程式
第 三 组 :KCl、Na CO 、CuSO
盐
KC|=K++Cl-
2-
Na CO =2Na++CO;
CuSO =Cu ++SO
高中化学
任务二
从电离的角度认识溶液,书写电离方程式
第一组(酸) HCI、H SO 、HNO
第 二 组 (碱 ) NaOH、KOH、Ba(OH)
第 三 组 (盐 ) KCl 、Na CO 、CuSO
高中化学
讨论 如何判断某物质是否是电解质
1 宏观实验事实
—水溶液里或熔融状态下能够导电的化合物
2 微观粒子构成
—由离子构成的化合物
3 物质类别的角度
—酸、碱和大多数盐
高中化学
离子反应(第一课时)
高中化学
NaCl溶液能导电
湿手不要摸电器 干燥绝缘要牢记
高中化学
活动1 设计实验证明NaCl溶液能导电
高中化学
物质 实验现象
导电性
NaCl溶液 灯泡亮
能够导电
活动1 设计实验证明NaCl溶液能导电
高中化学
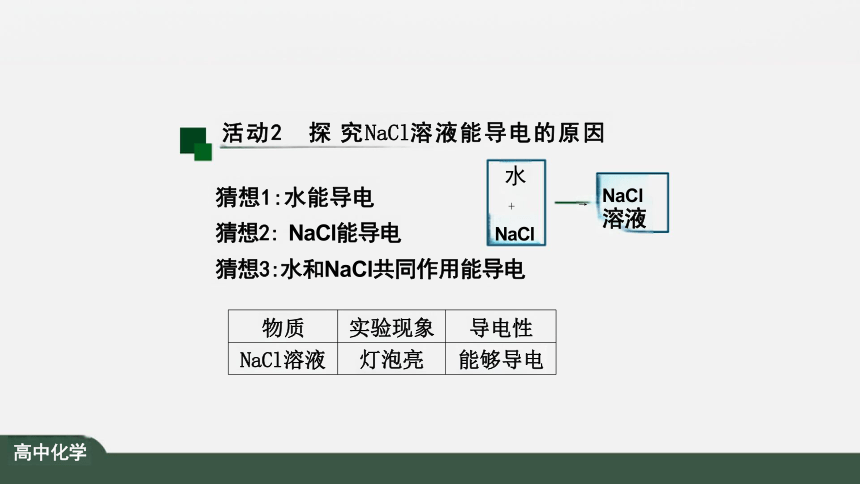
猜想1:水能导电 +
猜想2: NaCl能导电 NaCl 猜想3:水和NaCl共同作用能导电
物质 实验现象
导电性
NaCl溶液 灯泡亮
能够导电
活动2 探 究NaCl溶液能导电的原因
NaCl 溶液
→
高中化学
水
实验 序号 物质 实验现象
导电性
1 NaCl溶润 2 蒸馏水 3 NaCl固体
活动2 探究NaCl溶液能导电的原因
高中化学
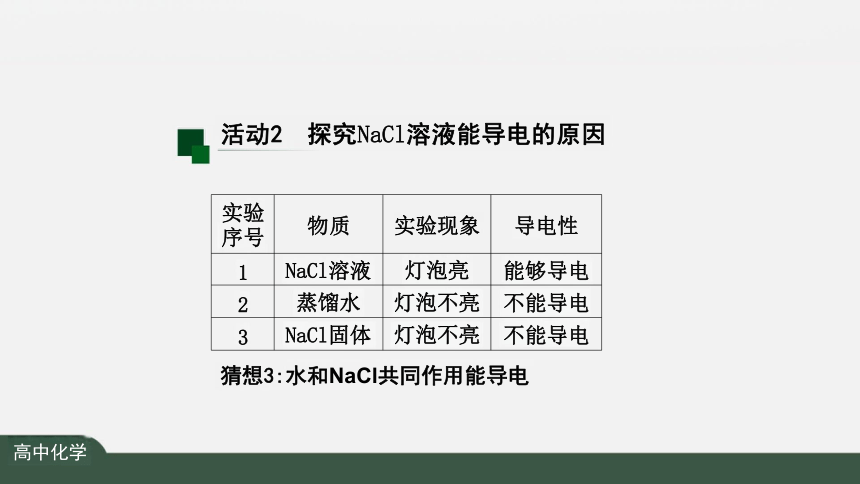
实验 序号 物质 实验现象
导电性
1 NaCl溶液 灯泡亮
能够导电
2 蒸馏水 灯泡不亮
不能导电
3 NaCl固体 灯泡不亮
不能导电
猜想3:水和NaCl共同作用能导电
高中化学
活动2 探究NaCl溶液能导电的原因
电流是由 带电荷的粒子 按一定方向移 动而形成的
活动2 探究NaCl溶液能导电的原因
高中化学
活动2 探究NaCl溶液能导电的原因
猜想4: NaCl溶液中有自由移动的带电粒子
高中化学
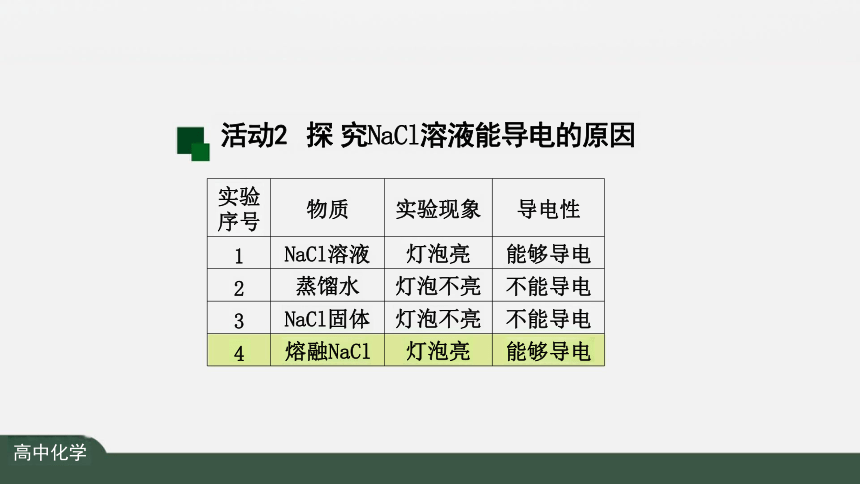
实验 序号 物质 实验现象
导电性
1 NaCl溶液 灯泡亮
能够导电
2 蒸馏水 灯泡不亮
不能导电
3 NaCl固体 灯泡不亮
不能导电
4 熔融NaCl 灯泡亮
能够导电
活动2 探 究NaCl溶液能导电的原因
高中化学
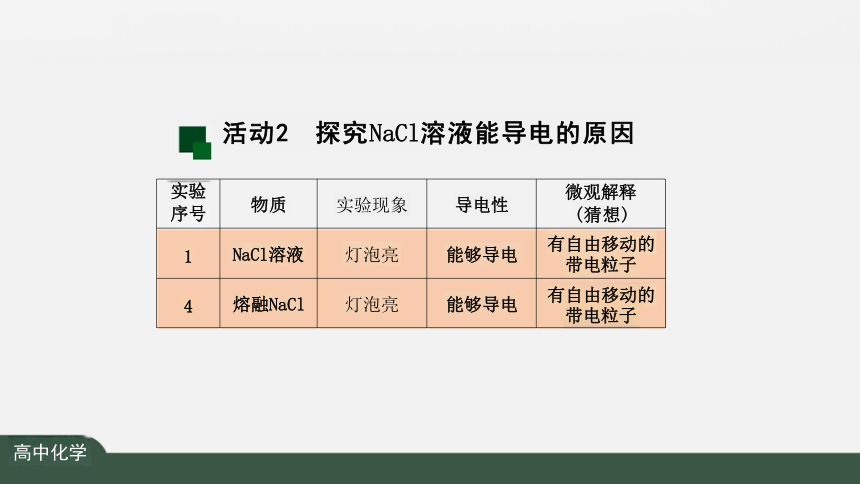
实验 序号 物质 实验现象 导电性
微观解释
(猜想)
1 NaCl溶液 灯泡亮 能够导电
有自由移动的 带电粒子
4 熔融NaCl 灯泡亮 能够导电
有自由移动的 带电粒子
活动2 探究NaCl溶液能导电的原因
高中化学
实验 序号 物质 实验现象 导电性
微观解释
(猜想)
1 NaCl溶液 灯泡亮 能够导电
有自由移动的 带电粒子
2 蒸馏水 灯泡不亮 不能导电
3 NaCl固体 灯泡不亮 不能导电
4 熔融NaCl 灯泡亮 能够导电
有自由移动的 带电粒子
活动2 探究NaCl溶液能导电的原因
高中化学
实验 序号 物质 实验现象 导电性
微观解释
(猜想)
3 NaCl固体 灯泡不亮 不能导电
有带电粒子, 不能自由移动
4 熔融NaCl 灯泡亮 能够导电
有自由移动的 带电粒子
活动2 探 究NaCl溶液能导电的原因
高中化学
活动2 探 究NaCl溶液能导电的原因
能够导电
熔融
NaCl
Na+ 和Cl
能
自由移动
不能导电
NaCl
固体
Na+和Cl
不能
自由移动
加热熔化
高中化学
微观
宏观
活动2 探究NaCl溶液能导电的原因
NaCl晶体及其结构模型
高中化学
Na+ CI
+ -A=
一 +- -
+ 一+ 一 -
一)+--
+ ( 一 + - -
干燥的NaCl固体不导电
熔融的NaCl能够导电
与电 源负 —极相 连的 电极
与电 源正 极相 连的 电极
与电源负极 相连的电极
与电源正极 相连的电极
高中化学
Na+
CI
实验 序号 物质 实验现象 导电性
微观解释
(猜想)
1 NaCl溶液 灯泡亮 能够导电
有自由移动的 带电粒子
2 蒸馏水 灯泡不亮 不能导电
无大量带电粒子
3 NaCl固体 灯泡不亮 不能导电
有带电粒子,
不能自由移动
4 熔融NaCl 灯泡亮 能够导电
有自由移动的 带电粒子
活动2 探究NaCl溶液能导电的原因
高中化学
实验 序号 物质 实验现象 导电性
微观解释
(猜想)
1 NaCl溶液 灯泡亮 能够导电
有自由移动的 带电粒子
2 蒸馏水 灯泡不亮 不能导电
无大量带电粒子
3 NaCl固体 灯泡不亮 不能导电
有带电粒子, 不能自由移动
4 熔融NaCl 灯泡亮 能够导电
有自由移动的 带电粒子
活动2 探究NaCl溶液能导电的原因
高中化学
宏观
微观
高中化学
活动2 探究NaCl溶液能导电的原因
能够导电
NaCl
溶液
Na+ 和Cl
能
自由移动
不能导电
NaCl
固体
Na+和Cl
不能
自由移动
加水溶解,
NaCl
宏观
完全溶解
均一稳定
微观
Na+ 和Cl- 进入水中
Na+ 和Cl-自 由 移 动
活动2 探究NaCl溶液能导电的原因
高中化学
H O-
Na -
将NaCl固体加入水中 水分子与NaCl固体作用 NaCl固体溶解并形成水合离子
NaCl固体在水中的溶解和形成水合离子示意图
高中化学
NaCl溶液导电示意图
与电源负极 相连的电极
与电源正极 相连的电极
高中化学
CI H O
Na+
实验 序号 物质 实验 现象 导电 性
微观解释
1 NaCI 溶液 灯泡 亮 能够 导电
有自由移动的 带电粒子
2 蒸馏水 灯泡 不亮 不能 导电
无大量
带电粒子
3 NaCl 固体 灯泡 不亮 不能 导电
有带电粒子, 不能自由移动
4 熔融 NaCl 灯泡 亮 能够 导电
有自由移动的 带电粒子
湿手不要摸电器 干燥绝缘要牢记
高中化学
能够导电
NaCl 溶 液
熔 融NaCl
加水溶解
加热熔化
Na+和Cl
不能
自由移动
Na+ 和Cl
能
自由移动
不能导电
NaCl固 体
高中化学
微观
电离
宏观
电解质溶于水或受热熔化时,
形成自由移动的离子的过程。
电离
高中化学
加水溶解
或
加热熔化
电解质 溶液
熔融 电解质
形成
自由移动的离子
能导电
电解质
高中化学
电离
微观
宏观
电解质
在水溶液里或熔融状态下能够
导电的化合物叫做电解质。
高中化学
思考
结合初中做过的物质导电性实验, 列举电解质。
HCl、NaOH、KNO 等都是电解质
高中化学
加水溶解
或
加热熔化
电解质 溶液
熔融 电解质
形成
自由移动的离子
微观
符号
电离
能导电
电解质
高中化学
宏观
3.NaCl==Na++Cl-
活动3 用化学用语表示NaCl的电离
Na++Cl-
Na++Cl-
1.NaC|
2.NaC|
水
熔融
高中化学
活动3 用化学用语表示NaCl的电离
NaCl的电离方程式:
NaCl=—Na++Cl-
高中化学
微观
符号
高中化学
形成
自由移动的离子
电离方程式 NaCl——Na++Cl-
加水溶解
或
加热熔化
电解质 溶液
熔融 电解质
电离
能导电
电解质
宏观
任务一
分析BaS0 在水中的主要存在形式
资料1 25 ℃时,BaSO 的溶解度为2.38×10-4 g
资料2 (25 ℃)
蒸馏水
饱和BaSO 溶液
电导率 (S/m) 1.52×10-4
4.58×10-4
高中化学
任务一
分析BaSO 在水中的主要存在形式
A同学: BaSO 难溶→ BaSO 固体
B同学: BaSO 属于盐→在水中电离→
2-
自由移动的 Ba +和SO
高中化学
BaSO 在水中的变化过程
BaSO
在水中的主要存在形式
大多数BaSO 不溶解 极少数BaSO 溶解
大量BaSO 固体
任务 一
分析BaSO 在水中的主要存在形式
资料1 25 ℃时,BaSO 的溶解度为2.38×10-4 g
高中化学
任务一
分析BaS0 在水中的主要存在形式
资料125 ℃时, BaSO 的溶解度为2.38×10-4 g
资料2 (25 ℃)
蒸馏水
饱和BaSO 溶液
电导率 (S/m) 1.52×10-4
4.58×10-4
高中化学
BaSO 在水中的变化过程
BaSO
在水中的主要存在形式
大多数BaSO 不溶解 极少数BaSO 溶解
大量BaSO 固体
溶解的BaSO 发生电离
极少量自由移动的
2-
Ba +、SO
任务一
分析BaSO 在水中的主要存在形式
高中化学
任务一
分析BaSO 在水中的主要存在形式
A同学: BaSO 难溶→ BaSO 固体
B同学: BaSO 是电解质→在水中电离→
2-
自由移动的 Ba2+和SO
C同学:主要以BaSO 固体形式存在,
2-
极少量的自由移动的 Ba +和SO
高中化学
物 质 物质在水中的变化过程
物质在水中的 主要存在形式
宏观 微观 NaCl 溶解 电离
自由移动的Na+、Cl-
BaSO 大多数 不溶解 极少数溶解 的发生电离
大量BaSO 固体,
极少量自由移动的 Ba 、SO
物质在水中的主要存在形式
高中化学
是否溶解
(宏观)
是
业
能否电离 (微观)
碳酸钙固体在水中的主要存在形式
物质
在水中的 存在形式
物质
在水中的 变化过程
自由移动 的离子
否 能
固体形式
高中化学
任务二
从电离的角度认识溶液,书写电离方程式
第一组: HCl、H SO 、HNO
第 二 组 :NaOH 、KOH 、Ba(OH)
第三组: KCl、Na CO 、CuSO
高中化学
第 一 组 :HCI、H SO 、HNO
酸
HCI= H+ +CI-
2-
H SO = 2H+ +SO
HNO = H+ +NO
任务二
从电离的角度认识溶液,书写电离方程式
酸
电离时生成的 阳离子全部是 H+的化合物。
高中化学
第 二 组 :NaOH、KOH、Ba(OH)
碱
Na0H=Na++OH
KOH =K++OH-
Ba(OH) =Ba ++20H
任务二
从电离的角度认识溶液,书写电离方程式
碱
电离时生成的 阴离子全部是 OH-的化合物。
高中化学
任务二
从电离的角度认识溶液,书写电离方程式
第 三 组 :KCl、Na CO 、CuSO
盐
KC|=K++Cl-
2-
Na CO =2Na++CO;
CuSO =Cu ++SO
高中化学
任务二
从电离的角度认识溶液,书写电离方程式
第一组(酸) HCI、H SO 、HNO
第 二 组 (碱 ) NaOH、KOH、Ba(OH)
第 三 组 (盐 ) KCl 、Na CO 、CuSO
高中化学
讨论 如何判断某物质是否是电解质
1 宏观实验事实
—水溶液里或熔融状态下能够导电的化合物
2 微观粒子构成
—由离子构成的化合物
3 物质类别的角度
—酸、碱和大多数盐
高中化学
