2.3 物质的量 课件(共28张PPT)
文档属性
| 名称 | 2.3 物质的量 课件(共28张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 00:00:00 | ||
图片预览








文档简介
(共28张PPT)
物质的量(第一课时)
高中化学
活动1 回顾常见的计量方式,寻找规律
高中化学
问题1 水是重要的物质,如何计量
1 t水 3.34×1028个水分子
1 kg水 3.34×1025个水分子
1 L水 3.34×1025个水分子(按1 g/mL计算)
1 mL水 3.34×1022个水分子(按1 g/mL 计算)
高中化学
任务一认识计量微观粒子的物理量
1971年,在第14届国际计量大会上,正式宣 布了“物质的量”是国际单位制中的一个基本物 理量,其单位为摩尔。
高中化学
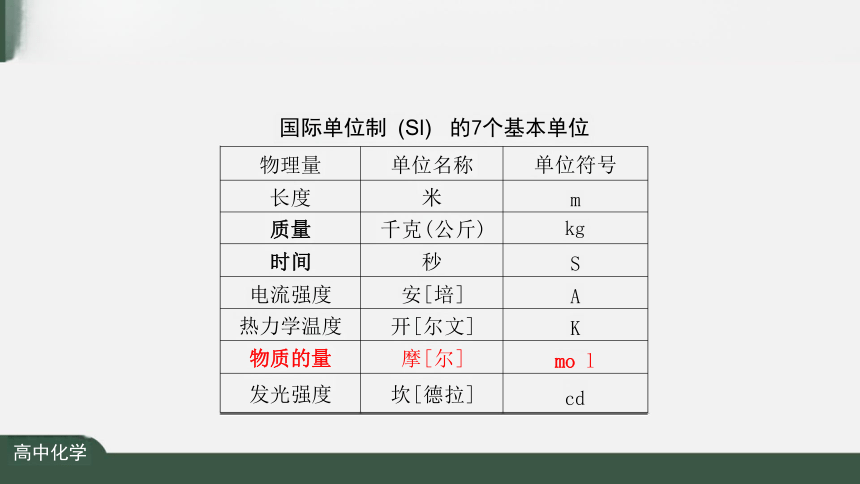
物理量 单位名称
单位符号
长度 米
m
质量 千克(公斤)
kg
时间 秒
S
电流强度 安[培]
A
热力学温度 开[尔文]
K
物质的量 摩[尔]
mo l
发光强度 坎[德拉]
cd
国际单位制 (Sl) 的7个基本单位
高中化学
一 、物质的量的单位 — — 摩尔
物质的量——表示含有一定数目粒子的集合体
符号: n
单位: 摩尔 (mol), 简称摩
高中化学
一、物质的量的单位——摩尔
1盒签字笔12支
1包白纸500张
1盒曲别针100个
■■■■■
1 mol 粒子 多少个
高中化学
一 、物质的量的单位 — — 摩尔
1.国际上规定,1 mol粒子集合体所含的粒
子数约为6.02×1023。1 mol任何粒子的粒子数叫 做阿伏加德罗常数,符号为M, 通常用6.02×1023
mol-1表示。
高中化学
阿伏加德罗
意大利物理学家、化学家, 1776年生于意大利都灵市。
高中化学
作为物质的量的单位,摩尔可以计量原
子、分子、离子、原子团、电子、质子、中
子等微观粒子。
如1 mol Fe、1 mol O 、1 mol Na+、1 mol SO 等
高中化学
任务二建立以物质的量为中心的计量体系
知识巩固
1.1 mol H O中约含有6 .02×1023 个水分子; 2.0.5 mol NaOH中约含有 3 .01×1023 个Na+;
3.6.02×1023个H 相 当 于 1molH ;
4.1.204×1024个NO 相 当 于 2 molNO 。
高中化学
一 、物质的量的单位——摩尔
2.物质的量与粒子数之间的关系:
物质的量 人n(mol) N (个)
高中化学
÷N(mol-1)
知识迁移
H O ~ 2 H ~ 0
1×6.02×1023 2×6.02×1023 1×6.02×1023
1 mol 2 mol 1 mol
粒子数之比 = 物质的量之比
B=D
高中化学
问题2 分享“1 molH O” 的含义
同学A: 水分子的物质的量为1 mol;
同学B:1 molH O所含的分子数约为6.02×1023个;
同学C:1 molH O中所含的氢原子数约为1.204×1024个;
同学D:1 molH O中所含的氧原子数约为6.02×1023个;
同学E:1 molH O中含有2 mol氢原子,1 mol氧原子
■■■■
高中化学
问题2 分享“1 molH O” 的含义
①1个水分子的质量 ---- 质量 <--- -②总结规律
③数学推导
1 mol H O
1 mol水分子 2 mol氢原子和1 mol氧原子
1 mol水中
6.02×1023个水分子 1.204×1024个氢原子 1个水分子中 6.02×1023个氧原子
有2个氢原子1个氧原子
高中化学
序号 物质 相对原子(分子)质量 质量
物质的量
1 Fe 56 56 g
1 mol
2 Cu 64 64 g
1 mol
3 Al 27 27 g
1 mol
4 Zn 65 65 g
1 mol
5 S 32 32 g
1 mol
6 NaCI 58.5 58.5 g
1 mol
7 H O 18 18 g
1 mol
8 蔗糖 342 342 g
1 mol
活动2 阅读教材,总结规律
高中化学
一 、物质的量的单位 — — 摩尔
3. 摩尔质量——单位物质的量的物质所具有的质量
符号: M
单位: g/mol 或 g·mol-1
表达式:
摩尔质量数值 =相对原子(分子)质量
高中化学
摩尔质量
相对分子质量
H O 18 g/mol
18
H SO 98 g/mol
98
NaOH 40 g/mol
40
知识巩固
高中化学
一、物质的量的单位——摩尔
×M(g/mol)
→
÷M(g/mol)
4. 物质的量与质量之间的关系:
物质的量
n(mol)
质量
m(g)
高中化学
问题3 计算1 molH 0的质量
18 g H O
×18 g/mol
1 mol H O
1 mol水分子 2 mol氢原子和1 mol氧原子
1.204×1024个氢原子
6.02×1023个氧原子
1个水分子中
有2个氢原子1个氧原子
高中化学
6.02×1023个水分子
问题3 计算1 molH 0的质量
宏观 质量 18 g H O
(m) ×18
H O
物质的量
(n) 1 mol水分子 2 mol氢原子和1 mol氧原子
1.204×1024个氢原子
微观 粒( )数 6.02×1023个水分子 6.02×1023个氧原子
有2个氢原子1个氧原子
高中化学
1个水分子中
N
子
18 g H O
×18 g/mol
1 mol H O
1 mol水分子 2 mol氢原子和1 mol氧原子
6.02×1023个水分子
1个水分子中
有2个氢原子1个氧原子
高中化学
个氧原子
4个氢原子
3
2
2
0
0
1
1
×
02
20
.
.
6
1
计算H O的质量
18 g H O
×18 g/mol
1 mol H O
1 mol水分子 2 mol氢原子和1 mol氧原子
6.02×1023个水分子
1个水分子中
有2个氢原子1个氧原子
高中化学
个氧原子
4个氢原子
3
2
2
0
0
1
02
20
.
.
6
1
1 mol水分子 2 mol氢原子和1 mol氧原子
6.02×1023个水分子
1个水分子中
有2个氢原子1个氧原子
高中化学
个氧原子
4个氢原子
3
2
2
0
0
1
1
×
02
20
.
.
6
1
计算H O中的粒子数
18 g H O
×18 g/mol
1 mol H O
任务三多水平定量认识物质
问题4 与1 mol H O含有相同氧原子数的0 的质量
16 g O
×32 g/mol
相同氧原子数
1 mol H O → 0.5 mol O
1 mol氧原子 6.02 ×1023个氧原子
高中化学
27 g Al → 1mol Al → 约6.02×1023个铝原子
物质的量
学以致用
微观
宏观
称质量
高中化学
课堂小结
质量、物质的量与粒子数之间的关系:
×阿伏加德罗常数(M)
物质的量 —— 粒子数
(n ) ÷阿伏加德罗常数(w)(N)
物质的量
<—
摩尔质量(M
微观
宏观
质量 (m)÷
×摩尔质量(M
高中化学
——
课后思考
在科学研究或实际生产中,涉及气态物质时,
测量体积往往比称量质量更方便。那么气体体积与
物质的量之间又有什么关系呢
高中化学
物质的量(第一课时)
高中化学
活动1 回顾常见的计量方式,寻找规律
高中化学
问题1 水是重要的物质,如何计量
1 t水 3.34×1028个水分子
1 kg水 3.34×1025个水分子
1 L水 3.34×1025个水分子(按1 g/mL计算)
1 mL水 3.34×1022个水分子(按1 g/mL 计算)
高中化学
任务一认识计量微观粒子的物理量
1971年,在第14届国际计量大会上,正式宣 布了“物质的量”是国际单位制中的一个基本物 理量,其单位为摩尔。
高中化学
物理量 单位名称
单位符号
长度 米
m
质量 千克(公斤)
kg
时间 秒
S
电流强度 安[培]
A
热力学温度 开[尔文]
K
物质的量 摩[尔]
mo l
发光强度 坎[德拉]
cd
国际单位制 (Sl) 的7个基本单位
高中化学
一 、物质的量的单位 — — 摩尔
物质的量——表示含有一定数目粒子的集合体
符号: n
单位: 摩尔 (mol), 简称摩
高中化学
一、物质的量的单位——摩尔
1盒签字笔12支
1包白纸500张
1盒曲别针100个
■■■■■
1 mol 粒子 多少个
高中化学
一 、物质的量的单位 — — 摩尔
1.国际上规定,1 mol粒子集合体所含的粒
子数约为6.02×1023。1 mol任何粒子的粒子数叫 做阿伏加德罗常数,符号为M, 通常用6.02×1023
mol-1表示。
高中化学
阿伏加德罗
意大利物理学家、化学家, 1776年生于意大利都灵市。
高中化学
作为物质的量的单位,摩尔可以计量原
子、分子、离子、原子团、电子、质子、中
子等微观粒子。
如1 mol Fe、1 mol O 、1 mol Na+、1 mol SO 等
高中化学
任务二建立以物质的量为中心的计量体系
知识巩固
1.1 mol H O中约含有6 .02×1023 个水分子; 2.0.5 mol NaOH中约含有 3 .01×1023 个Na+;
3.6.02×1023个H 相 当 于 1molH ;
4.1.204×1024个NO 相 当 于 2 molNO 。
高中化学
一 、物质的量的单位——摩尔
2.物质的量与粒子数之间的关系:
物质的量 人
高中化学
÷N(mol-1)
知识迁移
H O ~ 2 H ~ 0
1×6.02×1023 2×6.02×1023 1×6.02×1023
1 mol 2 mol 1 mol
粒子数之比 = 物质的量之比
B=D
高中化学
问题2 分享“1 molH O” 的含义
同学A: 水分子的物质的量为1 mol;
同学B:1 molH O所含的分子数约为6.02×1023个;
同学C:1 molH O中所含的氢原子数约为1.204×1024个;
同学D:1 molH O中所含的氧原子数约为6.02×1023个;
同学E:1 molH O中含有2 mol氢原子,1 mol氧原子
■■■■
高中化学
问题2 分享“1 molH O” 的含义
①1个水分子的质量 ---- 质量 <--- -②总结规律
③数学推导
1 mol H O
1 mol水分子 2 mol氢原子和1 mol氧原子
1 mol水中
6.02×1023个水分子 1.204×1024个氢原子 1个水分子中 6.02×1023个氧原子
有2个氢原子1个氧原子
高中化学
序号 物质 相对原子(分子)质量 质量
物质的量
1 Fe 56 56 g
1 mol
2 Cu 64 64 g
1 mol
3 Al 27 27 g
1 mol
4 Zn 65 65 g
1 mol
5 S 32 32 g
1 mol
6 NaCI 58.5 58.5 g
1 mol
7 H O 18 18 g
1 mol
8 蔗糖 342 342 g
1 mol
活动2 阅读教材,总结规律
高中化学
一 、物质的量的单位 — — 摩尔
3. 摩尔质量——单位物质的量的物质所具有的质量
符号: M
单位: g/mol 或 g·mol-1
表达式:
摩尔质量数值 =相对原子(分子)质量
高中化学
摩尔质量
相对分子质量
H O 18 g/mol
18
H SO 98 g/mol
98
NaOH 40 g/mol
40
知识巩固
高中化学
一、物质的量的单位——摩尔
×M(g/mol)
→
÷M(g/mol)
4. 物质的量与质量之间的关系:
物质的量
n(mol)
质量
m(g)
高中化学
问题3 计算1 molH 0的质量
18 g H O
×18 g/mol
1 mol H O
1 mol水分子 2 mol氢原子和1 mol氧原子
1.204×1024个氢原子
6.02×1023个氧原子
1个水分子中
有2个氢原子1个氧原子
高中化学
6.02×1023个水分子
问题3 计算1 molH 0的质量
宏观 质量 18 g H O
(m) ×18
H O
物质的量
(n) 1 mol水分子 2 mol氢原子和1 mol氧原子
1.204×1024个氢原子
微观 粒( )数 6.02×1023个水分子 6.02×1023个氧原子
有2个氢原子1个氧原子
高中化学
1个水分子中
N
子
18 g H O
×18 g/mol
1 mol H O
1 mol水分子 2 mol氢原子和1 mol氧原子
6.02×1023个水分子
1个水分子中
有2个氢原子1个氧原子
高中化学
个氧原子
4个氢原子
3
2
2
0
0
1
1
×
02
20
.
.
6
1
计算H O的质量
18 g H O
×18 g/mol
1 mol H O
1 mol水分子 2 mol氢原子和1 mol氧原子
6.02×1023个水分子
1个水分子中
有2个氢原子1个氧原子
高中化学
个氧原子
4个氢原子
3
2
2
0
0
1
02
20
.
.
6
1
1 mol水分子 2 mol氢原子和1 mol氧原子
6.02×1023个水分子
1个水分子中
有2个氢原子1个氧原子
高中化学
个氧原子
4个氢原子
3
2
2
0
0
1
1
×
02
20
.
.
6
1
计算H O中的粒子数
18 g H O
×18 g/mol
1 mol H O
任务三多水平定量认识物质
问题4 与1 mol H O含有相同氧原子数的0 的质量
16 g O
×32 g/mol
相同氧原子数
1 mol H O → 0.5 mol O
1 mol氧原子 6.02 ×1023个氧原子
高中化学
27 g Al → 1mol Al → 约6.02×1023个铝原子
物质的量
学以致用
微观
宏观
称质量
高中化学
课堂小结
质量、物质的量与粒子数之间的关系:
×阿伏加德罗常数(M)
物质的量 —— 粒子数
(n ) ÷阿伏加德罗常数(w)(N)
物质的量
<—
摩尔质量(M
微观
宏观
质量 (m)÷
×摩尔质量(M
高中化学
——
课后思考
在科学研究或实际生产中,涉及气态物质时,
测量体积往往比称量质量更方便。那么气体体积与
物质的量之间又有什么关系呢
高中化学
