3.2 金属材料 课件(共30张PPT)
文档属性
| 名称 | 3.2 金属材料 课件(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 09:35:31 | ||
图片预览










文档简介
(共30张PPT)
金属材料(第二课时)
高中化学
任务1 通过铝及铝合金的应用,你
认识了铝的哪些性质 还有哪些角 度可以进一步认识铝的性质
高中化学
性质
结构
类别
高中化学
用途
铝的物理性质
具有金属光泽,良好的延展性, 密
度小,质地软,是电、热的良导体。
“硬铝”(含Cu 4%、Mg 0.5%、Mn 0.5%、
Si 0.7%的铝合金)
高中化学
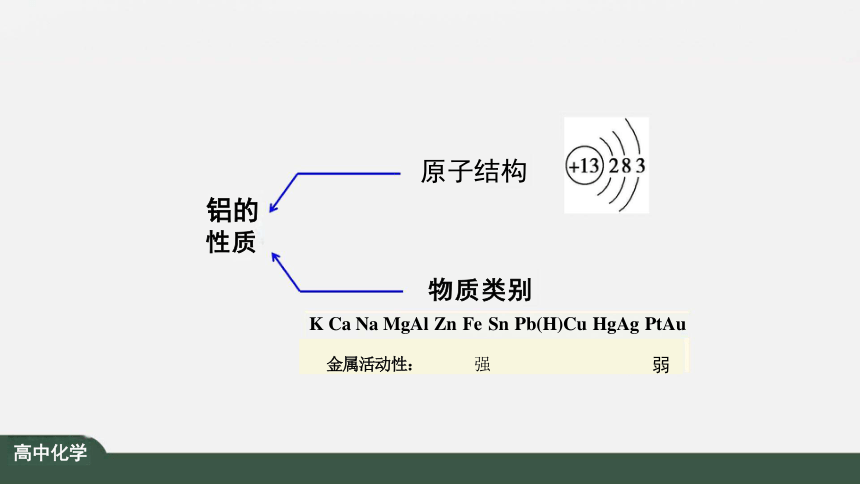
物质类别
K Ca Na MgAl Zn Fe Sn Pb(H)Cu HgAg PtAu
铝的 性质
金属活动性: 强
原子结构
高中化学
弱
1. 与非金属反应
4AI+30 ==2Al O
2. 与酸反应
2Al+6H+ -2AI ++3H ↑
3. 与盐溶液反应
2A|+3Cu2+ —2Al3++3Cu
高中化学
铝的化学性质
进一步探究铝的化学性质
问题1 铝制餐具为何不宜用来蒸煮或 长时间存放酸性或碱性食品
高中化学
任务2 分析实验现象,进一步认
识铝制品的化学性质。
高中化学
铝片与盐酸反应
开始不太明显,随后铝片 表面有气泡产生,气体遇 到明火发生爆鸣
铝片与氢氧化钠 溶液反应
开始没有明显现象,一段 时间后铝片表面有气泡产 生,气体遇到明火发生爆 鸣
高中化学
1.铝表面有某种物质, 能与盐酸和
氢氧化钠溶液反应,但不能产生气 体。
2.表面的物质反应完全之后,内部
的铝能与盐酸和氢氧化钠溶液继续 反应生成可燃性气体。
高中化学
1. 铝表面的物质是什么
Al O
2. 可燃性气体是什么
H
高中化学
思 考
1.氧化铝既能与盐酸又能与氢氧
化钠溶液反应
2.铝既能与盐酸又能与氢氧化钠
溶液反应生成氢气
高中化学
Al O +6HCl =2AICl +3H O
Al O +6H+==2Al ++3H O
Al O +2NaOH =2NaAlO +H O
偏铝酸钠
Al O +20H~=2A1O +H O
偏铝酸根离子
氧化铝的化学性质
既能与酸又能与碱反应
与酸 反应
与碱
反应
高中化学
两性氧化物:既能与酸又能与碱反应生成 盐和水的氧化物
酸性氧化物(例如CO ……)
碱性氧化物(例如Ca0、Na O、
Fe O 、Fe0……)
两性氧化物(例如Al O ……)
高中化学
氧化物
进一步认识铝的化学性质
铝既能与盐酸还能与氢氧化钠溶液
反应生成氢气
2Al+2NaOH+2H O =2NaAlO +3H 1
偏铝酸钠
2Al+20H+2H O =2AlO +3H ↑
偏铝酸根离子
高中化学
问题2 化学方程式是重要的化学用语,你 能从哪些角度认识一个化学方程式
反应物、生成物、反应条件、转化规律、
量的关系 ……
高中化学
问题3 化学方程式中的计量数表示
的是什么量的关系
高中化学
定量认识化学方程式
2Al+2H O+2NaOH=2NaAlO +3H T
化学计量数
2 2 3
之比
扩大 2×6.02×1023: 2×6.02×1023 3×6.02×1023
6.02×1023倍
之比 2 mol 2 mol 3 mol
高中化学
物质的量
化学方程式中各物质的化学计量数之
比等于参加反应的各物质的物质的量之比。
定量认识化学方程式
2Al+2H O+2NaOH=2NaAlO +3H ↑
2 mol 2 mol 3 mol
物质的量 之比
高中化学
任务3:应用化学方程式中
物质的量的关系进行化学计算
200 mL 1 mol/L NaOH 溶液与足量的铝反应。
计算:
(1)参加反应的铝的质量;
(2)生成的 H 的体积(标准状况)。
高中化学
已知: n(Na0H)=0.2 L×1 mol/L=0.2 mol
方程式 2Al+2H O+2NaOH=2NaAlO +3H ↑ (关系式)
关系量 2 mol 2 mol 3 mol
已、未知量 n(Al) 0.2mol n(H )
高中化学
n(Al)=0.2 mol, m(Al)=5.4 g
n(H )=0.3 mol , V(H )=6.72 L
高中化学
任务4:归纳总结应用物质的量进
行化学方程式计算的方法步骤
高中化学
找准关系式
列比例关系
求出未知量
应用物质的量进行化学方程式计算 的方法步骤
高中化学
应用物质的量进行化学方程式计算
的方法步骤
准确(定性、定量)书写 化学(离子)方程式
找准关系式
高中化学
应用物质的量进行化学方程式计算
的方法步骤
明确已知量和未知量,依据
列比例关系 关系式中计量数确定已、未
知量的物质的量的比例关系,
列出比例式
高中化学
按已、未知量的比例关系先
计算出未知量的物质的量, 再换算成要求的物理量
应用物质的量进行化学方程式计算 的方法步骤
求出未知量
高中化学
知识:
Al —O → Al O
课堂小结
|+
OH-
高中化学
AlO -
Al +
OH-
H+
找准关系式
列比例关系
求出未知量
应用物质的量进行化学方程式计算 的方法步骤
高中化学
课堂小结
研究
物质
创造
宏观
微观
符号
观察
解释
表示
组成
结构 性质
应用
方法:
高中化学
金属材料(第二课时)
高中化学
任务1 通过铝及铝合金的应用,你
认识了铝的哪些性质 还有哪些角 度可以进一步认识铝的性质
高中化学
性质
结构
类别
高中化学
用途
铝的物理性质
具有金属光泽,良好的延展性, 密
度小,质地软,是电、热的良导体。
“硬铝”(含Cu 4%、Mg 0.5%、Mn 0.5%、
Si 0.7%的铝合金)
高中化学
物质类别
K Ca Na MgAl Zn Fe Sn Pb(H)Cu HgAg PtAu
铝的 性质
金属活动性: 强
原子结构
高中化学
弱
1. 与非金属反应
4AI+30 ==2Al O
2. 与酸反应
2Al+6H+ -2AI ++3H ↑
3. 与盐溶液反应
2A|+3Cu2+ —2Al3++3Cu
高中化学
铝的化学性质
进一步探究铝的化学性质
问题1 铝制餐具为何不宜用来蒸煮或 长时间存放酸性或碱性食品
高中化学
任务2 分析实验现象,进一步认
识铝制品的化学性质。
高中化学
铝片与盐酸反应
开始不太明显,随后铝片 表面有气泡产生,气体遇 到明火发生爆鸣
铝片与氢氧化钠 溶液反应
开始没有明显现象,一段 时间后铝片表面有气泡产 生,气体遇到明火发生爆 鸣
高中化学
1.铝表面有某种物质, 能与盐酸和
氢氧化钠溶液反应,但不能产生气 体。
2.表面的物质反应完全之后,内部
的铝能与盐酸和氢氧化钠溶液继续 反应生成可燃性气体。
高中化学
1. 铝表面的物质是什么
Al O
2. 可燃性气体是什么
H
高中化学
思 考
1.氧化铝既能与盐酸又能与氢氧
化钠溶液反应
2.铝既能与盐酸又能与氢氧化钠
溶液反应生成氢气
高中化学
Al O +6HCl =2AICl +3H O
Al O +6H+==2Al ++3H O
Al O +2NaOH =2NaAlO +H O
偏铝酸钠
Al O +20H~=2A1O +H O
偏铝酸根离子
氧化铝的化学性质
既能与酸又能与碱反应
与酸 反应
与碱
反应
高中化学
两性氧化物:既能与酸又能与碱反应生成 盐和水的氧化物
酸性氧化物(例如CO ……)
碱性氧化物(例如Ca0、Na O、
Fe O 、Fe0……)
两性氧化物(例如Al O ……)
高中化学
氧化物
进一步认识铝的化学性质
铝既能与盐酸还能与氢氧化钠溶液
反应生成氢气
2Al+2NaOH+2H O =2NaAlO +3H 1
偏铝酸钠
2Al+20H+2H O =2AlO +3H ↑
偏铝酸根离子
高中化学
问题2 化学方程式是重要的化学用语,你 能从哪些角度认识一个化学方程式
反应物、生成物、反应条件、转化规律、
量的关系 ……
高中化学
问题3 化学方程式中的计量数表示
的是什么量的关系
高中化学
定量认识化学方程式
2Al+2H O+2NaOH=2NaAlO +3H T
化学计量数
2 2 3
之比
扩大 2×6.02×1023: 2×6.02×1023 3×6.02×1023
6.02×1023倍
之比 2 mol 2 mol 3 mol
高中化学
物质的量
化学方程式中各物质的化学计量数之
比等于参加反应的各物质的物质的量之比。
定量认识化学方程式
2Al+2H O+2NaOH=2NaAlO +3H ↑
2 mol 2 mol 3 mol
物质的量 之比
高中化学
任务3:应用化学方程式中
物质的量的关系进行化学计算
200 mL 1 mol/L NaOH 溶液与足量的铝反应。
计算:
(1)参加反应的铝的质量;
(2)生成的 H 的体积(标准状况)。
高中化学
已知: n(Na0H)=0.2 L×1 mol/L=0.2 mol
方程式 2Al+2H O+2NaOH=2NaAlO +3H ↑ (关系式)
关系量 2 mol 2 mol 3 mol
已、未知量 n(Al) 0.2mol n(H )
高中化学
n(Al)=0.2 mol, m(Al)=5.4 g
n(H )=0.3 mol , V(H )=6.72 L
高中化学
任务4:归纳总结应用物质的量进
行化学方程式计算的方法步骤
高中化学
找准关系式
列比例关系
求出未知量
应用物质的量进行化学方程式计算 的方法步骤
高中化学
应用物质的量进行化学方程式计算
的方法步骤
准确(定性、定量)书写 化学(离子)方程式
找准关系式
高中化学
应用物质的量进行化学方程式计算
的方法步骤
明确已知量和未知量,依据
列比例关系 关系式中计量数确定已、未
知量的物质的量的比例关系,
列出比例式
高中化学
按已、未知量的比例关系先
计算出未知量的物质的量, 再换算成要求的物理量
应用物质的量进行化学方程式计算 的方法步骤
求出未知量
高中化学
知识:
Al —O → Al O
课堂小结
|+
OH-
高中化学
AlO -
Al +
OH-
H+
找准关系式
列比例关系
求出未知量
应用物质的量进行化学方程式计算 的方法步骤
高中化学
课堂小结
研究
物质
创造
宏观
微观
符号
观察
解释
表示
组成
结构 性质
应用
方法:
高中化学
