4.1 原子结构与元素周期表 课件(共30张PPT)
文档属性
| 名称 | 4.1 原子结构与元素周期表 课件(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 09:37:53 | ||
图片预览







文档简介
(共30张PPT)
原子结构与元素周期表
(第三课时)
高中化学
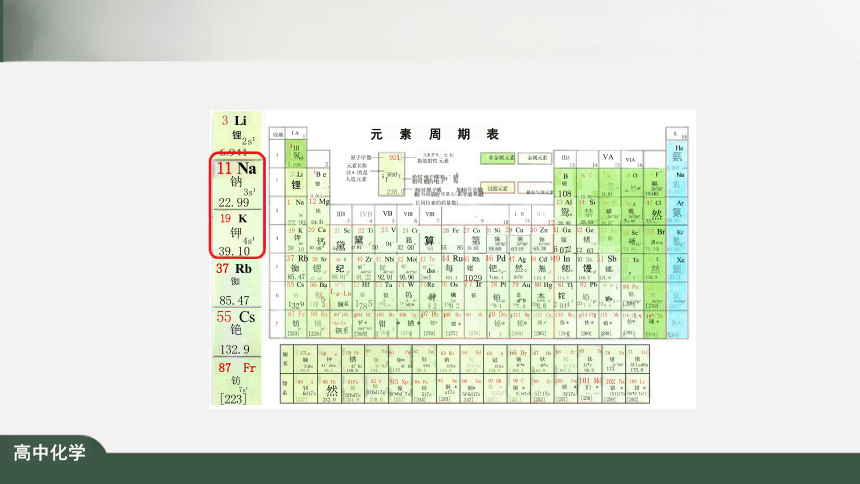
元素周期表如何揭示元素之间的关联
探寻元素性质与周期表的关系
思考
高中化学
元 素 周 期 表 0, 电子层
0族
电子数
周期 A 2 He 氢 .003 K
2
氢 .008 A 原子序数 元素名称 注*的是 人造元素 92 铀 5f'6d'7s 238.0 指放射性元素 非金属元素 金属元素 ⅢA IVA VA VIA VIA 17 2 3 Li 锂 6.941 4 Be 铍 8 9.012 价层电子排布,括号 5 B 硼 262p 10.8 6 C 碳 2p 12.01 7 N 氮 2s2p 14.01 8O 然 [b. 9 E 氟 9.0S 10 Ne 象 20.18
指可能的电子排布 相对原子质量(加括号的数 据为该放射性元素半衰期最 长同位素的质量数) 过渡元素 稀有气体元素 3 11 Na 钠 3s 22.99 12 Mg 镁 3s 24.31 13 A 鸳。 26.98 14 Si 鳞p 28.09 15 P 繁p 30.9 16 S 燕 32.06 17 CI 氯 35 18 Ar 氮。 39.95 w -
ⅢB IVB VB VIB 6 VIIB Vm 10 I B ⅡB 12 4 19 K 钾 4s 39.10 20 Ca 钙 4s 40.08 21 Sc 钪 jd4g 44.96 22 Ti 然 47.8/ 23 V 然 50.94 24 Cr 繁 52.00 25 Mn 算 54.94 26 Fa 练 53.85 27 Co 篮 58.93 28 N 集 58.69 29 Cu 黑 63.55 30 Zn 算 65.38 31 Ga 篮 69.72 32 Ge 锗 s4p 72.63 33 AS 砷 s34o 74.92 34 Se 硒 78.96 35 Br 494p 79.90 36 Kr 氮 83.80
5 37 Rb 铷 8547 38 Sr 锶 87.62 39 Y 88.91 40 Zr 篮 91.22 41 Nb 怨 92.91 42 Mo 钼 4d5s 95.96 43 Tc 锝 dss [98 44 Ru 45 Rh 铑 1029 46 Pd 钯 4d 106.4 47 Ag 银 1079 48 Cd 镉 124 49 ln 锶 114.8 50 Sn 锡 s 3P 118.7 51 Sh 锑 s3p 121.8 52 Te 127.6 53 s sp 26 54 Xe 磐
6 55 Cs 铯 1320 56 Ba 钡 6g 137.3 57~71 La~Lu 镧系 72 Hf 铪 66 178.5 73 Ta 钽 5d6s 80.9 74 W 钨 Sd6s 83.8 75 Re 铼 862 76 Os 锇 5d6s 190.2 7 Ir 铱 5d6s 192.2 78 Pt 铂 5d6s 195.1 79 Au 余 197.0 80 Hg 柔 200.6 81 Tl 铊 6s'6p 204.4 82 Pb 铅 SD 207.2 83 Bi 铋 209.0 84 Po 钋 S-6p [209] 5A 砹 1 86 Rn 氡 Sp
7 87 Fr 钫 [223] 88 Ra 镭 [226] 89~103 Ac~Lr 锏系 104 Rf 铲* (6d 7w) 265] 105 Db 钳* (6d'7s) [268] 06 Sg 镇* 2711 07 Bh 铍* [270] 08 Hs 锶* 277 09 Mt 钹* [276] 10 Ds 铋* 2811 11 Rg 铊* [280] 112 Cn 镉 [285] 113 NB 你* [284] 114 F 铁* [289] 15 Ma 馍* 288] 116 LV 位 293] 7 Ts 研* 294 180g 氮* [294]
镧 系 57 La 镧 dl 138.9 58 Cc 铈 4f 5d-6s 40.1 59 Pr 镨 4P6s 140.9 60 Nd 钕 41-6s 144.2 61 Pm 钷* 4P0s 145] 62 Sm 钐 4f6s 150.4 63 Eu 铕 4f(s 152.0 64 Gd 钆 4f5d'68 157.3 65 Tb 铽 4fks 158.9 66 Dy 镝 4f6s 162.5 67 Ho 钬 4f"6s 164.9 68 Er 铒 4[6s 67.3 69 Tm 铥 4['6s 168.9 70 Yb 镱 4f s 173.1
71 Lu
铂
4[*5d'6s
175.0
锕系 89 A 钢 6d17s [227] 90 Th 钍 6dP7g 232.0 91 Pa 镁 5f-6d'7s 231.0 92 U 铀 5f*6d7s 238.0 93 Np 锌 5f'6d'7s [237] 94 Pu 钚 5F7s [244] 95 Am 钼* 517s [243] 96 Cm 铝* 516d'7s [247] 97 Bk 倍* 517s [247] 98 Cf 铜* 5P*7s [251] 99 Es 镶 * 5f17s [252] 100 Fm 馈* 5f127s [257] 01 Md 钒* (5f27s) [258] 102 No 锆* (sF7s) [259]
103 Lr
捞* (sf 6d17s) 262|
周期
I A
2
3 Li
锂
2s'
6.941
3
11 Na
钠
3s
22790
4
19 K
钾4s
39.10
5
37 R
铷 5s
85.47
6
55 Cs
铯 6s
132.9
7
87 Fr
钫
7s
[223]
高中化学
元素符号,红色
k
加热时:剧烈燃烧,黄色火焰,生成过氧化钠。
4Na+2O ≌2Na O
钠浮在水面上,熔成小球,四处游动,溶液变为红色。
2Na+2H O=2NaOH+H 1
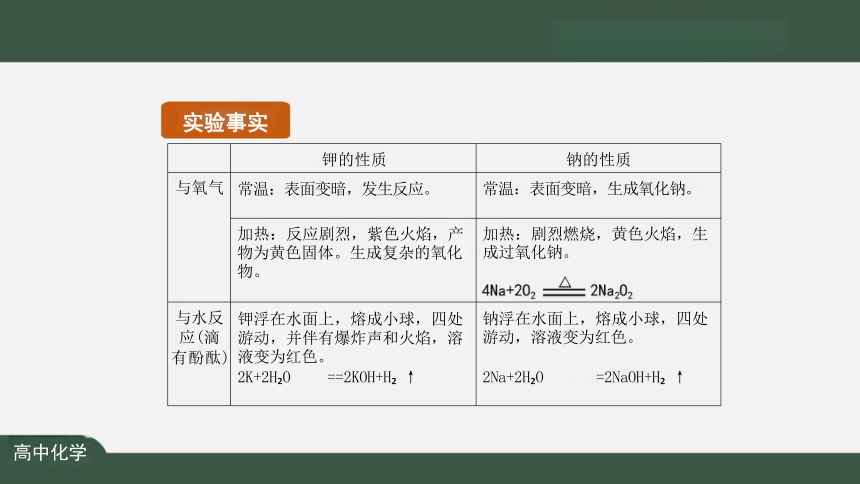
实验事实
常温下:表面变暗,生成氧化钠
钠与水 (滴有 酚酞)
钠与 氧气
高中化学
钾与 氧气
常温下:表面变暗,发生反应
加热时:反应剧烈,紫色火焰,产物为黄色固体。生 成复杂的氧化物。
钾与 水 ( 滴 有酚 酞 )
钾浮在水面上,熔成小球,四处游动,并伴有爆炸声 和火焰,溶液变为红色
2K+2H O=2KOH+H ↑
实验事实
高中化学
钾的性质
钠的性质
与氧气 常温:表面变暗,发生反应。
常温:表面变暗,生成氧化钠。
加热:反应剧烈,紫色火焰,产 物为黄色固体。生成复杂的氧化 物。
加热:剧烈燃烧,黄色火焰,生 成过氧化钠。
4Na+2O =△=2Na O
与水反 应(滴 有酚酞) 钾浮在水面上,熔成小球,四处 游动,并伴有爆炸声和火焰,溶 液变为红色。 2K+2H O ==2KOH+H ↑
钠浮在水面上,熔成小球,四处 游动,溶液变为红色。
2Na+2H O =2NaOH+H ↑
实验事实
高中化学
比较K与Na的化学性质
·相似:①都能与水反应生成碱和氢气
②都能与氧气剧烈反应
·不同:①钾与水反应比钠与水反应更剧烈
②钾燃烧的产物比钠燃烧的产物复杂
实验事实
都从0价转 化为+1价
高中化学
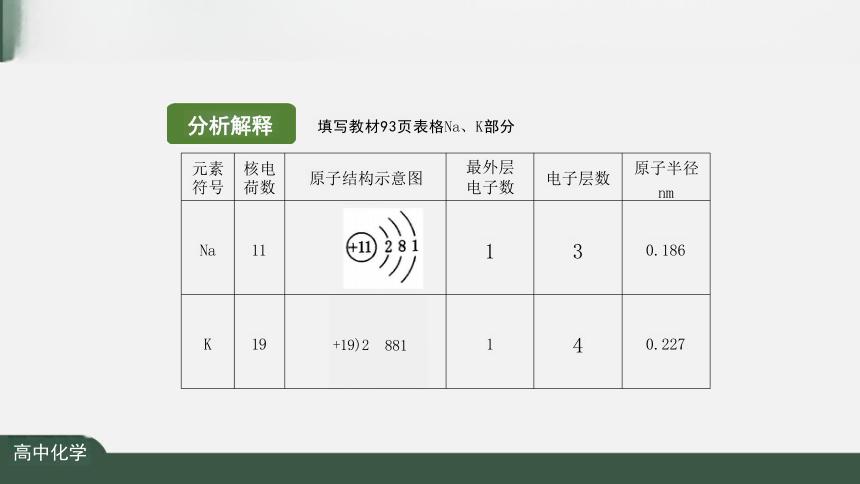
元素 符号 核电 荷数 原子结构示意图 最外层 电子数 电子层数
原子半径
nm
Na 11 +11 281 1 3
0.186
K 19 1 4
0.227
+19)2 881
分析解释
填写教材93页表格Na、K部分
高中化学
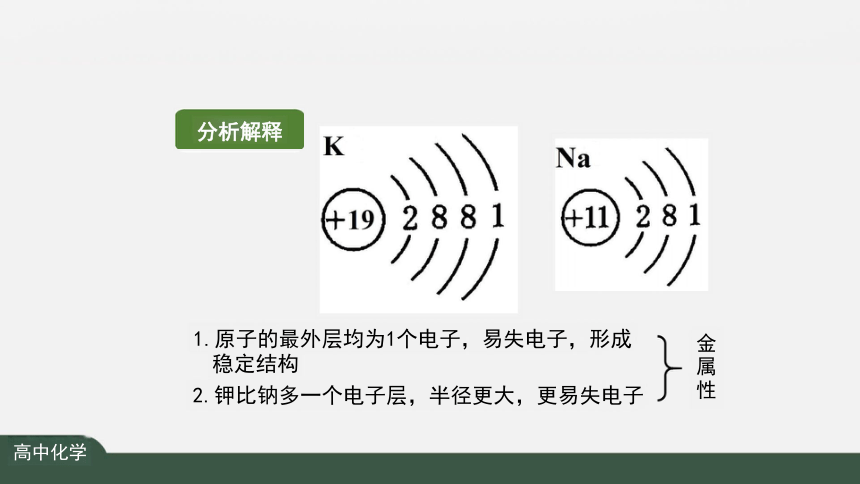
1.原子的最外层均为1个电子,易失电子,形成 稳定结构
2.钾比钠多一个电子层,半径更大,更易失电子
高中化学
分析解释
金属性
金属性判断依据
·单质与水(或酸)反应置换出氢的难易程度
钾与水反应比钠与水反应更容易—→金属性:钾>钠
·最高价氧化物对应的水化物-氢氧化物的碱性强弱
碱性强弱:氢氧化钾>氢氧化钠—→金属性:钾>钠
高中化学
资 料
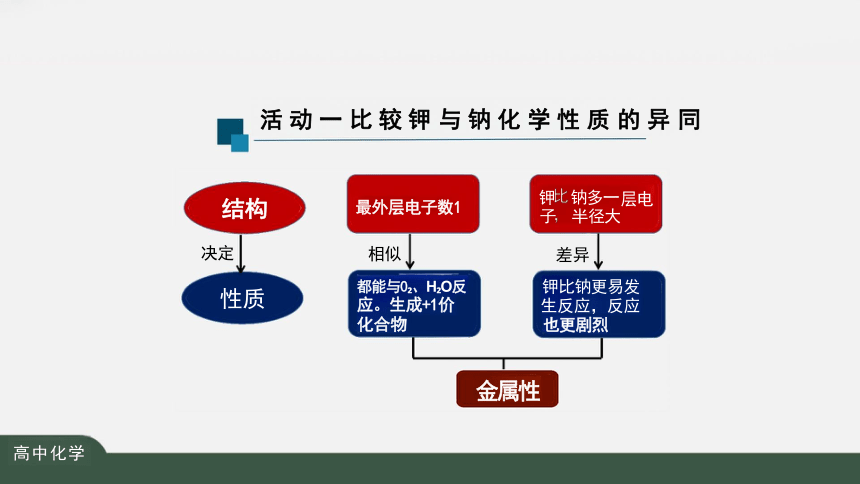
活 动 一 比 较 钾 与 钠 化 学 性 质 的 异 同
结构 最外层电子数1 层电
半径大
钠多一
子
钾
金属性
高中化学
决定 性质 相似 都能与0 、H O反 应。生成+1价 化合物
差异
钾比钠更易发 生反应,反应
也更剧烈
周期 I A 元 素 周 期 表
1H
氢, ⅡA 原子序数 921 非金属元素 金属元素 ⅢA IVA VA
.008 元素名称
2 4 5 6铀d'7 排, 号 5 6 C 7
3 钠 镁3s ⅢB IVB VB VIB VIB Vu 1 B Ⅱ B 鸳。 禁
22.99 24.31 8 10 12 26.98 28.09 30.97
19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As
39 40. 黛 47 50然94 52 54 55然85 58 6 2 72 74 2”
37 Rb 38 Sr 39 Y 40 Zr|41 Nb| 42 Mo| 43 Te 44 Ru45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 5 铷 锶 纪 锆 铌 钼 锝dss 每 铑 钯。 然。 無 鳃。 馒 键。
85.47 87.62 88.91° 91.22 92.91 95.96 [98] 101.1 1029 106.4 1070 112.4 114.8 118.7 121.8 55 Cs 56 Ba 57~71 72 Hf 73 Ta 74 W 75Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 82 Pb 83 Bi
1 9 13 s L 1 5 18 9'6s 18 s 18 19 1 19 19 s 20 2 4 20 20 。”
87 Fr 88 Ra 89~103 104 Rf 105 Db 106 Sg 07 Bh 108 Hs 109 Mt 10 Ds 111 Rg 112 Cn 113 Nh 114 Fl 115 Mc
7 钫 铺 Ac~Lr 铲 * 钳6c'7 镨 * 铍* 锶 * 镂* 铋* 铊* 镯 * 你 * 铁 * 镇 *
[223] 铜系 268] [271] [270] [277] [276] 281] [280] [285] [284] [289] 288]
s)
*
6
9 0
铯
7 2
铅
04
铊
0
b
02
铱
2
6s
0
锇
3d86
钨
05d
钽
78
铪
系
Lu
镧
a~
32
铯
4
9
砷
63
锗
07
镓
00
籍
08”
钙
10
钾
过渡元素
忽
N
硼
B
f
-
素
是
元
的
人造
注*
,20
e
铍
B
锂
3 Li
元素
红色
指放射性
元素符号,
镧 系 57La 镧 5d6s 38.9 58 e 钟 41'5ds 40.1 59 Pr 镨 4f'6s 140.9 60 Na 钕 4f-6s 144. 61 Pm 钷* 4f 6s 145 62 Sm 钐 416 50,4 63 Hu 销 4f6s 152.0 64 Gd 钆 F5d'6s 157.3 65 h 铽 416s 158.9 66 Dy 镝 4P * 162.5 67 Ho 钬 4P s 164.9 68 Er 铒 4f1 6s 167.3 69 Tm 铥 4f s 68.9 70 Yb 镱 173.
71 Lu
镨
4flsd6s 175.0
翎 系 89 A 钊 6d17s [227] 90 Th 然 232.0 91Pa 镁 5f6d7s 231.0 92 U 铀 5f6di7g 238.0 93 Np 镍 5f*6d'7s [237] 94 Pn 钚 517s [244] 95 Am 铜 * sf7s [243] 96 Cm 铜* 5f6d17s 247] 97 BK 铬 * 517g [247] 98 C 铜 * 5[1*7s [25|] 99 Es 5[!17s [252] 100 Fm 锁 * 5f17s [257] 101 Md 们 * [258] 102 No 错 * (51117s [259]
103 Lr
捞 * (Sf d'7s ) [262]
37 Rb
铷
5s
85.47
55 Cs 铯
6s'
132.9
87 Fr
钫
7s
6.941 9.012 238.0 性量元( 稀有气体元素 108 12.01 14.01 1 Na 12 Mg 长同位素的质量数) 13 Al 14 Si 15 P
锂2s
11 Na
钠
3s
22.99
19 K
钾
39.10
VIA
8 O
16.然00
16 S
32.06
34 Se 硒
78.96
52 Te
。
127.6
84 Po
钋
[209
116 I
拉*
[293]
氮
4
83.80
54 Xe
繁
131.3
86Rn
氧
[222]”
118 Og
氮 *
294]
溴484p
79.90
53 I
然
126.9
85 At
砹
Ts
硼 *
294]
高中化学
10 Ne
氮
20.18”
18 Ar
氮
39.95
3 Li
9 F
17 Cl
然
0
2 He
氨
[223]
35 Br 36 Kr
17 4.003
4s
VIA
元素 符号 核电 荷数 原子结构示意图 最外层 电子数 电子层数
原子半径
nm
Li 3 ③ 1 2
0.152
Na 11 +11) 1 3
0.186
K 19 19)2881 1 4
0.227
Rb 37 (37 AN 281881 1 5
0.248
Cs 55 5528i81881 1 6
0.265
活动二预测锂、铷、铯的化学性质
高中化学
活动二预测锂、铷、铯的化学性质
元素 最外层 电子 原子
符号 电子数 层数 半径 ①能与水反应、与氧气反应,
生成+1价的化合物
Li → ②与氧气或水反应时, Li 比
Na Na难反应
K 都是1 ③与氧气或水反应时,Rb、
Rb Cs 比K易 反 应
ψ
Cs
高中化学
逐 渐 变 大
逐渐增多
预测:
·锂与氧气加热时反应,生成氧化锂
4Li+O △=2Li 0
·与水反应时,锂比钠缓慢
·铷、铯遇空气立即燃烧
·铷、铯遇水剧烈反应,甚至爆炸
实验事实
高中化学
3 Li 锂 2s 6.941 11 Na 钠 3s 22.99 19 K 钾 4s 39.10 37 Rb 铷 5s 85.47 55 Cs 铯 6s 132.9 位置 艹 结构 决定 性质 碱金属元素 最外层电子数1 相似性、 能与O 、H O反应。 生成+1价化合物
周期序数逐渐增大
电子层数逐渐增多, 半径逐渐增大
递变性
与水或氧气反应更容 易,也更剧烈
金属性
活动三归纳碱金属的相似性和递变性
1A
周期
2
3
4
5
6
高中化学
活动三归纳碱金属的相似性和递变性
1 A
原子最外层均 为一个电子
电子层
数越来
越多
半径越 来越大
ψ
3 Li
锂
2s 6.941
11 Na
钠 3s
22.99
19 K
钾 4s
39.10
37 Rb
铷
5s 85.47
55 Cs
铯 6s
132.9
单质易与
水或氧气
等反应
周期
2
3
4
5
6
元素金属性 都较强
原子易失去 一个电子
与水反应越来越容易
失电子能力越来越强
金 属 性 越 来 越 强
高中化学
→
→
活动四巩固与应用
已知镁分别能与氧气和水反应。
1.请预测钙的性质
2.请设计实验验证镁与钙金属性的强弱
高中化学
元 素 周 期 表 0 电子层
0族 电子数
周期 1A 2 He 氯 4.003 K
2
1 氢 .008 IA 原子序数 元素名称 注◆的是 人造元素 92 铀 7s 5f'6d 0 238. 元素符号,红色 指放射性元素 非金属元素 金属元素 ⅢA 3 IVA 14 VA VIA VIA 价层电子排布,括号 指可能的电子排布 _相对原子质量(加括号的数 过渡元素 稀有气体元素 据为该放射性元素半衰期最 长同位素的质量数) 2 3 Li 锂 2s 6.941 4 Be 铍 5 B 硼 282p 10.81 6 C 碳 Zs2p 12.01 7 N 氮 2s2p 14.01 8O 煞 16.00 9 F 氮 9.(0 10 Ne 氮 20.18
3 11 N 钠 22.99 12 Mg 镁 24.31 13 AI 鸳 26.98 4 Si 盛 28.09 5 30.97 16 S 盛 32.06 17 CI 然 35.45 18 Ar 氮 39.95 w k
ⅢB IVB VB VIB VIB m 10 I B ⅡB 12 4 19 K 钾 39.10 20Ca 钙 40.05 Sc 篮 .96 22 T 然 47.87 23 V 级 50.94 24 Cr 繁 52.00 25 Mn 算 54.94 26 Fe 然 55.85 27 Co 第 58.93 28 N 堡 58.69 29 Cu 63.55 30 Zn 集 65.38 31 Ga 69.72 32 Ge 锗 s4g 72.63 33 As 砷 54p 74.92 34 Se 硕 78.96 35 Br 79.90 36 Kr 氮 53.80 KLnz
5 37 Rb 铷 85.47 T 锶 87.62 39 钇 88.91 40 Zr 锆 13 91.22 41 Nb 怨 92.91 42 Mo 怨。 95.96 43 Te 锝 d 5s [98] 44 Ru 钉 01.1 45 Rh 铑 102.9° 46 Pd 钯 06.4 47 Ag 银 107.9 48 Cd 镉 d"5s 12.4 49 In 锶 114.8 50 Sn 锡 s5p 118. 51 Sb 锑 121.8 52 Te 5p 127.6 531 26.9 54 Xe 氮 131.3
6 55 Cs 铯 6s 132.9 56 Ba 领 17.3 57~71 La~Lu 酬系 72 Hf 铪 d-6s 178.5 73 Ta 钽 d6s 80.9 74 W 钨 5d*6s 83. 75 Re 铼 5d 6s 862 76 Os 锇 5d*6s 190.2 77 Ir 铱 d6s 192.2 78 Pt 铂 195. s 79 Au 金 5d'6s 197.0 80 Hg 汞 d'6s 200.6 81 Tl 铊 56p 204.4 82 Ph 铅 6s'6p 207.2 83 Bi 铋 6s 6p' 209.0 84 Po 钋 6s 6p^ 209 85 At 砹 6s6p [210 86 Rn 氡 2
7 87 Fr 钫 [223 Ka 2.20 89-103 Ac~Lr 铜系 04 Rf 钻 6dP7s [265] 05 Db 钳* 6d)7s 268 106 Sg 镇* 271 07 Rh 铍* 270] 108 Hs 锶* 277] 109 Mt 镂* 276] 10D 铋* 281] 111 Rg 铊* 280] 112 Cn 销 [285] /1x N 你* [284] 114F 快 289] 15 Me 馍* [288] 16 L 位* 293] 1715 硼* 294] 118 Og 氮* 294]
1
db
镧 系 57 La 镧 5d'6s 138.9 58 Ce 铈 4f|5d'6s 140.1 59 Pr 镨 4[us 140.9 60 Nd 钕 41'6s 144.2 61 Pm 钷* 4F6s 145 62 Sm 钐 4f'6s' 150.4 63 Eu 铕 4f6s 152.0 64 Gd 钆 4f'5d'6s 157.3 65 Tb 铽 4f6s 58.9 66 Dy 镝 4f16s 162.5 67 Ho 钬 4f6s 164.9 68 Er 铒 4(16g 167.3 69 Tm 铥 4fg 168.9 70 Yb 镱 4f+6s 173.1
71 Lu
镥 4[*5d'6s 175.0
钢 系 89 Ac 钢 6d!7s [227] 90 Th 钍 6dF7s 232.0 91 Pa 镁 5f6d-7s 231.0 92 U 钽 5f 6d'7s 238.0 93 Np 锋 sft6d'7s [237] 94 Pu 钚 5P7g [244] 95 Am 钼* 5 [243] 96 Cm 率 5r6d7g [247] 97 Bk 铬* 517g [247] 98 Cf 铜 * 51-7s [251] 99 Es 镶* 5f'I7s [252] 100 Fml 馈* 5f7s [257] lor Md 们* (5f 7s) [258] 102 No 锆* (50473 [259]
103 Lr
捞*
|(5d
[262]
高中化学
确
金属性
高中化学
电子层数(4) 比Mg多一层
金属性比Mg强
与水或氧气反应更 容易,也更剧烈
最外层电子数2
与Mg相似
能与0 、H 0反应。 生成+2价化合物
位置
ψ
结构
决定
业
性质
预测钙的性质
IIA族
12 Mg
镁 3s
24.31
20 Ca
钙
4s 40.08
3
4
Ca
+20)
周期序数4
2882
活动四巩固与应用
2.设计实验验证镁与钙金属性的强弱
方案一比较钙、镁单质分别与水(或酸)反应置换出 氢的难易
方案二比较氢氧化钙与氢氧化镁的碱性强弱
高中化学
1.氢氧化钙是强碱,氢氧化镁是中强碱
碱性强弱: Ca(OH) >Mg(OH) → 金属性:钙>镁
2.IlA 族金属元素最高价氧化物对应水化物
的碱性递变次序如下:
Be(OH)金属性强弱: Be高中化学
ⅡA
2
4 Be
铍
2s 9.012
12 Mg
镁 3s
24.31
20 Ca
钙
4s
40.08
38 Sr
锶
5s
87.62
56 Ba
钡
6s
137.3
2
3
4
5
6
资 料
元素 符号
Be
Mg
Ca
Sr
Ba
高中化学
原子最外
层均为2个 电子
电子层 数越来 越多
半径越 来越大
原子半径
nm
0.111
0.160
0.197
0.215
0.217
④
地 282
4202882
3 81882
;
核电 荷数
4
12
20
38
56
金属性越来越强
→
活动四拓展与应用
原子易 → 失去2 个电子
原子结构示 意图
元素金 → 属性都
失电子能力越来越强
强
较
总结:
元素位置
原子结构
高中化学
性质
碱金属单质
颜色(常态)
Li
银白色
Na
银白色
K
银白色
Rb
银白色
Cs
略带金色光泽
拓展碱金属的物理性质
高中化学
碱金属单质
密度/(g·cm-3)
Li
0.534
Na
0.97
K
0.86
Rb
1.532
Cs
1.879
拓展碱金属的物理性质
高中化学
碱金属单质 熔点/℃
沸点/℃
Li 180.5
1347
Na 97.81
882.9
K 63.65
774
Rb 38.89
688
Cs 28.40
678.4
拓展碱金属的物理性质
高中化学
拓展碱金属的物理性质
·相似性:都比较柔软,有延展性;密度小,
熔点低;有较好的导电导热性。
·递变性:熔沸点逐渐降低
高中化学
课后作业
·查找资料,评价用金属锂做电池的优势和潜
在危险。并对锂电池的使用提出合理的建议。
高中化学
谢谢大家
高中化学
原子结构与元素周期表
(第三课时)
高中化学
元素周期表如何揭示元素之间的关联
探寻元素性质与周期表的关系
思考
高中化学
元 素 周 期 表 0, 电子层
0族
电子数
周期 A 2 He 氢 .003 K
2
氢 .008 A 原子序数 元素名称 注*的是 人造元素 92 铀 5f'6d'7s 238.0 指放射性元素 非金属元素 金属元素 ⅢA IVA VA VIA VIA 17 2 3 Li 锂 6.941 4 Be 铍 8 9.012 价层电子排布,括号 5 B 硼 262p 10.8 6 C 碳 2p 12.01 7 N 氮 2s2p 14.01 8O 然 [b. 9 E 氟 9.0S 10 Ne 象 20.18
指可能的电子排布 相对原子质量(加括号的数 据为该放射性元素半衰期最 长同位素的质量数) 过渡元素 稀有气体元素 3 11 Na 钠 3s 22.99 12 Mg 镁 3s 24.31 13 A 鸳。 26.98 14 Si 鳞p 28.09 15 P 繁p 30.9 16 S 燕 32.06 17 CI 氯 35 18 Ar 氮。 39.95 w -
ⅢB IVB VB VIB 6 VIIB Vm 10 I B ⅡB 12 4 19 K 钾 4s 39.10 20 Ca 钙 4s 40.08 21 Sc 钪 jd4g 44.96 22 Ti 然 47.8/ 23 V 然 50.94 24 Cr 繁 52.00 25 Mn 算 54.94 26 Fa 练 53.85 27 Co 篮 58.93 28 N 集 58.69 29 Cu 黑 63.55 30 Zn 算 65.38 31 Ga 篮 69.72 32 Ge 锗 s4p 72.63 33 AS 砷 s34o 74.92 34 Se 硒 78.96 35 Br 494p 79.90 36 Kr 氮 83.80
5 37 Rb 铷 8547 38 Sr 锶 87.62 39 Y 88.91 40 Zr 篮 91.22 41 Nb 怨 92.91 42 Mo 钼 4d5s 95.96 43 Tc 锝 dss [98 44 Ru 45 Rh 铑 1029 46 Pd 钯 4d 106.4 47 Ag 银 1079 48 Cd 镉 124 49 ln 锶 114.8 50 Sn 锡 s 3P 118.7 51 Sh 锑 s3p 121.8 52 Te 127.6 53 s sp 26 54 Xe 磐
6 55 Cs 铯 1320 56 Ba 钡 6g 137.3 57~71 La~Lu 镧系 72 Hf 铪 66 178.5 73 Ta 钽 5d6s 80.9 74 W 钨 Sd6s 83.8 75 Re 铼 862 76 Os 锇 5d6s 190.2 7 Ir 铱 5d6s 192.2 78 Pt 铂 5d6s 195.1 79 Au 余 197.0 80 Hg 柔 200.6 81 Tl 铊 6s'6p 204.4 82 Pb 铅 SD 207.2 83 Bi 铋 209.0 84 Po 钋 S-6p [209] 5A 砹 1 86 Rn 氡 Sp
7 87 Fr 钫 [223] 88 Ra 镭 [226] 89~103 Ac~Lr 锏系 104 Rf 铲* (6d 7w) 265] 105 Db 钳* (6d'7s) [268] 06 Sg 镇* 2711 07 Bh 铍* [270] 08 Hs 锶* 277 09 Mt 钹* [276] 10 Ds 铋* 2811 11 Rg 铊* [280] 112 Cn 镉 [285] 113 NB 你* [284] 114 F 铁* [289] 15 Ma 馍* 288] 116 LV 位 293] 7 Ts 研* 294 180g 氮* [294]
镧 系 57 La 镧 dl 138.9 58 Cc 铈 4f 5d-6s 40.1 59 Pr 镨 4P6s 140.9 60 Nd 钕 41-6s 144.2 61 Pm 钷* 4P0s 145] 62 Sm 钐 4f6s 150.4 63 Eu 铕 4f(s 152.0 64 Gd 钆 4f5d'68 157.3 65 Tb 铽 4fks 158.9 66 Dy 镝 4f6s 162.5 67 Ho 钬 4f"6s 164.9 68 Er 铒 4[6s 67.3 69 Tm 铥 4['6s 168.9 70 Yb 镱 4f s 173.1
71 Lu
铂
4[*5d'6s
175.0
锕系 89 A 钢 6d17s [227] 90 Th 钍 6dP7g 232.0 91 Pa 镁 5f-6d'7s 231.0 92 U 铀 5f*6d7s 238.0 93 Np 锌 5f'6d'7s [237] 94 Pu 钚 5F7s [244] 95 Am 钼* 517s [243] 96 Cm 铝* 516d'7s [247] 97 Bk 倍* 517s [247] 98 Cf 铜* 5P*7s [251] 99 Es 镶 * 5f17s [252] 100 Fm 馈* 5f127s [257] 01 Md 钒* (5f27s) [258] 102 No 锆* (sF7s) [259]
103 Lr
捞* (sf 6d17s) 262|
周期
I A
2
3 Li
锂
2s'
6.941
3
11 Na
钠
3s
22790
4
19 K
钾4s
39.10
5
37 R
铷 5s
85.47
6
55 Cs
铯 6s
132.9
7
87 Fr
钫
7s
[223]
高中化学
元素符号,红色
k
加热时:剧烈燃烧,黄色火焰,生成过氧化钠。
4Na+2O ≌2Na O
钠浮在水面上,熔成小球,四处游动,溶液变为红色。
2Na+2H O=2NaOH+H 1
实验事实
常温下:表面变暗,生成氧化钠
钠与水 (滴有 酚酞)
钠与 氧气
高中化学
钾与 氧气
常温下:表面变暗,发生反应
加热时:反应剧烈,紫色火焰,产物为黄色固体。生 成复杂的氧化物。
钾与 水 ( 滴 有酚 酞 )
钾浮在水面上,熔成小球,四处游动,并伴有爆炸声 和火焰,溶液变为红色
2K+2H O=2KOH+H ↑
实验事实
高中化学
钾的性质
钠的性质
与氧气 常温:表面变暗,发生反应。
常温:表面变暗,生成氧化钠。
加热:反应剧烈,紫色火焰,产 物为黄色固体。生成复杂的氧化 物。
加热:剧烈燃烧,黄色火焰,生 成过氧化钠。
4Na+2O =△=2Na O
与水反 应(滴 有酚酞) 钾浮在水面上,熔成小球,四处 游动,并伴有爆炸声和火焰,溶 液变为红色。 2K+2H O ==2KOH+H ↑
钠浮在水面上,熔成小球,四处 游动,溶液变为红色。
2Na+2H O =2NaOH+H ↑
实验事实
高中化学
比较K与Na的化学性质
·相似:①都能与水反应生成碱和氢气
②都能与氧气剧烈反应
·不同:①钾与水反应比钠与水反应更剧烈
②钾燃烧的产物比钠燃烧的产物复杂
实验事实
都从0价转 化为+1价
高中化学
元素 符号 核电 荷数 原子结构示意图 最外层 电子数 电子层数
原子半径
nm
Na 11 +11 281 1 3
0.186
K 19 1 4
0.227
+19)2 881
分析解释
填写教材93页表格Na、K部分
高中化学
1.原子的最外层均为1个电子,易失电子,形成 稳定结构
2.钾比钠多一个电子层,半径更大,更易失电子
高中化学
分析解释
金属性
金属性判断依据
·单质与水(或酸)反应置换出氢的难易程度
钾与水反应比钠与水反应更容易—→金属性:钾>钠
·最高价氧化物对应的水化物-氢氧化物的碱性强弱
碱性强弱:氢氧化钾>氢氧化钠—→金属性:钾>钠
高中化学
资 料
活 动 一 比 较 钾 与 钠 化 学 性 质 的 异 同
结构 最外层电子数1 层电
半径大
钠多一
子
钾
金属性
高中化学
决定 性质 相似 都能与0 、H O反 应。生成+1价 化合物
差异
钾比钠更易发 生反应,反应
也更剧烈
周期 I A 元 素 周 期 表
1H
氢, ⅡA 原子序数 921 非金属元素 金属元素 ⅢA IVA VA
.008 元素名称
2 4 5 6铀d'7 排, 号 5 6 C 7
3 钠 镁3s ⅢB IVB VB VIB VIB Vu 1 B Ⅱ B 鸳。 禁
22.99 24.31 8 10 12 26.98 28.09 30.97
19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As
39 40. 黛 47 50然94 52 54 55然85 58 6 2 72 74 2”
37 Rb 38 Sr 39 Y 40 Zr|41 Nb| 42 Mo| 43 Te 44 Ru45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 5 铷 锶 纪 锆 铌 钼 锝dss 每 铑 钯。 然。 無 鳃。 馒 键。
85.47 87.62 88.91° 91.22 92.91 95.96 [98] 101.1 1029 106.4 1070 112.4 114.8 118.7 121.8 55 Cs 56 Ba 57~71 72 Hf 73 Ta 74 W 75Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 82 Pb 83 Bi
1 9 13 s L 1 5 18 9'6s 18 s 18 19 1 19 19 s 20 2 4 20 20 。”
87 Fr 88 Ra 89~103 104 Rf 105 Db 106 Sg 07 Bh 108 Hs 109 Mt 10 Ds 111 Rg 112 Cn 113 Nh 114 Fl 115 Mc
7 钫 铺 Ac~Lr 铲 * 钳6c'7 镨 * 铍* 锶 * 镂* 铋* 铊* 镯 * 你 * 铁 * 镇 *
[223] 铜系 268] [271] [270] [277] [276] 281] [280] [285] [284] [289] 288]
s)
*
6
9 0
铯
7 2
铅
04
铊
0
b
02
铱
2
6s
0
锇
3d86
钨
05d
钽
78
铪
系
Lu
镧
a~
32
铯
4
9
砷
63
锗
07
镓
00
籍
08”
钙
10
钾
过渡元素
忽
N
硼
B
f
-
素
是
元
的
人造
注*
,20
e
铍
B
锂
3 Li
元素
红色
指放射性
元素符号,
镧 系 57La 镧 5d6s 38.9 58 e 钟 41'5ds 40.1 59 Pr 镨 4f'6s 140.9 60 Na 钕 4f-6s 144. 61 Pm 钷* 4f 6s 145 62 Sm 钐 416 50,4 63 Hu 销 4f6s 152.0 64 Gd 钆 F5d'6s 157.3 65 h 铽 416s 158.9 66 Dy 镝 4P * 162.5 67 Ho 钬 4P s 164.9 68 Er 铒 4f1 6s 167.3 69 Tm 铥 4f s 68.9 70 Yb 镱 173.
71 Lu
镨
4flsd6s 175.0
翎 系 89 A 钊 6d17s [227] 90 Th 然 232.0 91Pa 镁 5f6d7s 231.0 92 U 铀 5f6di7g 238.0 93 Np 镍 5f*6d'7s [237] 94 Pn 钚 517s [244] 95 Am 铜 * sf7s [243] 96 Cm 铜* 5f6d17s 247] 97 BK 铬 * 517g [247] 98 C 铜 * 5[1*7s [25|] 99 Es 5[!17s [252] 100 Fm 锁 * 5f17s [257] 101 Md 们 * [258] 102 No 错 * (51117s [259]
103 Lr
捞 * (Sf d'7s ) [262]
37 Rb
铷
5s
85.47
55 Cs 铯
6s'
132.9
87 Fr
钫
7s
6.941 9.012 238.0 性量元( 稀有气体元素 108 12.01 14.01 1 Na 12 Mg 长同位素的质量数) 13 Al 14 Si 15 P
锂2s
11 Na
钠
3s
22.99
19 K
钾
39.10
VIA
8 O
16.然00
16 S
32.06
34 Se 硒
78.96
52 Te
。
127.6
84 Po
钋
[209
116 I
拉*
[293]
氮
4
83.80
54 Xe
繁
131.3
86Rn
氧
[222]”
118 Og
氮 *
294]
溴484p
79.90
53 I
然
126.9
85 At
砹
Ts
硼 *
294]
高中化学
10 Ne
氮
20.18”
18 Ar
氮
39.95
3 Li
9 F
17 Cl
然
0
2 He
氨
[223]
35 Br 36 Kr
17 4.003
4s
VIA
元素 符号 核电 荷数 原子结构示意图 最外层 电子数 电子层数
原子半径
nm
Li 3 ③ 1 2
0.152
Na 11 +11) 1 3
0.186
K 19 19)2881 1 4
0.227
Rb 37 (37 AN 281881 1 5
0.248
Cs 55 5528i81881 1 6
0.265
活动二预测锂、铷、铯的化学性质
高中化学
活动二预测锂、铷、铯的化学性质
元素 最外层 电子 原子
符号 电子数 层数 半径 ①能与水反应、与氧气反应,
生成+1价的化合物
Li → ②与氧气或水反应时, Li 比
Na Na难反应
K 都是1 ③与氧气或水反应时,Rb、
Rb Cs 比K易 反 应
ψ
Cs
高中化学
逐 渐 变 大
逐渐增多
预测:
·锂与氧气加热时反应,生成氧化锂
4Li+O △=2Li 0
·与水反应时,锂比钠缓慢
·铷、铯遇空气立即燃烧
·铷、铯遇水剧烈反应,甚至爆炸
实验事实
高中化学
3 Li 锂 2s 6.941 11 Na 钠 3s 22.99 19 K 钾 4s 39.10 37 Rb 铷 5s 85.47 55 Cs 铯 6s 132.9 位置 艹 结构 决定 性质 碱金属元素 最外层电子数1 相似性、 能与O 、H O反应。 生成+1价化合物
周期序数逐渐增大
电子层数逐渐增多, 半径逐渐增大
递变性
与水或氧气反应更容 易,也更剧烈
金属性
活动三归纳碱金属的相似性和递变性
1A
周期
2
3
4
5
6
高中化学
活动三归纳碱金属的相似性和递变性
1 A
原子最外层均 为一个电子
电子层
数越来
越多
半径越 来越大
ψ
3 Li
锂
2s 6.941
11 Na
钠 3s
22.99
19 K
钾 4s
39.10
37 Rb
铷
5s 85.47
55 Cs
铯 6s
132.9
单质易与
水或氧气
等反应
周期
2
3
4
5
6
元素金属性 都较强
原子易失去 一个电子
与水反应越来越容易
失电子能力越来越强
金 属 性 越 来 越 强
高中化学
→
→
活动四巩固与应用
已知镁分别能与氧气和水反应。
1.请预测钙的性质
2.请设计实验验证镁与钙金属性的强弱
高中化学
元 素 周 期 表 0 电子层
0族 电子数
周期 1A 2 He 氯 4.003 K
2
1 氢 .008 IA 原子序数 元素名称 注◆的是 人造元素 92 铀 7s 5f'6d 0 238. 元素符号,红色 指放射性元素 非金属元素 金属元素 ⅢA 3 IVA 14 VA VIA VIA 价层电子排布,括号 指可能的电子排布 _相对原子质量(加括号的数 过渡元素 稀有气体元素 据为该放射性元素半衰期最 长同位素的质量数) 2 3 Li 锂 2s 6.941 4 Be 铍 5 B 硼 282p 10.81 6 C 碳 Zs2p 12.01 7 N 氮 2s2p 14.01 8O 煞 16.00 9 F 氮 9.(0 10 Ne 氮 20.18
3 11 N 钠 22.99 12 Mg 镁 24.31 13 AI 鸳 26.98 4 Si 盛 28.09 5 30.97 16 S 盛 32.06 17 CI 然 35.45 18 Ar 氮 39.95 w k
ⅢB IVB VB VIB VIB m 10 I B ⅡB 12 4 19 K 钾 39.10 20Ca 钙 40.05 Sc 篮 .96 22 T 然 47.87 23 V 级 50.94 24 Cr 繁 52.00 25 Mn 算 54.94 26 Fe 然 55.85 27 Co 第 58.93 28 N 堡 58.69 29 Cu 63.55 30 Zn 集 65.38 31 Ga 69.72 32 Ge 锗 s4g 72.63 33 As 砷 54p 74.92 34 Se 硕 78.96 35 Br 79.90 36 Kr 氮 53.80 KLnz
5 37 Rb 铷 85.47 T 锶 87.62 39 钇 88.91 40 Zr 锆 13 91.22 41 Nb 怨 92.91 42 Mo 怨。 95.96 43 Te 锝 d 5s [98] 44 Ru 钉 01.1 45 Rh 铑 102.9° 46 Pd 钯 06.4 47 Ag 银 107.9 48 Cd 镉 d"5s 12.4 49 In 锶 114.8 50 Sn 锡 s5p 118. 51 Sb 锑 121.8 52 Te 5p 127.6 531 26.9 54 Xe 氮 131.3
6 55 Cs 铯 6s 132.9 56 Ba 领 17.3 57~71 La~Lu 酬系 72 Hf 铪 d-6s 178.5 73 Ta 钽 d6s 80.9 74 W 钨 5d*6s 83. 75 Re 铼 5d 6s 862 76 Os 锇 5d*6s 190.2 77 Ir 铱 d6s 192.2 78 Pt 铂 195. s 79 Au 金 5d'6s 197.0 80 Hg 汞 d'6s 200.6 81 Tl 铊 56p 204.4 82 Ph 铅 6s'6p 207.2 83 Bi 铋 6s 6p' 209.0 84 Po 钋 6s 6p^ 209 85 At 砹 6s6p [210 86 Rn 氡 2
7 87 Fr 钫 [223 Ka 2.20 89-103 Ac~Lr 铜系 04 Rf 钻 6dP7s [265] 05 Db 钳* 6d)7s 268 106 Sg 镇* 271 07 Rh 铍* 270] 108 Hs 锶* 277] 109 Mt 镂* 276] 10D 铋* 281] 111 Rg 铊* 280] 112 Cn 销 [285] /1x N 你* [284] 114F 快 289] 15 Me 馍* [288] 16 L 位* 293] 1715 硼* 294] 118 Og 氮* 294]
1
db
镧 系 57 La 镧 5d'6s 138.9 58 Ce 铈 4f|5d'6s 140.1 59 Pr 镨 4[us 140.9 60 Nd 钕 41'6s 144.2 61 Pm 钷* 4F6s 145 62 Sm 钐 4f'6s' 150.4 63 Eu 铕 4f6s 152.0 64 Gd 钆 4f'5d'6s 157.3 65 Tb 铽 4f6s 58.9 66 Dy 镝 4f16s 162.5 67 Ho 钬 4f6s 164.9 68 Er 铒 4(16g 167.3 69 Tm 铥 4fg 168.9 70 Yb 镱 4f+6s 173.1
71 Lu
镥 4[*5d'6s 175.0
钢 系 89 Ac 钢 6d!7s [227] 90 Th 钍 6dF7s 232.0 91 Pa 镁 5f6d-7s 231.0 92 U 钽 5f 6d'7s 238.0 93 Np 锋 sft6d'7s [237] 94 Pu 钚 5P7g [244] 95 Am 钼* 5 [243] 96 Cm 率 5r6d7g [247] 97 Bk 铬* 517g [247] 98 Cf 铜 * 51-7s [251] 99 Es 镶* 5f'I7s [252] 100 Fml 馈* 5f7s [257] lor Md 们* (5f 7s) [258] 102 No 锆* (50473 [259]
103 Lr
捞*
|(5d
[262]
高中化学
确
金属性
高中化学
电子层数(4) 比Mg多一层
金属性比Mg强
与水或氧气反应更 容易,也更剧烈
最外层电子数2
与Mg相似
能与0 、H 0反应。 生成+2价化合物
位置
ψ
结构
决定
业
性质
预测钙的性质
IIA族
12 Mg
镁 3s
24.31
20 Ca
钙
4s 40.08
3
4
Ca
+20)
周期序数4
2882
活动四巩固与应用
2.设计实验验证镁与钙金属性的强弱
方案一比较钙、镁单质分别与水(或酸)反应置换出 氢的难易
方案二比较氢氧化钙与氢氧化镁的碱性强弱
高中化学
1.氢氧化钙是强碱,氢氧化镁是中强碱
碱性强弱: Ca(OH) >Mg(OH) → 金属性:钙>镁
2.IlA 族金属元素最高价氧化物对应水化物
的碱性递变次序如下:
Be(OH)
ⅡA
2
4 Be
铍
2s 9.012
12 Mg
镁 3s
24.31
20 Ca
钙
4s
40.08
38 Sr
锶
5s
87.62
56 Ba
钡
6s
137.3
2
3
4
5
6
资 料
元素 符号
Be
Mg
Ca
Sr
Ba
高中化学
原子最外
层均为2个 电子
电子层 数越来 越多
半径越 来越大
原子半径
nm
0.111
0.160
0.197
0.215
0.217
④
地 282
4202882
3 81882
;
核电 荷数
4
12
20
38
56
金属性越来越强
→
活动四拓展与应用
原子易 → 失去2 个电子
原子结构示 意图
元素金 → 属性都
失电子能力越来越强
强
较
总结:
元素位置
原子结构
高中化学
性质
碱金属单质
颜色(常态)
Li
银白色
Na
银白色
K
银白色
Rb
银白色
Cs
略带金色光泽
拓展碱金属的物理性质
高中化学
碱金属单质
密度/(g·cm-3)
Li
0.534
Na
0.97
K
0.86
Rb
1.532
Cs
1.879
拓展碱金属的物理性质
高中化学
碱金属单质 熔点/℃
沸点/℃
Li 180.5
1347
Na 97.81
882.9
K 63.65
774
Rb 38.89
688
Cs 28.40
678.4
拓展碱金属的物理性质
高中化学
拓展碱金属的物理性质
·相似性:都比较柔软,有延展性;密度小,
熔点低;有较好的导电导热性。
·递变性:熔沸点逐渐降低
高中化学
课后作业
·查找资料,评价用金属锂做电池的优势和潜
在危险。并对锂电池的使用提出合理的建议。
高中化学
谢谢大家
高中化学
