4.1 原子结构与元素周期表 课件(共42张PPT)
文档属性
| 名称 | 4.1 原子结构与元素周期表 课件(共42张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 09:38:28 | ||
图片预览




文档简介
(共42张PPT)
原子结构与元素周期表
(第二课时)
高中化学
2015年,国际纯粹与应用化学联合会 (IUPAC) 确认新的超重元素Ts (中文名称-硒)已被发现。
硼有什么性质 它与哪些已知元素性质相似
资 料
问题
高中化学
内在联系 现已发现的一百多种元素之间能否
有序排列或分类
高中化学
环节一寻找元素间的内在联系
元素的性质有何规律可循 元素之间有何
思考
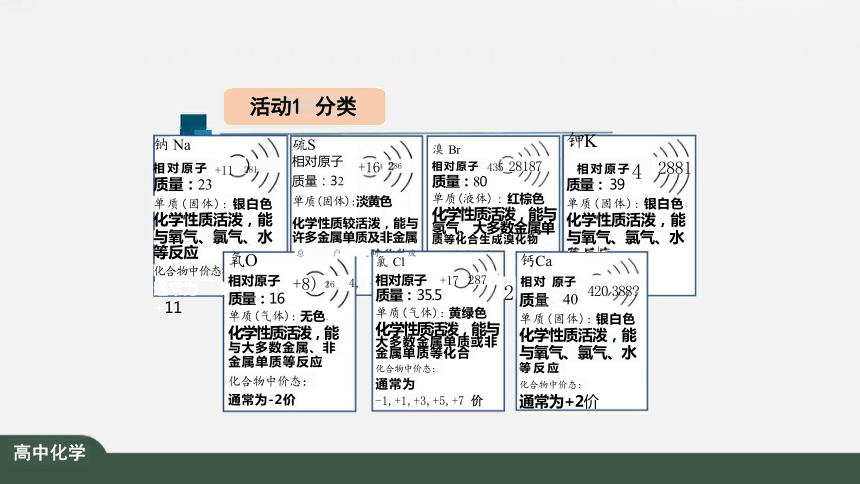
钾K
相 对 原 子 4 2881
质量: 39
单质(固体): 银白色 化学性质活泼,能 与氧气、氯气、水
氧O 总 户 向 成
相对原子 +8) 26 4,
质量:16
单质(气体): 无色
化学性质活泼,能
与大多数金属、非
金属单质等反应
化合物中价态:
通常为-2价
2 420 388
单质(固体): 银白色 化学性质活泼,能 与氧气、氯气、水 等 反 应
化合物中价态:
通常为+2价
40
子
:
原
质量
相 对
相对原子 +17 287 质量: 35.5
单质(气体): 黄绿色
化学性质活泼,能与 大多数金属单质或非 金属单质等化合
化合物中价态:
通常为
-1,+1,+3,+5,+7 价
钠 Na
相 对 原 子 +11 281
质量:23
单质(固体): 银白色 化学性质活泼,能 与氧气、氯气、水
溴 Br
相 对 原 子 435 28187 质量:80
单质(液体) : 红棕色
化学性质活泼,能与 氢气、大多数金属单 质 等 化 合 生 成 溴 化 物
质量:32
单质(固体):淡黄色
化学性质较活泼,能与 许多金属单质及非金属
活动1 分类
等反应
化合物中价态 通常为+11
氯 Cl 钙Ca
硫S
相对原子
高中化学
+16 86
溴 Br
相 对 原 子 435 28is7 质量: 80
单质(液体) 红 棕 色
化学性质活泼,能与 氢气、大多数金属单 质等化合生成溴化物
化合物中价态:
通常为
-1,+1,+3,+5,+7价
氧 O
相对原子
质量: 16
单质(气体): 无 色
化学性质活泼,能 与大多数金属、非 金属单质等反应
化合物中价态:
通常为-2价
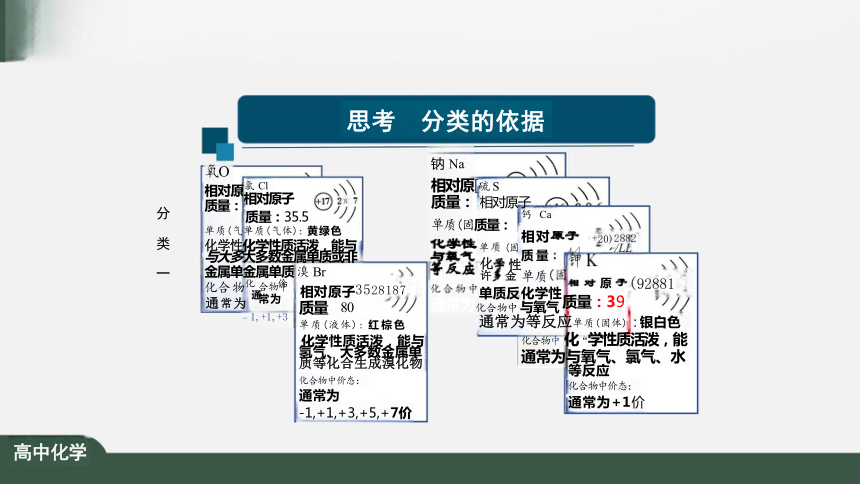
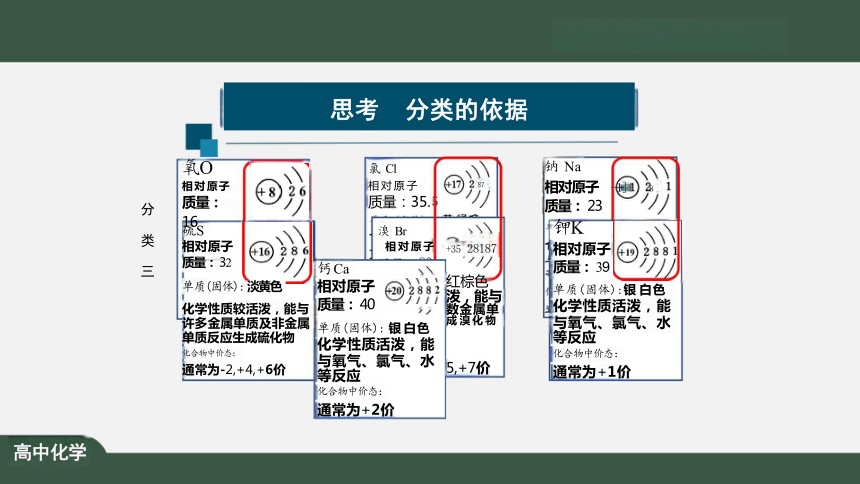
思考 分类的依据
单质(气体) : 黄 绿 色
化学性质活泼,能与 大多数金属单质或非 金属单质等化合
化合物中价态:
通 常 为
-1,+1,+3,+5,+7价
氯 Cl
相 对 原 子
质量: 35.5
高中化学
分 类 一
钠 Na
相对原[硫 S
质量: 相对原子
钙 Ca
单质(固质量:
通常为化合物中 与氧气 质量:3 9
通常为等反应单质(固体) : 银白色 化合物中 化“学性质活泼,能 通常为与氧气、氯气、水
等反应
化合物中价态:
通常为+1价
92881
原
20)
质
量
对
单
质
相
金
性
(固
许
化
单
单质(气单质(气体): 黄 绿 色
化学性化学性质活泼,能与
与大多大多数金属单质或非
金属单金属单质 溴 Br
化通 价 3528187
单质(液体): 红 棕 色
化学性质活泼,能与
氢气、大多数金属单
化合物中价态:
通常为
-1,+1,+3,+5,+7价
-
80
子
:
原
质量
相对
常为
合物中
为
物
常
合
通
化
氧O
相对原
相对原子 质量:
质量:35.5
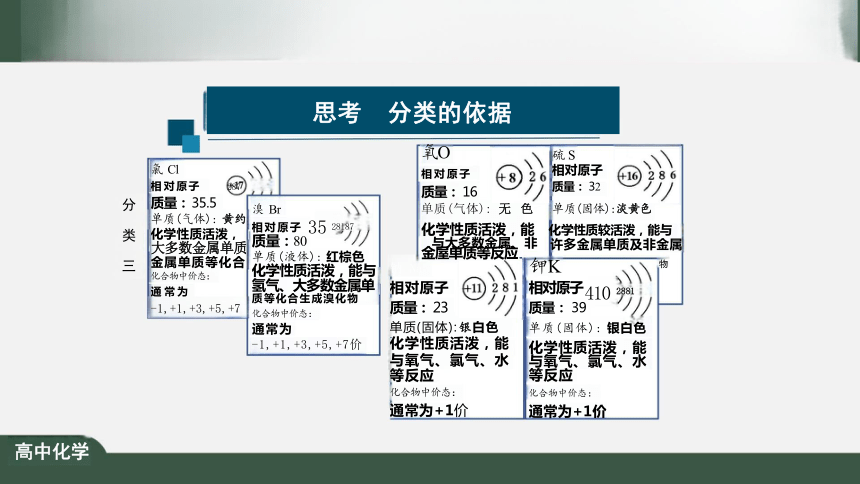
思考 分类的依据
质等化合生成溴化物
高中化学
分 类 一
单质反 化学性
1,+1,+3
氯 Cl
8
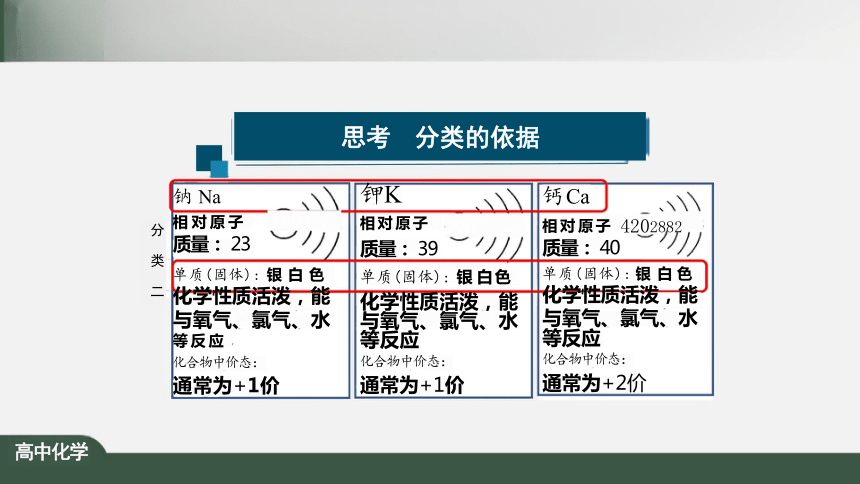
钾K
相 对 原 子 (2881 质量: 39
单质(固体): 银 白 色
化学性质活泼,能 与氧气、氯气、水 等反应
化合物中价态:
通常为+1价
钠 Na
相 对 原 子 +11)281
质量: 23
单质(固体): 银 白 色
化学性质活泼,能 与氧气、氯气、水
等 反 应
化合物中价态:
通常为+1价
钙Ca
相 对 原 子 4202882 质量: 40
单质(固体): 银 白 色
化学性质活泼,能 与氧气、氯气、水
等反应
化合物中价态:
通常为+2价
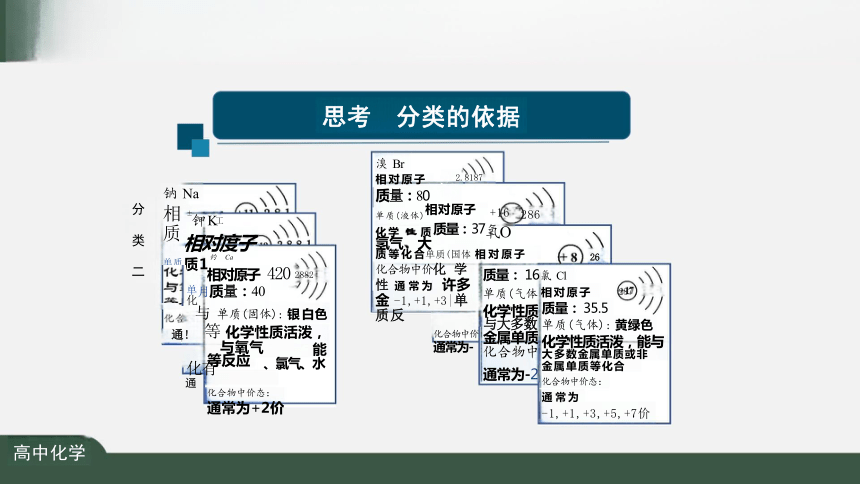
思考 分类的依据
高中化学
分 类 二
钠 Na
钾 K工
相对度子
单质质1钓 Ca
相对原子 420 2882
月质量:40
与 单质(固体): 银 白 色 通! 等 化学性质活泼,能
化有 、氯气、水
通
化合物中价态:
通常为+2价
等反应
与氧气
化
单
±
化合物中价化 学 性 通 常 为 许多金 -1,+1,+3|单质反 化合物中价 通常为- 质量: 16 氯 Cl 单质(气体 相 对 原 子 287 化学性质 与大多数 金属单质 化合物中
质量: 35.5
单质(气体): 黄绿色
化学性质活泼,能与 大 多 数 金 属 单 质 或 非
溴 Br
相 对 原 子 f 5) 2.8187
单质(液体)相对原子 +16 286
质量: 37氧O
质 等 化 合单质(国体 相 对 原 子
大
质
氢气
化 学
金 属 单 质 等 化 合
化合物中价态:
通 常 为
-1,+1,+3,+5,+7价
思考 分类的依据
相质
质量:80硫S
高中化学
分 类 二
通常为-2
26
钠 Na
相对原子 -1] 8
质量: 23
钾K
相对原子
质量: 39
单质(固体):银 白 色 化学性质活泼,能 与氧气、氯气、水
等反应
化合物中价态:
通常为+1价
硫S
相对原子
质量: 32
单质(固体): 淡黄色
化学性质较活泼,能与 许多金属单质及非金属 单质反应生成硫化物
化合物中价态:
通常为-2,+4,+6价
思考 分类的依据
单质(固体): 银 白 色 化学性质活泼,能 与氧气、氯气、水
等反应
化合物中价态:
通常为+2价
+35 28187
红棕色
泼,能与 数金属单 成 溴 化 物
5,+7价
氯 Cl
相 对 原 子
质量:35.
溴 Br
相 对 原 子
钙Ca
相对原子
质量: 40
氧O
相 对 原 子
质量:16
高中化学
分 类 三
87
质量: 35.5 单质(气体): 黄约 化学性质活泼, 大多数金属单质 金属单质等化合 化合物中价态: 通 常 为 -1,+1,+3,+5,+7
溴 Br
相 对 原 子 35 28187 质量:80
单质(液体): 红棕色 化学性质活泼,能与 氢气、大多数金属单 质 等 化 合 生 成 溴 化 物
化合物中价态:
通常为
-1,+1,+3,+5,+7价
分 类 三
学 化 中 高
思考 分类的依据
氧O 相 对 原 子 质量: 16 单质(气体): 无 色
硫 S
相对原子
质量: 32
单质(固体):淡黄色
相对原子
质量: 23
单质(固体): 银白色 化学性质活泼,能 与氧气、氯气、水
等反应
化合物中价态:
通常为+1价
相对原子 410 2881 质量: 39
单质(固体): 银白色
化学性质活泼,能 与氧气、氯气、水 等反应
化合物中价态:
通常为+1价
与大多数金属、非 许多金属单质及非金属
钠 Na 钾K 物
化学性质活泼,能 化学性质较活泼,能与
氯 Cl
相 对 原 子 287
金屋单质等反应
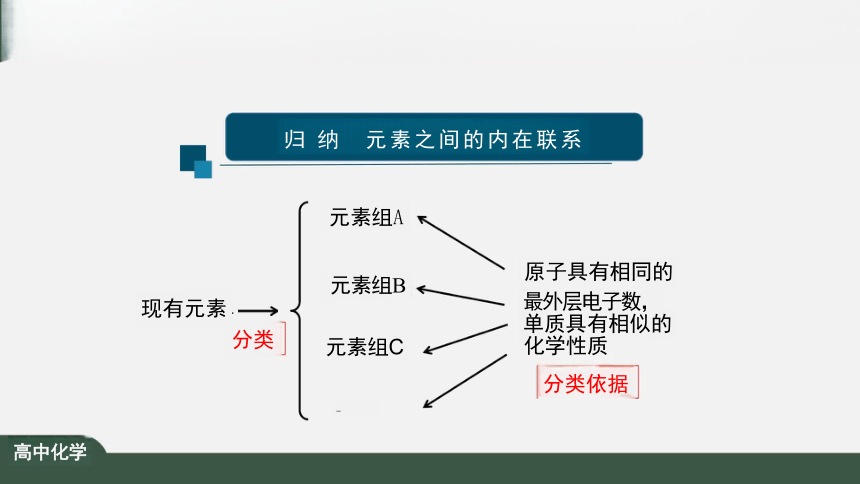
归 纳 元素之间的内在联系
元素组A
原子具有相同的
现有元素 ■ 最外层电子数,
分类 元素组C 化学性质
分类依据
高中化学
单质具有相似的
元素组B
t
钙Ca
p, 相对原子 420 2882 质量: 40
单质(固体): 银 白 色
化学性质活泼,能 与氧气、氯气、水 等反应
化合物中价态:
通常为+2价
相 对 原 子 +8) 26 4, 质量: 16
单质(气体): 无色
化学性质活泼,能
与大多数金属、非
金属单质等反应
化合物中价态:
通常为-2价
相对原子
质量: 35.5
单质(气体): 黄绿色
化学性质活泼,能与
大 多 数 金 属 单 质 或 非 金 属 单 质 等 化 合
化合物中价态:
通 常 为
-1,+1,+3,+5,+7价
钾K
相对原子 (iy 2881 质量: 39
单质(固体): 银 白 色
化学性质活泼,能 与氧气、氯气、水
硫S
相对原子 +16 286
质量: 32
单质(固体): 淡黄色
化学性质较活泼,能与 许多金属单质及非金属
溴Br
相 对 原 子 43528187 质量:80
单质(液体): 红棕色
化学性质活泼,能与 氢气、大多数金属单 质 等 化 合 生 成 溴 化 物
钠 Na
相对原子 +11 281 质量: 23
单质(固体): 银白色
化学性质活泼,能 与氧气、氯气、水
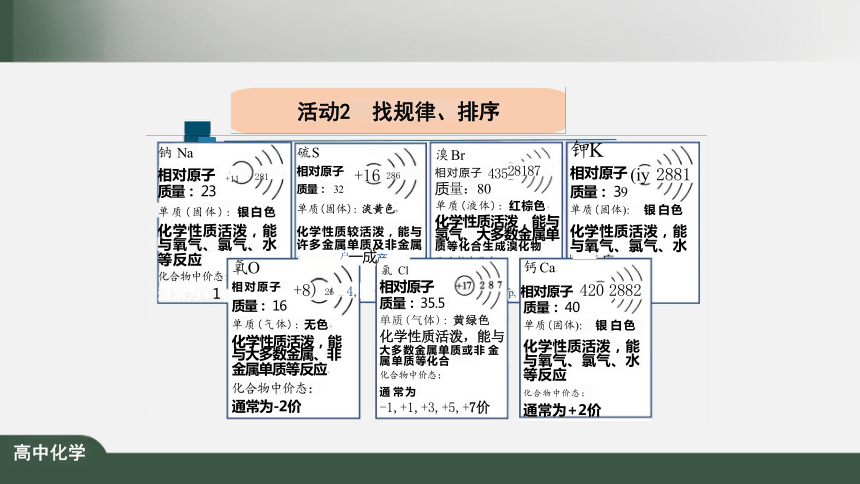
活动2 找规律、排序
等反应
化合物中价态
通常为+1
户一成产
氯 Cl
高中化学
氧O
口
氯 Cl
硫 S
氧O 相对原子 质量: 32 质量: 35
相对原子 质量:23 单质(气体)
单 质 ( 固 体 ) 价
通 常 为 +1价
通 常 为 -2
通常为
化合物中
质反应
多金属
单
许
反应
氧气、
学性质
等
与
化
数
质
多
性
大
学
与
化
金:
大化
化学性质
单质(固体)
体)
16
气
:
质 (
量
单
质
钾K 相 对 原 子 质量: 39 单质(固体) 化学性质 与氧气、 等反应 钙 Ca 相 对 原 子 质量: 40 单质(固体) 化学性质 与氧气 、 等 反 应 化合物中价态[ 溴 Br
相对原子 28187 质量:80
单质(液体): 红棕色
化学性质活泼,能与 氢气、大多数金属单 质等化合生成溴化物
化合物中价态:
通常为
-1,+1,+3,+5,+7 价
金 属 单 质 化合物中价态-1,+1,+3; 化合物中化合物中价态通常为-2,,
化合物中价态通常为+2价 通常为+1价
TJ,TTD
思考 排序的依据
钠 Na 相对原子 相对原子
排 序
高中化学
氧 O 相对原子 质量:16 +8 单质(气体):无色 钠 N a 相对原子 +11)28 质 量 :23 追质(因休)·银白色 硫S 相对原子 质 量 :32 氯Cl 相对原子 质量:35.5 单质(气体):黄绿色
单质(固体):淡黄色 化学性质较活泼,能与 许多金属单质及非金属 单质反应生成硫化物 化合物中价态: 通常为-2,+4,+6价 钾 K 相对原子 质 量 :39 (19 881 钙 C a 相对原子 质量:40 +209 溴 B r 相对原子 +35 28187 质 量 :80 单质(液体):红棕色 化学性质活泼,能与 氢气、大多数金属单 质等化合生成溴化物 化合物中价态: 通常为 -1,+1,+3,+5,+7价
单 质 ( 固 体 ) :银 白 色 化 学 性 质 活 泼 , 能 与 氧 气 、 氯 气 、 水 等反应 化合物中价态: 通 常 为 + 1 价 单质(固体):银白色 化学性质活泼,能 与氧气、氯气、水 等反应 化合物中价态: 通常为+2价
思考 排序的依据
高中化学
排 序 二
0
Na S
Cl
K Ca
Br
简单元素表
0 Na S Cl K Ca
Br
高中化学
简单元素表
氧O
相对原子 +8
质量: 16
单质(气体):无色
硫S
相对原子 46 8
质量:32
单质(固体): 淡黄色
化学性质较活泼,能与 许多金属单质及非金属 单质反应生成硫化物
化合物中价态:
通常为-2,+4,+6价
氯 Cl
相对原子
质量: 35.5
单质(气体):黄绿色
溴 Br
相对原子 8187 质量:80
单质(液体): 红棕色
化学性质活泼,能与 氢气、大多数金属单 质等化合生成溴化物
化合物中价态:
通常为
-1,+1,+3,+5,+7价
相对原子 四2881 质量:39
单质(固体): 银白色
化学性质活泼,能 与氧气、氯气、水 等反应
化合物中价态:
通常为+1价
单质(固体): 银 白 色 化学性质活泼,能 与氧气、氯气、水 等反应
化合物中价态:
通常为+2价
钠 Na
相对原子 皿 81
质量:23
单质(周体)· 银白色 钾K
钙 Ca
相对原子 质量:40
高中化学
20 288
碲 Te
相 对 原 子
+52) 2818186
质量: 128
单质化学性质:
能与氢气、某些金属
单 质 等 化 合 得 到 碲 化 物。可氧化得到二氧 化碲
化合物中价态:
通常为-2,+4,+6价
高中化学
活动3 确定元素Te在元素表中的位置
钙 Ca 相对原子 质量:40 单质(固体):银白色 学 质活泼能 相对原子 质量:16 氧0 相对原子 质量:16 单质(气体);无色 硫S 相对原子 质量:32 单质(因体):淡黄色 化学性质较活泼,能与 许多金属单质及非金属 单质反应生成硫化物 化合物中价态: 通常为-2,+4,+6价 硫 S 相对原子 质量:32
氯 Cl
相对原子
质量:35.5
单质(气体):黄绿色
化学性质活波, 能与
溴 Br
相对原子
质量:80
单质(液体): 红棕色
华类性要酒流签
O
性
能与氢气、某些金属
单 质 等 化 合 得 到 碲 化 物。可氧化得到二氧 化 碲
化合物中价态:
通常为-2,+4,+6价
单 质 ( 气 体 ) : 无 色 化学性质活泼,能 与大多数金属、非 金属单质等反应 化合物中价态: 通常为-2价
单质(固体): 淡 黄 色
化学性质较活泼,能与 许多金属单质及非金属 单质反应生成硫化物
化 合 物 中 价 态 :
通常为-2,+4,+6价
活动3 确定元素Te在元素表中的位置
碲 Te
相 对 原 子
质量: 128
单质化学性质:
钠 Na
相对原子
质量:23
钾 K
相对原子(D)288 质量:39
单质(圆体) : 银白色
化学性质活泼,能
与氧气、氯气、水
等 反 应
化合物中价态:
通常为+1价
高中化学
2818186
函
2882
氧 O 相对原子 质量·16 +8 26 钠 N a 相对原子 质量·23 +1] 281 硫 S 相对原子 质 量 : 3 2 +16)86 氯Cl 相对原子 质量:35.
钾 K 相对原子 质量:39 +19 88 钙 C a 相对原子 质量:40 420882 碲 T e 相对原子 质量:128 5 2818186 溴 B r 相对原子 质量:80 t35)28187
活动3 确定元素Te在元素表中的位置
高中化学
氧O 相对原子 质量:16 +8 6 钠 N a 相对原子 质量·23 8 · 硫 S 相 对 原 子 质量:32 +16)286 氯Cl 相对原子 +I 质 量 :35.5
钾 K 相对原子 质量:39 +19)881 钙Ca 相 对 原 子 +202882 质量:40 溴Br 相对原子 质 量 :80 t35) 8187 碲 T e 相对原子 质量:128 4522818186
活动3 确定元素Te在元素表中的位置
高中化学
环节二初识元素周期表
·拉瓦锡的元素表
·德贝莱纳的三元素组
·纽兰兹的八音律
·门捷列夫的元素周期表
高中化学
·简单中性物质:光、热、氧、氮、氢
·简单的非金属物质:硫、磷、碳、盐酸基、氢氟酸基、 硼酸基
·简单的金属物质:锑、银、铋、铜、钴、锰、汞、金、 铂、铅、锌、锡、铁、钼、镍、钨
·简单的碱性物质:石灰、镁土、铝土、钡土、硅土
拉瓦锡的化学元素表
高中化学
Na K
·C Br
·S Se Te
·Ca Sr Ba
Mn Cr Fe
德贝莱纳的三元素组
高中化学
No. No. No. No. No. No. No.
No.
H 1 F 8 Cl 15 Co &Ni 22 Br 29 Pd 36 I 42
Pt &Ir 50
Li 2 Na 9 K 16 Cu 23 Rb 30 |Cs 44
0s 51
G 3 Mg10 Ca 17 Zn 24 Sr 31 Cd 38 Ba &V 45
Hg 52
Bo 4 Al 11 Cr 19 Y 25 Ce &La 33 U 40 Ta 46
T153
C 5 Si 12 Ti 18 In 26 Zr 32 Sn 39 W 47
Pb 54
N 6 P 13 Mn 20 As 27 Di &Mo 34 Sb 41 Nb 48
Bi 55
07 S 14 Fe 21 Se 28 Ro &Ru 35 Te 43 Au 49
Th 56
纽兰兹的八音律
高中化学
Ag
37
H=1
Be=9.4 Mg=24 Zn=65.2 Cd=112
B=11 Al=27.4 =68 Ur=116 Au=197
C=12 Si=28 =70 Sn=118
N=14 P=31 As=75 Sb=122 Bi=210
O=16 S=32 Se=79.4 Te=128
F=19 Cl=35.5 Br=80 I=127
Li=7 Na=23 K=39 Rb=85.4 Cs=133 Tl=204
Ca=40 Sr=87.6 Ba=137 Pb=207
=45 Ce=92
Er=56 La=94
Yt=66 Di=95
In=75 Th=118
高中化学
门捷列夫的元素周期表
周期 1A 元 素 周 期 表 0 电子月
0族 电子数
1H 氢 .008 2 He 氮 4.003 K
ⅢA IVA VA VIA VIA ⅡA 原子序数 元素名称 注*的是 人造元素 92 U 铀 7s 5f'6d 0 238. 元素符号,红色 指放射性元素 非金属元素 金属元素 价层电子排布,括号 2 3 Li 锂 2s 6.941 4 Be 铍 2s 9.012 5 B 烈 10.81 6 C 然 2.0 7N 然 4.01 8 氧 16.00 y 9.0 10 Ne 氮 20.18
指可能的电子排布 相对原子质量(加括号的数 据为该放射性元素半衰期最 长同位素的质量数) 过渡元素 稀有气体元素 3 11 Na 的 22.99 12 Mg 镁 3s 24.31 13 Al 鸳 26.98 14 Si 酷 28.09 15 P 30.97 16 S 32.06 17 CI 氯。 35.45 18 Ar 氯 39.95 M -
ⅢB IVB VB VIB VIB m 10 IB ⅡB 2 4 19 K 钾 48 39.10 20 Ca 钙 4s 40.08 21 Sc 筑。 44.96 22 Ti 然 17.87 23 V 50.94 24 Cr 繁 50.00 25 Mn 算 54.94 26 Fe 繁 55.85 27 Co 第 58.93 28 Ni 黛 38.69 29 Cu 架 65.33 30 Zn 集 65 31 Ga 黛 6917 32 Ge 篮 2.63 33 As 体 74.92 34 Se 硒 78.96 35 Br 误 s4 79.90 36 Kr 氮 83.80
5 37 Rb 铷 8547” 38 Sr 锶 58 87.62 39 Y 38.91 40 Zr 41 Nb 42 Mo 怨 95.96 43 Tc 44 KU 45 Rh 46 Pd 钟 4d 06.4 47 Ag 48 Cd 112.4 49 In 鳃 114.8 50 Sn 锡 118.7 51 Sb 121.8 52 Te 隳 127.6 585p 260 54 Xe 氮 131.3
6 55 Cs 铯 1329 56 Ba 钡 373 57~71 La~Lu 镧系 72 Hf 铪 1785 73 Ta 钽 809 74 W 75 Re 铼 1862 76 Os 锇 902 77 Ir 铱 922 78 Pt 9 79 Au 80 Hg 81 Tl 82 Pb 铅 2072 83 Bi 铋 86F 209.0 84 Po 钋 6p 209 85 At 46k1 氡 p 222
87 Fr 钫 22.5 88 Ra 铺 [226] 89-103 Ac~Lr 铜系 104 Rf 钻* (6d'7s ) [265] 05 Db 钳* (6c s) 268| 106 Sg 镇* [271] 07 Bh 陂 270 08 Hs 锶* [277] 109 Mt 铵* |276 10 Ds 铋* [281] 111 Rg 铊* [280] 12(n 钨* [285] 113 NI 钦* [284] 114 Fl 铁* 289] 15 Me 镇* |288 116 LN 位* [293] 17Is 础* 294 118 Og 氮* 294]
铺 系 57 La 镧 5d-Gs 138.9 58 Ce 铈 lsdld 140.1 59 Pr 错 4[%s 1411.9 60 Nd 钕 41Cs 14.4.2 61 Pm 钯 4fYs [145] 62 Sm 4168 50.4 63 Eu 铂 4ts 52.0 64 Gd 钆 4f5d 6s 157.3 65Tb 铽 4f6 158.9 66 Dy 镝 4f6s 162.5 67 H 钛 t6s 164.9 68 Hπ 铒 4fGs 167.3 69 Tm 铥 4f'Gs 68.9 70 Yb 镱 173.1
71 Lu
镥
4I*5d'6s 175.0
铜系 89 Ac 锶 1227] 90 Th 桀。 232.0 91 Pa 然 231.0 92 U 铀 5f 6d 7s 238.0 93 Np [237] 94 Pu 钚 5f 7s [244] 95 Am 钼* 5f^7s [243] 96 Cm 镉* 5f6d 7s 1247 97 Bk 铬 * 57s [247] 98 Cf 锇 ste [251] 99 Es 银* 5f"'7s [252] 100 Fm 锁 5ft7g [257] 101 Md 们 * (5f 7s) [258] 102 No 错 * 5t79( [259]
103 LI
午分
5Pd7
[262]
高中化学
k
IA
0
第 一 周 期 1 H
2 He
IA IIIA IVA VA VIA VIIA 第 二 周 期 3 Li 4 Be 5 B 6 C 7 N 80 9 F
10 Ne
10 8
第 三 周 期 11 Na 12 Mg 2 13 AI ( 14 Si 15 P 5 16 S 17 CI
18 Ar
⑧ 8
归纳元素周期表排布规律
高中化学
按照核电荷数(质子数)由小到大排列
横行:周期
周期序数=电子层数
归纳 元素周期表排布特点
纵列:族
主族序数=最外层电子数
元素周期表
高中化学
人
223 226 制系 6d 7s 265] 268 271 270 277] 276 281 280 2852 284] 289 288 203 94
70 Y 镱 4f's 173. b 71 Lu 镥 41*5d 75.0 铺 系 57 La 镧 56 138.0 58 Ce 铈 4f'5d'6s 140. 59 Pr 镨 4['6s 40.9 60 Nd 钕 4f s 144.2 61 Pm 钷* 4 [145] 62 Sm 钐 4f'f 50.4 63 Eu 铕 4f'6s 152.0 64 Gd 钆 4f'5d 6e 157.3 65 Tb 铽 4f*6 158.9 66 Dy 镝 4f6 162.3 67 Ho 钬 4f s 164. 68 Er 铒 4[ 6g 167.3 69 Tm 钴 4fts 68.9 锕 系 89 Ac 锏 6d17s [227] 90 Th 钍 6t7s 232.0 91 Pa 镁 5f-6d7s 231.0 92 U 铀 5f'6d176 238.0 93 Np 镗 5f'6d-7s [237] 94 Pu 钚 5P7s 244 95 Am 铜* 5f'7s [243] 96 Cm 铝 5f6dl7s [247] 97 Bk 镕* 5f7s 247| 98 Cf 钢* 5f 07s 251 99 Es * 5fl17s 252 100 Fm 馈* 5f127s [257] 101 Md 钒* 5f117s) 258 102 No 错* (5F 7s) [259] 103 Lr 钳* (5f*6d7s) 1262
高中化学
按照核电荷数(质子数)由小到大排列
短周期:1-3
横行:周期,7个
周期序数=电子层数 [长周期:4-7
主族: IA-VIIA
副族: IB-VIIB,VIII
0族:稀有气体
纵列:族,18列,16个族
主族序数=最外层电子数
归纳 元素周期表排布特点
元素周期表
高中化学
练习
·科学家用钙离子撞击放射性元素 (Bk), 产生 了质子数为117的超重元素Ts。Ts的原子结构示 意图如下,试判断它在元素周期表中的位置。
第七周期,第VIIA 族
高中化学
元素周期表与原子结构的关系
元素周期表 反映
(元素位置) 原子结构
决定
原子 族
序数 (主)
高中化学
电子层数
原 子 核
最外层电子数
周期
练习
1.寻找26号元素铁 (Fe) 在元素周期表中的位置。
第四周期,第VIIl 族
2.寻找钛 (Ti)、 金 (Au)、 铀 (U) 三种元素 在周期表中的位置,并分别指出它们的核电荷数。
Ti在第四周期,第IVB族,核电荷数为22
Au在第六周期,第IB族,核电荷数为79
U在第七周期,第IlIB 族,核电荷数为92
高中化学
周期 1A 元 素 周 期 表 0 电子周
0族 电子数
1H 氢 008 2 He 氡 4.003 k
2
ⅡA 原子序数 元素名称 注*的是 人造元素 92 铀 5f'6d 7s 238.0 _元素符号,红色 指放射性元素 作金属元素 金属元素 ⅢA IVA VA VIA VIIA 2 3 Li 锂 6.941 4 Be 铍 9.012 价层电子排布,括号 5 B 硼 o8f 6C 碳。 12.01 7 N 氮 401 8) 氧 16.00 9F 氯 19.00 10 Ne
指可能的电子排布 相对原子质量(加括号的数 据 为 该 放 射 性 元 素 半 衰 期 最 长同位素的质量数) 过渡元素 稀有气体元素 3 11 Na 的 。 22.99 12 Mg 镁 , 24.31 13 Al 鸳 26.98 4 S 碟 28.09 15 P 30.97 16 S 盛 32.06 17 Cl 氮, 35.45 18 Ar 39.95
ⅢB IVB VB VIB VIB m 10 I B ⅡB 12 4 19 K 钾 39.10 20 Ca 钙 0.08 21 Sc 筑 44.96 22 Ti 23 24 Cr 25 Mn 26 Fe 然 55.85 27 Co 镇 58.93 28 Ni 繁 58.69 29 Cu 30 Zn 31 Ga 镓 69.72 32 Ge 锗 72.63 33 AS 砷 74.92 34 Se 硒 78.96 35 Br 溴 79.90 36 Kr
5 37 Rb 铷 85.47 38 Sr 锶 5g 87.62 39】 岛 88.91 40Zr 墨 1N 铌 9291 42 Mo 银 950 43|c 斜 98 44Ru 5 Rh 基 46 Pd 色 106 47 Ag 银 79 48 Cd 镉 12.4 49 In 锶 14.8 50 Sn 锡 18.7 51 Sb 锑 121.8 52 Te 127.6 531 26.9 54 Xe 蟹 131.3
6 ss Cs 铯 132.9 56 Ba 钡 137.3” 57~71 La~Lu 镧系 72 Hf 铪 178.5 73 Ta 钽 180.9 74 W 钨 183.8 75 Re 铼 86.2 76 Os 锇 1902 77 Ir 铱 922 78 Pt 铂 951 0A 金 97.0 80 Hg 汞 200.6 81 Tl 铊 204.4 82 Pb 铅 2072” 83 Bi 铋 2090 84 Po 钋 [2可 85 At 砹 12m 86 Rn 氧 bs-bp [222
8
18
32
18
7 87 Fr 钫 223 88 Ka 铺 226 89-103 Ac~L 铜系 104 Kf 铲* (6d7s) 265] 10s Db 钳* 6d'7s [268] 106 Sg 镇* 271] 107 Bh 铍* [270 108 Hs 锶* 277 09 Mt 铑* [276 110 Ds 铋* 281 111 Rg 铊 280 112 Cn 针 285 113 Nh 钦 284 114 FI 铁* 289 115 Mc 馍* 288 161.1 钕* 293 17 Ts 细 294 18 Og 氮* 294
镧 系 57 La 铺 38.9 58 Ce 铈 140. 54 D 错 4[Vs 140.9 60 Nd 钕 0s 44 61 Pm 钯 6s 145 62 Sm f 50. 63 Eu 铕 fus 152.0 64 Gd 钆 57.3 65 Tb 镇 58.9 66 镝 62 67 Ho 钬 164.9 68 Er 铒 167. 69 Tm 铥 Pis 68.9 70 Yb 镱 73.
71 Lu
铂
5d6
175.0
钢 系 9AC 时 |2 7g 90 Th 钍 6dP s 232/ 91 Pa 镁 51-6d'7s 231.0 92U 钿 5f 6dl7s 138.(1 93 Np 钾 5f%d7s 237] 94 Pu 钋 5PT [244] 95 Am 阳* 5f'7s [243] 96Cm 铜 5T6dl7s 2471 97 Bk 镕* 5F7s [247] 98 5F*7s [251] gg E 银 * 5f!!7k [252] 00 Fm 馈 * 5f127= [257] 01 M 5f137) [258] 02 No 结* 31*7s [259]
103 LN
错*
(5f 6dP7s
[262]
27]
6d
环节三深入认识元素周期表
高中化学
·问题1各周期元素的种数分别是多少 你是如何
得出结论的
·问题2 同周期的第IIA 族与第IIlA 族元素的原子序
数是不是都相差1 请举例说明。
·问题3 同一主族的元素一定都是金属元素或非金
属元素吗 元素有什么分布规律吗
观察与思考
高中化学
周期序数 包含元素种类
起止元素
1 2
1H~,He
2 8
3Li~10Ne
3 8
11Na~ gAr
4 18
19K~36Kr
5 18
37Rb~s Xe
6 32
55Cs~86Rn
7 32
87Fr~11gOg
Q1 各周期元素的种数分别是多少 你是如何得出结论的
高中化学
所在 周期 核电 荷数 元素 符号 各电子层的电子数 K L M N 0 P
Q
1 2 He 2
2 10 Ne 2 8
3 18 Ar 2 8 8
4 36 Kr 2 8 18 8
5 54 Xe 2 8 18 18 8
6 86 Rn 2 8 18 32 18 8
7 118 Og 2 8 18 32 32 18
8
Q1 各周期元素的种数分别是多少 你是如何得出结论的
高中化学
周期 IA IIA IA
IVA
3 11Na 12Mg 13Al
14Si
4 19K 20Ca 31Ga 镓
32Ge 锗
6 55Cs 铯 56Ba 81TI 铊
82Pb 铅
Q2 同周期的第IIA 族与第IIIA 族元素的原子序数 是不是都相差1
周期 1 A
l A
2 3 Li 锂 2s 6.941
4 Be
铍
2s
9.012
3 11 Na 钠 3s 22.99
12 Mg
镁 3s
24.31
4 19 K 钾 4s 39.10
20 Ca
钙
4s 40.08
5 37 Rb 铷 5s 85.47
38 Sr
锶
87.62
6 55 Cs 铯 1329
56 Ba
钡
6s
137.3
7 87 Fr 钫 7s [223]
88 Ra
镭
7s
226]
ⅢA 13
IVA
14
5 B 硼 2s2p 10.81
6 C
碳
2s2p
12.01
13 Al 铝 26.98
14 Si
硅
36 3p
28.09
31 Ga 篮 69.72
32 Ge
镇。
72.63
49 In 锶 114.8
50 Sn
锡
118.7
81 TI 笼。 204.4
82 Pb
铅
6s'6p
207.2
113 Nh 钦* [284]
114 FI
铁*
[289]
高中化学
綱 系 57 La 镧 5d'6s 138.9 58 Ce 铈 4f 5d'6s 140.1 59 Pr 镨 4f6s 140.9 60 Nd 钕 4f6s 144.2 61 Pm 钷* 4P6s [145] 62 Sm 钐 4f6s 150.4 63 Eu 铕 4f6s 152.0 64 Gd 钆 4f'5d'6s 157.3 65 Tb 铽 4f^6s 158.9 66 Dy 镝 4f'6s 162.5 67 Ho 钬 4f6s 164.9 68 Er 铒 4f°6s 167.3 69 Tm 铥 4f6s 168.9 70 Yb 镱 4f6s 173.1
71 Lu
镥
4[*5d'6s 175.0
锏 系 89 Ac 锕 6d'7s [227] 90 Th 钍 6d 7s 232.0 91 Pa 镁 5f 6d!7s 231.0 92 U 铀 5f 6d 7s 238.0 93 Np 锋 5f'6d'7s [237] 94 Pu 钚 517s [244] 95 Am 镭* 5f7s [243] 96 Cm 镉* 5P6d'7s [247] 97 Bk 铬* 5f7s [247] 98 Cf 铜 * 5f17s [251] 99 Es 银* 5f117s [252] 100 Fm 馈 * 5f+7s [257] 101 Md 们* (5f 7s) [258] 102 No 锆* (5r*7s) [259]
103 Lr
捞*
(5f *6d'7s ) [262]
ⅢB 3 IVB 4 VB 5 VIB 6 VIIB 7 8 VⅢI 9 10 I B 11
ⅡB
12
21 Sc 钪 3d 4s 44.96 22 Ti 钛 3d4s 47.87 23 V 钒 3d 4s 50.94 24 Cr 铬 3d 4s 52.00 25 Mn 锰 3d 4s 54.94 26 Fe 铁 3d4s 55.85 27 Co 钴 3d'4s 58.93 28 Ni 镍 3d4s 58.69 29 Cu 铜 3d 4s 63.55
30 Zn
锌
3d4s 65.38
Q2 同周期的第IIA 族与第IIIA 族元素的原子序数 是不是都相差1
Ac~Lr 锏系 1U4 NI 铲* (6d 7s ) [265] Iu3 UU 钳* (6d'7s') [268] 1U0 Dg] 镨* [271] 1U/DN 铍* [270] [1 U8 MS 锶* [277] 10y IVIL 镂* [276] 11U US 铋* [281] 11 Kg 铊* [280]
1z Cn
镭*
[285]
高中化学
Q3 同一主族的元素一定都是金属元素或非金属元素吗 元素有什么分布规律吗
镧 系 57 L0 铺 5d'6s 38. 58 Ce 中 4f'5ds 40.1 59 Pr 错 4s 140.9 60 Nd 钕 41*℃s 144.2 61 Pm 钜 * 4F6s [145] 62 Sm 钐 4h 50.4 63 Eu 们 410s 152.0 64 Gd 钆 4d 6 57.3 5 Tb 铽 4ffs 138.9 66 Dy 镝 41*hs 162.3 67 Ho 钬 46g 64.9 68 EF 叫 4[s 167.3 60 Tm 铥 s 68.9 70 Yb 4fs 173.
71 LU
错
41“5d6s
75.0
钢 系 9 Ac 铜 6d7 [227] 90 Th 钍 6dP7s 232.0 91 Pa 镁 51-6d7s 231.0 92 [ 铀 5f'6dF7s 2380 93 Np 饽 5f'6d7g [237] 94 Pu 钚 5P7 [244] 95 Am 销* 243] 96 Cm 铜* 5P6dl7s [247] 97 Bk 培 * 5PN 247] 98( 铜* 51#7k [251] 99 Es 银申 sF"7w [252 100 Fm * sfrw [257] 101 Md 们車 [258] 102 No 错* (sr*7s [259]
103 Lr
捞* (3f*6d) [262]
高中化学
元素周期表
(元素位置)
结构 规律
总结
决定
原子结构
反映
核外电子排布
核电荷数
高中化学
谢谢大家!
高中化学
原子结构与元素周期表
(第二课时)
高中化学
2015年,国际纯粹与应用化学联合会 (IUPAC) 确认新的超重元素Ts (中文名称-硒)已被发现。
硼有什么性质 它与哪些已知元素性质相似
资 料
问题
高中化学
内在联系 现已发现的一百多种元素之间能否
有序排列或分类
高中化学
环节一寻找元素间的内在联系
元素的性质有何规律可循 元素之间有何
思考
钾K
相 对 原 子 4 2881
质量: 39
单质(固体): 银白色 化学性质活泼,能 与氧气、氯气、水
氧O 总 户 向 成
相对原子 +8) 26 4,
质量:16
单质(气体): 无色
化学性质活泼,能
与大多数金属、非
金属单质等反应
化合物中价态:
通常为-2价
2 420 388
单质(固体): 银白色 化学性质活泼,能 与氧气、氯气、水 等 反 应
化合物中价态:
通常为+2价
40
子
:
原
质量
相 对
相对原子 +17 287 质量: 35.5
单质(气体): 黄绿色
化学性质活泼,能与 大多数金属单质或非 金属单质等化合
化合物中价态:
通常为
-1,+1,+3,+5,+7 价
钠 Na
相 对 原 子 +11 281
质量:23
单质(固体): 银白色 化学性质活泼,能 与氧气、氯气、水
溴 Br
相 对 原 子 435 28187 质量:80
单质(液体) : 红棕色
化学性质活泼,能与 氢气、大多数金属单 质 等 化 合 生 成 溴 化 物
质量:32
单质(固体):淡黄色
化学性质较活泼,能与 许多金属单质及非金属
活动1 分类
等反应
化合物中价态 通常为+11
氯 Cl 钙Ca
硫S
相对原子
高中化学
+16 86
溴 Br
相 对 原 子 435 28is7 质量: 80
单质(液体) 红 棕 色
化学性质活泼,能与 氢气、大多数金属单 质等化合生成溴化物
化合物中价态:
通常为
-1,+1,+3,+5,+7价
氧 O
相对原子
质量: 16
单质(气体): 无 色
化学性质活泼,能 与大多数金属、非 金属单质等反应
化合物中价态:
通常为-2价
思考 分类的依据
单质(气体) : 黄 绿 色
化学性质活泼,能与 大多数金属单质或非 金属单质等化合
化合物中价态:
通 常 为
-1,+1,+3,+5,+7价
氯 Cl
相 对 原 子
质量: 35.5
高中化学
分 类 一
钠 Na
相对原[硫 S
质量: 相对原子
钙 Ca
单质(固质量:
通常为化合物中 与氧气 质量:3 9
通常为等反应单质(固体) : 银白色 化合物中 化“学性质活泼,能 通常为与氧气、氯气、水
等反应
化合物中价态:
通常为+1价
92881
原
20)
质
量
对
单
质
相
金
性
(固
许
化
单
单质(气单质(气体): 黄 绿 色
化学性化学性质活泼,能与
与大多大多数金属单质或非
金属单金属单质 溴 Br
化通 价 3528187
单质(液体): 红 棕 色
化学性质活泼,能与
氢气、大多数金属单
化合物中价态:
通常为
-1,+1,+3,+5,+7价
-
80
子
:
原
质量
相对
常为
合物中
为
物
常
合
通
化
氧O
相对原
相对原子 质量:
质量:35.5
思考 分类的依据
质等化合生成溴化物
高中化学
分 类 一
单质反 化学性
1,+1,+3
氯 Cl
8
钾K
相 对 原 子 (2881 质量: 39
单质(固体): 银 白 色
化学性质活泼,能 与氧气、氯气、水 等反应
化合物中价态:
通常为+1价
钠 Na
相 对 原 子 +11)281
质量: 23
单质(固体): 银 白 色
化学性质活泼,能 与氧气、氯气、水
等 反 应
化合物中价态:
通常为+1价
钙Ca
相 对 原 子 4202882 质量: 40
单质(固体): 银 白 色
化学性质活泼,能 与氧气、氯气、水
等反应
化合物中价态:
通常为+2价
思考 分类的依据
高中化学
分 类 二
钠 Na
钾 K工
相对度子
单质质1钓 Ca
相对原子 420 2882
月质量:40
与 单质(固体): 银 白 色 通! 等 化学性质活泼,能
化有 、氯气、水
通
化合物中价态:
通常为+2价
等反应
与氧气
化
单
±
化合物中价化 学 性 通 常 为 许多金 -1,+1,+3|单质反 化合物中价 通常为- 质量: 16 氯 Cl 单质(气体 相 对 原 子 287 化学性质 与大多数 金属单质 化合物中
质量: 35.5
单质(气体): 黄绿色
化学性质活泼,能与 大 多 数 金 属 单 质 或 非
溴 Br
相 对 原 子 f 5) 2.8187
单质(液体)相对原子 +16 286
质量: 37氧O
质 等 化 合单质(国体 相 对 原 子
大
质
氢气
化 学
金 属 单 质 等 化 合
化合物中价态:
通 常 为
-1,+1,+3,+5,+7价
思考 分类的依据
相质
质量:80硫S
高中化学
分 类 二
通常为-2
26
钠 Na
相对原子 -1] 8
质量: 23
钾K
相对原子
质量: 39
单质(固体):银 白 色 化学性质活泼,能 与氧气、氯气、水
等反应
化合物中价态:
通常为+1价
硫S
相对原子
质量: 32
单质(固体): 淡黄色
化学性质较活泼,能与 许多金属单质及非金属 单质反应生成硫化物
化合物中价态:
通常为-2,+4,+6价
思考 分类的依据
单质(固体): 银 白 色 化学性质活泼,能 与氧气、氯气、水
等反应
化合物中价态:
通常为+2价
+35 28187
红棕色
泼,能与 数金属单 成 溴 化 物
5,+7价
氯 Cl
相 对 原 子
质量:35.
溴 Br
相 对 原 子
钙Ca
相对原子
质量: 40
氧O
相 对 原 子
质量:16
高中化学
分 类 三
87
质量: 35.5 单质(气体): 黄约 化学性质活泼, 大多数金属单质 金属单质等化合 化合物中价态: 通 常 为 -1,+1,+3,+5,+7
溴 Br
相 对 原 子 35 28187 质量:80
单质(液体): 红棕色 化学性质活泼,能与 氢气、大多数金属单 质 等 化 合 生 成 溴 化 物
化合物中价态:
通常为
-1,+1,+3,+5,+7价
分 类 三
学 化 中 高
思考 分类的依据
氧O 相 对 原 子 质量: 16 单质(气体): 无 色
硫 S
相对原子
质量: 32
单质(固体):淡黄色
相对原子
质量: 23
单质(固体): 银白色 化学性质活泼,能 与氧气、氯气、水
等反应
化合物中价态:
通常为+1价
相对原子 410 2881 质量: 39
单质(固体): 银白色
化学性质活泼,能 与氧气、氯气、水 等反应
化合物中价态:
通常为+1价
与大多数金属、非 许多金属单质及非金属
钠 Na 钾K 物
化学性质活泼,能 化学性质较活泼,能与
氯 Cl
相 对 原 子 287
金屋单质等反应
归 纳 元素之间的内在联系
元素组A
原子具有相同的
现有元素 ■ 最外层电子数,
分类 元素组C 化学性质
分类依据
高中化学
单质具有相似的
元素组B
t
钙Ca
p, 相对原子 420 2882 质量: 40
单质(固体): 银 白 色
化学性质活泼,能 与氧气、氯气、水 等反应
化合物中价态:
通常为+2价
相 对 原 子 +8) 26 4, 质量: 16
单质(气体): 无色
化学性质活泼,能
与大多数金属、非
金属单质等反应
化合物中价态:
通常为-2价
相对原子
质量: 35.5
单质(气体): 黄绿色
化学性质活泼,能与
大 多 数 金 属 单 质 或 非 金 属 单 质 等 化 合
化合物中价态:
通 常 为
-1,+1,+3,+5,+7价
钾K
相对原子 (iy 2881 质量: 39
单质(固体): 银 白 色
化学性质活泼,能 与氧气、氯气、水
硫S
相对原子 +16 286
质量: 32
单质(固体): 淡黄色
化学性质较活泼,能与 许多金属单质及非金属
溴Br
相 对 原 子 43528187 质量:80
单质(液体): 红棕色
化学性质活泼,能与 氢气、大多数金属单 质 等 化 合 生 成 溴 化 物
钠 Na
相对原子 +11 281 质量: 23
单质(固体): 银白色
化学性质活泼,能 与氧气、氯气、水
活动2 找规律、排序
等反应
化合物中价态
通常为+1
户一成产
氯 Cl
高中化学
氧O
口
氯 Cl
硫 S
氧O 相对原子 质量: 32 质量: 35
相对原子 质量:23 单质(气体)
单 质 ( 固 体 ) 价
通 常 为 +1价
通 常 为 -2
通常为
化合物中
质反应
多金属
单
许
反应
氧气、
学性质
等
与
化
数
质
多
性
大
学
与
化
金:
大化
化学性质
单质(固体)
体)
16
气
:
质 (
量
单
质
钾K 相 对 原 子 质量: 39 单质(固体) 化学性质 与氧气、 等反应 钙 Ca 相 对 原 子 质量: 40 单质(固体) 化学性质 与氧气 、 等 反 应 化合物中价态[ 溴 Br
相对原子 28187 质量:80
单质(液体): 红棕色
化学性质活泼,能与 氢气、大多数金属单 质等化合生成溴化物
化合物中价态:
通常为
-1,+1,+3,+5,+7 价
金 属 单 质 化合物中价态-1,+1,+3; 化合物中化合物中价态通常为-2,,
化合物中价态通常为+2价 通常为+1价
TJ,TTD
思考 排序的依据
钠 Na 相对原子 相对原子
排 序
高中化学
氧 O 相对原子 质量:16 +8 单质(气体):无色 钠 N a 相对原子 +11)28 质 量 :23 追质(因休)·银白色 硫S 相对原子 质 量 :32 氯Cl 相对原子 质量:35.5 单质(气体):黄绿色
单质(固体):淡黄色 化学性质较活泼,能与 许多金属单质及非金属 单质反应生成硫化物 化合物中价态: 通常为-2,+4,+6价 钾 K 相对原子 质 量 :39 (19 881 钙 C a 相对原子 质量:40 +209 溴 B r 相对原子 +35 28187 质 量 :80 单质(液体):红棕色 化学性质活泼,能与 氢气、大多数金属单 质等化合生成溴化物 化合物中价态: 通常为 -1,+1,+3,+5,+7价
单 质 ( 固 体 ) :银 白 色 化 学 性 质 活 泼 , 能 与 氧 气 、 氯 气 、 水 等反应 化合物中价态: 通 常 为 + 1 价 单质(固体):银白色 化学性质活泼,能 与氧气、氯气、水 等反应 化合物中价态: 通常为+2价
思考 排序的依据
高中化学
排 序 二
0
Na S
Cl
K Ca
Br
简单元素表
0 Na S Cl K Ca
Br
高中化学
简单元素表
氧O
相对原子 +8
质量: 16
单质(气体):无色
硫S
相对原子 46 8
质量:32
单质(固体): 淡黄色
化学性质较活泼,能与 许多金属单质及非金属 单质反应生成硫化物
化合物中价态:
通常为-2,+4,+6价
氯 Cl
相对原子
质量: 35.5
单质(气体):黄绿色
溴 Br
相对原子 8187 质量:80
单质(液体): 红棕色
化学性质活泼,能与 氢气、大多数金属单 质等化合生成溴化物
化合物中价态:
通常为
-1,+1,+3,+5,+7价
相对原子 四2881 质量:39
单质(固体): 银白色
化学性质活泼,能 与氧气、氯气、水 等反应
化合物中价态:
通常为+1价
单质(固体): 银 白 色 化学性质活泼,能 与氧气、氯气、水 等反应
化合物中价态:
通常为+2价
钠 Na
相对原子 皿 81
质量:23
单质(周体)· 银白色 钾K
钙 Ca
相对原子 质量:40
高中化学
20 288
碲 Te
相 对 原 子
+52) 2818186
质量: 128
单质化学性质:
能与氢气、某些金属
单 质 等 化 合 得 到 碲 化 物。可氧化得到二氧 化碲
化合物中价态:
通常为-2,+4,+6价
高中化学
活动3 确定元素Te在元素表中的位置
钙 Ca 相对原子 质量:40 单质(固体):银白色 学 质活泼能 相对原子 质量:16 氧0 相对原子 质量:16 单质(气体);无色 硫S 相对原子 质量:32 单质(因体):淡黄色 化学性质较活泼,能与 许多金属单质及非金属 单质反应生成硫化物 化合物中价态: 通常为-2,+4,+6价 硫 S 相对原子 质量:32
氯 Cl
相对原子
质量:35.5
单质(气体):黄绿色
化学性质活波, 能与
溴 Br
相对原子
质量:80
单质(液体): 红棕色
华类性要酒流签
O
性
能与氢气、某些金属
单 质 等 化 合 得 到 碲 化 物。可氧化得到二氧 化 碲
化合物中价态:
通常为-2,+4,+6价
单 质 ( 气 体 ) : 无 色 化学性质活泼,能 与大多数金属、非 金属单质等反应 化合物中价态: 通常为-2价
单质(固体): 淡 黄 色
化学性质较活泼,能与 许多金属单质及非金属 单质反应生成硫化物
化 合 物 中 价 态 :
通常为-2,+4,+6价
活动3 确定元素Te在元素表中的位置
碲 Te
相 对 原 子
质量: 128
单质化学性质:
钠 Na
相对原子
质量:23
钾 K
相对原子(D)288 质量:39
单质(圆体) : 银白色
化学性质活泼,能
与氧气、氯气、水
等 反 应
化合物中价态:
通常为+1价
高中化学
2818186
函
2882
氧 O 相对原子 质量·16 +8 26 钠 N a 相对原子 质量·23 +1] 281 硫 S 相对原子 质 量 : 3 2 +16)86 氯Cl 相对原子 质量:35.
钾 K 相对原子 质量:39 +19 88 钙 C a 相对原子 质量:40 420882 碲 T e 相对原子 质量:128 5 2818186 溴 B r 相对原子 质量:80 t35)28187
活动3 确定元素Te在元素表中的位置
高中化学
氧O 相对原子 质量:16 +8 6 钠 N a 相对原子 质量·23 8 · 硫 S 相 对 原 子 质量:32 +16)286 氯Cl 相对原子 +I 质 量 :35.5
钾 K 相对原子 质量:39 +19)881 钙Ca 相 对 原 子 +202882 质量:40 溴Br 相对原子 质 量 :80 t35) 8187 碲 T e 相对原子 质量:128 4522818186
活动3 确定元素Te在元素表中的位置
高中化学
环节二初识元素周期表
·拉瓦锡的元素表
·德贝莱纳的三元素组
·纽兰兹的八音律
·门捷列夫的元素周期表
高中化学
·简单中性物质:光、热、氧、氮、氢
·简单的非金属物质:硫、磷、碳、盐酸基、氢氟酸基、 硼酸基
·简单的金属物质:锑、银、铋、铜、钴、锰、汞、金、 铂、铅、锌、锡、铁、钼、镍、钨
·简单的碱性物质:石灰、镁土、铝土、钡土、硅土
拉瓦锡的化学元素表
高中化学
Na K
·C Br
·S Se Te
·Ca Sr Ba
Mn Cr Fe
德贝莱纳的三元素组
高中化学
No. No. No. No. No. No. No.
No.
H 1 F 8 Cl 15 Co &Ni 22 Br 29 Pd 36 I 42
Pt &Ir 50
Li 2 Na 9 K 16 Cu 23 Rb 30 |Cs 44
0s 51
G 3 Mg10 Ca 17 Zn 24 Sr 31 Cd 38 Ba &V 45
Hg 52
Bo 4 Al 11 Cr 19 Y 25 Ce &La 33 U 40 Ta 46
T153
C 5 Si 12 Ti 18 In 26 Zr 32 Sn 39 W 47
Pb 54
N 6 P 13 Mn 20 As 27 Di &Mo 34 Sb 41 Nb 48
Bi 55
07 S 14 Fe 21 Se 28 Ro &Ru 35 Te 43 Au 49
Th 56
纽兰兹的八音律
高中化学
Ag
37
H=1
Be=9.4 Mg=24 Zn=65.2 Cd=112
B=11 Al=27.4 =68 Ur=116 Au=197
C=12 Si=28 =70 Sn=118
N=14 P=31 As=75 Sb=122 Bi=210
O=16 S=32 Se=79.4 Te=128
F=19 Cl=35.5 Br=80 I=127
Li=7 Na=23 K=39 Rb=85.4 Cs=133 Tl=204
Ca=40 Sr=87.6 Ba=137 Pb=207
=45 Ce=92
Er=56 La=94
Yt=66 Di=95
In=75 Th=118
高中化学
门捷列夫的元素周期表
周期 1A 元 素 周 期 表 0 电子月
0族 电子数
1H 氢 .008 2 He 氮 4.003 K
ⅢA IVA VA VIA VIA ⅡA 原子序数 元素名称 注*的是 人造元素 92 U 铀 7s 5f'6d 0 238. 元素符号,红色 指放射性元素 非金属元素 金属元素 价层电子排布,括号 2 3 Li 锂 2s 6.941 4 Be 铍 2s 9.012 5 B 烈 10.81 6 C 然 2.0 7N 然 4.01 8 氧 16.00 y 9.0 10 Ne 氮 20.18
指可能的电子排布 相对原子质量(加括号的数 据为该放射性元素半衰期最 长同位素的质量数) 过渡元素 稀有气体元素 3 11 Na 的 22.99 12 Mg 镁 3s 24.31 13 Al 鸳 26.98 14 Si 酷 28.09 15 P 30.97 16 S 32.06 17 CI 氯。 35.45 18 Ar 氯 39.95 M -
ⅢB IVB VB VIB VIB m 10 IB ⅡB 2 4 19 K 钾 48 39.10 20 Ca 钙 4s 40.08 21 Sc 筑。 44.96 22 Ti 然 17.87 23 V 50.94 24 Cr 繁 50.00 25 Mn 算 54.94 26 Fe 繁 55.85 27 Co 第 58.93 28 Ni 黛 38.69 29 Cu 架 65.33 30 Zn 集 65 31 Ga 黛 6917 32 Ge 篮 2.63 33 As 体 74.92 34 Se 硒 78.96 35 Br 误 s4 79.90 36 Kr 氮 83.80
5 37 Rb 铷 8547” 38 Sr 锶 58 87.62 39 Y 38.91 40 Zr 41 Nb 42 Mo 怨 95.96 43 Tc 44 KU 45 Rh 46 Pd 钟 4d 06.4 47 Ag 48 Cd 112.4 49 In 鳃 114.8 50 Sn 锡 118.7 51 Sb 121.8 52 Te 隳 127.6 585p 260 54 Xe 氮 131.3
6 55 Cs 铯 1329 56 Ba 钡 373 57~71 La~Lu 镧系 72 Hf 铪 1785 73 Ta 钽 809 74 W 75 Re 铼 1862 76 Os 锇 902 77 Ir 铱 922 78 Pt 9 79 Au 80 Hg 81 Tl 82 Pb 铅 2072 83 Bi 铋 86F 209.0 84 Po 钋 6p 209 85 At 46k1 氡 p 222
87 Fr 钫 22.5 88 Ra 铺 [226] 89-103 Ac~Lr 铜系 104 Rf 钻* (6d'7s ) [265] 05 Db 钳* (6c s) 268| 106 Sg 镇* [271] 07 Bh 陂 270 08 Hs 锶* [277] 109 Mt 铵* |276 10 Ds 铋* [281] 111 Rg 铊* [280] 12(n 钨* [285] 113 NI 钦* [284] 114 Fl 铁* 289] 15 Me 镇* |288 116 LN 位* [293] 17Is 础* 294 118 Og 氮* 294]
铺 系 57 La 镧 5d-Gs 138.9 58 Ce 铈 lsdld 140.1 59 Pr 错 4[%s 1411.9 60 Nd 钕 41Cs 14.4.2 61 Pm 钯 4fYs [145] 62 Sm 4168 50.4 63 Eu 铂 4ts 52.0 64 Gd 钆 4f5d 6s 157.3 65Tb 铽 4f6 158.9 66 Dy 镝 4f6s 162.5 67 H 钛 t6s 164.9 68 Hπ 铒 4fGs 167.3 69 Tm 铥 4f'Gs 68.9 70 Yb 镱 173.1
71 Lu
镥
4I*5d'6s 175.0
铜系 89 Ac 锶 1227] 90 Th 桀。 232.0 91 Pa 然 231.0 92 U 铀 5f 6d 7s 238.0 93 Np [237] 94 Pu 钚 5f 7s [244] 95 Am 钼* 5f^7s [243] 96 Cm 镉* 5f6d 7s 1247 97 Bk 铬 * 57s [247] 98 Cf 锇 ste [251] 99 Es 银* 5f"'7s [252] 100 Fm 锁 5ft7g [257] 101 Md 们 * (5f 7s) [258] 102 No 错 * 5t79( [259]
103 LI
午分
5Pd7
[262]
高中化学
k
IA
0
第 一 周 期 1 H
2 He
IA IIIA IVA VA VIA VIIA 第 二 周 期 3 Li 4 Be 5 B 6 C 7 N 80 9 F
10 Ne
10 8
第 三 周 期 11 Na 12 Mg 2 13 AI ( 14 Si 15 P 5 16 S 17 CI
18 Ar
⑧ 8
归纳元素周期表排布规律
高中化学
按照核电荷数(质子数)由小到大排列
横行:周期
周期序数=电子层数
归纳 元素周期表排布特点
纵列:族
主族序数=最外层电子数
元素周期表
高中化学
人
223 226 制系 6d 7s 265] 268 271 270 277] 276 281 280 2852 284] 289 288 203 94
70 Y 镱 4f's 173. b 71 Lu 镥 41*5d 75.0 铺 系 57 La 镧 56 138.0 58 Ce 铈 4f'5d'6s 140. 59 Pr 镨 4['6s 40.9 60 Nd 钕 4f s 144.2 61 Pm 钷* 4 [145] 62 Sm 钐 4f'f 50.4 63 Eu 铕 4f'6s 152.0 64 Gd 钆 4f'5d 6e 157.3 65 Tb 铽 4f*6 158.9 66 Dy 镝 4f6 162.3 67 Ho 钬 4f s 164. 68 Er 铒 4[ 6g 167.3 69 Tm 钴 4fts 68.9 锕 系 89 Ac 锏 6d17s [227] 90 Th 钍 6t7s 232.0 91 Pa 镁 5f-6d7s 231.0 92 U 铀 5f'6d176 238.0 93 Np 镗 5f'6d-7s [237] 94 Pu 钚 5P7s 244 95 Am 铜* 5f'7s [243] 96 Cm 铝 5f6dl7s [247] 97 Bk 镕* 5f7s 247| 98 Cf 钢* 5f 07s 251 99 Es * 5fl17s 252 100 Fm 馈* 5f127s [257] 101 Md 钒* 5f117s) 258 102 No 错* (5F 7s) [259] 103 Lr 钳* (5f*6d7s) 1262
高中化学
按照核电荷数(质子数)由小到大排列
短周期:1-3
横行:周期,7个
周期序数=电子层数 [长周期:4-7
主族: IA-VIIA
副族: IB-VIIB,VIII
0族:稀有气体
纵列:族,18列,16个族
主族序数=最外层电子数
归纳 元素周期表排布特点
元素周期表
高中化学
练习
·科学家用钙离子撞击放射性元素 (Bk), 产生 了质子数为117的超重元素Ts。Ts的原子结构示 意图如下,试判断它在元素周期表中的位置。
第七周期,第VIIA 族
高中化学
元素周期表与原子结构的关系
元素周期表 反映
(元素位置) 原子结构
决定
原子 族
序数 (主)
高中化学
电子层数
原 子 核
最外层电子数
周期
练习
1.寻找26号元素铁 (Fe) 在元素周期表中的位置。
第四周期,第VIIl 族
2.寻找钛 (Ti)、 金 (Au)、 铀 (U) 三种元素 在周期表中的位置,并分别指出它们的核电荷数。
Ti在第四周期,第IVB族,核电荷数为22
Au在第六周期,第IB族,核电荷数为79
U在第七周期,第IlIB 族,核电荷数为92
高中化学
周期 1A 元 素 周 期 表 0 电子周
0族 电子数
1H 氢 008 2 He 氡 4.003 k
2
ⅡA 原子序数 元素名称 注*的是 人造元素 92 铀 5f'6d 7s 238.0 _元素符号,红色 指放射性元素 作金属元素 金属元素 ⅢA IVA VA VIA VIIA 2 3 Li 锂 6.941 4 Be 铍 9.012 价层电子排布,括号 5 B 硼 o8f 6C 碳。 12.01 7 N 氮 401 8) 氧 16.00 9F 氯 19.00 10 Ne
指可能的电子排布 相对原子质量(加括号的数 据 为 该 放 射 性 元 素 半 衰 期 最 长同位素的质量数) 过渡元素 稀有气体元素 3 11 Na 的 。 22.99 12 Mg 镁 , 24.31 13 Al 鸳 26.98 4 S 碟 28.09 15 P 30.97 16 S 盛 32.06 17 Cl 氮, 35.45 18 Ar 39.95
ⅢB IVB VB VIB VIB m 10 I B ⅡB 12 4 19 K 钾 39.10 20 Ca 钙 0.08 21 Sc 筑 44.96 22 Ti 23 24 Cr 25 Mn 26 Fe 然 55.85 27 Co 镇 58.93 28 Ni 繁 58.69 29 Cu 30 Zn 31 Ga 镓 69.72 32 Ge 锗 72.63 33 AS 砷 74.92 34 Se 硒 78.96 35 Br 溴 79.90 36 Kr
5 37 Rb 铷 85.47 38 Sr 锶 5g 87.62 39】 岛 88.91 40Zr 墨 1N 铌 9291 42 Mo 银 950 43|c 斜 98 44Ru 5 Rh 基 46 Pd 色 106 47 Ag 银 79 48 Cd 镉 12.4 49 In 锶 14.8 50 Sn 锡 18.7 51 Sb 锑 121.8 52 Te 127.6 531 26.9 54 Xe 蟹 131.3
6 ss Cs 铯 132.9 56 Ba 钡 137.3” 57~71 La~Lu 镧系 72 Hf 铪 178.5 73 Ta 钽 180.9 74 W 钨 183.8 75 Re 铼 86.2 76 Os 锇 1902 77 Ir 铱 922 78 Pt 铂 951 0A 金 97.0 80 Hg 汞 200.6 81 Tl 铊 204.4 82 Pb 铅 2072” 83 Bi 铋 2090 84 Po 钋 [2可 85 At 砹 12m 86 Rn 氧 bs-bp [222
8
18
32
18
7 87 Fr 钫 223 88 Ka 铺 226 89-103 Ac~L 铜系 104 Kf 铲* (6d7s) 265] 10s Db 钳* 6d'7s [268] 106 Sg 镇* 271] 107 Bh 铍* [270 108 Hs 锶* 277 09 Mt 铑* [276 110 Ds 铋* 281 111 Rg 铊 280 112 Cn 针 285 113 Nh 钦 284 114 FI 铁* 289 115 Mc 馍* 288 161.1 钕* 293 17 Ts 细 294 18 Og 氮* 294
镧 系 57 La 铺 38.9 58 Ce 铈 140. 54 D 错 4[Vs 140.9 60 Nd 钕 0s 44 61 Pm 钯 6s 145 62 Sm f 50. 63 Eu 铕 fus 152.0 64 Gd 钆 57.3 65 Tb 镇 58.9 66 镝 62 67 Ho 钬 164.9 68 Er 铒 167. 69 Tm 铥 Pis 68.9 70 Yb 镱 73.
71 Lu
铂
5d6
175.0
钢 系 9AC 时 |2 7g 90 Th 钍 6dP s 232/ 91 Pa 镁 51-6d'7s 231.0 92U 钿 5f 6dl7s 138.(1 93 Np 钾 5f%d7s 237] 94 Pu 钋 5PT [244] 95 Am 阳* 5f'7s [243] 96Cm 铜 5T6dl7s 2471 97 Bk 镕* 5F7s [247] 98 5F*7s [251] gg E 银 * 5f!!7k [252] 00 Fm 馈 * 5f127= [257] 01 M 5f137) [258] 02 No 结* 31*7s [259]
103 LN
错*
(5f 6dP7s
[262]
27]
6d
环节三深入认识元素周期表
高中化学
·问题1各周期元素的种数分别是多少 你是如何
得出结论的
·问题2 同周期的第IIA 族与第IIlA 族元素的原子序
数是不是都相差1 请举例说明。
·问题3 同一主族的元素一定都是金属元素或非金
属元素吗 元素有什么分布规律吗
观察与思考
高中化学
周期序数 包含元素种类
起止元素
1 2
1H~,He
2 8
3Li~10Ne
3 8
11Na~ gAr
4 18
19K~36Kr
5 18
37Rb~s Xe
6 32
55Cs~86Rn
7 32
87Fr~11gOg
Q1 各周期元素的种数分别是多少 你是如何得出结论的
高中化学
所在 周期 核电 荷数 元素 符号 各电子层的电子数 K L M N 0 P
Q
1 2 He 2
2 10 Ne 2 8
3 18 Ar 2 8 8
4 36 Kr 2 8 18 8
5 54 Xe 2 8 18 18 8
6 86 Rn 2 8 18 32 18 8
7 118 Og 2 8 18 32 32 18
8
Q1 各周期元素的种数分别是多少 你是如何得出结论的
高中化学
周期 IA IIA IA
IVA
3 11Na 12Mg 13Al
14Si
4 19K 20Ca 31Ga 镓
32Ge 锗
6 55Cs 铯 56Ba 81TI 铊
82Pb 铅
Q2 同周期的第IIA 族与第IIIA 族元素的原子序数 是不是都相差1
周期 1 A
l A
2 3 Li 锂 2s 6.941
4 Be
铍
2s
9.012
3 11 Na 钠 3s 22.99
12 Mg
镁 3s
24.31
4 19 K 钾 4s 39.10
20 Ca
钙
4s 40.08
5 37 Rb 铷 5s 85.47
38 Sr
锶
87.62
6 55 Cs 铯 1329
56 Ba
钡
6s
137.3
7 87 Fr 钫 7s [223]
88 Ra
镭
7s
226]
ⅢA 13
IVA
14
5 B 硼 2s2p 10.81
6 C
碳
2s2p
12.01
13 Al 铝 26.98
14 Si
硅
36 3p
28.09
31 Ga 篮 69.72
32 Ge
镇。
72.63
49 In 锶 114.8
50 Sn
锡
118.7
81 TI 笼。 204.4
82 Pb
铅
6s'6p
207.2
113 Nh 钦* [284]
114 FI
铁*
[289]
高中化学
綱 系 57 La 镧 5d'6s 138.9 58 Ce 铈 4f 5d'6s 140.1 59 Pr 镨 4f6s 140.9 60 Nd 钕 4f6s 144.2 61 Pm 钷* 4P6s [145] 62 Sm 钐 4f6s 150.4 63 Eu 铕 4f6s 152.0 64 Gd 钆 4f'5d'6s 157.3 65 Tb 铽 4f^6s 158.9 66 Dy 镝 4f'6s 162.5 67 Ho 钬 4f6s 164.9 68 Er 铒 4f°6s 167.3 69 Tm 铥 4f6s 168.9 70 Yb 镱 4f6s 173.1
71 Lu
镥
4[*5d'6s 175.0
锏 系 89 Ac 锕 6d'7s [227] 90 Th 钍 6d 7s 232.0 91 Pa 镁 5f 6d!7s 231.0 92 U 铀 5f 6d 7s 238.0 93 Np 锋 5f'6d'7s [237] 94 Pu 钚 517s [244] 95 Am 镭* 5f7s [243] 96 Cm 镉* 5P6d'7s [247] 97 Bk 铬* 5f7s [247] 98 Cf 铜 * 5f17s [251] 99 Es 银* 5f117s [252] 100 Fm 馈 * 5f+7s [257] 101 Md 们* (5f 7s) [258] 102 No 锆* (5r*7s) [259]
103 Lr
捞*
(5f *6d'7s ) [262]
ⅢB 3 IVB 4 VB 5 VIB 6 VIIB 7 8 VⅢI 9 10 I B 11
ⅡB
12
21 Sc 钪 3d 4s 44.96 22 Ti 钛 3d4s 47.87 23 V 钒 3d 4s 50.94 24 Cr 铬 3d 4s 52.00 25 Mn 锰 3d 4s 54.94 26 Fe 铁 3d4s 55.85 27 Co 钴 3d'4s 58.93 28 Ni 镍 3d4s 58.69 29 Cu 铜 3d 4s 63.55
30 Zn
锌
3d4s 65.38
Q2 同周期的第IIA 族与第IIIA 族元素的原子序数 是不是都相差1
Ac~Lr 锏系 1U4 NI 铲* (6d 7s ) [265] Iu3 UU 钳* (6d'7s') [268] 1U0 Dg] 镨* [271] 1U/DN 铍* [270] [1 U8 MS 锶* [277] 10y IVIL 镂* [276] 11U US 铋* [281] 11 Kg 铊* [280]
1z Cn
镭*
[285]
高中化学
Q3 同一主族的元素一定都是金属元素或非金属元素吗 元素有什么分布规律吗
镧 系 57 L0 铺 5d'6s 38. 58 Ce 中 4f'5ds 40.1 59 Pr 错 4s 140.9 60 Nd 钕 41*℃s 144.2 61 Pm 钜 * 4F6s [145] 62 Sm 钐 4h 50.4 63 Eu 们 410s 152.0 64 Gd 钆 4d 6 57.3 5 Tb 铽 4ffs 138.9 66 Dy 镝 41*hs 162.3 67 Ho 钬 46g 64.9 68 EF 叫 4[s 167.3 60 Tm 铥 s 68.9 70 Yb 4fs 173.
71 LU
错
41“5d6s
75.0
钢 系 9 Ac 铜 6d7 [227] 90 Th 钍 6dP7s 232.0 91 Pa 镁 51-6d7s 231.0 92 [ 铀 5f'6dF7s 2380 93 Np 饽 5f'6d7g [237] 94 Pu 钚 5P7 [244] 95 Am 销* 243] 96 Cm 铜* 5P6dl7s [247] 97 Bk 培 * 5PN 247] 98( 铜* 51#7k [251] 99 Es 银申 sF"7w [252 100 Fm * sfrw [257] 101 Md 们車 [258] 102 No 错* (sr*7s [259]
103 Lr
捞* (3f*6d) [262]
高中化学
元素周期表
(元素位置)
结构 规律
总结
决定
原子结构
反映
核外电子排布
核电荷数
高中化学
谢谢大家!
高中化学
