4.3 化学键 课件(39张PPT)
文档属性
| 名称 | 4.3 化学键 课件(39张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 09:41:37 | ||
图片预览




文档简介
(共39张PPT)
化学键(第二课时)
高中化学
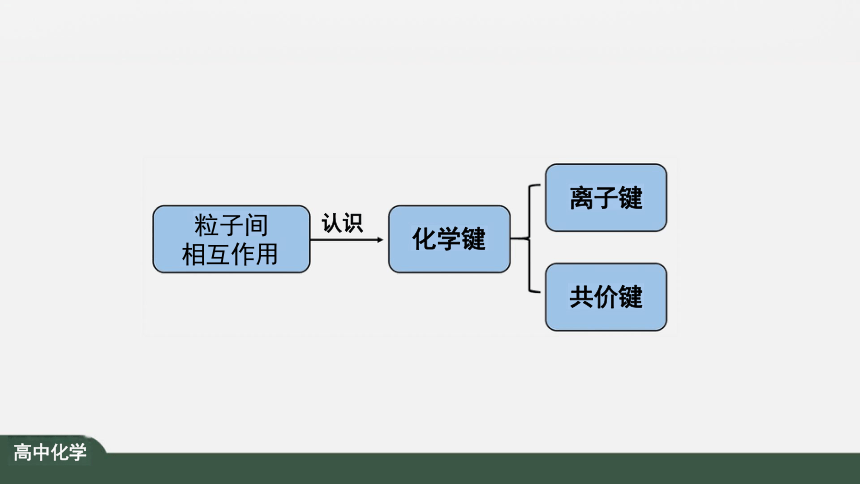
粒子间 相互作用
化学键
共价键
离子键
高中化学
认识
物质 NaCl
HCl
成键元素 Na Cl
H Cl
成键粒子 Na+Cl-
H Cl
粒子间相互作用 静电作用
共用电子对
化学键的类型 离子键
共价键
任务1 请填写下列表格
高中化学
由离子键构成的化合物叫做离子化合物。
如 NaCl 、KCl 、MgCl 、CaCl 、ZnSO 、NaOH 均
是离子化合物。
通常,活泼金属和活泼非金属形成离子化合物。
高中化学
以共用电子对形成分子的化合物叫做共价化合物。
如 HCI、H O、CO 、CH 都是共价化合物。
通常,由非金属元素形成的化合物是共价化合物。
高中化学
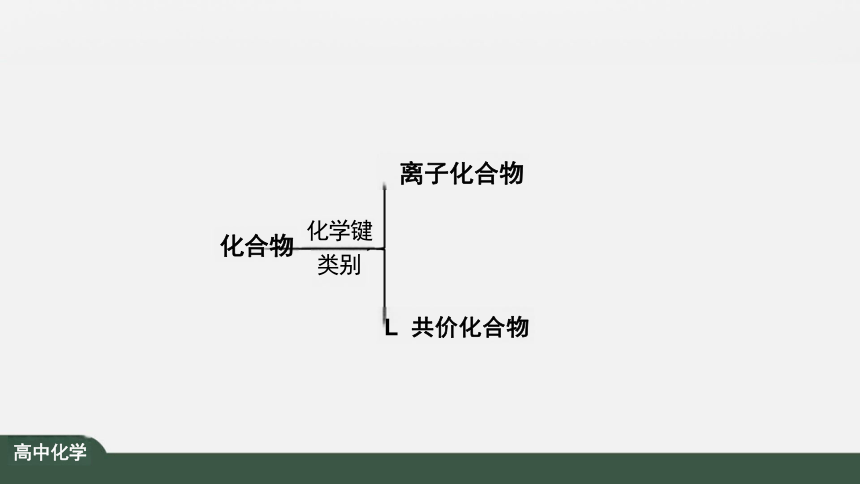
离子化合物
化学键
类别
L 共价化合物
化合物
高中化学
物质 NaCl
HCI
成键元素 Na Cl
H Cl
成键粒子 Na+Cl-
H Cl
粒子间相互作用 静电作用
共用电子对
化学键的类型 离子键
共价键
水溶液的导电性
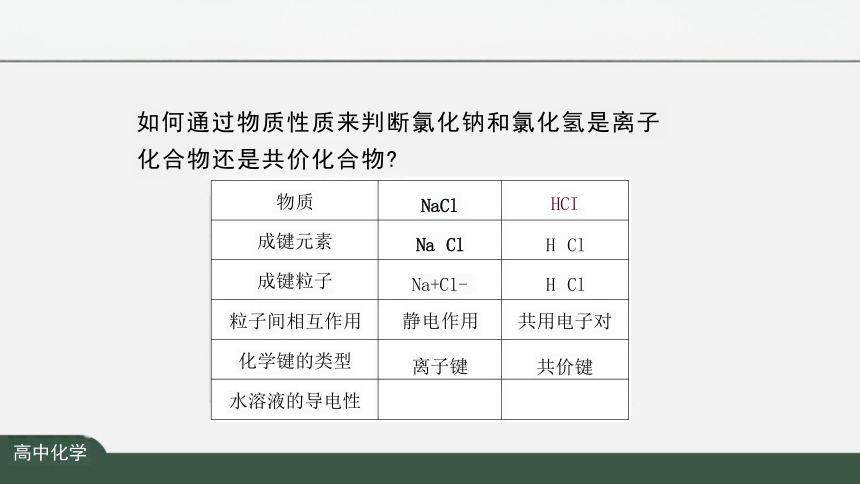
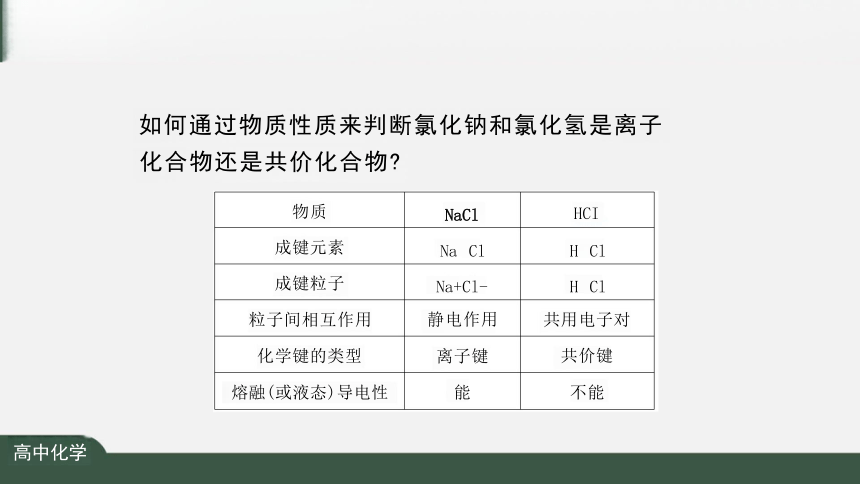
如何通过物质性质来判断氯化钠和氯化氢是离子
化合物还是共价化合物
高中化学
物质 NaCl
HCl
成键元素 Na Cl
H Cl
成键粒子 Na+Cl-
H Cl
粒子间相互作用 静电作用
共用电子对
化学键的类型 离子键
共价键
水溶液的导电性
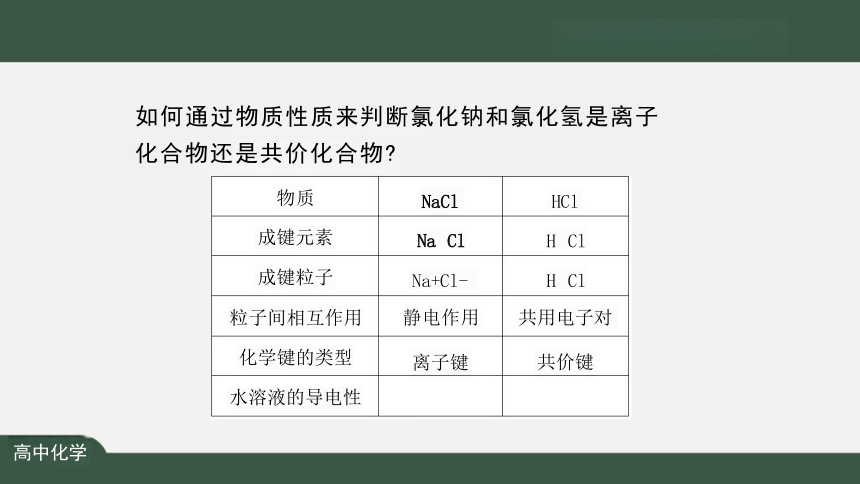
如何通过物质性质来判断氯化钠和氯化氢是离子
化合物还是共价化合物
高中化学
物质 NaCl
HCI
成键元素 Na Cl
H Cl
成键粒子 Na+Cl-
H Cl
粒子间相互作用 静电作用
共用电子对
化学键的类型 离子键
共价键
熔融(或液态)导电性 能
不能
如何通过物质性质来判断氯化钠和氯化氢是离子
化合物还是共价化合物
高中化学
物质
导电性
(熔融态或液态)
常见离子化合物 NaCl、KCl、Ca0
导电
常见共价化合物 HCI、H O、CO 、C H OH
不导电
高中化学
资料
熔点/℃
-83.36
-114.17
-86.80
-50.76
熔点/℃
610
802
771
724
共价化 合物
HF
HCl
HBr
Hl
离子化 合物 LiCl
NaCl
KCl
RbCl
部分离子化合物、共价化合物的熔点。
高中化学
物质 NaCl
HCI
成键元素 Na Cl
H Cl
成键粒子 Na+Cl-
H Cl
化学键的类型 离子键
共价键
物质类别 离子化合物
共价化合物
熔融(或液态)导电性 能
不能
达稳定
结构时 →化学键 需电子数
元素及 原子结构
得失电 子趋势
物质 类别
高中化学
性质
物质 NaCl
HCI
成键元素 Na Cl
H Cl
成键粒子 Na+Cl-
H Cl
化学键的类型 离子键
共价键
物质类别 离子化合物
共价化合物
熔融(或液态)导电性 能
不能
达稳定
→结构时 →化学键
需电子数
元素及 原子结构
得失电 子趋势
物质 类别
高中化学
性质
现有下列物质: HCl、CO 、CH 、MgCl 、CaO
请回答下列问题
(1)上述物质中分别存在哪些类型的化学键
(2)哪些是离子化合物,哪些是共价化合物
(3)推测在熔融态(或液态)哪些物质能导电
【答案】
(1)极性键,极性键,极性键,离子键,离子键
(2)MgCl 、CaO是离子化合物, HCI、CO 、CH 是共价化合物
(3)MgCl 、Ca0 在熔融态能导电
高中化学
达稳定
一 结构时 → 化学键
需电子数
共价 × 化合物
C H- —H
液态时 不导电
元素及
原子结构
得失电 子趋势
物质 类别
高中化学
性质
CH
性质
高中化学
化学键 认识 物质— → 化合物
离子化合物 共价化合物
任务2 我们知道化学反应是反应物中的原子重新
结合为产物分子的过程。从化学键的角度, 如何解释H 和Cl 反应生成HCl的过程
高中化学
任务2 我们知道化学反应是反应物中的原子重新
结合为产物分子的过程。从化学键的角度, 如何解释H 和Cl 反应生成HCl的过程
H—H Cl—Cl H—Cl
旧化学键断裂,新化学键形成
反应 本质
高中化学
十
下图是H (g)+Cl (g)=2HCl(g) 反应能量变化示意
图。请判断该反应吸热还是放热
提示
断键吸收能量
成键放出能量
HH
436kJ·mol-!
能量;ci( cì)
243kJ·mol
能量
H
+
Cl
H Cl
H
十
ai
Cl
431kJ·mol-! 能量
键 断裂 键 断裂
431kJ·mol-1
能量
假想 中间 物质
高中化学
键形成
键形成
键 436kJ·mol-l 能量;Cl Cl 243kJ·mol 能量 431kJ·mol-1 能量
H
十
a
Cl
431kJ·mol-1 能量
ZE 断键=436+243=679 kJ
ZE成键=2x431=862 kJ E成键 > ∑ E断键 放热反应
下图是H (g)+Cl (g)=2HCl(g) 反应能量变化示意
图。请判断该反应吸热还是放热
提示
断键吸收能量
成键放出能量
H 十 c) 成
假想 中间 物质
形
键
断裂 键 断裂
高中化学
键形成
HCl
旧化学键的断裂 新化学键的形成
化学反应 的本质
化学键
高中化学
认识
实例1 通常情况下,水在加热至100 ℃时可以
变为水蒸气;水加热至2000 ℃缓慢分
解为H 和O 。这说明了什么 请从粒子间
相互作用的角度加以分析。
H O(I) 加热 H O(g)
2H O =D-2H T+O +
高中化学
实例1 通常情况下,水在加热至100 ℃时可以
变为水蒸气;水加热至2000 ℃缓慢分
解为H 和O 。这说明了什么 请从粒子间
相互作用的角度加以分析。
H O(l) 加热 → H O(g) H O之间存在着相互作用
2H O C2H ↑+O 1 H O内H、0 存在着相互作用
化学键的作用远大于分子间的相互作用
高中化学
实例1 通常情况下,水在加热至100 ℃时可以
变为水蒸气;水加热至2000 ℃缓慢分
解为H 和O 。这说明了什么 请从粒子间
相互作用的角度加以分析。
粒子间的相互作用既存在于分子内相邻的原子之间,
也存在于分子之间,且前者远大于后者。
相邻原子间强烈的相互作用叫做化学键。
高中化学
化学键 H—F H—Cl H—Br
H—I
断裂1 mol化 学键吸收的能 量/kJ·mol-1 568 431.8 366
298.7
实例2 我们知道“随核电荷数递增,卤族元素气
态氢化物稳定性依次降低”,结合表中数
据,请从化学键的角度谈谈对这一现象的
看法。
高中化学
化学键 H—F H—Cl H—Br
H—l
断裂1 mol化 学键吸收的能 量/kJ·mol-1 568 431.8 366
298.7
2H—X △ H—H +X—X
高中化学
化学键 H—F H—Cl H—Br
H—l
断裂1 mol化 学键吸收的能 量/kJ·mol-1 568 431.8 366
298.7
H—X越来越容易断裂,稳定性逐渐减弱
高中化学
2H—X △ H H +X X
卤化氢 HF HCl HBr
HI
分解 温度/℃ 几乎 不分解 3000 500
300
2H—X: △=H—H +X—X
高中化学
化学键 H—F H—Cl H—Br
H—I
断裂1 mol化 学键吸收的能 量/kJ·mol-1 568 431.8 366
298.7
H—X越来越容易断裂,稳定性逐渐减弱
高中化学
2H X △ H H +X X
化学键 H—F H—Cl H—Br
H—I
断裂1 mol化 学键吸收的能 量/kJ·mol-1 568 431.8 366
298.7
H—X越来越容易断裂,稳定性逐渐减弱
高中化学
2H—X =△ H H +X X
实例3 在做金属钠的实验时,往往有小块的钠剩余。
一般将这些小块钠加入到无水乙醇中,充分 反应,将钠完全消耗,消除隐患。乙醇的结 构式如下图所示。请结合乙醇的结构分析其
能与钠发生反应的原因。
高中化学
实例3 在做金属钠的实验时,往往有小块的钠剩余。
一般将这些小块钠加入到无水乙醇中,充分 反应,将钠完全消耗,消除隐患。乙醇的结 构式如下图所示。请结合乙醇的结构分析其
能与钠发生反应的原因。
高中化学
实例3 在做金属钠的实验时,往往有小块的钠剩余。
一般将这些小块钠加入到无水乙醇中,充分 反应,将钠完全消耗,消除隐患。乙醇的结 构式如下图所示。请结合乙醇的结构分析其
能与钠发生反应的原因。
高中化学
工 H
乙醇 H— C -0—H
H H
水 H+ 0—H
高中化学
乙醇 H-
水
高中化学
C H
H H
H + 0—H
2H—0- -H +2Na==2NaOH+H 1
L
工
工
一
a mm
高中化学
乙醇和钠反应的化学方程式
H H
H- -C -0—H
H H
H + 0—H
乙醇和钠反应要比水和钠反应缓慢的多。
高中化学
乙醇
水
H H
H- C- 0—H
H H
H+ 0—H
乙醇和钠反应要比水和钠反应缓慢的多。
高中化学
乙醇
水
物质 化学反应
粒子间 相互作用
离子键
共价键
化学键
高中化学
认识
认识
化学键(第二课时)
高中化学
粒子间 相互作用
化学键
共价键
离子键
高中化学
认识
物质 NaCl
HCl
成键元素 Na Cl
H Cl
成键粒子 Na+Cl-
H Cl
粒子间相互作用 静电作用
共用电子对
化学键的类型 离子键
共价键
任务1 请填写下列表格
高中化学
由离子键构成的化合物叫做离子化合物。
如 NaCl 、KCl 、MgCl 、CaCl 、ZnSO 、NaOH 均
是离子化合物。
通常,活泼金属和活泼非金属形成离子化合物。
高中化学
以共用电子对形成分子的化合物叫做共价化合物。
如 HCI、H O、CO 、CH 都是共价化合物。
通常,由非金属元素形成的化合物是共价化合物。
高中化学
离子化合物
化学键
类别
L 共价化合物
化合物
高中化学
物质 NaCl
HCI
成键元素 Na Cl
H Cl
成键粒子 Na+Cl-
H Cl
粒子间相互作用 静电作用
共用电子对
化学键的类型 离子键
共价键
水溶液的导电性
如何通过物质性质来判断氯化钠和氯化氢是离子
化合物还是共价化合物
高中化学
物质 NaCl
HCl
成键元素 Na Cl
H Cl
成键粒子 Na+Cl-
H Cl
粒子间相互作用 静电作用
共用电子对
化学键的类型 离子键
共价键
水溶液的导电性
如何通过物质性质来判断氯化钠和氯化氢是离子
化合物还是共价化合物
高中化学
物质 NaCl
HCI
成键元素 Na Cl
H Cl
成键粒子 Na+Cl-
H Cl
粒子间相互作用 静电作用
共用电子对
化学键的类型 离子键
共价键
熔融(或液态)导电性 能
不能
如何通过物质性质来判断氯化钠和氯化氢是离子
化合物还是共价化合物
高中化学
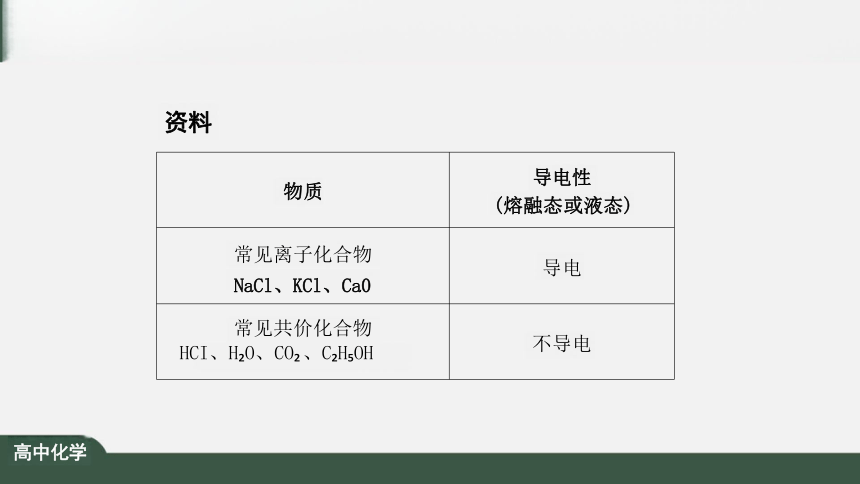
物质
导电性
(熔融态或液态)
常见离子化合物 NaCl、KCl、Ca0
导电
常见共价化合物 HCI、H O、CO 、C H OH
不导电
高中化学
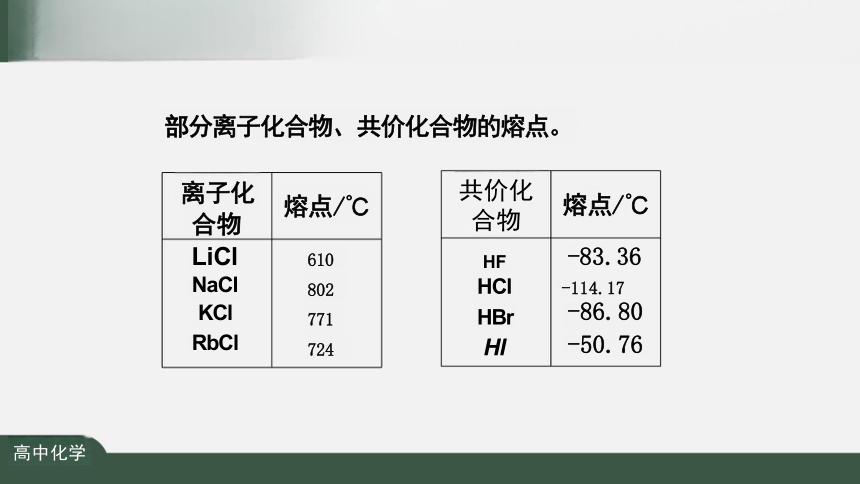
资料
熔点/℃
-83.36
-114.17
-86.80
-50.76
熔点/℃
610
802
771
724
共价化 合物
HF
HCl
HBr
Hl
离子化 合物 LiCl
NaCl
KCl
RbCl
部分离子化合物、共价化合物的熔点。
高中化学
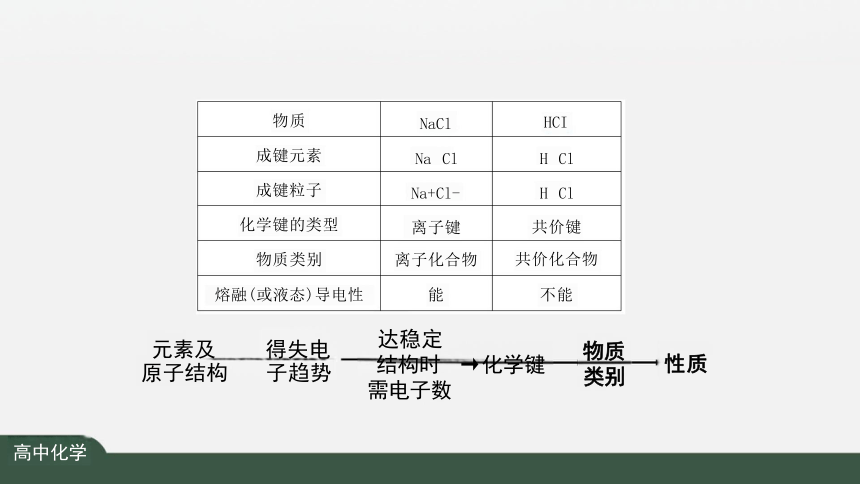
物质 NaCl
HCI
成键元素 Na Cl
H Cl
成键粒子 Na+Cl-
H Cl
化学键的类型 离子键
共价键
物质类别 离子化合物
共价化合物
熔融(或液态)导电性 能
不能
达稳定
结构时 →化学键 需电子数
元素及 原子结构
得失电 子趋势
物质 类别
高中化学
性质
物质 NaCl
HCI
成键元素 Na Cl
H Cl
成键粒子 Na+Cl-
H Cl
化学键的类型 离子键
共价键
物质类别 离子化合物
共价化合物
熔融(或液态)导电性 能
不能
达稳定
→结构时 →化学键
需电子数
元素及 原子结构
得失电 子趋势
物质 类别
高中化学
性质
现有下列物质: HCl、CO 、CH 、MgCl 、CaO
请回答下列问题
(1)上述物质中分别存在哪些类型的化学键
(2)哪些是离子化合物,哪些是共价化合物
(3)推测在熔融态(或液态)哪些物质能导电
【答案】
(1)极性键,极性键,极性键,离子键,离子键
(2)MgCl 、CaO是离子化合物, HCI、CO 、CH 是共价化合物
(3)MgCl 、Ca0 在熔融态能导电
高中化学
达稳定
一 结构时 → 化学键
需电子数
共价 × 化合物
C H- —H
液态时 不导电
元素及
原子结构
得失电 子趋势
物质 类别
高中化学
性质
CH
性质
高中化学
化学键 认识 物质— → 化合物
离子化合物 共价化合物
任务2 我们知道化学反应是反应物中的原子重新
结合为产物分子的过程。从化学键的角度, 如何解释H 和Cl 反应生成HCl的过程
高中化学
任务2 我们知道化学反应是反应物中的原子重新
结合为产物分子的过程。从化学键的角度, 如何解释H 和Cl 反应生成HCl的过程
H—H Cl—Cl H—Cl
旧化学键断裂,新化学键形成
反应 本质
高中化学
十
下图是H (g)+Cl (g)=2HCl(g) 反应能量变化示意
图。请判断该反应吸热还是放热
提示
断键吸收能量
成键放出能量
HH
436kJ·mol-!
能量;ci( cì)
243kJ·mol
能量
H
+
Cl
H Cl
H
十
ai
Cl
431kJ·mol-! 能量
键 断裂 键 断裂
431kJ·mol-1
能量
假想 中间 物质
高中化学
键形成
键形成
键 436kJ·mol-l 能量;Cl Cl 243kJ·mol 能量 431kJ·mol-1 能量
H
十
a
Cl
431kJ·mol-1 能量
ZE 断键=436+243=679 kJ
ZE成键=2x431=862 kJ E成键 > ∑ E断键 放热反应
下图是H (g)+Cl (g)=2HCl(g) 反应能量变化示意
图。请判断该反应吸热还是放热
提示
断键吸收能量
成键放出能量
H 十 c) 成
假想 中间 物质
形
键
断裂 键 断裂
高中化学
键形成
HCl
旧化学键的断裂 新化学键的形成
化学反应 的本质
化学键
高中化学
认识
实例1 通常情况下,水在加热至100 ℃时可以
变为水蒸气;水加热至2000 ℃缓慢分
解为H 和O 。这说明了什么 请从粒子间
相互作用的角度加以分析。
H O(I) 加热 H O(g)
2H O =D-2H T+O +
高中化学
实例1 通常情况下,水在加热至100 ℃时可以
变为水蒸气;水加热至2000 ℃缓慢分
解为H 和O 。这说明了什么 请从粒子间
相互作用的角度加以分析。
H O(l) 加热 → H O(g) H O之间存在着相互作用
2H O C2H ↑+O 1 H O内H、0 存在着相互作用
化学键的作用远大于分子间的相互作用
高中化学
实例1 通常情况下,水在加热至100 ℃时可以
变为水蒸气;水加热至2000 ℃缓慢分
解为H 和O 。这说明了什么 请从粒子间
相互作用的角度加以分析。
粒子间的相互作用既存在于分子内相邻的原子之间,
也存在于分子之间,且前者远大于后者。
相邻原子间强烈的相互作用叫做化学键。
高中化学
化学键 H—F H—Cl H—Br
H—I
断裂1 mol化 学键吸收的能 量/kJ·mol-1 568 431.8 366
298.7
实例2 我们知道“随核电荷数递增,卤族元素气
态氢化物稳定性依次降低”,结合表中数
据,请从化学键的角度谈谈对这一现象的
看法。
高中化学
化学键 H—F H—Cl H—Br
H—l
断裂1 mol化 学键吸收的能 量/kJ·mol-1 568 431.8 366
298.7
2H—X △ H—H +X—X
高中化学
化学键 H—F H—Cl H—Br
H—l
断裂1 mol化 学键吸收的能 量/kJ·mol-1 568 431.8 366
298.7
H—X越来越容易断裂,稳定性逐渐减弱
高中化学
2H—X △ H H +X X
卤化氢 HF HCl HBr
HI
分解 温度/℃ 几乎 不分解 3000 500
300
2H—X: △=H—H +X—X
高中化学
化学键 H—F H—Cl H—Br
H—I
断裂1 mol化 学键吸收的能 量/kJ·mol-1 568 431.8 366
298.7
H—X越来越容易断裂,稳定性逐渐减弱
高中化学
2H X △ H H +X X
化学键 H—F H—Cl H—Br
H—I
断裂1 mol化 学键吸收的能 量/kJ·mol-1 568 431.8 366
298.7
H—X越来越容易断裂,稳定性逐渐减弱
高中化学
2H—X =△ H H +X X
实例3 在做金属钠的实验时,往往有小块的钠剩余。
一般将这些小块钠加入到无水乙醇中,充分 反应,将钠完全消耗,消除隐患。乙醇的结 构式如下图所示。请结合乙醇的结构分析其
能与钠发生反应的原因。
高中化学
实例3 在做金属钠的实验时,往往有小块的钠剩余。
一般将这些小块钠加入到无水乙醇中,充分 反应,将钠完全消耗,消除隐患。乙醇的结 构式如下图所示。请结合乙醇的结构分析其
能与钠发生反应的原因。
高中化学
实例3 在做金属钠的实验时,往往有小块的钠剩余。
一般将这些小块钠加入到无水乙醇中,充分 反应,将钠完全消耗,消除隐患。乙醇的结 构式如下图所示。请结合乙醇的结构分析其
能与钠发生反应的原因。
高中化学
工 H
乙醇 H— C -0—H
H H
水 H+ 0—H
高中化学
乙醇 H-
水
高中化学
C H
H H
H + 0—H
2H—0- -H +2Na==2NaOH+H 1
L
工
工
一
a mm
高中化学
乙醇和钠反应的化学方程式
H H
H- -C -0—H
H H
H + 0—H
乙醇和钠反应要比水和钠反应缓慢的多。
高中化学
乙醇
水
H H
H- C- 0—H
H H
H+ 0—H
乙醇和钠反应要比水和钠反应缓慢的多。
高中化学
乙醇
水
物质 化学反应
粒子间 相互作用
离子键
共价键
化学键
高中化学
认识
认识
