4.2 元素周期律 课件(共41张PPT)
文档属性
| 名称 | 4.2 元素周期律 课件(共41张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 00:00:00 | ||
图片预览









文档简介
(共41张PPT)
元素周期律(第二课时)
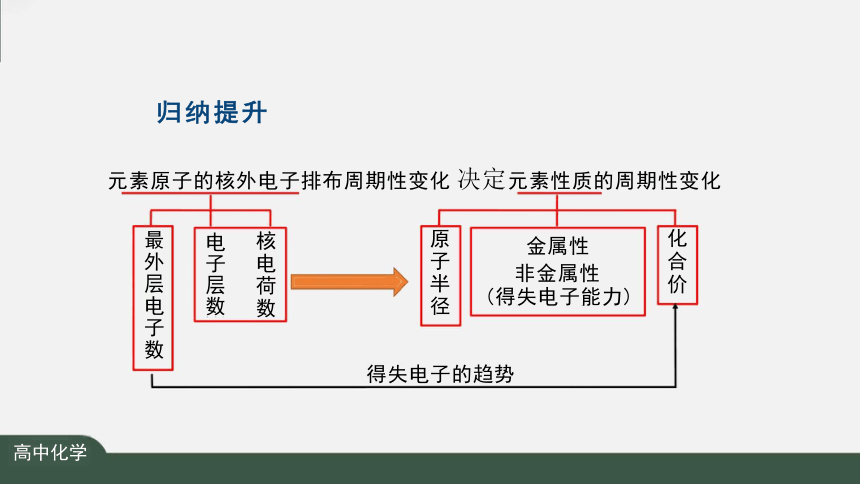
归纳提升
元素原子的核外电子排布周期性变化 决定元素性质的周期性变化
金属性
非金属性
(得失电子能力)
得失电子的趋势
高中化学
核电荷数
电子层数
最外层电子数
原子半径
化合价
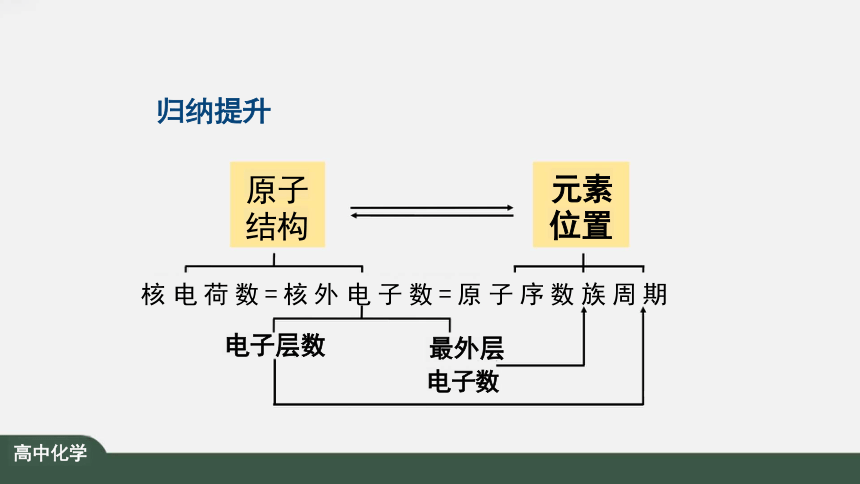
归纳提升
元素原子的核外电子排布周期性变化 决定元素性质的周期性变化
金属性
非金属性
(得失电子能力)
得失电子的趋势
高中化学
核电荷数
电子层数
最外层电子数
原子半径
化合价
核 电 荷 数 = 核 外 电 子 数 = 原 子 序 数 族 周 期
电子层数 最外层
电子数
高中化学
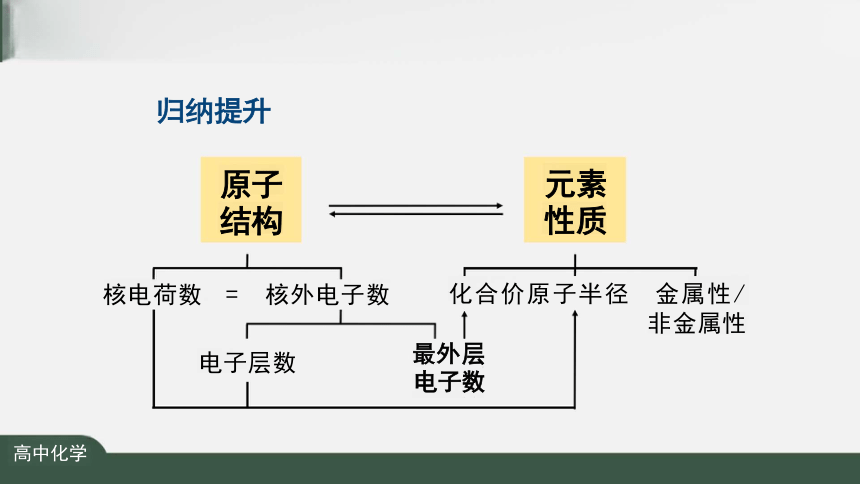
归纳提升
原子 结构
元素 位置
化合价原子半径 金属性/ 非金属性
最外层
电子数
核电荷数 = 核外电子数
电子层数
归纳提升
原子 结构
元素 性质
高中化学
化合价原子半径 金属性/ 非金属性
最外层
电子数
核电荷数 = 核外电子数
电子层数
归纳提升
原子 结构
元素 性质
高中化学
原子序数-
周期一
族
高中化学
化合价
原子半径
L 金属性/非金属性 判断依据
得失电子难易程度
电子
层数
原子
结构
归纳提升
最外层 电子数
核电 荷数
元素 位置
元素 性质
例题分析
VIIA VIA VA
例1.有同周期的三种元素X、Y、Z , 已知它
们的最高价含氧酸的酸性由强到弱的顺序为 HXO > H YO >H ZO , 则下列叙述中不正确的是( ) A. 非金属性 X>Y> Z
B.X、Y、Z 形成的阴离子还原性逐渐增强
C. 原子半径 XD.X、Y、Z 的气态氢化物稳定性由弱到强
高中化学
例题分析
VIIA VIA VA
例1.有同周期的三种元素X、Y、Z , 已知它
们的最高价含氧酸的酸性由强到弱的顺序为 HXO > H YO >H ZO , 则下列叙述中不正确的是 (D ) A. 非金属性 X>Y> Z
B.X、Y、Z 形成的阴离子还原性逐渐增强
C. 原子半径 XD.X、Y、Z 的气态氢化物稳定性由弱到强
高中化学
例题分析
例2.短周期中的两种元素X 和Y,X 的原子序数大
于Y,X 原子的最外层电子数是次外层电子数的一半, Y 的二价阴离子和Ne 的电子层结构相同 关于X 和Y 形
成的化合物Z的说法中正确的是( Y 为氧元素 A.Z 是酸性氧化物 B.Z 的水化物是碱
C.Z 的化学式为X Y D.Z 的水化物的酸性强于碳酸
高中化学
例题分析
例2.短周期中的两种元素X 和Y,X 的原子序数大
于Y,X 原子的最外层电子数是次外层电子数的一半, Y 的二价阴离子和Ne 的电子层结构相同 关于X 和Y 形
成的化合物Z的说法中正确的是( Y 为氧元素 A.Z 是酸性氧化物 B.Z 的水化物是碱
C.Z 的化学式为X Y D.Z 的水化物的酸性强于碳酸
高中化学
例题分析
Si O
例2.短周期中的两种元素X 和Y,X 的原子序数大
于Y,X 原子的最外层电子数是次外层电子数的一半, Y 的二价阴离子和Ne 的电子层结构相同,关于X 和Y 形
成的化合物Z 的 说 法 中 正 确 的 是 ( )
A.Z 是酸性氧化物 B.Z 的水化物是碱
C.Z 的化学式为区Y D.Z 的水化物的酸性强于碳酸
SiO
高中化学
例题分析
例2.短周期中的两种元素X 和Y,X 的原子序数大
于Y,X 原子的最外层电子数是次外层电子数的一半, Y 的二价阴离子和Ne 的电子层结构相同,关于X 和Y 形 成的化合物Z 的说法中正确的是 (A)
A.Z 是酸性氧化物 B.Z 的水化物是碱
C.Z 的化学式为X Y D.Z 的水化物的酸性强于碳酸
同主族非金属元素最高价
高中化学 氧化物对应的水化物酸性
例题分析
例3 .X、Y、Z、W 均为短周期元素,它们在元素周期表中的
位置如图所示。若Y 原子的最外层电子数是次外层电子数的3倍,
则下列说法中正确的是( )
A.原子半径: W>Z>Y>X
B. 最高价氧化物对应的水化物的酸性: Z>W>X
C.W 单质能与水反应生成两种强酸
D.四种元素的单质中,只有Z单质在常温常压下是固体
高中化学
XY
z w
例题分析
例3.X、Y、Z、W 均为短周期元素,它们在元素
周期表中的位置如图所示。若Y 原子的最外层电子数 是次外层电子数的3倍,则下列说法中正确的是()
X Y N
Z W S C1
高中化学
例题分析
X Y N
Z W S C1
A.原子半径: Z > W > X> Y
B.最高价氧化物对应的水化物的酸性: Z>W>X
酸性: HCIO >H SO
高中化学
例题分析
X Y N
Z W S C1
C.W 单质能与水反应生成两种强酸
Cl +H O=HCl+HClO
D.四种元素的单质中,只有Z单质在常温常压下是固体
气体: N O Cl
高中化学
周期
族
IA IA ⅢA IVA VA VIA VIIA 0
1 2 3 4 5 6 7
非金属性逐渐增强
稀有气体元素
非金属性逐渐增强
金属性逐渐增强
归纳提升
Te
Po At
高中化学
金属性逐渐增强
As
Sb
非金属
B
Al
Si
Ge
金属
周期
族
IA IA ⅢA IVA VA VIA VIIA 0
1 2 3 4 5 6 7
非金属性逐渐增强
稀有气体元素
非金属性逐渐增强
金属性逐渐增强
归纳提升
Te
Po At
高中化学
金属性逐渐增强
As
Sb
非金属
B
Al
Si
Ge
金属
周期
族
IA IA ⅢA IVA VA VIA VIIA 0
1 2 3 4 5 6 7
非金属性逐渐增强
稀有气体元素
非金属性逐渐增强
金属性逐渐增强
归纳提升
Te
Po At
高中化学
金属性逐渐增强
As
Sb
非金属
B
Al
Si
Ge
金属
周期
族
IA IA ⅢA IVA VA VIA VIIA 0
1 2 3 4 5 6 7
非金属性逐渐增强
稀有气体元素
非金属性逐渐增强
金属性逐渐增强
归纳提升
Te
Po At
高中化学
金属性逐渐增强
As
Sb
非金属
B
Al
Si
Ge
金属
实际应用
硅芯片
高中化学
硅芯片 高效低毒的
有机磷农药
高中化学
实际应用
耐高温、耐腐蚀 铱合金用于制造 发动机的火花塞
高效低毒的
有机磷农药
实际应用
硅芯片
高中化学
美国化学家托马斯·米奇利
制冷剂——氟利昂
实际应用
高中化学
美国化学家托马斯·米奇利
制冷剂——氟利昂
实际应用
高中化学
1H 3Li g Be sB CH NH H O
建
iRa 设山整 型 ldSi PH H S|
CI
AsH
实际应用
高中化学
南极臭氧空洞示意图
高中化学
新的制冷剂
实际应用
氟利昂
解毒 排毒 抗污染
提高
红细胞的
携氧能力
保护 修复细胞
抗氧化
抗衰老
实际应用
提高人体
免疫力
高中化学
预防癌变
实际应用
已知34号硒(Se)元素,在周期表中的
位置是第四周期VIA族元素,依据你所学的 元素周期律的知识,预测该元素及其化合 物的性质。
高中化学
I A 元 素 周 期 表 O 16.00
1 1 H 氢 1.008 Ⅱ A 原子序数 元素名称 注·的是 人造元素 92 U 铀 5f'6d'7s 238.0 元素符号,红色 指放射性元素 价电子排布,加括号的 表示可能收格由三 相对原子质量,加括号的数 渡元 据为该放射性元素半衰期最 长同位素的质量数 Ⅲ A IV A V A VI A VI A 17 2 3 Li 锂 28 6.941 4 Be 铍 ooi2 5 B 硼 2* 2p 0.8 6 C 碳 2w 2r 2,01 7 N 氮 2a 2p 4.01 2w 2p 16.00 9 F 19.00 3 11 Na 钠 3% 22.99 Mg 镁 3t 24.31 13 Al 铝 3g 3p 26,98 14 Si 硅 3g 3p 28.09 15 P 磷 s 16 S 感 32.06 品 16 S 32.06
Ⅲ B IV B V B VI B VI B m 10 I B Ⅱ B 4 19 K 钾 4s 39.10 20 Ca 钙 4. 40.08 21 Sc 钪 3d'4g 44.96 22 Ti 钛 3d 4x 47.87 23 V 钒 3d 4s 50.94 24 Cr 铬 3f 4k 52.0 25 Mn 锰 4g 54,94 26 Fe 铁 3d4 55.85 27 C 钴 3d4 58.93 28 N 镍 4 58.69 29 Cu 铜 3d4s 63.55 30 Zn 65.38 31 Ga 镓 4s 4p' 69.72 32 Ge 锗 4s p 72.63 33 AS 砷 4s4p 74.92 34 Se 硒 5 Br 热 79.90 5 37 Rb 即 5 85.47 38 Sr 锶 5= 87.62 39 钇 4d+5 88.91 40 Zr 锆 4df5s 91.22 41 Nb 铌 4d5 92.91 42 Mo 钼 4d 5s 95.95 43 Tc 锝 4d*5s 98 44 Ru 钉 4d Sk 101.1 45 Rh 铑 4d5g 1029 P 靶 4d 106.4 47 Ag 银 4d5 107.9 48 Cd 镉 4d5s 12.4 49 In 铟 5s 5p 114.8 50 Sn 锡 5s 5p 18.7 51 Sb 锑 5g5p 121.8 52 Te 筛 5k p 127.6 53 I 碘 5 5p 126.9 34 Se 78.97
6 55 Cs 绝 6g 132.9 56 Ba 钡 1373 57-7 La-Lu 镧系 72 Hf 铪 5f6g 178.5 73 Tg 钽 5dfcs 80.9 74 W 钨 5d%s 83.8 75 R 铼 5d s 86.2 76 Os 锇 5A6s 90.2 77 Ir 铱 空 78 Pt 铂 56 195.1 79 Au 象 197.0 80 Hg 汞 5d6s 200.6 81 TI 铊 2044 82 Pb 铅 2022 83 Bi 铋 2026 84 Po 钋 6c 6p 〔209〕 85 At 砹 6c'tp 〔210〕 87 Fr 钫 7g [223] 网Ra 铺 [226]7% 9-103 Ac~Lr 铜系 104 Rf 铲 6d 7x 6 105 Db 针* 6d 7g) 106 Sg 镨* [269] 107 Bh 镀 10 108 Hs 镍 270 109 Mt 镀* (278】 10 D 铋* (282 i Rg 轮 12CT 镭 (285) 13 Nh 你 〔286 114 FI 铁 [289] 115 Me 锁 ” [289 116 Lv 铊* 293) 117 Ts 础 [293
7 CT
镧 系 57 L8 5d'e 38.9 58 Ce 铈 4f'5df6s 140. 59 PT 4f'6s 40.9 60 Nd 钕 4f*6 144. 61 Pm 4f'6m [145 62 Sn 钐 4f6s 150.4 63 EU 铂 4f'6s 152.0 64 Gd 钆 4f'sd6 157.3 65 TT 铽 4r 158.9 66 Dy 镝 4f“ 62.5 67 Ho 钬 4f''6s 164.9 68 Er 铒 4r 167.3 69 Tm 铥 4f%e 168.9 70 Yb 镱 4f*6g 173.0
71 L
镨
4f*5d'6
175.0
钢 系 89 Ac 钢 6d' L22/」 90 Th 钍 6f 252.0 91 Pa 模 sfd'T 231.0 92 U 铀 5f'6d'7 238.0 93 Np 镗 sr*6d'7 [237] 94 Pu 钋 s 244] 95 Am 锢“ sf7e [243] g6 Cm 锡* sf6d [247] 97 Bk 铬 * 57s 24/』 98 Cf 铜* 5f7s [251] 99 Es 铱 * 5f'"7s [252] 100 Fm 锁* 5r 7 [257] 01 Md 们 (Sf 7s ) [258] 102 No 错 * (sr-me [259]
103 Lr
捞*
Sr*6d s
[262]
氧 族 元 素
实际应用
高中化学
8
与氢气生成气态氢化物由易到难:
O >S>Se
氢化物稳定性由强到弱:
H O>H S>H Se
最高价氧化物对应的水化物的酸性:
H SeO8
O
16.00
16
S
32.06
34
Se
78.97
实际应用
高中化学
与氢气生成气态氢化物由难到易:
As氢化物稳定性由弱到强:
AsH最高价氧化物对应的水化物的酸性:
H AsO8 O 16.00
16 S 32.06 33 As 74.92 34 Se 78.97
35
Br
79.90
实际应用
高中化学
Ti=50 Zr=90
V=51 Nb=94
Cr=52 Mo=96
Mn=55 Rh=104,4
Fe=56 Ru=104,4
Ni=Co=59 P]=106,6
Cu=63,4 Ag=108
zm0ort Cd= 112
Au=197
=70
Bi=210
Te=128
J=127
TI=204. Pb=207.
=45
Er=56
Yt=60
In=75,6
A.Menoexeee.
门捷列夫的预言
科学史话
=180.
fa—Tsz.
W=186.
Pt=197,4 Ir=198. Os=199.
Hg=200.
Mg=24
Al=27,4 Si=28
P=31
S=32
Cl=35,5 K=39
Be=9,4 B=11 C=12
N=14
0=16
F=19
Na=23
也小A
pr a=ner
a
AS—7o
Se=79,4 Br=80
Rb=85,4 Sr=87,6
高中化学
Ce=92 La=94 Di=95 Th=118
Ur=116 Sn=118 Sb=122
Cs=133 Ba=137
F
&a
7=学
A/
AX A
AF
=68
Li=7
H=1
偶
炉
&-
luda.a
B*
加
高
4
,
科学史话
门捷列夫的预言
镓 (1875)
高中化学
科学史话
门捷列夫的预言
镓 (1875)
高中化学
科学史话
门捷列夫的预言
教材114页第8题
8. 门捷列夫曾预测镓、钪、锗元素的存在及其性质,三种元素后来被发现,且性质与预测相吻合;莫
塞莱也曾预测锝、钷、铪、铼等元素的存在,这些元素几十年后也分别被发现。到目前为止,元素
周期表的第七周期已经被填满。你认为周期表是否还能拓展 请你设想一下,如果发现119号元素,
它应该位于周期表的什么位置,可能具有什么性质 你对元素周期表有什么新的认识
门捷列夫 预测镓、钪、锗让头 科学家
莫塞莱预测锝、钷、铪、铼,证实 科学家
高中化学
IA 元 素 周 期 表 电子厘
' ,008 He 氮 .003 K
Ⅱ A 原子序数 元素名称 92 U 铀 5rWd7 238.0 元款符号,红色 措放射性元素 价电子排布,加括号的 表示可能的价电子排布 相对原子质量,加括号的数 元 据为该放射性元素半衰期最 长同位素的质量数 Ⅱ A Iv A V A VI A Ⅱ A 3 Li 锂 2a 6.94 Be 皱 4 .01 5 B 硼 08 2a 7 N 氮 2x2p 14.01 2m 6.00 F 氟 19.0 10 Ne 氟 201
2
11 Na 钠 22.99 12 Mg 铁 24.3 13 Al 14 Si 硅 3 jg 28.09 15 P 6 S 盛 17 Cl 18 Ar 益
ⅢB IV B V B VI B VⅡ B Vm I B Ⅱ B 19 K 钾 39.10 20 Ca 的 40.08 21 Se 44.9 22 Ti 47.8 23V 50.94 24 Cr 52.00 25 Mn 篮 54.94 26 Fe 4g 55.85 27 C 58.93 28 Ni 58.69 29C 63.5 30 Z 焦 65.3 Ga 69.72 32 Ge 72.63 “ 4.9 4Se 6.97 35 Br 恐 79.90 Kr 83.80
37 Rb 伽 85.47 38 Sr 能 82 39 Y 解 88.9 40 Z 错 91.22 41 Nb 铌 92.9 42 Mo 5.9 43 Tc 码 4fs 98 44 Ru 钉 101.1 45 Rh 铑 029 46 Pd 配 106.4 nA 假 48 Cd 幅 124 49 In 铟 148 50 Sn 51 Sb 评 23 52 Te 碲 53 I 碘 269 54 Xe
5 C 铯 132.9 56 Ba 钡 1n5 57-71 La-Lu 镧系 72 Hf 输 178.5 73 Ta 钽 1809 74 W 鱼 83.8 75 Re 林 862 76 Os 锅 190.2 77 Ir 铱 192.2 78 P 钾 t 79 A 金。 97.0 80 Hg 求 200.6 1 Tl 铊 04 82 PI U 3 B 84 Pe 针 p (209 85 A (210) 86 Rn [222]
7 FT 钫 (223) 88 Rg 新 [226 89-103 Ac-Lr 铜 系 04 Rf 铲” 46d7s ) 0 105 Db 钳* (6'Ts 106 Sg 镇 107 Bh 镟* 2 08 Hs 饵 20 109 Mt 枝* 8 10 D 铋 111 R 轮* 112 Cn 错 83 113 Nh 你 L286』 114F 铁 1289 15Me 锁* L289] 116 LW 粒 117 Ts 硼 ” [293]|[293] 180g 氲 [2941
科学史话
门捷列夫的预言
黑票 6s 8C r'dsi 140 9 Pr 错 4r'tw 40.9 Nd 1 Pm 62 Sm aru 50.4 3 E 4r 52.0 64 Gd 5 T 58.9 6 4r 62.5 67 He 64.9 8 Er r 167.3 6 Tn 4r"k 68.9 YI
请
180
制 系 A yy Ih 7 1 P 钱 231.0 2【 德 238.0 3 N 94 Pr 怀 244 95 Am 铜 96 Cm (247) 97 Bk 镝“ [247 9 CT 制 [251 9 Es 镇 252] 00 Fm 燃 101 Md [258] 102 No 编 2591
103 Lr
(262)
碱 金 属 元 素
高中化学
243) [257]
IA 元 素 周 期 表 电子厘
' ,008 He 氮 .003 K
Ⅱ A 原子序数 元素名称 92 U 铀 5rWd7 238.0 元就符号,虹色 措放射性元素 价电子排布,加括号的 表示可能的价电子排布 相对原子质量,加括号的数 元 据为该放射性元素半衰期最 长同位素的质量数 Ⅱ A IV A V A VI A Ⅱ A 3 Li 锂 2m 6.94 Be 皱 .01 5 B 硼 08 2a 7 N 氮 2x2p 14.01 2m 6.00 F 氟 19.0 10 Ne 氟 201
2
11 Na 钠 22.95 12 Mg 转 24.3 13 Al 14 Si 硅 3 jg 28.09 15 P 6 S 盛 17 Cl 18 Ar 益
ⅢB IV B V B VI B VⅡ B Vm I B Ⅱ B 19 K 钾 39.10 20 Ca 的 40.08 21 Se 44.9 22 Ti 47.8 23V 50.94 24 CT 52.00 25 Mn 篮 54.94 26 Ft 4g 55.85 27 C 58.93 28 Ni 58.69 29C 63.5 30 Z 焦 65.3 Ga 69.72 32 Ge 72.63 “ 4.92 4Se 6.97 35 Br 恐 79.90 Kr 83.80
37 Rb 伽 85.47 38 Sr 能 82 39 解 88.91 40 Z 错 91.22 41 Nb 铌 92.9 42 Mo 5.9 43 Tc 每 4f5 98 44 Ru 钉 101.1 45 Rh 铑 1029 46 Pd 配 106.4 nA 银 mg 48 Cd 幅 124 49 In 铟 148 50 Sn 51 Sb 评 23 52 Te 碲 53 I 碘 269 54 Xe
5 C 铯 32.9 56 Ba sn5 57-71 La-Lu 镧系 72 Hf 给 78.5 73 Ta 钼 180.9 74 W 钨 83.8 75 Re 林 862 76 Os 锅 190.2 77 Ir 帐 192.2 78 P 钾 t 79 A 金。 97.0 80 Hg 求 200.6 1 Tl 铊 04 82 PI U7 3 B 84 Pe 针 p (209 85 A (210) 86 Rn [222]
7 F 钫 培Rg 新 89-1 Ac~Lr 铜 系 104 Rf 铲 (drs) 105 Db 钍 6d'7s 106 Sg 禧 107 Bh 镟* 2701 08 Hs 0 109 Mt 枝* 8 10 D 铋 111 R 轮* 112 Cn 错 83 113 Nh 你 L286』 114F 铁 1289 15Me 锁* L289] 116 LW 粒 117 Ts 硼 ” [293]|[293] 180g 氲 [2941
8 119 ……
科学史话
门捷列夫的预言
器黑 8C r sd 140 h 错 4f' 40.9 Nd 1 Pm 2 Sm aru 50.4 3 E 4f6s 52.0 4 Gr 5 T 58.9 6 D 4r 62.5 67 He 64.9 8Er r 167.3 6 Tn 4r"k 68.9 YI
请
180
制 A yy l 1 P 钱 231.0 2【 德 238.0 3 N 94 Pr 怀 244 95 Am 铜 243] 96 Cm (247) 97 Bk 镝“ [247 98 CT 制 [251 9 Es 镇 2521 00 Fm 燃 [257] 101 Md [258] 102 No 2591
103 Lr
(262)
碱 金 属 元 素
高中化学
IA 元 素 周 期 表 电子厘
' ,008 He 氮 .003 K
Ⅱ A 原子序数 元素名称 92 U 铀 5rWd7 238.0 元就符号,虹色 措放射性元素 价电子排布,加括号的 表示可能的价电子排布 相对原子质量,加括号的数 元 据为该放射性元素半衰期最 长同位素的质量数 Ⅱ A IV A V A VI A Ⅱ A 3 Li 锂 2m 6.94 Be 皱 .01 5 B 硼 08 2a 7 N 氮 2x2p 14.01 2m 6.00 F 氟 19.0 10 Ne 氟 201
2
11 Na 钠 22.95 12 Mg 转 24.3 13 Al 14 Si 硅 3 jg 28.09 15 P 6 S 盛 17 Cl 18 Ar 益
ⅢB IV B V B VI B VⅡ B Vm I B Ⅱ B 19 K 钾 39.10 20 Ca 的 40.08 21 Se 44.9 22 Ti 47.8 23V 50.94 24 CT 52.00 25 Mn 篮 54.94 26 Ft 4g 55.85 27 C 58.93 28 Ni 58.69 29C 63.5 30 Z 焦 65.3 Ga 69.72 32 Ge 72.63 “ 4.92 4Se 6.97 35 Br 恐 79.90 Kr 83.80
37 Rb 伽 85.47 38 Sr 能 82 39 解 88.91 40 Z 错 91.22 41 Nb 铌 92.9 42 Mo 5.9 43 Tc 每 4f5 98 44 Ru 钉 101.1 45 Rh 铑 1029 46 Pd 配 106.4 nA 银 mg 48 Cd 幅 124 49 In 铟 148 50 Sn 51 Sb 评 23 52 Te 碲 53 I 碘 269 54 Xe
5 C 铯 32.9 56 Ba sn5 57-71 La-Lu 镧系 72 Hf 给 78.5 73 Ta 钼 180.9 74 W 钨 83.8 75 Re 林 862 76 Os 锅 190.2 77 Ir 帐 192.2 78 P 钾 t 79 A 金。 97.0 80 Hg 求 200.6 1 Tl 铊 04 82 PI U7 3 B 84 Pe 针 p (209 85 A (210) 86 Rn [222]
7 F 钫 培Rg 新 89-1 Ac~Lr 铜 系 104 Rf 铲 (drs) 105 Db 钍 6d'7s 106 Sg 禧 107 Bh 镟* 2701 08 Hs 0 109 Mt 枝* 8 10 D 铋 111 R 轮* 112 Cn 错 83 113 Nh 你 L286』 114F 铁 1289 15Me 锁* L289] 116 LW 粒 117 Ts 硼 ” [293]|[293] 180g 氲 [2941
8 119 ……
科学史话
门捷列夫的预言
器黑 8C r sd 140 h 错 4f' 40.9 Nd 1 Pm 2 Sm aru 50.4 3 E 4f6s 52.0 4 Gr 5 T 58.9 6 D 4r 62.5 67 He 64.9 8Er r 167.3 6 Tn 4r"k 68.9 YI
请
180
制 A yy l 1 P 钱 231.0 2【 德 238.0 3 N 94 Pr 怀 244 95 Am 铜 243] 96 Cm (247) 97 Bk 镝“ [247 98 CT 制 [251 9 Es 镇 2521 00 Fm 燃 [257] 101 Md [258] 102 No 2591
103 Lr
(262)
碱 金 属 元 素
高中化学
课堂小结
元素周期律的应用和意义
学习化学 应用于科 论证了事物
的一种重 学研究和 变化的量变
要工具 生产 引起质变
和性质
高中化学
预测或推
测元素的
原子结构
元素周期律(第二课时)
归纳提升
元素原子的核外电子排布周期性变化 决定元素性质的周期性变化
金属性
非金属性
(得失电子能力)
得失电子的趋势
高中化学
核电荷数
电子层数
最外层电子数
原子半径
化合价
归纳提升
元素原子的核外电子排布周期性变化 决定元素性质的周期性变化
金属性
非金属性
(得失电子能力)
得失电子的趋势
高中化学
核电荷数
电子层数
最外层电子数
原子半径
化合价
核 电 荷 数 = 核 外 电 子 数 = 原 子 序 数 族 周 期
电子层数 最外层
电子数
高中化学
归纳提升
原子 结构
元素 位置
化合价原子半径 金属性/ 非金属性
最外层
电子数
核电荷数 = 核外电子数
电子层数
归纳提升
原子 结构
元素 性质
高中化学
化合价原子半径 金属性/ 非金属性
最外层
电子数
核电荷数 = 核外电子数
电子层数
归纳提升
原子 结构
元素 性质
高中化学
原子序数-
周期一
族
高中化学
化合价
原子半径
L 金属性/非金属性 判断依据
得失电子难易程度
电子
层数
原子
结构
归纳提升
最外层 电子数
核电 荷数
元素 位置
元素 性质
例题分析
VIIA VIA VA
例1.有同周期的三种元素X、Y、Z , 已知它
们的最高价含氧酸的酸性由强到弱的顺序为 HXO > H YO >H ZO , 则下列叙述中不正确的是( ) A. 非金属性 X>Y> Z
B.X、Y、Z 形成的阴离子还原性逐渐增强
C. 原子半径 X
高中化学
例题分析
VIIA VIA VA
例1.有同周期的三种元素X、Y、Z , 已知它
们的最高价含氧酸的酸性由强到弱的顺序为 HXO > H YO >H ZO , 则下列叙述中不正确的是 (D ) A. 非金属性 X>Y> Z
B.X、Y、Z 形成的阴离子还原性逐渐增强
C. 原子半径 X
高中化学
例题分析
例2.短周期中的两种元素X 和Y,X 的原子序数大
于Y,X 原子的最外层电子数是次外层电子数的一半, Y 的二价阴离子和Ne 的电子层结构相同 关于X 和Y 形
成的化合物Z的说法中正确的是( Y 为氧元素 A.Z 是酸性氧化物 B.Z 的水化物是碱
C.Z 的化学式为X Y D.Z 的水化物的酸性强于碳酸
高中化学
例题分析
例2.短周期中的两种元素X 和Y,X 的原子序数大
于Y,X 原子的最外层电子数是次外层电子数的一半, Y 的二价阴离子和Ne 的电子层结构相同 关于X 和Y 形
成的化合物Z的说法中正确的是( Y 为氧元素 A.Z 是酸性氧化物 B.Z 的水化物是碱
C.Z 的化学式为X Y D.Z 的水化物的酸性强于碳酸
高中化学
例题分析
Si O
例2.短周期中的两种元素X 和Y,X 的原子序数大
于Y,X 原子的最外层电子数是次外层电子数的一半, Y 的二价阴离子和Ne 的电子层结构相同,关于X 和Y 形
成的化合物Z 的 说 法 中 正 确 的 是 ( )
A.Z 是酸性氧化物 B.Z 的水化物是碱
C.Z 的化学式为区Y D.Z 的水化物的酸性强于碳酸
SiO
高中化学
例题分析
例2.短周期中的两种元素X 和Y,X 的原子序数大
于Y,X 原子的最外层电子数是次外层电子数的一半, Y 的二价阴离子和Ne 的电子层结构相同,关于X 和Y 形 成的化合物Z 的说法中正确的是 (A)
A.Z 是酸性氧化物 B.Z 的水化物是碱
C.Z 的化学式为X Y D.Z 的水化物的酸性强于碳酸
同主族非金属元素最高价
高中化学 氧化物对应的水化物酸性
例题分析
例3 .X、Y、Z、W 均为短周期元素,它们在元素周期表中的
位置如图所示。若Y 原子的最外层电子数是次外层电子数的3倍,
则下列说法中正确的是( )
A.原子半径: W>Z>Y>X
B. 最高价氧化物对应的水化物的酸性: Z>W>X
C.W 单质能与水反应生成两种强酸
D.四种元素的单质中,只有Z单质在常温常压下是固体
高中化学
XY
z w
例题分析
例3.X、Y、Z、W 均为短周期元素,它们在元素
周期表中的位置如图所示。若Y 原子的最外层电子数 是次外层电子数的3倍,则下列说法中正确的是()
X Y N
Z W S C1
高中化学
例题分析
X Y N
Z W S C1
A.原子半径: Z > W > X> Y
B.最高价氧化物对应的水化物的酸性: Z>W>X
酸性: HCIO >H SO
高中化学
例题分析
X Y N
Z W S C1
C.W 单质能与水反应生成两种强酸
Cl +H O=HCl+HClO
D.四种元素的单质中,只有Z单质在常温常压下是固体
气体: N O Cl
高中化学
周期
族
IA IA ⅢA IVA VA VIA VIIA 0
1 2 3 4 5 6 7
非金属性逐渐增强
稀有气体元素
非金属性逐渐增强
金属性逐渐增强
归纳提升
Te
Po At
高中化学
金属性逐渐增强
As
Sb
非金属
B
Al
Si
Ge
金属
周期
族
IA IA ⅢA IVA VA VIA VIIA 0
1 2 3 4 5 6 7
非金属性逐渐增强
稀有气体元素
非金属性逐渐增强
金属性逐渐增强
归纳提升
Te
Po At
高中化学
金属性逐渐增强
As
Sb
非金属
B
Al
Si
Ge
金属
周期
族
IA IA ⅢA IVA VA VIA VIIA 0
1 2 3 4 5 6 7
非金属性逐渐增强
稀有气体元素
非金属性逐渐增强
金属性逐渐增强
归纳提升
Te
Po At
高中化学
金属性逐渐增强
As
Sb
非金属
B
Al
Si
Ge
金属
周期
族
IA IA ⅢA IVA VA VIA VIIA 0
1 2 3 4 5 6 7
非金属性逐渐增强
稀有气体元素
非金属性逐渐增强
金属性逐渐增强
归纳提升
Te
Po At
高中化学
金属性逐渐增强
As
Sb
非金属
B
Al
Si
Ge
金属
实际应用
硅芯片
高中化学
硅芯片 高效低毒的
有机磷农药
高中化学
实际应用
耐高温、耐腐蚀 铱合金用于制造 发动机的火花塞
高效低毒的
有机磷农药
实际应用
硅芯片
高中化学
美国化学家托马斯·米奇利
制冷剂——氟利昂
实际应用
高中化学
美国化学家托马斯·米奇利
制冷剂——氟利昂
实际应用
高中化学
1H 3Li g Be sB CH NH H O
建
iRa 设山整 型 ldSi PH H S|
CI
AsH
实际应用
高中化学
南极臭氧空洞示意图
高中化学
新的制冷剂
实际应用
氟利昂
解毒 排毒 抗污染
提高
红细胞的
携氧能力
保护 修复细胞
抗氧化
抗衰老
实际应用
提高人体
免疫力
高中化学
预防癌变
实际应用
已知34号硒(Se)元素,在周期表中的
位置是第四周期VIA族元素,依据你所学的 元素周期律的知识,预测该元素及其化合 物的性质。
高中化学
I A 元 素 周 期 表 O 16.00
1 1 H 氢 1.008 Ⅱ A 原子序数 元素名称 注·的是 人造元素 92 U 铀 5f'6d'7s 238.0 元素符号,红色 指放射性元素 价电子排布,加括号的 表示可能收格由三 相对原子质量,加括号的数 渡元 据为该放射性元素半衰期最 长同位素的质量数 Ⅲ A IV A V A VI A VI A 17 2 3 Li 锂 28 6.941 4 Be 铍 ooi2 5 B 硼 2* 2p 0.8 6 C 碳 2w 2r 2,01 7 N 氮 2a 2p 4.01 2w 2p 16.00 9 F 19.00 3 11 Na 钠 3% 22.99 Mg 镁 3t 24.31 13 Al 铝 3g 3p 26,98 14 Si 硅 3g 3p 28.09 15 P 磷 s 16 S 感 32.06 品 16 S 32.06
Ⅲ B IV B V B VI B VI B m 10 I B Ⅱ B 4 19 K 钾 4s 39.10 20 Ca 钙 4. 40.08 21 Sc 钪 3d'4g 44.96 22 Ti 钛 3d 4x 47.87 23 V 钒 3d 4s 50.94 24 Cr 铬 3f 4k 52.0 25 Mn 锰 4g 54,94 26 Fe 铁 3d4 55.85 27 C 钴 3d4 58.93 28 N 镍 4 58.69 29 Cu 铜 3d4s 63.55 30 Zn 65.38 31 Ga 镓 4s 4p' 69.72 32 Ge 锗 4s p 72.63 33 AS 砷 4s4p 74.92 34 Se 硒 5 Br 热 79.90 5 37 Rb 即 5 85.47 38 Sr 锶 5= 87.62 39 钇 4d+5 88.91 40 Zr 锆 4df5s 91.22 41 Nb 铌 4d5 92.91 42 Mo 钼 4d 5s 95.95 43 Tc 锝 4d*5s 98 44 Ru 钉 4d Sk 101.1 45 Rh 铑 4d5g 1029 P 靶 4d 106.4 47 Ag 银 4d5 107.9 48 Cd 镉 4d5s 12.4 49 In 铟 5s 5p 114.8 50 Sn 锡 5s 5p 18.7 51 Sb 锑 5g5p 121.8 52 Te 筛 5k p 127.6 53 I 碘 5 5p 126.9 34 Se 78.97
6 55 Cs 绝 6g 132.9 56 Ba 钡 1373 57-7 La-Lu 镧系 72 Hf 铪 5f6g 178.5 73 Tg 钽 5dfcs 80.9 74 W 钨 5d%s 83.8 75 R 铼 5d s 86.2 76 Os 锇 5A6s 90.2 77 Ir 铱 空 78 Pt 铂 56 195.1 79 Au 象 197.0 80 Hg 汞 5d6s 200.6 81 TI 铊 2044 82 Pb 铅 2022 83 Bi 铋 2026 84 Po 钋 6c 6p 〔209〕 85 At 砹 6c'tp 〔210〕 87 Fr 钫 7g [223] 网Ra 铺 [226]7% 9-103 Ac~Lr 铜系 104 Rf 铲 6d 7x 6 105 Db 针* 6d 7g) 106 Sg 镨* [269] 107 Bh 镀 10 108 Hs 镍 270 109 Mt 镀* (278】 10 D 铋* (282 i Rg 轮 12CT 镭 (285) 13 Nh 你 〔286 114 FI 铁 [289] 115 Me 锁 ” [289 116 Lv 铊* 293) 117 Ts 础 [293
7 CT
镧 系 57 L8 5d'e 38.9 58 Ce 铈 4f'5df6s 140. 59 PT 4f'6s 40.9 60 Nd 钕 4f*6 144. 61 Pm 4f'6m [145 62 Sn 钐 4f6s 150.4 63 EU 铂 4f'6s 152.0 64 Gd 钆 4f'sd6 157.3 65 TT 铽 4r 158.9 66 Dy 镝 4f“ 62.5 67 Ho 钬 4f''6s 164.9 68 Er 铒 4r 167.3 69 Tm 铥 4f%e 168.9 70 Yb 镱 4f*6g 173.0
71 L
镨
4f*5d'6
175.0
钢 系 89 Ac 钢 6d' L22/」 90 Th 钍 6f 252.0 91 Pa 模 sfd'T 231.0 92 U 铀 5f'6d'7 238.0 93 Np 镗 sr*6d'7 [237] 94 Pu 钋 s 244] 95 Am 锢“ sf7e [243] g6 Cm 锡* sf6d [247] 97 Bk 铬 * 57s 24/』 98 Cf 铜* 5f7s [251] 99 Es 铱 * 5f'"7s [252] 100 Fm 锁* 5r 7 [257] 01 Md 们 (Sf 7s ) [258] 102 No 错 * (sr-me [259]
103 Lr
捞*
Sr*6d s
[262]
氧 族 元 素
实际应用
高中化学
8
与氢气生成气态氢化物由易到难:
O >S>Se
氢化物稳定性由强到弱:
H O>H S>H Se
最高价氧化物对应的水化物的酸性:
H SeO
O
16.00
16
S
32.06
34
Se
78.97
实际应用
高中化学
与氢气生成气态氢化物由难到易:
As
AsH
H AsO
16 S 32.06 33 As 74.92 34 Se 78.97
35
Br
79.90
实际应用
高中化学
Ti=50 Zr=90
V=51 Nb=94
Cr=52 Mo=96
Mn=55 Rh=104,4
Fe=56 Ru=104,4
Ni=Co=59 P]=106,6
Cu=63,4 Ag=108
zm0ort Cd= 112
Au=197
=70
Bi=210
Te=128
J=127
TI=204. Pb=207.
=45
Er=56
Yt=60
In=75,6
A.Menoexeee.
门捷列夫的预言
科学史话
=180.
fa—Tsz.
W=186.
Pt=197,4 Ir=198. Os=199.
Hg=200.
Mg=24
Al=27,4 Si=28
P=31
S=32
Cl=35,5 K=39
Be=9,4 B=11 C=12
N=14
0=16
F=19
Na=23
也小A
pr a=ner
a
AS—7o
Se=79,4 Br=80
Rb=85,4 Sr=87,6
高中化学
Ce=92 La=94 Di=95 Th=118
Ur=116 Sn=118 Sb=122
Cs=133 Ba=137
F
&a
7=学
A/
AX A
AF
=68
Li=7
H=1
偶
炉
&-
luda.a
B*
加
高
4
,
科学史话
门捷列夫的预言
镓 (1875)
高中化学
科学史话
门捷列夫的预言
镓 (1875)
高中化学
科学史话
门捷列夫的预言
教材114页第8题
8. 门捷列夫曾预测镓、钪、锗元素的存在及其性质,三种元素后来被发现,且性质与预测相吻合;莫
塞莱也曾预测锝、钷、铪、铼等元素的存在,这些元素几十年后也分别被发现。到目前为止,元素
周期表的第七周期已经被填满。你认为周期表是否还能拓展 请你设想一下,如果发现119号元素,
它应该位于周期表的什么位置,可能具有什么性质 你对元素周期表有什么新的认识
门捷列夫 预测镓、钪、锗让头 科学家
莫塞莱预测锝、钷、铪、铼,证实 科学家
高中化学
IA 元 素 周 期 表 电子厘
' ,008 He 氮 .003 K
Ⅱ A 原子序数 元素名称 92 U 铀 5rWd7 238.0 元款符号,红色 措放射性元素 价电子排布,加括号的 表示可能的价电子排布 相对原子质量,加括号的数 元 据为该放射性元素半衰期最 长同位素的质量数 Ⅱ A Iv A V A VI A Ⅱ A 3 Li 锂 2a 6.94 Be 皱 4 .01 5 B 硼 08 2a 7 N 氮 2x2p 14.01 2m 6.00 F 氟 19.0 10 Ne 氟 201
2
11 Na 钠 22.99 12 Mg 铁 24.3 13 Al 14 Si 硅 3 jg 28.09 15 P 6 S 盛 17 Cl 18 Ar 益
ⅢB IV B V B VI B VⅡ B Vm I B Ⅱ B 19 K 钾 39.10 20 Ca 的 40.08 21 Se 44.9 22 Ti 47.8 23V 50.94 24 Cr 52.00 25 Mn 篮 54.94 26 Fe 4g 55.85 27 C 58.93 28 Ni 58.69 29C 63.5 30 Z 焦 65.3 Ga 69.72 32 Ge 72.63 “ 4.9 4Se 6.97 35 Br 恐 79.90 Kr 83.80
37 Rb 伽 85.47 38 Sr 能 82 39 Y 解 88.9 40 Z 错 91.22 41 Nb 铌 92.9 42 Mo 5.9 43 Tc 码 4fs 98 44 Ru 钉 101.1 45 Rh 铑 029 46 Pd 配 106.4 nA 假 48 Cd 幅 124 49 In 铟 148 50 Sn 51 Sb 评 23 52 Te 碲 53 I 碘 269 54 Xe
5 C 铯 132.9 56 Ba 钡 1n5 57-71 La-Lu 镧系 72 Hf 输 178.5 73 Ta 钽 1809 74 W 鱼 83.8 75 Re 林 862 76 Os 锅 190.2 77 Ir 铱 192.2 78 P 钾 t 79 A 金。 97.0 80 Hg 求 200.6 1 Tl 铊 04 82 PI U 3 B 84 Pe 针 p (209 85 A (210) 86 Rn [222]
7 FT 钫 (223) 88 Rg 新 [226 89-103 Ac-Lr 铜 系 04 Rf 铲” 46d7s ) 0 105 Db 钳* (6'Ts 106 Sg 镇 107 Bh 镟* 2 08 Hs 饵 20 109 Mt 枝* 8 10 D 铋 111 R 轮* 112 Cn 错 83 113 Nh 你 L286』 114F 铁 1289 15Me 锁* L289] 116 LW 粒 117 Ts 硼 ” [293]|[293] 180g 氲 [2941
科学史话
门捷列夫的预言
黑票 6s 8C r'dsi 140 9 Pr 错 4r'tw 40.9 Nd 1 Pm 62 Sm aru 50.4 3 E 4r 52.0 64 Gd 5 T 58.9 6 4r 62.5 67 He 64.9 8 Er r 167.3 6 Tn 4r"k 68.9 YI
请
180
制 系 A yy Ih 7 1 P 钱 231.0 2【 德 238.0 3 N 94 Pr 怀 244 95 Am 铜 96 Cm (247) 97 Bk 镝“ [247 9 CT 制 [251 9 Es 镇 252] 00 Fm 燃 101 Md [258] 102 No 编 2591
103 Lr
(262)
碱 金 属 元 素
高中化学
243) [257]
IA 元 素 周 期 表 电子厘
' ,008 He 氮 .003 K
Ⅱ A 原子序数 元素名称 92 U 铀 5rWd7 238.0 元就符号,虹色 措放射性元素 价电子排布,加括号的 表示可能的价电子排布 相对原子质量,加括号的数 元 据为该放射性元素半衰期最 长同位素的质量数 Ⅱ A IV A V A VI A Ⅱ A 3 Li 锂 2m 6.94 Be 皱 .01 5 B 硼 08 2a 7 N 氮 2x2p 14.01 2m 6.00 F 氟 19.0 10 Ne 氟 201
2
11 Na 钠 22.95 12 Mg 转 24.3 13 Al 14 Si 硅 3 jg 28.09 15 P 6 S 盛 17 Cl 18 Ar 益
ⅢB IV B V B VI B VⅡ B Vm I B Ⅱ B 19 K 钾 39.10 20 Ca 的 40.08 21 Se 44.9 22 Ti 47.8 23V 50.94 24 CT 52.00 25 Mn 篮 54.94 26 Ft 4g 55.85 27 C 58.93 28 Ni 58.69 29C 63.5 30 Z 焦 65.3 Ga 69.72 32 Ge 72.63 “ 4.92 4Se 6.97 35 Br 恐 79.90 Kr 83.80
37 Rb 伽 85.47 38 Sr 能 82 39 解 88.91 40 Z 错 91.22 41 Nb 铌 92.9 42 Mo 5.9 43 Tc 每 4f5 98 44 Ru 钉 101.1 45 Rh 铑 1029 46 Pd 配 106.4 nA 银 mg 48 Cd 幅 124 49 In 铟 148 50 Sn 51 Sb 评 23 52 Te 碲 53 I 碘 269 54 Xe
5 C 铯 32.9 56 Ba sn5 57-71 La-Lu 镧系 72 Hf 给 78.5 73 Ta 钼 180.9 74 W 钨 83.8 75 Re 林 862 76 Os 锅 190.2 77 Ir 帐 192.2 78 P 钾 t 79 A 金。 97.0 80 Hg 求 200.6 1 Tl 铊 04 82 PI U7 3 B 84 Pe 针 p (209 85 A (210) 86 Rn [222]
7 F 钫 培Rg 新 89-1 Ac~Lr 铜 系 104 Rf 铲 (drs) 105 Db 钍 6d'7s 106 Sg 禧 107 Bh 镟* 2701 08 Hs 0 109 Mt 枝* 8 10 D 铋 111 R 轮* 112 Cn 错 83 113 Nh 你 L286』 114F 铁 1289 15Me 锁* L289] 116 LW 粒 117 Ts 硼 ” [293]|[293] 180g 氲 [2941
8 119 ……
科学史话
门捷列夫的预言
器黑 8C r sd 140 h 错 4f' 40.9 Nd 1 Pm 2 Sm aru 50.4 3 E 4f6s 52.0 4 Gr 5 T 58.9 6 D 4r 62.5 67 He 64.9 8Er r 167.3 6 Tn 4r"k 68.9 YI
请
180
制 A yy l 1 P 钱 231.0 2【 德 238.0 3 N 94 Pr 怀 244 95 Am 铜 243] 96 Cm (247) 97 Bk 镝“ [247 98 CT 制 [251 9 Es 镇 2521 00 Fm 燃 [257] 101 Md [258] 102 No 2591
103 Lr
(262)
碱 金 属 元 素
高中化学
IA 元 素 周 期 表 电子厘
' ,008 He 氮 .003 K
Ⅱ A 原子序数 元素名称 92 U 铀 5rWd7 238.0 元就符号,虹色 措放射性元素 价电子排布,加括号的 表示可能的价电子排布 相对原子质量,加括号的数 元 据为该放射性元素半衰期最 长同位素的质量数 Ⅱ A IV A V A VI A Ⅱ A 3 Li 锂 2m 6.94 Be 皱 .01 5 B 硼 08 2a 7 N 氮 2x2p 14.01 2m 6.00 F 氟 19.0 10 Ne 氟 201
2
11 Na 钠 22.95 12 Mg 转 24.3 13 Al 14 Si 硅 3 jg 28.09 15 P 6 S 盛 17 Cl 18 Ar 益
ⅢB IV B V B VI B VⅡ B Vm I B Ⅱ B 19 K 钾 39.10 20 Ca 的 40.08 21 Se 44.9 22 Ti 47.8 23V 50.94 24 CT 52.00 25 Mn 篮 54.94 26 Ft 4g 55.85 27 C 58.93 28 Ni 58.69 29C 63.5 30 Z 焦 65.3 Ga 69.72 32 Ge 72.63 “ 4.92 4Se 6.97 35 Br 恐 79.90 Kr 83.80
37 Rb 伽 85.47 38 Sr 能 82 39 解 88.91 40 Z 错 91.22 41 Nb 铌 92.9 42 Mo 5.9 43 Tc 每 4f5 98 44 Ru 钉 101.1 45 Rh 铑 1029 46 Pd 配 106.4 nA 银 mg 48 Cd 幅 124 49 In 铟 148 50 Sn 51 Sb 评 23 52 Te 碲 53 I 碘 269 54 Xe
5 C 铯 32.9 56 Ba sn5 57-71 La-Lu 镧系 72 Hf 给 78.5 73 Ta 钼 180.9 74 W 钨 83.8 75 Re 林 862 76 Os 锅 190.2 77 Ir 帐 192.2 78 P 钾 t 79 A 金。 97.0 80 Hg 求 200.6 1 Tl 铊 04 82 PI U7 3 B 84 Pe 针 p (209 85 A (210) 86 Rn [222]
7 F 钫 培Rg 新 89-1 Ac~Lr 铜 系 104 Rf 铲 (drs) 105 Db 钍 6d'7s 106 Sg 禧 107 Bh 镟* 2701 08 Hs 0 109 Mt 枝* 8 10 D 铋 111 R 轮* 112 Cn 错 83 113 Nh 你 L286』 114F 铁 1289 15Me 锁* L289] 116 LW 粒 117 Ts 硼 ” [293]|[293] 180g 氲 [2941
8 119 ……
科学史话
门捷列夫的预言
器黑 8C r sd 140 h 错 4f' 40.9 Nd 1 Pm 2 Sm aru 50.4 3 E 4f6s 52.0 4 Gr 5 T 58.9 6 D 4r 62.5 67 He 64.9 8Er r 167.3 6 Tn 4r"k 68.9 YI
请
180
制 A yy l 1 P 钱 231.0 2【 德 238.0 3 N 94 Pr 怀 244 95 Am 铜 243] 96 Cm (247) 97 Bk 镝“ [247 98 CT 制 [251 9 Es 镇 2521 00 Fm 燃 [257] 101 Md [258] 102 No 2591
103 Lr
(262)
碱 金 属 元 素
高中化学
课堂小结
元素周期律的应用和意义
学习化学 应用于科 论证了事物
的一种重 学研究和 变化的量变
要工具 生产 引起质变
和性质
高中化学
预测或推
测元素的
原子结构
