4.3 化学键 课件(共39张PPT)
文档属性
| 名称 | 4.3 化学键 课件(共39张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 09:44:01 | ||
图片预览








文档简介
(共39张PPT)
化学键(第一课时)
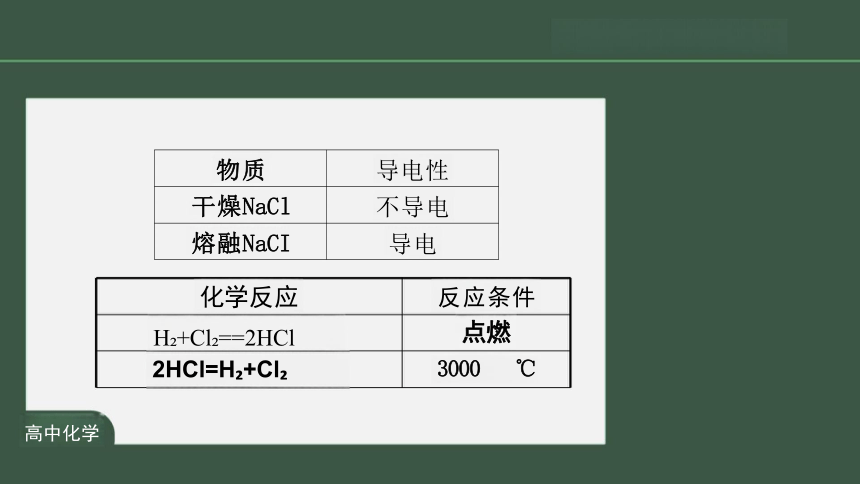
化学反应
反应条件
H +Cl ==2HCl
点燃
2HCl=H +Cl
3000 ℃
物质
导电性
干燥NaCl
不导电
熔融NaCI
导电
高中化学
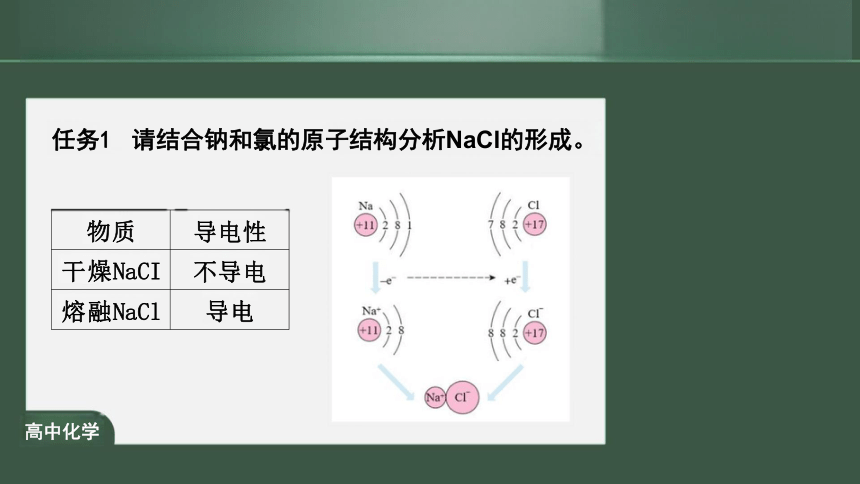
物质
导电性
干燥NaCI
不导电
熔融NaCl
导电
任务1 请结合钠和氯的原子结构分析NaCl的形成。
高中化学
物质
导电性
干燥NaCI
不导电
熔融NaCl
导电
任务1 请结合钠和氯的原子结构分析NaCl的形成。
高中化学
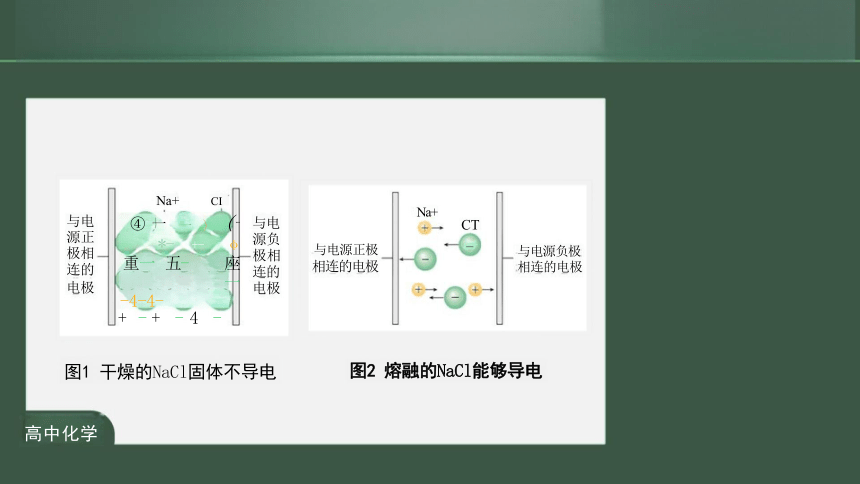
与电 源正 极相 连的 电极 Na+ CI ④ 一 一 ) (一 *- +- φ 重一 五- 座一 -4-4- + - + - 4 -
与电 源负 极相 连的 电极
Na+
与电源正极
相连的电极
图1 干燥的NaCl固体不导电
图2 熔融的NaCl能够导电
与电源负极 相连的电极
高中化学
CT
一
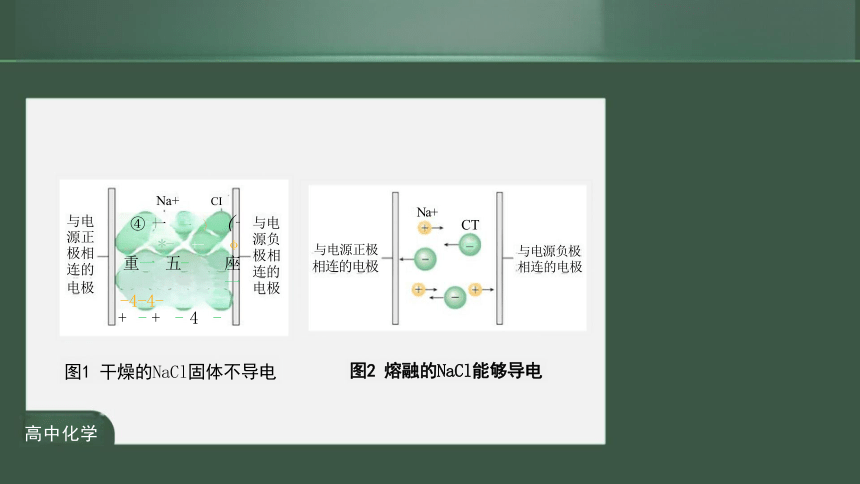
与电 源正 极相 连的 电极 Na+ CI ④ 一 一 ) (一 *- +- φ 重一 五- 座一 -4-4- + - + - 4 -
与电 源负 极相 连的 电极
Na+
与电源正极
相连的电极
图1 干燥的NaCl固体不导电
图2 熔融的NaCl能够导电
与电源负极 相连的电极
高中化学
CT
一
这种带相反电荷离子之间的相互作用叫做离子键。
电子式 Nax :Ci. xMgx ·S.
用电子式表示氯化钠的形成过程
高中化学
这种带相反电荷离子之间的相互作用叫做离子键。
电子式 Nax :Cì . xMgx ·S.
用电子式表示氯化钠的形成过程
高中化学
MgCl 是由离子键形成的物质。请用电子式表示
其形成过程。
:Gi+>Mg×+Ci:— → [:Ci:]Mg +[×Ci:]
高中化学
请书写KBr、Na 0、Ca0的电子式。
KBr K+[×Br:]
高中化学
请书写KBr、Na 0、Ca0的电子式。
KBr
Na O
K+[×Br:]
高中化学
KBr
Na O
CaO
高中化学
请书写KBr、Na 0、Ca0的电子式。
K+[×B|r:
化学反应
反应条件
H +Cl ==2HCI
点燃
2HCl==H +Cl
3000 ℃
任务2 请结合氢和氯的原子结构分析HCl的形成。
化学反应
反应条件
H +Cl ==2HCI
点燃
2HCl==H +Cl
3000℃
任务2 请结合氢和氯的原子结构分析HCl的形成。
高中化学
原子间通过共用电子对所形成的相互作用
叫做共价键。
HCl Hx+·Cl: →HXCI: H—Cl
结构式
Cl :Cl+·Cl: :Cl:Cl Cl—CIJ
高中化学
Hx+· ·+xH →H: ×H
H—0—H
请用电子式表示H O的形成过程。
高中化学
请写出CH 、CO 、N 的电子式。
高中化学
CH
请写出CH 、CO 、N 的电子式。
CO :0xCx:0:
高中化学
CH
CH
CO
N
高中化学
请写出CH 、CO 、N 的电子式。
:0:xCx: :
:N:N:
0=C=0
N=N
工
H
分子 电子式
结构式
H HH
H—H
HCl H:ci:
H—Cl
CO :6:cx:0:
O=C=0
H O
CH
高中化学
分子
氢原子与其他原子个数比
HCl
1:1
H O
2:1
CH
4:1
请解释氢原子与其他原子个数比不同的原因。
·Cl: · .
分子 电子式
结构式
H HH
H—H
HCl H:ci:
H—Cl
CO :6:cx:0:
O=C=0
H O
CH
高中化学
以共价键形成的分子具有一定的空间结构。
H HCl CO H O CH
高中化学
分子 电子式 结构式
分子结构模型
H HH H—H
HCl Hxci: H—Cl
CO :0:Cx:0: O=C=0
H O H×O:H ·
CH H H×C×H 并 H- -H H
高中化学
物质 Cl
HCl
结构式 C|—Cl
H—Cl
原子对电子的吸引能力
共用电子对是否发生偏移
成键原子是否显电性
物质
非极性键 结构式
原子对电子的吸引能力
共用电子对是否发生偏移
成键原子是否显电性
Cl
Cl—Cl
相同
不偏移
不显电性
高中化学
HCl
物质
非极性键
结构式
原子对电子的吸引能力
共用电子对是否发生偏移
成键原子是否显电性
相同 不偏移 不显电性
Cl强 于H
偏向Cl
偏离H
Cl显负电 H显正电
Cl 极性 HCl
键
Cl—Cl H—Cl
高中化学
非极性键(同种原子形成)
共价键.
极性键(不同种原子形成)
高中化学
1
相邻原子间强烈的相互作用叫做化学键。
离子键
共价键
化学键
高中化学
任务3 请从化学键的角度分析NaCl、HCl、Cl 中
各元素的化合价。
Na+[×Ci:]
+1价 -1价
高中化学
1个Na失1 e-, 形成了 带1个单位正电荷的Na+
1个Cl得1 e, 形成了 带1个单位负电荷的Cl-
任务3 请从化学键的角度分析NaCl、HCl、Cl 中
各元素的化合价。
两个Cl对电
子的吸引— 能力相同
Cl不显 — 电 性
共用电子 对无偏移
C|—Cl
→CI呈0价
高中化学
任务3 请从化学键的角度分析NaCl、HCl、Cl 中
各元素的化合价。
H—Cl
H、Cl对电 共用电子 子的吸引 — → 对偏向Cl- 能力不同 偏离H
1对共
H显正电性 用电子 H呈+1价 Cl 显负电性 ——Cl 呈-1价
高中化学
任务3 请从化学键的角度分析NaCl、HCl、Cl 中
各元素的化合价。
+1 -1
NaCl
+1-1
HCl
○
Cl
高中化学
从化学键的角度解释H O 中0为-1价的原因。
Hx : xH
高中化学
从化学键的角度解释H O 中0为-1价的原因。
Hx 0 ×H
无偏移 偏向氧,显负电性
呈-1价
高中化学
氯气处理含氰 (CN-) 废水,其化学反应原理如下(未配
平),则还原剂与氧化剂物质的量之比是多少
高中化学
氯气处理含氰 (CN-) 废水,其化学反应原理如下(未配
平),则还原剂与氧化剂物质的量之比是多少
高中化学
氯气处理含氰 (CN-) 废水,其化学反应原理如下(未配
平),则还原剂与氧化剂物质的量之比是多少
+2
-3.
[×C::N:]
高中化学
CN-~5e-
得失电子守恒
Cl ~2e-
:5
粒子间 相互作用
化学键
共价键
离子键
高中化学
认识
化学键(第一课时)
化学反应
反应条件
H +Cl ==2HCl
点燃
2HCl=H +Cl
3000 ℃
物质
导电性
干燥NaCl
不导电
熔融NaCI
导电
高中化学
物质
导电性
干燥NaCI
不导电
熔融NaCl
导电
任务1 请结合钠和氯的原子结构分析NaCl的形成。
高中化学
物质
导电性
干燥NaCI
不导电
熔融NaCl
导电
任务1 请结合钠和氯的原子结构分析NaCl的形成。
高中化学
与电 源正 极相 连的 电极 Na+ CI ④ 一 一 ) (一 *- +- φ 重一 五- 座一 -4-4- + - + - 4 -
与电 源负 极相 连的 电极
Na+
与电源正极
相连的电极
图1 干燥的NaCl固体不导电
图2 熔融的NaCl能够导电
与电源负极 相连的电极
高中化学
CT
一
与电 源正 极相 连的 电极 Na+ CI ④ 一 一 ) (一 *- +- φ 重一 五- 座一 -4-4- + - + - 4 -
与电 源负 极相 连的 电极
Na+
与电源正极
相连的电极
图1 干燥的NaCl固体不导电
图2 熔融的NaCl能够导电
与电源负极 相连的电极
高中化学
CT
一
这种带相反电荷离子之间的相互作用叫做离子键。
电子式 Nax :Ci. xMgx ·S.
用电子式表示氯化钠的形成过程
高中化学
这种带相反电荷离子之间的相互作用叫做离子键。
电子式 Nax :Cì . xMgx ·S.
用电子式表示氯化钠的形成过程
高中化学
MgCl 是由离子键形成的物质。请用电子式表示
其形成过程。
:Gi+>Mg×+Ci:— → [:Ci:]Mg +[×Ci:]
高中化学
请书写KBr、Na 0、Ca0的电子式。
KBr K+[×Br:]
高中化学
请书写KBr、Na 0、Ca0的电子式。
KBr
Na O
K+[×Br:]
高中化学
KBr
Na O
CaO
高中化学
请书写KBr、Na 0、Ca0的电子式。
K+[×B|r:
化学反应
反应条件
H +Cl ==2HCI
点燃
2HCl==H +Cl
3000 ℃
任务2 请结合氢和氯的原子结构分析HCl的形成。
化学反应
反应条件
H +Cl ==2HCI
点燃
2HCl==H +Cl
3000℃
任务2 请结合氢和氯的原子结构分析HCl的形成。
高中化学
原子间通过共用电子对所形成的相互作用
叫做共价键。
HCl Hx+·Cl: →HXCI: H—Cl
结构式
Cl :Cl+·Cl: :Cl:Cl Cl—CIJ
高中化学
Hx+· ·+xH →H: ×H
H—0—H
请用电子式表示H O的形成过程。
高中化学
请写出CH 、CO 、N 的电子式。
高中化学
CH
请写出CH 、CO 、N 的电子式。
CO :0xCx:0:
高中化学
CH
CH
CO
N
高中化学
请写出CH 、CO 、N 的电子式。
:0:xCx: :
:N:N:
0=C=0
N=N
工
H
分子 电子式
结构式
H HH
H—H
HCl H:ci:
H—Cl
CO :6:cx:0:
O=C=0
H O
CH
高中化学
分子
氢原子与其他原子个数比
HCl
1:1
H O
2:1
CH
4:1
请解释氢原子与其他原子个数比不同的原因。
·Cl: · .
分子 电子式
结构式
H HH
H—H
HCl H:ci:
H—Cl
CO :6:cx:0:
O=C=0
H O
CH
高中化学
以共价键形成的分子具有一定的空间结构。
H HCl CO H O CH
高中化学
分子 电子式 结构式
分子结构模型
H HH H—H
HCl Hxci: H—Cl
CO :0:Cx:0: O=C=0
H O H×O:H ·
CH H H×C×H 并 H- -H H
高中化学
物质 Cl
HCl
结构式 C|—Cl
H—Cl
原子对电子的吸引能力
共用电子对是否发生偏移
成键原子是否显电性
物质
非极性键 结构式
原子对电子的吸引能力
共用电子对是否发生偏移
成键原子是否显电性
Cl
Cl—Cl
相同
不偏移
不显电性
高中化学
HCl
物质
非极性键
结构式
原子对电子的吸引能力
共用电子对是否发生偏移
成键原子是否显电性
相同 不偏移 不显电性
Cl强 于H
偏向Cl
偏离H
Cl显负电 H显正电
Cl 极性 HCl
键
Cl—Cl H—Cl
高中化学
非极性键(同种原子形成)
共价键.
极性键(不同种原子形成)
高中化学
1
相邻原子间强烈的相互作用叫做化学键。
离子键
共价键
化学键
高中化学
任务3 请从化学键的角度分析NaCl、HCl、Cl 中
各元素的化合价。
Na+[×Ci:]
+1价 -1价
高中化学
1个Na失1 e-, 形成了 带1个单位正电荷的Na+
1个Cl得1 e, 形成了 带1个单位负电荷的Cl-
任务3 请从化学键的角度分析NaCl、HCl、Cl 中
各元素的化合价。
两个Cl对电
子的吸引— 能力相同
Cl不显 — 电 性
共用电子 对无偏移
C|—Cl
→CI呈0价
高中化学
任务3 请从化学键的角度分析NaCl、HCl、Cl 中
各元素的化合价。
H—Cl
H、Cl对电 共用电子 子的吸引 — → 对偏向Cl- 能力不同 偏离H
1对共
H显正电性 用电子 H呈+1价 Cl 显负电性 ——Cl 呈-1价
高中化学
任务3 请从化学键的角度分析NaCl、HCl、Cl 中
各元素的化合价。
+1 -1
NaCl
+1-1
HCl
○
Cl
高中化学
从化学键的角度解释H O 中0为-1价的原因。
Hx : xH
高中化学
从化学键的角度解释H O 中0为-1价的原因。
Hx 0 ×H
无偏移 偏向氧,显负电性
呈-1价
高中化学
氯气处理含氰 (CN-) 废水,其化学反应原理如下(未配
平),则还原剂与氧化剂物质的量之比是多少
高中化学
氯气处理含氰 (CN-) 废水,其化学反应原理如下(未配
平),则还原剂与氧化剂物质的量之比是多少
高中化学
氯气处理含氰 (CN-) 废水,其化学反应原理如下(未配
平),则还原剂与氧化剂物质的量之比是多少
+2
-3.
[×C::N:]
高中化学
CN-~5e-
得失电子守恒
Cl ~2e-
:5
粒子间 相互作用
化学键
共价键
离子键
高中化学
认识
