专题1《化学反应与能量变化》单元检测题(含解析)2023--2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题1《化学反应与能量变化》单元检测题(含解析)2023--2024学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 453.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 16:02:21 | ||
图片预览



文档简介
专题1《化学反应与能量变化》
一、单选题(共12题)
1.下列有关同素异形体的说法正确的是( )
A.C60与C70属于同素异形体
B.白磷转化为红磷是物理变化
C.O2转化为O3属于氧化还原反应
D.金刚石与石墨化学式不同,但结构相同
2.化学与生产、生活密切相关。下列做法或说法正确的是
A.运动员“战袍”内层添加石墨烯片用于保暖,石墨烯和碳纳米管互为同位素
B.BaCO3可用于胃肠X射线造影检查
C.采用合适的催化剂可以提高合成氨工业中原料的转化率
D.NH4Cl和ZnCl2溶液可作为焊接除锈剂
3.最近,科学家开发出一种低成本光伏材料一蜂窝状石墨烯。生产原理是:Na2O+ 2CO Na2CO3 +C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
A.石墨烯与金刚石互为同素异形体
B.该生产石墨烯的反应中CO只作还原剂
C.Na2O属于碱性氧化物,Na2CO3属于盐
D.自然界中钠元素只有化合态
4.科学家发现金星大气中存在,据此推断金星大气层或许存在生命。利用与足量的浓KOH溶液反应可制备:。下列说法正确的是
A.的电子式为 B.中子数为16的原子:
C.是强电解质,属酸式盐 D.参加反应,转移电子
5.原子核外电子的运动规律是元素周期律的基础,下列说法错误的是
A.同一原子中,离核较远的电子受到的吸引力较小
B.原子核外电子排布时L层未排满,则M层无电子
C.同一周期中,随着核电荷数的增加,元素的最高化合价一定增大
D.第四周期中,IIA与IIIA族元素原子的核电荷数相差11
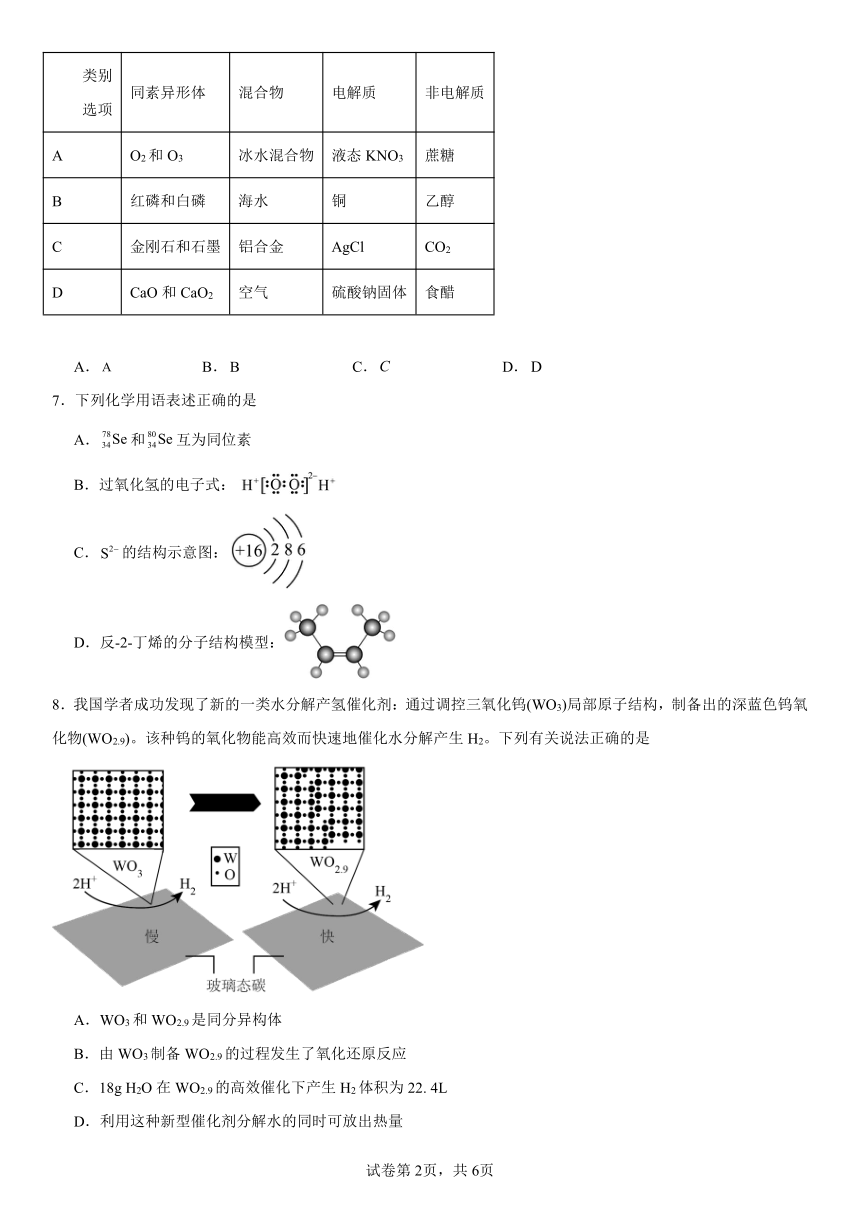
6.下列表格中各项分类都正确的一组是
类别 选项 同素异形体 混合物 电解质 非电解质
A O2和O3 冰水混合物 液态KNO3 蔗糖
B 红磷和白磷 海水 铜 乙醇
C 金刚石和石墨 铝合金 AgCl CO2
D CaO和CaO2 空气 硫酸钠固体 食醋
A. B. C. D.
7.下列化学用语表述正确的是
A.和互为同位素
B.过氧化氢的电子式:
C.的结构示意图:
D.反-2-丁烯的分子结构模型:
8.我国学者成功发现了新的一类水分解产氢催化剂:通过调控三氧化钨(WO3)局部原子结构,制备出的深蓝色钨氧化物(WO2.9)。该种钨的氧化物能高效而快速地催化水分解产生H2。下列有关说法正确的是
A.WO3和WO2.9是同分异构体
B.由WO3制备WO2.9的过程发生了氧化还原反应
C.18g H2O在WO2.9的高效催化下产生H2体积为22. 4L
D.利用这种新型催化剂分解水的同时可放出热量
9.三星堆两次考古挖掘举世震惊,二号祭祀坑出土商代的铜人铜像填补了我国考古学、青铜文化、青铜艺术史上的诸多空白。下列有关说法错误的是
A.铜像表面的铜绿[]能在空气中稳定存在
B.测定出土文物年代的是碳的一种同素异形体
C.X射线衍射法可对青铜器微观晶体结构进行分析
D.青铜器的出土表明我国商代已经掌握冶炼铜技术
10.我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。在实际生产中,可利用反应来捕捉废气中的,下列有关化学用语或说法正确的是
A.中子数为8的氧原子:
B.H、D、T互为同位素
C.的结构示意图:
D.的电离方程式:
11.2016年IUPAC将117号元素命名为(Ts)。下列关于和的说法正确的是
A.二者互为同位素 B.都含有117个中子
C.含有不同的电子数 D.分别含有176个和177个质子
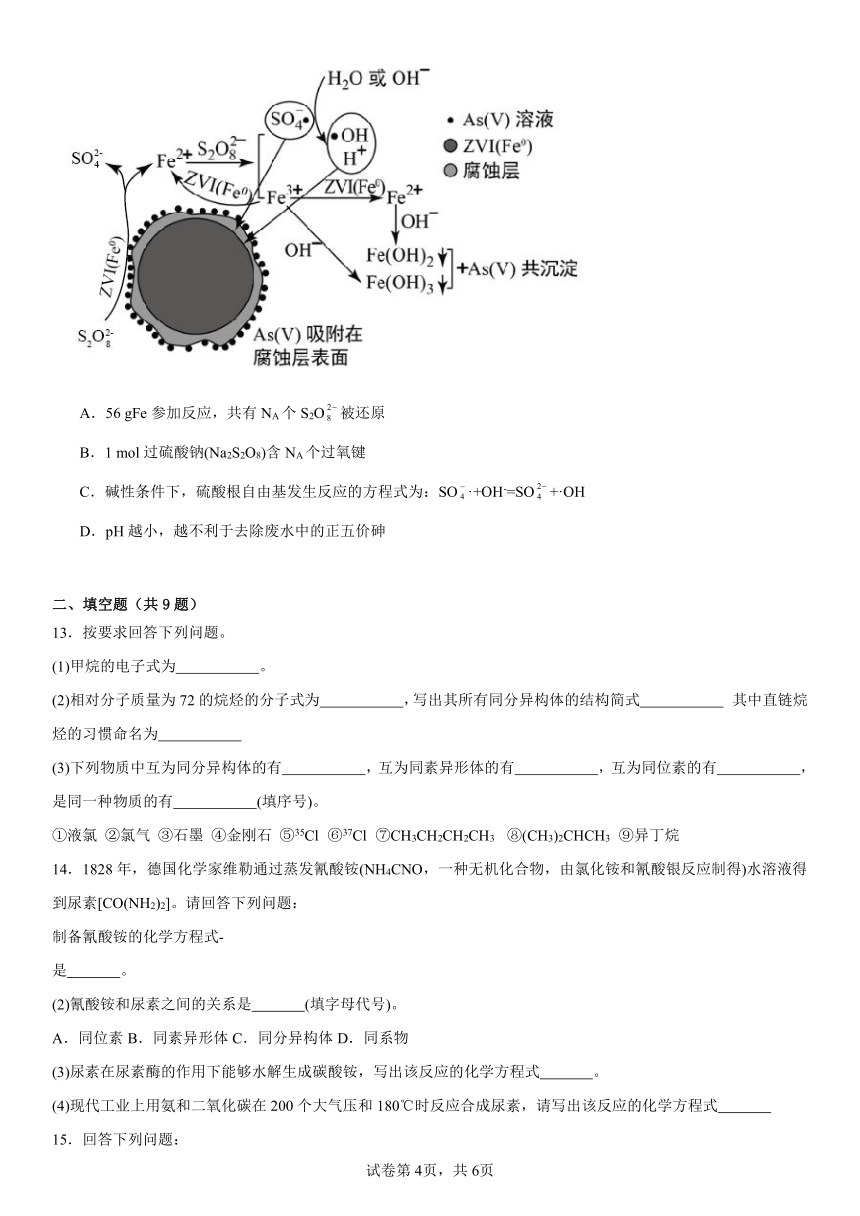
12.《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。下列叙述错误的是
A.56 gFe参加反应,共有NA个S2O被还原
B.1 mol过硫酸钠(Na2S2O8)含NA个过氧键
C.碱性条件下,硫酸根自由基发生反应的方程式为:SO·+OH-=SO+·OH
D.pH越小,越不利于去除废水中的正五价砷
二、填空题(共9题)
13.按要求回答下列问题。
(1)甲烷的电子式为 。
(2)相对分子质量为72的烷烃的分子式为 ,写出其所有同分异构体的结构简式 其中直链烷烃的习惯命名为
(3)下列物质中互为同分异构体的有 ,互为同素异形体的有 ,互为同位素的有 ,是同一种物质的有 (填序号)。
①液氯 ②氯气 ③石墨 ④金刚石 ⑤35Cl ⑥37Cl ⑦CH3CH2CH2CH3 ⑧(CH3)2CHCH3 ⑨异丁烷
14.1828年,德国化学家维勒通过蒸发氰酸铵(NH4CNO,一种无机化合物,由氯化铵和氰酸银反应制得)水溶液得到尿素[CO(NH2)2]。请回答下列问题:
制备氰酸铵的化学方程式-
是 。
(2)氰酸铵和尿素之间的关系是 (填字母代号)。
A.同位素B.同素异形体C.同分异构体D.同系物
(3)尿素在尿素酶的作用下能够水解生成碳酸铵,写出该反应的化学方程式 。
(4)现代工业上用氨和二氧化碳在200个大气压和180℃时反应合成尿素,请写出该反应的化学方程式
15.回答下列问题:
(1)0.2L1.0molL﹣1NaCl溶液与0.1L1.0molL﹣1MgCl2溶液中的Cl﹣的物质的量浓度之比为 。
(2)配制90mL1mol/LCuSO4溶液,需要胆矾 g。
(3)某元素R的简单阳离子Rn+核外有a个电子,中子数为b,则其质量数为 。
(4)氨气常用此反应N2+3H2=2NH3合成,请用双线桥法表示该反应的电子转移的方向和数目 。
16.有如下物质:①石墨②NaOH溶液③NaHSO4固体④CO2⑤酒精⑥蒸馏水⑦CH4⑧熔融的KNO3⑨氢氧化铁胶体⑩NH3 Na2O 氨水 CH3COOH C60
(1)以上物质中,属于电解质的是 (填序号,下同),属于非电解质的是 ;属于强电解质的是 ;属于弱电解质的是 ;互为同素异形体的是 。
(2)物质③熔融状态的电离方程式为 。
(3)向⑨的溶液中逐渐滴加足量③的溶液,看到的现象是 。
17.Ⅰ.用表示原子:
(1)中性原子的中子数:N= 。
(2)中性分子中子数:12C16O2分子中,N= 。
(3)A2-原子核内有x个中子,其质量数为m,则ngA2-所含电子的物质的量为 mol。
Ⅱ.有①、、②H2、D2、T2③红磷、白磷④、、四组微粒或物质,回答下列问题:
(1)互为同位素的是 (填编号,下同)。
(2)互为同素异形体的是 。
18.用X表示原子:
(1)中性原子的中子数N= 。
(2)AXn+共有x个电子,则该阳离子的中子数N= 。
(3)AXn-共有x个电子,则该阴离子的中子数 N= 。
(4)12C16O2分子中的中子数N= 。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为 。
19.磷、硫元素存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,被称为生命元素。回答下列问题:
(1)红磷和白磷互称为 。
(2)已知磷的常见含氧酸有次磷酸(H3PO2)、亚磷酸(H3PO3)、磷酸(H3PO4),它们依次为一元酸、二元酸、三元酸。则NaH2PO2为 ;NaH2PO3为 (填“正盐”或“酸式盐”)
(3)H3PO2及NaH2PO2均可将溶液中的还原为银,从而可用于对器皿实现化学镀银。
①H3PO2中,P元素的化合价为 。
②利用H3PO2进行化学镀银反应中,氧化产物为H3PO4,则氧化剂和还原剂的个数之比为 。
(4)测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
葡萄酒样品100.00mL 馏分溶液出现蓝色且30s内不褪色
(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
按上述方案实验,消耗标准I2溶液20.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g L-1。
20.近年来,科学家通过粒子加速器进行了一周的实验,获得了6个非常罕见的Fe原子,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。回答下列问题:
(1)Fe原子的核内中子数为 ,该原子的核外电子数为 。
(2)以下关于Fe的叙述正确的是___________(填序号)。
A.Fe与Fe是两种核素
B.科学家获得了一种新元素
C.Fe的衰变不是化学变化
D.这种铁原子衰变放出两个质子后变成Fe
(3)某同学认为Fe在一定条件下也可与氧气反应,他的判断依据是 。
21.请按要求填空:
(1)简单原子的原子结构可用下图形象地表示:
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是
A.①②③是三种不同的核素
B.①②③具有相同的质量数
C.①②③互为同位素
D.①②③是三种化学性质不同的粒子
(2)科学家已发现一种新型氢分子(H3),在相同条件下,等质量的H3和H2相同的是
A 分子数 B 原子数 C 体积 D 电子数
(3)微粒AXn+核外有a个电子,则它的核内中子数为
(4)与10克D2O含有相同电子数的NH3在标准状况下的体积是
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.C60与C70均是由C元素组成的单质,属于同素异形体,A正确;
B.白磷和红磷是不同的物质,白磷转化为红磷有新物质生成,是化学变化,B错误;
C.O2转化为O3无元素化合价变化,不属于氧化还原反应,C错误;
D.金刚石与石墨化学式相同,均为C,但结构不同,D错误。
答案选A。
2.D
【详解】A.同位素必须是原子,石墨烯和碳纳米管都是单质,A错误;
B.BaCO3可溶于胃酸,不能用于胃肠X射线造影检查,B错误;
C.催化剂不能改变合成氨工业中原料的转化率,只能改变反应速率,C错误;
D.NH4Cl和ZnCl2溶液水解呈酸性,可用作焊接除锈剂,D正确;
故答案选D。
3.B
【详解】A. 同种元素的不同单质互为同素异形体,石墨烯与金刚石都是碳单质,互为同素异形体,故A不选;
B. 反应中存在化合价的变化的反应属于氧化还原反应,反应中C元素的化合价既升高又降低,CO既做氧化剂又还原剂,故B选;
C. Na2O与酸反应只生成盐和水,属于碱性氧化物, Na2CO3属于盐,故C不选;
D. 钠是活泼金属在自然界中不存在单质,自然界中钠元素以化合态形式存在,故D不选;
故选:B。
4.D
【详解】A.PH3的电子式为,A错误;
B.核素的表示方法为:元素符号左下角为质子数,左上角为质量数;中子数为16的原子:,B错误;
C.P4与足量的浓KOH溶液反应得到KH2PO2,则其为正盐,C错误;
D.由方程式可知,1分子P4中3个磷原子失去3个电子得到KH2PO2,1个磷原子得到3个电子形成PH3,故1mol P4参与反应,转移3mol电子,D正确;
故选D。
5.C
【详解】A.距离原子核较远的区域运动的电子原子核对它的吸引力较小,A项正确;
B.L层能量低于M层,原子核外电子在排布时,先排满L层再排M层,B项正确;
C.第二周期元素中随着核电荷数的增加,元素的最高化合价并不是一定增大的,C项错误;
D.第四周期中ⅡA与ⅢA族元素原子的核电荷数相差,D项正确;
故选C。
6.C
【详解】A.冰水混合物为纯净物,故A错误;
B.铜为单质,不是电解质,故B错误;
C.金刚石和石墨为碳元素的不同单质为同素异形体,铝合金为混合物,AgCl熔融态能导电为电解质,CO2为非电解质,故C正确;
D.CaO和CaO2不是单质,不是同素异形体,故D错误;
故选C。
7.A
【详解】A.和质子数相同而中子数不相同,互为同位素,A正确;
B.过氧化氢为共价化合物,不存在阴阳离子,B错误;
C.为硫原子得到两个电子形成的离子,核外电子数为18,最外层满足8电子稳定结构,C错误;
D.该图示为顺-2-丁烯,D错误;
故选A。
8.B
【详解】A.WO3和WO2.9的分子式不同,二者不是同分异构体的关系,错误;
B.WO3和WO2.9中W的化合价不同,由WO3制备WO2.9的过程发生了氧化还原反应,正确;
C.外界条件不确定时,无法确定氢气的体积,且不是标准状况下,体积不一定为22.4L,错误;
D.水的分解反应为吸热反应,使用催化剂不能改变物质的能量,错误。
答案选B。
9.B
【详解】A.铜像表面的铜绿[]不会与空气反应,能在空气中稳定存在,A正确;
B.同素异形体是同种元素构成的不同的单质,测定出土文物年代的是一种核素,不是单质,所以不是碳的一种同素异形体,B错误;
C.X射线衍射法研究晶体结构、形貌和各种缺陷的重要手段,可对青铜器微观晶体结构进行分析,C正确;
D.商代青铜器都是利用化学变化制备出铜为原料,说明我国商代已经掌握冶炼铜技术,D正确;
答案选B。
10.B
【详解】A.中子数为8的氧原子:,A错误;
B.H、D、T为氢元素的三种核素,互为同位素,B正确;
C.核电荷数为11,C错误;
D.的电离方程式为,D错误;
故选B。
11.A
【详解】A.同位素是质子数相同而中子数不同的核数,故二者互为同位素,A正确;
B.二者都含有117个质子,B错误;
C.同种元素的不同核素含有相同的质子数,原子中有:质子数=电子数,故二者所含电子数相同,C错误;
D.同种元素的不同核素质子数相同,二者都为117,D错误;
故选A。
12.A
【详解】A.一个S2O和一个Fe反应生成两个SO和一个Fe2+,该过程转移2个电子,但是Fe2+还要与个S2O反应变成Fe3+和自由基,56gFe为1molFe因此1mol铁参加反应要消耗1.5 molS2O,共有1.5NA个S2O被还原,故A错误;
B.1 mol过硫酸钠(Na2S2O8)含1 mol过氧键,即含有NA个过氧键,故B正确;
C.结合图示可知,碱性条件下,SO·发生反应的方程式为:SO·+OH-=SO+·OH,故C正确;
D.因为最后是将离子转变为沉淀析出的,则溶液的碱性越强越有利于析出,即pH越大越有利于去除废水中的正五价砷,pH越小,越不利于去除废水中的正五价砷,故D正确;
故选A。
13.(1)
(2) C5H12 CH3CH2CH2CH2CH3、CH3CH(CH3) CH2CH3、C(CH3)4 正戊烷
(3) ⑦⑧ ③④ ⑤⑥ ①②
【分析】(1)
甲烷的分子式为CH4,碳原子和4 氢原子形成4条共价键,其电子式为,故答案:。
(2)
饱和烷烃的通式为CnH2n+2,所以相对分子质量为72的烷烃的分子式为C5H12,其所有同分异构体有三种:正戊烷CH3CH2CH2CH2CH3;异戊烷 (2-甲基丁烷):CH3CH(CH3) CH2CH3;新戊烷(2,2-二甲基丙烷) C(CH3)4,故答案:C5H12;CH3CH2CH2CH2CH3、CH3CH(CH3) CH2CH3、C(CH3)4;正戊烷。
(3)
同分异构体是分子式相同,结构不同,所以⑦CH3CH2CH2CH3 ⑧(CH3)2CHCH3互为同分异构体;同素异形体由同种元素组成的不同单质,所以③石墨 ④金刚石互为同素异形体;同位素是质子数相同,中子数不同,所以⑤35Cl ⑥37Cl互为同位素;①液氯是氯气的液态,所以①液氯②氯气是同一种物质。故答案:⑦⑧;③④;⑤⑥;①②。
14. C (3)
【详解】(1)(3)(4).主要考查根据条件写化学方程式的能力,只要确定反应物和生成物配平即可;
(2).氰酸铵和尿素的化学式相同,但属于不同的物质,所以它们之间的关系为同分异构体。
15.(1)1:2
(2)25.0
(3)a+n+b
(4)
【详解】(1)0.2L1.0molL﹣1NaCl溶液中Cl-的物质的量浓度为1.0molL﹣1,0.1L1.0molL﹣1MgCl2溶液中Cl-的物质的量浓度为2×1.0molL﹣1=0.2 molL﹣1,故答案为:1:1。
(2)验室配制90mL1mol/LCuSO4溶液,用100mL的容量瓶配制,则配制出100mL1mol/L的溶液,若用胆矾(CuSO4 5H2O)固体来配制,所需的硫酸铜的物质的量n=CV=1mol/L×0.1L=0.1mol,所需的质量m=nM=0.1mol×250g/mol=25.0g。
(3)Rn+离子有a个电子,电荷数为+n,阳离子的核外电子数=质子数-电荷数,所以质子数=核外电子数+电荷数=a+n,质量数=质子数+中子数=b+a+n。
(4)反应N2+3H2=2NH3中,N元素由0价下降到-3价,H元素由0价上升到+1价,用双线桥法表示该反应的电子转移的方向和数目为。
16.(1) ③⑥⑧ ④⑤⑦⑩ ③⑧ ⑥ ①
(2)NaHSO4=Na++HSO
(3)先产生红褐色沉淀,后沉淀溶解,得到黄色溶液
【分析】①石墨是单质,既不属于电解质也不属于非电解质;
②NaOH溶液是混合物,既不属于电解质也不属于非电解质;
③NaHSO4固体是化合物、在水溶液中可电离出Na+、H+、SO,在熔融状态下只能电离成Na+、HSO,属于电解质、是强电解质;
④在水溶液中和熔融状态下均不导电的化合物为非电解质,CO2在熔融状态下不导电,在溶液中导电和其本身无关,为非电解质;
⑤酒精是有机物,在水溶液和熔融状况下均不导电,属于非电解质;
⑥蒸馏水能微弱地电离出氢离子和氢氧根离子,属于电解质、是弱电解质;
⑦CH4是有机物,属于非电解质;
⑧KNO3是离子化合物、熔融的KNO3电离成钠离子和硝酸根离子,是电解质、是强电解质;
⑨氢氧化铁胶体是混合物,既不属于电解质也不属于非电解质;
⑩在水溶液中和熔融状态下均不导电的化合物为非电解质, NH3在熔融状态下不导电,在溶液中导电和其本身无关,为非电解质;
Na2O是离子化合物、融熔状态电离成钠离子和氧离子,是电解质、是强电解质;
氨水是混合物,既不属于电解质也不属于非电解质;
CH3COOH是电解质、在水中部分电离,是弱电解质;
C60是单质,既不属于电解质也不属于非电解质;
(1)
据分析,以上物质中,属于电解质的是③⑥⑧ ,属于非电解质的是④⑤⑦⑩;属于强电解质的是③⑧ ;属于弱电解质的是⑥ ;同素异形体是由同种元素组成的不同单质,石墨和C60是组成元素相同,结构不同,性质不同的两种单质,则互为同素异形体的是① 。
(2)
物质③NaHSO4在熔融状态下只能电离成Na+、HSO,熔融状态的电离方程式为:NaHSO4=Na++HSO。
(3)
向⑨氢氧化铁胶体中逐渐滴加足量③NaHSO4的溶液,开始时,在硫酸氢钠的作用下胶体发生聚沉、产生红褐色的氢氧化铁沉淀、后沉淀与氢离子发生反应生成硫酸铁和水,故能看到沉淀溶解得到黄色溶液,因此答案为:先产生红褐色沉淀,后沉淀溶解,得到黄色溶液。
17. A-Z 22 ①④ ③
【详解】Ⅰ(1)中子数=质量数-原子序数,的中子数=A-Z;
(2) 中性分子中子数:12C16O2分子中,N=12-6+2×(16-8)=22;
(3) A2-原子核内有x个中子,其质量数为m,则原子序数为m-x,原子序数等于原子核外电子数,则A2-所含电子数为m-x+2,ng A2-的物质的量为,所含电子数为;
Ⅱ(1)同位素是质子相同,而中子数不同的原子,互为同位素的是①④;
(2) 同素异形体是虽然含有同样的元素组成,不同形态的单质,互为同素异形体的是③。
18. A-Z A-x-n A-x+n 22 mol
【详解】(1)根据“质子数+中子数=质量数”的关系可知:N=A-Z。
(2)AXn+共有x个电子,中性原子X的电子数为x+n,则N=A-x-n。
(3)AXn-共有x个电子,中性原子X的电子数为x-n,则N=A-x+n。
(4)12C16O2分子中的中子数为12-6+(16-8)×2=22。
(5)A2-原子核内有x个中子,其质量数为m,则质子数为m-x,含电子数为m-x+2,则n g A2-所含电子的物质的量为 mol。
19. 同素异形体 正盐 酸式盐 +1 4:1 0.128g/L
【详解】(1)白磷和红磷为同种元素组成的不同单质,为同素异形体;
(2)次磷酸(H3PO2)为一元酸,所以与碱反应生成的盐NaH2PO2为正盐,亚磷酸(H3PO3)为二元酸,所以与碱反应后消耗1个H+的盐NaH2PO3为酸式盐;
(3)①H3PO2中,P元素的化合价为+1;
②化学镀银,根据Ag的价态从+1→0,P的价态从+1→+5,根据氧化还原反应得失电子守恒,所以氧化剂和还原剂的个数为4:1;
(4)20.00 mL I2溶液的质量为=0.0508 g,设二氧化硫的质量为x,根据化学反应式可知
列式计算,,可得x=0.0128 g,所以氧化剂的残留量为。
20.(1) 19 26
(2)AC
(3)Fe与Fe的核外电子数相同,化学性质几乎完全相同
【详解】(1)Fe的中子数=质量数-质子数=45-26=19,电子数=质子数=26。
(2)Fe与Fe的质子数相同,属同一元素Fe元素,但中子数不同,是两种不同的核素,A正确;Fe元素不是一种新元素,B错误;Fe衰变后变为质子数为24的新原子,原子核发生了变化,不是化学变化,因为化学的范畴是在原子、分子水平上研究物质的,C正确;Fe衰变放出两个质子后变为Fe,D错误;故选AC。
(3)Fe与Fe的核外电子数相同,化学性质几乎完全相同
21. AC BD 11.2L
【详解】(1)根据示意图不难看出①②③分别是H、D、T原子:
A.首先明确核素的定义,不同的原子即不同的核素,氕、氘、氚明显是三种不同的核素,A项正确;
B.质量数=质子数+中子数,氕、氘、氚的质量数分别为1、2、3,B项错误;
C.氕、氘、氚互为氢元素的同位素,C项正确;
D.同位素的化学性质几乎完全一样,物理性质有差别,D项错误;
答案选AC;
(2)的分子量为3,的分子量为2,等质量的和,其分子数为反比,即2:3:
A.分子数为2:3,A项错误;
B.不管是还是,都是由氢原子构成的,因此等质量的和必然是由等量的氢原子构成的,B项正确;
C.虽然在相同条件下,但是二者的分子数不同,因此体积不同,C项错误;
D.同B项,二者都是由等量的氢原子构成的,因此二者所含的电子数也是相等的,D项正确;
答案选BD;
(3)首先带有n个正电荷,表明其失去了n个电子,则有个电子,又因为电子数=质子数,质量数=质子数+中子数,不难得出其核内有个中子;
(4)1个分子中有个电子,一个分子中有个电子,可以发现二者的电子数相等,n()=,则的物质的量也为0.5mol,v()=。
答案第1页,共2页
答案第1页,共2页
一、单选题(共12题)
1.下列有关同素异形体的说法正确的是( )
A.C60与C70属于同素异形体
B.白磷转化为红磷是物理变化
C.O2转化为O3属于氧化还原反应
D.金刚石与石墨化学式不同,但结构相同
2.化学与生产、生活密切相关。下列做法或说法正确的是
A.运动员“战袍”内层添加石墨烯片用于保暖,石墨烯和碳纳米管互为同位素
B.BaCO3可用于胃肠X射线造影检查
C.采用合适的催化剂可以提高合成氨工业中原料的转化率
D.NH4Cl和ZnCl2溶液可作为焊接除锈剂
3.最近,科学家开发出一种低成本光伏材料一蜂窝状石墨烯。生产原理是:Na2O+ 2CO Na2CO3 +C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
A.石墨烯与金刚石互为同素异形体
B.该生产石墨烯的反应中CO只作还原剂
C.Na2O属于碱性氧化物,Na2CO3属于盐
D.自然界中钠元素只有化合态
4.科学家发现金星大气中存在,据此推断金星大气层或许存在生命。利用与足量的浓KOH溶液反应可制备:。下列说法正确的是
A.的电子式为 B.中子数为16的原子:
C.是强电解质,属酸式盐 D.参加反应,转移电子
5.原子核外电子的运动规律是元素周期律的基础,下列说法错误的是
A.同一原子中,离核较远的电子受到的吸引力较小
B.原子核外电子排布时L层未排满,则M层无电子
C.同一周期中,随着核电荷数的增加,元素的最高化合价一定增大
D.第四周期中,IIA与IIIA族元素原子的核电荷数相差11
6.下列表格中各项分类都正确的一组是
类别 选项 同素异形体 混合物 电解质 非电解质
A O2和O3 冰水混合物 液态KNO3 蔗糖
B 红磷和白磷 海水 铜 乙醇
C 金刚石和石墨 铝合金 AgCl CO2
D CaO和CaO2 空气 硫酸钠固体 食醋
A. B. C. D.
7.下列化学用语表述正确的是
A.和互为同位素
B.过氧化氢的电子式:
C.的结构示意图:
D.反-2-丁烯的分子结构模型:
8.我国学者成功发现了新的一类水分解产氢催化剂:通过调控三氧化钨(WO3)局部原子结构,制备出的深蓝色钨氧化物(WO2.9)。该种钨的氧化物能高效而快速地催化水分解产生H2。下列有关说法正确的是
A.WO3和WO2.9是同分异构体
B.由WO3制备WO2.9的过程发生了氧化还原反应
C.18g H2O在WO2.9的高效催化下产生H2体积为22. 4L
D.利用这种新型催化剂分解水的同时可放出热量
9.三星堆两次考古挖掘举世震惊,二号祭祀坑出土商代的铜人铜像填补了我国考古学、青铜文化、青铜艺术史上的诸多空白。下列有关说法错误的是
A.铜像表面的铜绿[]能在空气中稳定存在
B.测定出土文物年代的是碳的一种同素异形体
C.X射线衍射法可对青铜器微观晶体结构进行分析
D.青铜器的出土表明我国商代已经掌握冶炼铜技术
10.我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。在实际生产中,可利用反应来捕捉废气中的,下列有关化学用语或说法正确的是
A.中子数为8的氧原子:
B.H、D、T互为同位素
C.的结构示意图:
D.的电离方程式:
11.2016年IUPAC将117号元素命名为(Ts)。下列关于和的说法正确的是
A.二者互为同位素 B.都含有117个中子
C.含有不同的电子数 D.分别含有176个和177个质子
12.《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。下列叙述错误的是
A.56 gFe参加反应,共有NA个S2O被还原
B.1 mol过硫酸钠(Na2S2O8)含NA个过氧键
C.碱性条件下,硫酸根自由基发生反应的方程式为:SO·+OH-=SO+·OH
D.pH越小,越不利于去除废水中的正五价砷
二、填空题(共9题)
13.按要求回答下列问题。
(1)甲烷的电子式为 。
(2)相对分子质量为72的烷烃的分子式为 ,写出其所有同分异构体的结构简式 其中直链烷烃的习惯命名为
(3)下列物质中互为同分异构体的有 ,互为同素异形体的有 ,互为同位素的有 ,是同一种物质的有 (填序号)。
①液氯 ②氯气 ③石墨 ④金刚石 ⑤35Cl ⑥37Cl ⑦CH3CH2CH2CH3 ⑧(CH3)2CHCH3 ⑨异丁烷
14.1828年,德国化学家维勒通过蒸发氰酸铵(NH4CNO,一种无机化合物,由氯化铵和氰酸银反应制得)水溶液得到尿素[CO(NH2)2]。请回答下列问题:
制备氰酸铵的化学方程式-
是 。
(2)氰酸铵和尿素之间的关系是 (填字母代号)。
A.同位素B.同素异形体C.同分异构体D.同系物
(3)尿素在尿素酶的作用下能够水解生成碳酸铵,写出该反应的化学方程式 。
(4)现代工业上用氨和二氧化碳在200个大气压和180℃时反应合成尿素,请写出该反应的化学方程式
15.回答下列问题:
(1)0.2L1.0molL﹣1NaCl溶液与0.1L1.0molL﹣1MgCl2溶液中的Cl﹣的物质的量浓度之比为 。
(2)配制90mL1mol/LCuSO4溶液,需要胆矾 g。
(3)某元素R的简单阳离子Rn+核外有a个电子,中子数为b,则其质量数为 。
(4)氨气常用此反应N2+3H2=2NH3合成,请用双线桥法表示该反应的电子转移的方向和数目 。
16.有如下物质:①石墨②NaOH溶液③NaHSO4固体④CO2⑤酒精⑥蒸馏水⑦CH4⑧熔融的KNO3⑨氢氧化铁胶体⑩NH3 Na2O 氨水 CH3COOH C60
(1)以上物质中,属于电解质的是 (填序号,下同),属于非电解质的是 ;属于强电解质的是 ;属于弱电解质的是 ;互为同素异形体的是 。
(2)物质③熔融状态的电离方程式为 。
(3)向⑨的溶液中逐渐滴加足量③的溶液,看到的现象是 。
17.Ⅰ.用表示原子:
(1)中性原子的中子数:N= 。
(2)中性分子中子数:12C16O2分子中,N= 。
(3)A2-原子核内有x个中子,其质量数为m,则ngA2-所含电子的物质的量为 mol。
Ⅱ.有①、、②H2、D2、T2③红磷、白磷④、、四组微粒或物质,回答下列问题:
(1)互为同位素的是 (填编号,下同)。
(2)互为同素异形体的是 。
18.用X表示原子:
(1)中性原子的中子数N= 。
(2)AXn+共有x个电子,则该阳离子的中子数N= 。
(3)AXn-共有x个电子,则该阴离子的中子数 N= 。
(4)12C16O2分子中的中子数N= 。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为 。
19.磷、硫元素存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,被称为生命元素。回答下列问题:
(1)红磷和白磷互称为 。
(2)已知磷的常见含氧酸有次磷酸(H3PO2)、亚磷酸(H3PO3)、磷酸(H3PO4),它们依次为一元酸、二元酸、三元酸。则NaH2PO2为 ;NaH2PO3为 (填“正盐”或“酸式盐”)
(3)H3PO2及NaH2PO2均可将溶液中的还原为银,从而可用于对器皿实现化学镀银。
①H3PO2中,P元素的化合价为 。
②利用H3PO2进行化学镀银反应中,氧化产物为H3PO4,则氧化剂和还原剂的个数之比为 。
(4)测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
葡萄酒样品100.00mL 馏分溶液出现蓝色且30s内不褪色
(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
按上述方案实验,消耗标准I2溶液20.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g L-1。
20.近年来,科学家通过粒子加速器进行了一周的实验,获得了6个非常罕见的Fe原子,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。回答下列问题:
(1)Fe原子的核内中子数为 ,该原子的核外电子数为 。
(2)以下关于Fe的叙述正确的是___________(填序号)。
A.Fe与Fe是两种核素
B.科学家获得了一种新元素
C.Fe的衰变不是化学变化
D.这种铁原子衰变放出两个质子后变成Fe
(3)某同学认为Fe在一定条件下也可与氧气反应,他的判断依据是 。
21.请按要求填空:
(1)简单原子的原子结构可用下图形象地表示:
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是
A.①②③是三种不同的核素
B.①②③具有相同的质量数
C.①②③互为同位素
D.①②③是三种化学性质不同的粒子
(2)科学家已发现一种新型氢分子(H3),在相同条件下,等质量的H3和H2相同的是
A 分子数 B 原子数 C 体积 D 电子数
(3)微粒AXn+核外有a个电子,则它的核内中子数为
(4)与10克D2O含有相同电子数的NH3在标准状况下的体积是
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.C60与C70均是由C元素组成的单质,属于同素异形体,A正确;
B.白磷和红磷是不同的物质,白磷转化为红磷有新物质生成,是化学变化,B错误;
C.O2转化为O3无元素化合价变化,不属于氧化还原反应,C错误;
D.金刚石与石墨化学式相同,均为C,但结构不同,D错误。
答案选A。
2.D
【详解】A.同位素必须是原子,石墨烯和碳纳米管都是单质,A错误;
B.BaCO3可溶于胃酸,不能用于胃肠X射线造影检查,B错误;
C.催化剂不能改变合成氨工业中原料的转化率,只能改变反应速率,C错误;
D.NH4Cl和ZnCl2溶液水解呈酸性,可用作焊接除锈剂,D正确;
故答案选D。
3.B
【详解】A. 同种元素的不同单质互为同素异形体,石墨烯与金刚石都是碳单质,互为同素异形体,故A不选;
B. 反应中存在化合价的变化的反应属于氧化还原反应,反应中C元素的化合价既升高又降低,CO既做氧化剂又还原剂,故B选;
C. Na2O与酸反应只生成盐和水,属于碱性氧化物, Na2CO3属于盐,故C不选;
D. 钠是活泼金属在自然界中不存在单质,自然界中钠元素以化合态形式存在,故D不选;
故选:B。
4.D
【详解】A.PH3的电子式为,A错误;
B.核素的表示方法为:元素符号左下角为质子数,左上角为质量数;中子数为16的原子:,B错误;
C.P4与足量的浓KOH溶液反应得到KH2PO2,则其为正盐,C错误;
D.由方程式可知,1分子P4中3个磷原子失去3个电子得到KH2PO2,1个磷原子得到3个电子形成PH3,故1mol P4参与反应,转移3mol电子,D正确;
故选D。
5.C
【详解】A.距离原子核较远的区域运动的电子原子核对它的吸引力较小,A项正确;
B.L层能量低于M层,原子核外电子在排布时,先排满L层再排M层,B项正确;
C.第二周期元素中随着核电荷数的增加,元素的最高化合价并不是一定增大的,C项错误;
D.第四周期中ⅡA与ⅢA族元素原子的核电荷数相差,D项正确;
故选C。
6.C
【详解】A.冰水混合物为纯净物,故A错误;
B.铜为单质,不是电解质,故B错误;
C.金刚石和石墨为碳元素的不同单质为同素异形体,铝合金为混合物,AgCl熔融态能导电为电解质,CO2为非电解质,故C正确;
D.CaO和CaO2不是单质,不是同素异形体,故D错误;
故选C。
7.A
【详解】A.和质子数相同而中子数不相同,互为同位素,A正确;
B.过氧化氢为共价化合物,不存在阴阳离子,B错误;
C.为硫原子得到两个电子形成的离子,核外电子数为18,最外层满足8电子稳定结构,C错误;
D.该图示为顺-2-丁烯,D错误;
故选A。
8.B
【详解】A.WO3和WO2.9的分子式不同,二者不是同分异构体的关系,错误;
B.WO3和WO2.9中W的化合价不同,由WO3制备WO2.9的过程发生了氧化还原反应,正确;
C.外界条件不确定时,无法确定氢气的体积,且不是标准状况下,体积不一定为22.4L,错误;
D.水的分解反应为吸热反应,使用催化剂不能改变物质的能量,错误。
答案选B。
9.B
【详解】A.铜像表面的铜绿[]不会与空气反应,能在空气中稳定存在,A正确;
B.同素异形体是同种元素构成的不同的单质,测定出土文物年代的是一种核素,不是单质,所以不是碳的一种同素异形体,B错误;
C.X射线衍射法研究晶体结构、形貌和各种缺陷的重要手段,可对青铜器微观晶体结构进行分析,C正确;
D.商代青铜器都是利用化学变化制备出铜为原料,说明我国商代已经掌握冶炼铜技术,D正确;
答案选B。
10.B
【详解】A.中子数为8的氧原子:,A错误;
B.H、D、T为氢元素的三种核素,互为同位素,B正确;
C.核电荷数为11,C错误;
D.的电离方程式为,D错误;
故选B。
11.A
【详解】A.同位素是质子数相同而中子数不同的核数,故二者互为同位素,A正确;
B.二者都含有117个质子,B错误;
C.同种元素的不同核素含有相同的质子数,原子中有:质子数=电子数,故二者所含电子数相同,C错误;
D.同种元素的不同核素质子数相同,二者都为117,D错误;
故选A。
12.A
【详解】A.一个S2O和一个Fe反应生成两个SO和一个Fe2+,该过程转移2个电子,但是Fe2+还要与个S2O反应变成Fe3+和自由基,56gFe为1molFe因此1mol铁参加反应要消耗1.5 molS2O,共有1.5NA个S2O被还原,故A错误;
B.1 mol过硫酸钠(Na2S2O8)含1 mol过氧键,即含有NA个过氧键,故B正确;
C.结合图示可知,碱性条件下,SO·发生反应的方程式为:SO·+OH-=SO+·OH,故C正确;
D.因为最后是将离子转变为沉淀析出的,则溶液的碱性越强越有利于析出,即pH越大越有利于去除废水中的正五价砷,pH越小,越不利于去除废水中的正五价砷,故D正确;
故选A。
13.(1)
(2) C5H12 CH3CH2CH2CH2CH3、CH3CH(CH3) CH2CH3、C(CH3)4 正戊烷
(3) ⑦⑧ ③④ ⑤⑥ ①②
【分析】(1)
甲烷的分子式为CH4,碳原子和4 氢原子形成4条共价键,其电子式为,故答案:。
(2)
饱和烷烃的通式为CnH2n+2,所以相对分子质量为72的烷烃的分子式为C5H12,其所有同分异构体有三种:正戊烷CH3CH2CH2CH2CH3;异戊烷 (2-甲基丁烷):CH3CH(CH3) CH2CH3;新戊烷(2,2-二甲基丙烷) C(CH3)4,故答案:C5H12;CH3CH2CH2CH2CH3、CH3CH(CH3) CH2CH3、C(CH3)4;正戊烷。
(3)
同分异构体是分子式相同,结构不同,所以⑦CH3CH2CH2CH3 ⑧(CH3)2CHCH3互为同分异构体;同素异形体由同种元素组成的不同单质,所以③石墨 ④金刚石互为同素异形体;同位素是质子数相同,中子数不同,所以⑤35Cl ⑥37Cl互为同位素;①液氯是氯气的液态,所以①液氯②氯气是同一种物质。故答案:⑦⑧;③④;⑤⑥;①②。
14. C (3)
【详解】(1)(3)(4).主要考查根据条件写化学方程式的能力,只要确定反应物和生成物配平即可;
(2).氰酸铵和尿素的化学式相同,但属于不同的物质,所以它们之间的关系为同分异构体。
15.(1)1:2
(2)25.0
(3)a+n+b
(4)
【详解】(1)0.2L1.0molL﹣1NaCl溶液中Cl-的物质的量浓度为1.0molL﹣1,0.1L1.0molL﹣1MgCl2溶液中Cl-的物质的量浓度为2×1.0molL﹣1=0.2 molL﹣1,故答案为:1:1。
(2)验室配制90mL1mol/LCuSO4溶液,用100mL的容量瓶配制,则配制出100mL1mol/L的溶液,若用胆矾(CuSO4 5H2O)固体来配制,所需的硫酸铜的物质的量n=CV=1mol/L×0.1L=0.1mol,所需的质量m=nM=0.1mol×250g/mol=25.0g。
(3)Rn+离子有a个电子,电荷数为+n,阳离子的核外电子数=质子数-电荷数,所以质子数=核外电子数+电荷数=a+n,质量数=质子数+中子数=b+a+n。
(4)反应N2+3H2=2NH3中,N元素由0价下降到-3价,H元素由0价上升到+1价,用双线桥法表示该反应的电子转移的方向和数目为。
16.(1) ③⑥⑧ ④⑤⑦⑩ ③⑧ ⑥ ①
(2)NaHSO4=Na++HSO
(3)先产生红褐色沉淀,后沉淀溶解,得到黄色溶液
【分析】①石墨是单质,既不属于电解质也不属于非电解质;
②NaOH溶液是混合物,既不属于电解质也不属于非电解质;
③NaHSO4固体是化合物、在水溶液中可电离出Na+、H+、SO,在熔融状态下只能电离成Na+、HSO,属于电解质、是强电解质;
④在水溶液中和熔融状态下均不导电的化合物为非电解质,CO2在熔融状态下不导电,在溶液中导电和其本身无关,为非电解质;
⑤酒精是有机物,在水溶液和熔融状况下均不导电,属于非电解质;
⑥蒸馏水能微弱地电离出氢离子和氢氧根离子,属于电解质、是弱电解质;
⑦CH4是有机物,属于非电解质;
⑧KNO3是离子化合物、熔融的KNO3电离成钠离子和硝酸根离子,是电解质、是强电解质;
⑨氢氧化铁胶体是混合物,既不属于电解质也不属于非电解质;
⑩在水溶液中和熔融状态下均不导电的化合物为非电解质, NH3在熔融状态下不导电,在溶液中导电和其本身无关,为非电解质;
Na2O是离子化合物、融熔状态电离成钠离子和氧离子,是电解质、是强电解质;
氨水是混合物,既不属于电解质也不属于非电解质;
CH3COOH是电解质、在水中部分电离,是弱电解质;
C60是单质,既不属于电解质也不属于非电解质;
(1)
据分析,以上物质中,属于电解质的是③⑥⑧ ,属于非电解质的是④⑤⑦⑩;属于强电解质的是③⑧ ;属于弱电解质的是⑥ ;同素异形体是由同种元素组成的不同单质,石墨和C60是组成元素相同,结构不同,性质不同的两种单质,则互为同素异形体的是① 。
(2)
物质③NaHSO4在熔融状态下只能电离成Na+、HSO,熔融状态的电离方程式为:NaHSO4=Na++HSO。
(3)
向⑨氢氧化铁胶体中逐渐滴加足量③NaHSO4的溶液,开始时,在硫酸氢钠的作用下胶体发生聚沉、产生红褐色的氢氧化铁沉淀、后沉淀与氢离子发生反应生成硫酸铁和水,故能看到沉淀溶解得到黄色溶液,因此答案为:先产生红褐色沉淀,后沉淀溶解,得到黄色溶液。
17. A-Z 22 ①④ ③
【详解】Ⅰ(1)中子数=质量数-原子序数,的中子数=A-Z;
(2) 中性分子中子数:12C16O2分子中,N=12-6+2×(16-8)=22;
(3) A2-原子核内有x个中子,其质量数为m,则原子序数为m-x,原子序数等于原子核外电子数,则A2-所含电子数为m-x+2,ng A2-的物质的量为,所含电子数为;
Ⅱ(1)同位素是质子相同,而中子数不同的原子,互为同位素的是①④;
(2) 同素异形体是虽然含有同样的元素组成,不同形态的单质,互为同素异形体的是③。
18. A-Z A-x-n A-x+n 22 mol
【详解】(1)根据“质子数+中子数=质量数”的关系可知:N=A-Z。
(2)AXn+共有x个电子,中性原子X的电子数为x+n,则N=A-x-n。
(3)AXn-共有x个电子,中性原子X的电子数为x-n,则N=A-x+n。
(4)12C16O2分子中的中子数为12-6+(16-8)×2=22。
(5)A2-原子核内有x个中子,其质量数为m,则质子数为m-x,含电子数为m-x+2,则n g A2-所含电子的物质的量为 mol。
19. 同素异形体 正盐 酸式盐 +1 4:1 0.128g/L
【详解】(1)白磷和红磷为同种元素组成的不同单质,为同素异形体;
(2)次磷酸(H3PO2)为一元酸,所以与碱反应生成的盐NaH2PO2为正盐,亚磷酸(H3PO3)为二元酸,所以与碱反应后消耗1个H+的盐NaH2PO3为酸式盐;
(3)①H3PO2中,P元素的化合价为+1;
②化学镀银,根据Ag的价态从+1→0,P的价态从+1→+5,根据氧化还原反应得失电子守恒,所以氧化剂和还原剂的个数为4:1;
(4)20.00 mL I2溶液的质量为=0.0508 g,设二氧化硫的质量为x,根据化学反应式可知
列式计算,,可得x=0.0128 g,所以氧化剂的残留量为。
20.(1) 19 26
(2)AC
(3)Fe与Fe的核外电子数相同,化学性质几乎完全相同
【详解】(1)Fe的中子数=质量数-质子数=45-26=19,电子数=质子数=26。
(2)Fe与Fe的质子数相同,属同一元素Fe元素,但中子数不同,是两种不同的核素,A正确;Fe元素不是一种新元素,B错误;Fe衰变后变为质子数为24的新原子,原子核发生了变化,不是化学变化,因为化学的范畴是在原子、分子水平上研究物质的,C正确;Fe衰变放出两个质子后变为Fe,D错误;故选AC。
(3)Fe与Fe的核外电子数相同,化学性质几乎完全相同
21. AC BD 11.2L
【详解】(1)根据示意图不难看出①②③分别是H、D、T原子:
A.首先明确核素的定义,不同的原子即不同的核素,氕、氘、氚明显是三种不同的核素,A项正确;
B.质量数=质子数+中子数,氕、氘、氚的质量数分别为1、2、3,B项错误;
C.氕、氘、氚互为氢元素的同位素,C项正确;
D.同位素的化学性质几乎完全一样,物理性质有差别,D项错误;
答案选AC;
(2)的分子量为3,的分子量为2,等质量的和,其分子数为反比,即2:3:
A.分子数为2:3,A项错误;
B.不管是还是,都是由氢原子构成的,因此等质量的和必然是由等量的氢原子构成的,B项正确;
C.虽然在相同条件下,但是二者的分子数不同,因此体积不同,C项错误;
D.同B项,二者都是由等量的氢原子构成的,因此二者所含的电子数也是相等的,D项正确;
答案选BD;
(3)首先带有n个正电荷,表明其失去了n个电子,则有个电子,又因为电子数=质子数,质量数=质子数+中子数,不难得出其核内有个中子;
(4)1个分子中有个电子,一个分子中有个电子,可以发现二者的电子数相等,n()=,则的物质的量也为0.5mol,v()=。
答案第1页,共2页
答案第1页,共2页
