专题2《化学反应速率与化学平衡》单元检测题(含解析)2023--2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题2《化学反应速率与化学平衡》单元检测题(含解析)2023--2024学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 954.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 16:03:02 | ||
图片预览

文档简介
专题2《化学反应速率与化学平衡》
一、单选题(共12题)
1.炼油、石化等工业会产生含硫(-2价)废水。一种在碱性条件下处理含硫废水的反应过程如图,其中为催化剂,附着在催化剂载体聚苯胺的表面。下列说法错误的是
A.转化a中化合价发生变化的元素仅有S和O
B.转化c是该过程的第一步反应
C.一段时间后催化效率会下降,原因可能是生成的S覆盖在催化剂表面或进入催化剂空位处
D.该反应过程的总方程式为:
2.下列各实验装置、目的或结论全都正确的是
实验装置
甲 乙 丙 丁
A.甲用于测定中和反应的反应热
B.乙可验证镁片与稀盐酸反应放热
C.由丙可推断出:反应为吸热反应
D.丁可验证对的分解反应有催化作用
3.下列事实不能用勒夏特列原理解释的是
A.加热浓氨水制取氨气
B.对2HI(g) H2(g)+I2(g)平衡体系增大压强使颜色变深
C.工业制金属钾:Na(l)+KCl(l) NaCl(l)+K(g),选取适宜的温度,使K从反应混合物中分离出来,有利于K的生成
D.光照新制氯水时,溶液的颜色逐渐变浅
4.结合实验与计算机模拟结果,研究了与在固体催化剂表面合成的反应历程。图示为反应历程中的能量面图(部分数据省略),其中吸附在催化剂表面的物种用*标注。下列说法不正确的是
A.氨气从催化剂表面脱附是吸热过程
B.增加Fe催化剂的用量,可改变合成氨反应的反应热
C.可计算推理合成氨的热化学方程式:
D.铁做催化剂时,通过改变反应历程降低了反应的活化能,使反应速率明显加快
5.已知2NO2(g)+O3(g)N2O5(g)+O2(g) △H<0,在一定温度下将2molNO2和1molO3充入一恒容密闭容器中进行反应,直至t1时达到平衡状态。下列图象正确的是
A. B.
C. D.
6.2021年10月16日,长征二号F火箭将神舟十三号载人飞船送入太空。其火箭使用的推进剂为偏二甲肼(C2H8N2)和四氧化二氮(N2O4),发生反应的化学方程式为C2H8N2+2N2O4=2CO2↑+4H2O↑+3N2↑;已知偏二甲肼中C、N元素的化合价相等。反应2NO2(g) N2O4(g)在一定体积的密闭容器中进行。下列说法正确的是
A.升高温度能减慢反应速率
B.减小N2O4浓度能加快反应速率
C.缩小反应容器的体积能加快反应速率
D.达到化学平衡时,NO2能100%转化为N2O4
7.工业尾气中含有H2S,会造成严重的环境污染。未脱除H2S的煤气在运输过程中还会腐蚀管道。氧化铁脱硫除去煤气中H2S的原理如图所示。下列说法错误的是
A.单质硫为黄色固体,易溶于水和CS2
B.脱硫反应为3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O
C.再生过程中,氧化剂与氧化产物的质量比为1:2
D.脱硫过程中,增大反应物的接触面积可提高脱硫效率
8.在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)pC(g)+qD(g),当m、n、p、q为任意整数时,下列说法一定能说明反应已达到平衡的是( )
①体系的压强不再改变②体系的温度不再改变③各组分的浓度相等④各组分的质量分数不再改变⑤反应速率(A)∶(B)=m∶n⑥n正(A)=m逆(B)⑦体系气体的平均相对分子质量不再改变
A.①②④⑥ B.③④⑥⑦ C.①②④⑤ D.②④⑥⑦
9.下列说法正确的是
A.一定条件下,增大反应物的量会加快化学反应速率
B.增大压强,肯定会加快化学反应速率
C.升高温度,无论吸热还是放热反应,v正、v逆均增大
D.催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,加快反应速率
10.在催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是
A.该过程的总反应为:
B.为中间产物,其中N元素的化合价为+3价
C.增大的量,的平衡转化率增大
D.不管发生包含①的历程还是发生包含②的历程,最终生成的水的量不变
11.CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH =+41.2 kJ·mol-1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) △H = -122.5 kJ·mol-1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性=。下列说法正确的是
A.其他条件不变,升高温度。CO2的转化率一定随着温度升高而降低
B.曲线b表示平衡时CH3OCH3的选择性随温度的变化情况
C.其它条件不变,增加氢气的投入量,一定能提高CH3OCH3的产率
D.220°C时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中X点),使用对反应II催化活性更高的催化剂,可提高CH3OCH3的选择性
12.在一恒压密闭容器中加入足量的碳,并充入0.2molCO2气体,发生反应:C(s)+CO2(g)2CO(g)。反应达平衡时[p(CO)、p(CO2)分别为体系中CO、CO2的平衡分压]随温度的变化关系如图所示。下列说法错误的是
A.该反应为吸热反应
B.向X点对应的平衡体系再充入CO、CO2各1mol,平衡逆向移动
C.980K时,CO2的平衡转化率约为33.3%
D.增大容器的体积有利于提高CO2的平衡转化率
二、填空题(共8题)
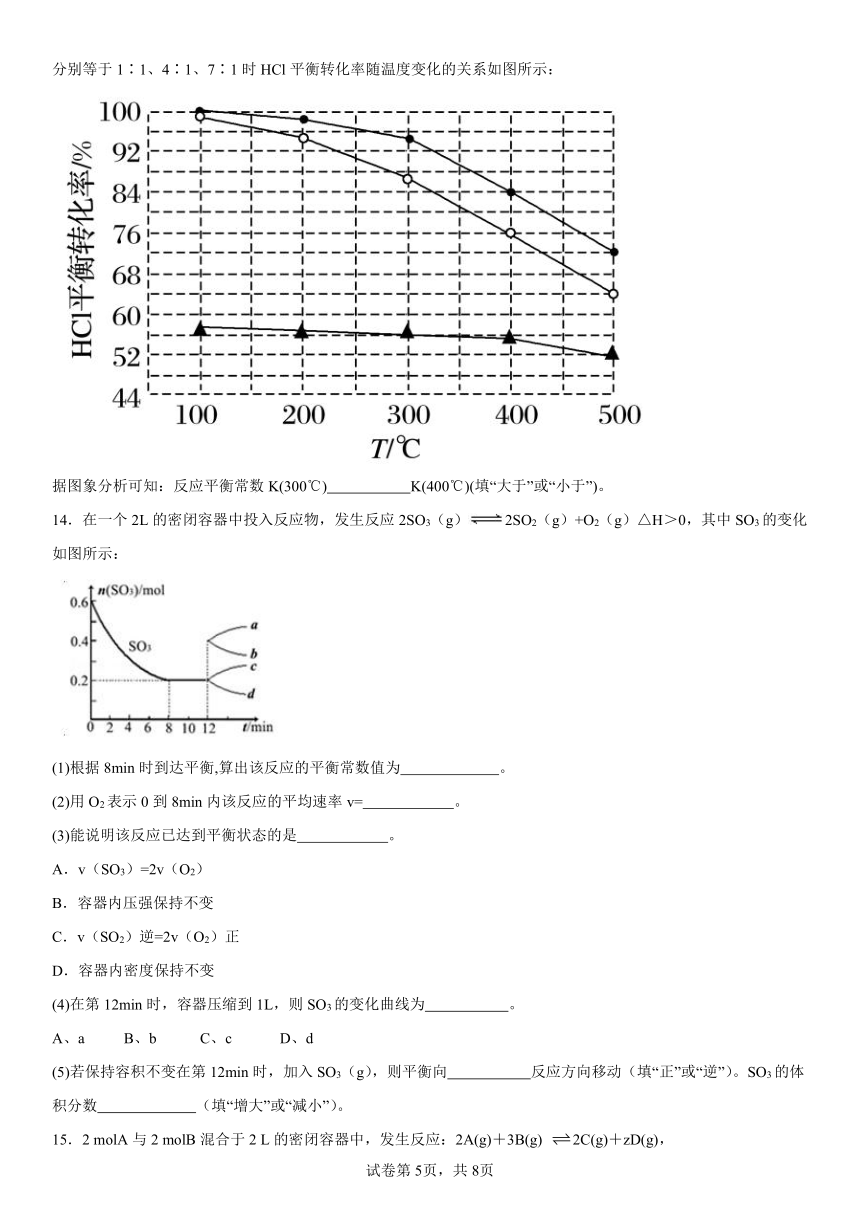
13.Deacon发明的直接氧化法原理为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g),在刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系如图所示:
据图象分析可知:反应平衡常数K(300℃) K(400℃)(填“大于”或“小于”)。
14.在一个2L的密闭容器中投入反应物,发生反应2SO3(g)2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
(1)根据8min时到达平衡,算出该反应的平衡常数值为 。
(2)用O2表示0到8min内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
A.v(SO3)=2v(O2)
B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正
D.容器内密度保持不变
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为 。
A、a B、b C、c D、d
(5)若保持容积不变在第12min时,加入SO3(g),则平衡向 反应方向移动(填“正”或“逆”)。SO3的体积分数 (填“增大”或“减小”)。
15.2 molA与2 molB混合于2 L的密闭容器中,发生反应:2A(g)+3B(g) 2C(g)+zD(g),
若2 s后反应达到平衡,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,计算:
(1)用C表示的反应速率v(C)= mol·L-1·s-1
(2)z=
(3)B的转化率为
(4)C平衡时的物质的量为 mol
16.已知化学反应①:Fe(s)+CO2(g)FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1 173 K情况下,K1、K2的值分别如下:
温度 K1 K2
973 K 1.47 2.38
1 173 K 2.15 1.67
请填空:
(1)通过表格中的数值可以推断:反应①是 (填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)CO(g)+H2O(g),写出该反应的平衡常数K3的表达式:K3= 。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式 ,据此关系式及上表数据,也能推断出反应③是 (填“吸热”或“放热”)反应。
(4)图甲、图乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图甲t2时刻改变的条件是 。
②图乙t2时刻改变的条件是 。
17.二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
Ⅰ.CO(g)+2H2(g) CH3OH(g)
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g)
500 K时,在2 L密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则:
(1)0~4 min,反应Ⅰ的v(H2)= 。
(2)反应Ⅱ中CH3OH的转化率α= ,反应 Ⅰ的平衡常数K= 。
18.氮、磷、砷是原子序数依次增大的同一主族的三种元素,其化合物在工业农业中有重要用途。
(1)氮有多种重要的化合物。其中,N2O可用作发泡剂。
①NH3在加热和有催化剂的条件下,可以与O2反应生成N2O,该反应的化学方程式是 。
②在体积为1L的密闭容器中充入1mol N2O气体,发生反应2N2O(g) 2N2(g)+O2(g)。在不同温度下N2O的平衡转化率如下图所示。该反应的△H 0(填“>”、“<”或“=” ),P1 P2(填“大于”、“小于”或“等于”),370℃时,该反应的平衡常数K= 。
(2)PH3和NH3与卤化氢的反应相似,产物的结构与性质也相似,下列对PH3与HCl反应产物的推断正确的是 (选填字母序号)。
a.能与NaOH溶液反应 b.含有离子键与非极性共价键 c.水溶液显酸性
(3)三价砷有剧毒,五价砷毒性减弱。含As2O3的污水可被次氯酸钠碱性溶液转化为AsO43-而降低毒性。该反应的离子方程式是 。
(4)HNO3、H3PO4、H3AsO4的酸性由强到弱的关系是 ,请用原子结构理论解释原因 。
19.化石燃料燃烧时会产生 SO2进入大气,有多种方法可用于 SO2的脱除。
(1)NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收SO2。
①反应离子方程式是 。
②为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如图所示:
a.过程1的离子方程式是Ni2O3+ClO- =2NiO2 +Cl-,则过程2的离子方程式 。
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是 。
(2)碘循环工艺也能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:
则碘循环工艺的总反应为: 。
20.完成下列问题。
(1)在2L的某恒容密闭容器中发生反应: 。某温度下,向该容器中充入、,发生上述反应,末,反应达到平衡,此时测得的物质的量分数为25%。
①内,平均速率 。
②每生成,转移的电子数为 。
③下列说法正确的是 (填标号)。
A.反应进行到一定程度时,的物质的量浓度可能为
B.无论反应进行到何种程度,碳、氢、氧元素的物质的量之比一定为1:6:2
C.加入合适的催化剂,反应速率发生改变的同时,的值也发生改变
(2)在T℃时,将一定物质的量的和置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可是 。
a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【分析】催化剂附着在催化剂载体聚苯胺的表面,空位吸附O2后,与H2O和S2-反应生成S,据此分析解题。
【详解】A.转化a中锰形成的化学键数目发生改变,故化合价发生变化的元素有S和O、Mn;故A错误;
B.据分析可知,第一步反应为转化c,故B正确;
C.反应中生成硫单质,生成的S覆盖在催化剂表面或进入催化剂内空位处,阻碍了反应的进行,导致催化剂使用一段时间后催化效率会下降,故C正确;
D.由图可知,催化氧化过程的总反应为氧气、水、硫离子在催化作用下生成氢氧根离子和硫单质:,故D正确;
故答案选A。
2.B
【详解】A.图中缺少玻璃搅拌器,不能搅拌,则不能准确测定中和热,故A错误;
B.Mg与盐酸反应放热,使饱和石灰水的温度升高,石灰水变浑浊,可验证镁片与稀盐酸反应放热,故B正确;
C.热水中颜色深,可知升高温度平衡向生成二氧化氮的方向移动,则反应2NO2(g) N2O4(g)为放热反应,故C错误;
D.右侧试管的温度高,且加催化剂,两个变量,不能验证FeCl3对H2O2的分解反应有催化作用,故D错误;
故选:B。
3.B
【详解】A.氨水中存在化学平衡:,升高温度促进一水合氨分解,平衡逆向移动,所以能用平衡移动原理解释,故A不符合题意;
B.加压不会使平衡发生移动,颜色变深是由于容器体积缩小导致浓度增大造成的,与平衡移动无关,故B符合题意;
C.工业制取金属钾时,选取适宜的温度使钾变成蒸汽从混合物中分离出来,钾的浓度变小,根据勒夏特列原理,平衡正向移动,利于钾的继续生成,能用勒夏特列原理解释,故C不符合题意;
D.光照新制氯水,,,次氯酸分解,促进氯气和水反应的平衡正向进行,氯气浓度减小,黄绿色逐渐变浅,可以用勒夏特列原理解释,故D不符合题意。
综上所述,答案为B。
4.B
【详解】A.NH3 →NH3的过程为脱附,由图知,氨气脱附后能量升高,则氨气的脱附过程是吸热过程,A正确;
B.催化剂只能改变反应速率,不能改变反应热,B错误;
C.由能量图可知,氮气和氢气被破坏生成1molN和3molH时吸收热量(21-17)kJ、1molN和3molH生成1mol NH3(g)时放热50kJ,则氮气和氢气生成1mol氨气需要放出46kJ的热量,可得合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,C正确;
D.催化剂发挥催化剂的原理为改变反应历程,从而降低活化能,从而使反应速率加快,D正确;
故选B。
5.D
【详解】A.在恒容密闭容器中进行反应,则气体的体积不变,则气体的密度始终不变,A错误;
B.反应刚开始时O2的物质的量为0,则其逆反应速率一开始应该为0,且NO2正反应速率一开始应该不为0,B错误;
C.NO2和O3的初始物质的量比为2:1,化学计量数之比为2:1,则两者的平衡转化率应该相同,C错误;
D.该反应正反应为放热反应,升高温度,化学平衡逆向移动,则K正减小,K逆增大,D正确;
故答案选D。
6.C
【详解】A.升高温度,化学反应速率加快,故A错误;
B.减小N2O4浓度反应速率减慢,故B错误;
C.缩小反应容器的体积,反应物浓度增大,能加快反应速率,故C正确;
D.2NO2(g) N2O4(g)反应可逆,达到化学平衡时,NO2不可能100%转化为N2O4,故D错误;
选C。
7.A
【详解】A.单质硫为黄色固体,不溶于水,微溶于酒精,易溶于CS2,A错误;
B.根据图示可知H2S与Fe2O3·H2O发生脱硫反应产生H2O、Fe2S3·H2O,根据质量守恒定律可知该反应方程式为:3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O,B正确;
C.在再生过程中O2与Fe2S3·H2O反应得到S和Fe2O3·H2O,Fe2S3·H2O为还原剂,1 mol反应失去6 mol电子产生3 mol S,O2为氧化剂,1 mol得到4 mol电子,则根据氧化还原反应中电子得失守恒,可知氧化剂与还原剂的物质的量的比是3:2,则氧化剂与氧化产物的质量比为3:(2×3)=1:2,C正确;
D.脱硫过程中,H2S是气体,Fe2O3·H2O是固体,增大反应物的接触面积可使单位时间内反应消耗更多的H2S,因而可提高脱硫效率,D正确;
故合理选项是A。
8.A
【详解】①mA(g)+nB(g)pC(g)+qD(g),若m+n=p+q,但由于是在一个不传热的固定容积的密闭容器中,则体系的压强不再改变说明体系温度不变,能作为判断是否达到化学平衡状态的依据;若m+n≠p+q,则体系的压强不再改变可作为判断是否达到化学平衡状态的依据,故不管m+n与p+q相不相等,都能说明反应达到化学平衡,①符合题意;
②由题干信息可知,在一个不传热的固定容积的密闭容器中体系的温度不再改变,说明正逆反应的速率相等,反应达平衡状态,②符合题意;
③各组分的浓度相等,不能说明正反应速率等于逆反应速率,故不能说明反应达到平衡状态,③不合题意;
④各组分的质量分数不再改变,是化学反应达到平衡的重要特征,故各物质的量不变,能够说明反应达平衡状态,④符合题意;
⑤反应速率(A)∶(B)=m∶n,未告知正、逆反应,故不能说明反应达到平衡状态,⑤不合题意;
⑥n正(A)=m逆(B),则有:,又根据反应速率之比等于化学计量系数比可知正(A):正(B)=m:n,则有:,故推出正(B)=m逆(B),能说明反应达到化学平衡,⑥符合题意;
⑦若m+n=p+q,体系中气体平均相对分子质量一直不变,不能作为判断是否达到化学平衡状态的依据,若m+n≠p+q,体系中气体平均相对分子质量是变量,现在不变了,能作为判断是否达到化学平衡状态的依据,⑦不合题意;
故一定能够说明反应达到化学平衡状态的是①②④⑥,故答案为:A。
9.C
【详解】A.一定条件下,增大固体反应物的量不会加快化学反应速率,A说法错误;
B.若反应体系中无气体参与的反应,增大压强,化学反应速率不变,B说法错误;
C.升高温度,v正、v逆均增大,与反应吸热还是放热无关,C说法正确;
D.催化剂能降低反应的活化能,能增大单位体积内活化分子百分数,加快反应速率,D说法错误;
答案为C。
10.C
【详解】A.根据反应机理,反应物为丙烷和氧气,生成物为丙烯和水,NO为催化剂,总反应为:,选项A正确;
B.中H为+1价,O为-2价,根据化合物中各元素代数和为0可知,N元素为+3价,选项B正确;
C.NO是催化剂,增大NO的量,丙烷的平衡转化率不变,选项C错误;
D.由A中总反应可知,包含①的历程还是②的历程,最终生成水的量不变,选项D正确;
答案选C。
11.D
【分析】反应I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH =+41.2 kJ·mol-1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) △H = -122.5 kJ·mol-1
由题意可知,反应I正反应方向是吸热反应,反应II正反应方向是放热热反应;
【详解】A.升高温度,反应I平衡正移,CO2转化率升高,反应I平衡逆移,CO2转化率降低,故整体CO2转化率受两个反应共同影响,所以升温CO2转化率不一定上升,描述错误,不符题意;
B.CH3OCH3是反应II产物,故其产量随温度上升一定是逐渐减少,所以曲线a应为CH3OCH3选择性对应图象曲线,曲线b应是CO2转化率曲线,描述错误,不符题意;
C.其他条件不变,只增加H2投入量,理论上两个反应平衡都应正移,都有H2O生成,故对于反应II来说,反应I生成的H2O会抑制反应II的正向移动,不同温度下反应I产生的H2O的量不同,对反应II的影响程度不同,所以CH3OCH3产率不一定增加,描述错误,不符题意;
D.X点未在曲线a上,X点状态处于未平衡状态,更换催化活性更高的催化剂,提高CH3OCH3选择性,使其达到相应温度下的曲线a上的点所对应的的选择性值,描述正确,符合题意;
综上,本题选D。
12.B
【详解】A.由图可得,随着温度的升高,增大,即混合气体中CO2的物质的量减小,CO的物质的量增大,说明温度升高时平衡正向移动,则该反应为吸热反应,A不符合题意。
B.X点对应的平衡体系中,=0,p(CO)=p(CO2)即n(CO2)=n(CO),由于是恒压密闭容器,向X点对应的平衡体系再充入CO、CO2各1mol,该体系与原平衡体系是等效平衡,平衡不移动,B符合题意。
C.980K时,反应达平衡时n(CO2)=n(CO),初始时n(CO2)=0.2mol,设反应过程中消耗CO2的物质的量为xmol,则反应过程中生成的CO的物质的量为2xmol,则有0.2 x=2x,x=mol,则CO2的转化率为,C不符合题意。
D.该反应的正反应为气体体积增大的反应,增大容器的体积,体系的压强减小,化学平衡正向移动,CO2的平衡转化率增大,D不符合题意。
故选B。
13.大于
【详解】根据图象可知,进料浓度比相同时,温度越高HCl平衡转化率越低,说明该反应为放热反应,升高温度平衡向着逆向移动,则温度越高平衡常数越小,所以反应平衡常数K(300℃)大于K(400℃),故答案为大于。
14. 0.4 0.0125mol/(L min) B、C C 逆 增大
【详解】(1)根据题意得:
根据该反应的平衡常数值为,故答案为:0.4;
(2)用O2表示0到8min内该反应的平均速率v==0.0125mol/(L min),故答案为:0.0125mol/(L min);
(3)A.v(SO3)=2v(O2)中没有反应速率的方向,反应不一定达到平衡状态,A错误;
B.正反应是体积增大的,则容器内压强保持不变,说明反应达到平衡状态,B正确;
C.v(SO2)逆=2v(O2)正中正逆反应速率相等,说明反应达到平衡状态,C正确;
D.容积和气体的质量均不变,因此密度是定值,则容器内密度保持不变不能说明反应达到平衡状态,D错误;
故选BC;
(4)在第12min时,容器压缩到1L,三氧化硫的浓度瞬间变为0.2mol/L,压强增大,平衡向逆反应方向进行,三氧化硫的浓度继续增大直至达到平衡状态,因此SO3的变化曲线为c曲线,故选C。
(5)若保持容积不变在第12min时,加入SO3(g),则相当于增大压强,平衡向逆反应方向移动。SO3的体积分数增大,故答案为:增大;
15.(1)0.25
(2)2
(3)75%
(4)1
【分析】若2s后,A的转化率为50%,则A转化的物质的量为2mol×50%=1mol,则 ,v(D)=0.25mol L-1 s-1,即=0.25mol L-1 s-1,解得z=2。
【详解】(1)据分析,z=2,化学反应速率之比等于化学计量数之比,故v(C)=v(D)=0.25mol L-1 s-1;
(2)据分析,计算可知,z=2;
(3)据分析,B的转化率为×100%=75%;
(4)据分析,2 s后反应达到平衡,C平衡时的物质的量为1mol。
16. 吸热 K3= 吸热 增大压强(或使用催化剂) 降低温度(或设法分离出H2)
【详解】(1)由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热;
(2)根据平衡常数的定义可知该反应的平衡常数表达式为K3=;
(3)反应①-反应②=反应③,所以K3=;由图表可知,温度升高K1增大,K2减小,所以K3增大,即温度升高,平衡向正反应方向移动,升高温度平衡吸热方向移动,所以反应③为吸热反应;
(4)①t2时刻改变条件后正逆反应速率均增大,但依然相等,即平衡不移动,所以可能是使用了催化剂,由于该反应前后气体系数之和相等,所以压强不会影响平衡,则也可能是增大压强;
②t2时刻改变条件后CO2的浓度增大,CO的浓度减小,平衡逆向移动,且不是移走CO2或增加CO使平衡逆向移动,该反应为吸热反应,降低温度可以使平衡逆向移动,出现图中变化,或者设法分离出H2,也可以使平衡逆向移动,CO2的浓度增大,CO的浓度减小。
17.(1)0.8 mol·L-1·min-1
(2) 80% 1.25
【详解】(1)利用C、H、O原子守恒计算平衡时各物质的物质的量,再求各物质的平衡浓度:
设平衡时CO为x mol,H2为y mol,CH3OH为z mol,则CH3OCH3为2z mol,H2O为2z mol,根据:
C守恒:x+z+2×2z=4
H守恒:2y+4z+6×2z+2×2z=2×8
O守恒:x+z+2z+2z=4
CO的转化率为=80%,解得x=0.8,y=1.6,z=0.64,v(H2)= =0.8 mol·L-1·min-1;
(2)反应Ⅰ中CO的转化率为80%,则生成的CH3OH的物质的量为4 mol×80%=3.2 mol,反应Ⅱ生成的CH3OCH3的物质的量为2z mol即2×0.64 mol=1.28 mol,则反应Ⅱ转化的CH3OH的物质的量为2×1.28 mol=2.56 mol,则反应Ⅱ中CH3OH的转化率α=×100%=80%。根据之前所解方程,可得平衡时:CH3OH、H2、CO的浓度分别为0.32 mol·L-1、0.8 mol·L-1、0.4 mol·L-1,反应Ⅰ的平衡常数K==1.25。
18. 2NH3+2O2N2O+3H2O > 小于 0.089 a c As2O3+2ClO— +6OH—=2AsO43—+2Cl—+3H2O HNO3>H3PO4>HAsO3 N、P、As三种非金属元素位于同主族,最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱
【分析】(1)①NH3在加热和有催化剂的条件下,与O2反应生成N2O,根据元素守恒,产物还有H2O,据此写出化学方程式;
②升高温度,N2O的转化率增大,平衡正移,结合温度对平衡移动的影响判断△H;温度相同时,P1对应N2O的转化率大,说明P1相对于P2平衡正移,结合该反应为气体体积增大的反应即可得结论;根据已知数据列三段式求解,K= ;
(2)NH3+HCl=NH4Cl,产物NH4Cl可与NaOH溶液反应,NH4Cl含有离子键和极性共价键,NH4Cl水解使溶液呈酸性,联系题意寻找答案;
(3)As2O3被次氯酸钠碱性溶液转化为AsO43-,同时结合化合价升降可知,次氯酸钠转化为Cl-,结合电荷守恒书写离子方程式;
(4)同主族元素最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱。
【详解】(1)①NH3在加热和有催化剂的条件下,与O2反应生成N2O,根据元素守恒,产物还有H2O,化学方程式为:2NH3+2O2=N2O+3H2O,故答案为:2NH3+2O2N2O+3H2O;
②根据图示,升高温度,N2O的转化率增大,平衡正移,说明正反应为吸热反应,△H>0;
温度相同时,P1对应N2O的转化率大,说明P1相对于P2平衡正移,结合该反应为气体体积增大的反应,所以P1<P2;
已知起始量1mol N2O,370℃时,N2O的转化率为40%,则△n(N2O)=1mol×40%=0.4mol,列三段式如下:
平衡常数K==0.089mol/L;故答案为:>;小于;0.089mol/L;
(2)由于PH3和NH3与卤化氢的反应相似,产物的结构与性质也相似,而NH3+HCl=NH4Cl,产物NH4Cl可与NaOH溶液反应,NH4Cl含有离子键和极性共价键,NH4Cl水解使溶液呈酸性,故答案为:ac;
(3)As2O3被次氯酸钠碱性溶液转化为AsO43-,同时结合化合价升降可知,次氯酸钠转化为Cl-,结合电荷守恒书写离子方程式为:As2O3+2ClO-+6OH-=2AsO43-+2Cl-+3H2O,故答案为:As2O3+2ClO-+6OH-=2AsO43-+2Cl-+3H2O;
(4)N、P、As三种非金属元素位于同主族,最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱,所以HNO3、H3PO4、H3AsO4的酸性由强到弱的关系是:HNO3>H3PO4>H3AsO4,故答案为:HNO3>H3PO4>H3AsO4;N、P、As三种非金属元素位于同主族,最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱。
【点睛】信息型氧化还原反应方程式的关键是找到氧化剂和还原剂,继而确定氧化产物和还原产物,再结合电子守恒和元素守恒配平方程式,要求学生平时多积累常见物质的性质,以及常见元素的化合价,同时要注意“类比”思想的运用,同主族元素在化合价变化方面会有相似之处。
19. ClO-+SO2+2OH-=Cl-+SO42-+H2O 2NiO2+ClO- =Ni2O3 +Cl-+2O Ca2+与SO42—结合生成微溶的CaSO4有利于反应的进行 SO2+2H2O H2SO4+H2
【分析】(1)二氧化硫排放到大气中易形成酸雨,需对其进行处理,可根据二氧化硫的还原性,采用氧化还原反应对其进行处理,次氯酸根具有氧化性,在碱性条件下可将二氧化硫氧化为硫酸根离子,催化剂可提高此反应速率,催化剂参加反应,但反应后催化剂没有变化,采用Ca(ClO)2也可吸收二氧化硫并且反应后生成微溶物硫酸钙,效果更好。
(2)通过流程图可看出反应器中发生的反应为:SO2+2H2O+I2 =H2SO4+2HI,在分离器中分离出硫酸后,HI进入到膜反应器中高温分解为氢气和碘单质,反应为2HI=I2+H2,经过一系列反应碘单质没有发生变化,因此可推断碘单质为此反应的催化剂。
【详解】(1)①用NaClO碱性溶液吸收SO2,次氯酸根将二氧化硫氧化生成硫酸根离子,离子方程式是ClO-+SO2+2OH- =Cl-+SO42-+H2O;
②a.为了提高吸收效率,常用Ni2O3作为催化剂,根据催化过程的示意图可知,过程2中NiO2和ClO-反应生成Ni2O3、Cl-、O,离子方程式为2NiO2+ClO- =Ni2O3 +Cl-+2O;
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,是因为Ca2+与SO42—结合生成微溶的CaSO4,有利于反应的进行;
③通过流程图可看出,经过一系列反应碘单质没有发生变化,因此可推断碘单质为此反应的催化剂,二氧化硫与水发生氧化还原反应生成硫酸和氢气,反应方程式为:SO2+2H2O H2SO4+H2。
20.(1) 0.06 0.9 B
(2)c
【详解】(1)①达到平衡时,H2O(g)物质的量的分数为25%,因此有,解得a=0.2,根据化学反应速率数学表达式为c(H2)==0.06mol/(L·min);故答案为0.06;
②根据反应方程式,每生成1molCH3OH,转移电子物质的量为6mol,因此每生成0.15molCH3OH,转移电子物质的量为6mol×0.15=0.9mol;故答案为0.9;
③A.当0.3molCO2与0.9molH2,完全反应时,生成CH3OH的物质的量为0.3mol,此时甲醇的浓度为0.15mol·L-1,因为此反应为可逆反应,不能完全进行到底,反应进行到一定程度时,c(CH3OH)小于0.15mol·L-1,故A错误;
B.根据原子守恒,反应任何程度碳、氢、氧原子物质的量之比一定是n(C)∶n(H) ∶n(O)=0.3∶1.8∶0.6=1∶6∶2,故B正确;
C.使用催化剂,可以加快反应速率,焓变只与始态和终态有关,使用催化剂,对焓变无影响,故C错误;
答案为B;
(2)a.升高温度且同时加压,正逆反应速率均增大,与图示不符合,故a不符合题意;
b.降低温度且同时减压,正逆反应速率均减小,与图示不符合,故b不符合题意;
c.保持温度、压强不变,增大反应物浓度,正反应速率增大,容器的体积增大导致生成物浓度减小,逆反应速率减小,平衡右移,达到新平衡时的正逆反应速率比原平衡大,与图示符合,故c符合题意;
d.保持温度压强不变,减小生成物浓度,逆反应速率减小,容器的体积减小导致反应物浓度增大,正反应速率增大,根据等效平衡知识,达到平衡时的速率比原平衡相同,与图示不符合,故d不符合题意;
答案为c。
答案第1页,共2页
答案第1页,共2页
一、单选题(共12题)
1.炼油、石化等工业会产生含硫(-2价)废水。一种在碱性条件下处理含硫废水的反应过程如图,其中为催化剂,附着在催化剂载体聚苯胺的表面。下列说法错误的是
A.转化a中化合价发生变化的元素仅有S和O
B.转化c是该过程的第一步反应
C.一段时间后催化效率会下降,原因可能是生成的S覆盖在催化剂表面或进入催化剂空位处
D.该反应过程的总方程式为:
2.下列各实验装置、目的或结论全都正确的是
实验装置
甲 乙 丙 丁
A.甲用于测定中和反应的反应热
B.乙可验证镁片与稀盐酸反应放热
C.由丙可推断出:反应为吸热反应
D.丁可验证对的分解反应有催化作用
3.下列事实不能用勒夏特列原理解释的是
A.加热浓氨水制取氨气
B.对2HI(g) H2(g)+I2(g)平衡体系增大压强使颜色变深
C.工业制金属钾:Na(l)+KCl(l) NaCl(l)+K(g),选取适宜的温度,使K从反应混合物中分离出来,有利于K的生成
D.光照新制氯水时,溶液的颜色逐渐变浅
4.结合实验与计算机模拟结果,研究了与在固体催化剂表面合成的反应历程。图示为反应历程中的能量面图(部分数据省略),其中吸附在催化剂表面的物种用*标注。下列说法不正确的是
A.氨气从催化剂表面脱附是吸热过程
B.增加Fe催化剂的用量,可改变合成氨反应的反应热
C.可计算推理合成氨的热化学方程式:
D.铁做催化剂时,通过改变反应历程降低了反应的活化能,使反应速率明显加快
5.已知2NO2(g)+O3(g)N2O5(g)+O2(g) △H<0,在一定温度下将2molNO2和1molO3充入一恒容密闭容器中进行反应,直至t1时达到平衡状态。下列图象正确的是
A. B.
C. D.
6.2021年10月16日,长征二号F火箭将神舟十三号载人飞船送入太空。其火箭使用的推进剂为偏二甲肼(C2H8N2)和四氧化二氮(N2O4),发生反应的化学方程式为C2H8N2+2N2O4=2CO2↑+4H2O↑+3N2↑;已知偏二甲肼中C、N元素的化合价相等。反应2NO2(g) N2O4(g)在一定体积的密闭容器中进行。下列说法正确的是
A.升高温度能减慢反应速率
B.减小N2O4浓度能加快反应速率
C.缩小反应容器的体积能加快反应速率
D.达到化学平衡时,NO2能100%转化为N2O4
7.工业尾气中含有H2S,会造成严重的环境污染。未脱除H2S的煤气在运输过程中还会腐蚀管道。氧化铁脱硫除去煤气中H2S的原理如图所示。下列说法错误的是
A.单质硫为黄色固体,易溶于水和CS2
B.脱硫反应为3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O
C.再生过程中,氧化剂与氧化产物的质量比为1:2
D.脱硫过程中,增大反应物的接触面积可提高脱硫效率
8.在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)pC(g)+qD(g),当m、n、p、q为任意整数时,下列说法一定能说明反应已达到平衡的是( )
①体系的压强不再改变②体系的温度不再改变③各组分的浓度相等④各组分的质量分数不再改变⑤反应速率(A)∶(B)=m∶n⑥n正(A)=m逆(B)⑦体系气体的平均相对分子质量不再改变
A.①②④⑥ B.③④⑥⑦ C.①②④⑤ D.②④⑥⑦
9.下列说法正确的是
A.一定条件下,增大反应物的量会加快化学反应速率
B.增大压强,肯定会加快化学反应速率
C.升高温度,无论吸热还是放热反应,v正、v逆均增大
D.催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,加快反应速率
10.在催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是
A.该过程的总反应为:
B.为中间产物,其中N元素的化合价为+3价
C.增大的量,的平衡转化率增大
D.不管发生包含①的历程还是发生包含②的历程,最终生成的水的量不变
11.CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH =+41.2 kJ·mol-1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) △H = -122.5 kJ·mol-1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性=。下列说法正确的是
A.其他条件不变,升高温度。CO2的转化率一定随着温度升高而降低
B.曲线b表示平衡时CH3OCH3的选择性随温度的变化情况
C.其它条件不变,增加氢气的投入量,一定能提高CH3OCH3的产率
D.220°C时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中X点),使用对反应II催化活性更高的催化剂,可提高CH3OCH3的选择性
12.在一恒压密闭容器中加入足量的碳,并充入0.2molCO2气体,发生反应:C(s)+CO2(g)2CO(g)。反应达平衡时[p(CO)、p(CO2)分别为体系中CO、CO2的平衡分压]随温度的变化关系如图所示。下列说法错误的是
A.该反应为吸热反应
B.向X点对应的平衡体系再充入CO、CO2各1mol,平衡逆向移动
C.980K时,CO2的平衡转化率约为33.3%
D.增大容器的体积有利于提高CO2的平衡转化率
二、填空题(共8题)
13.Deacon发明的直接氧化法原理为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g),在刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系如图所示:
据图象分析可知:反应平衡常数K(300℃) K(400℃)(填“大于”或“小于”)。
14.在一个2L的密闭容器中投入反应物,发生反应2SO3(g)2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
(1)根据8min时到达平衡,算出该反应的平衡常数值为 。
(2)用O2表示0到8min内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
A.v(SO3)=2v(O2)
B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正
D.容器内密度保持不变
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为 。
A、a B、b C、c D、d
(5)若保持容积不变在第12min时,加入SO3(g),则平衡向 反应方向移动(填“正”或“逆”)。SO3的体积分数 (填“增大”或“减小”)。
15.2 molA与2 molB混合于2 L的密闭容器中,发生反应:2A(g)+3B(g) 2C(g)+zD(g),
若2 s后反应达到平衡,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,计算:
(1)用C表示的反应速率v(C)= mol·L-1·s-1
(2)z=
(3)B的转化率为
(4)C平衡时的物质的量为 mol
16.已知化学反应①:Fe(s)+CO2(g)FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1 173 K情况下,K1、K2的值分别如下:
温度 K1 K2
973 K 1.47 2.38
1 173 K 2.15 1.67
请填空:
(1)通过表格中的数值可以推断:反应①是 (填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)CO(g)+H2O(g),写出该反应的平衡常数K3的表达式:K3= 。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式 ,据此关系式及上表数据,也能推断出反应③是 (填“吸热”或“放热”)反应。
(4)图甲、图乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图甲t2时刻改变的条件是 。
②图乙t2时刻改变的条件是 。
17.二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
Ⅰ.CO(g)+2H2(g) CH3OH(g)
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g)
500 K时,在2 L密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则:
(1)0~4 min,反应Ⅰ的v(H2)= 。
(2)反应Ⅱ中CH3OH的转化率α= ,反应 Ⅰ的平衡常数K= 。
18.氮、磷、砷是原子序数依次增大的同一主族的三种元素,其化合物在工业农业中有重要用途。
(1)氮有多种重要的化合物。其中,N2O可用作发泡剂。
①NH3在加热和有催化剂的条件下,可以与O2反应生成N2O,该反应的化学方程式是 。
②在体积为1L的密闭容器中充入1mol N2O气体,发生反应2N2O(g) 2N2(g)+O2(g)。在不同温度下N2O的平衡转化率如下图所示。该反应的△H 0(填“>”、“<”或“=” ),P1 P2(填“大于”、“小于”或“等于”),370℃时,该反应的平衡常数K= 。
(2)PH3和NH3与卤化氢的反应相似,产物的结构与性质也相似,下列对PH3与HCl反应产物的推断正确的是 (选填字母序号)。
a.能与NaOH溶液反应 b.含有离子键与非极性共价键 c.水溶液显酸性
(3)三价砷有剧毒,五价砷毒性减弱。含As2O3的污水可被次氯酸钠碱性溶液转化为AsO43-而降低毒性。该反应的离子方程式是 。
(4)HNO3、H3PO4、H3AsO4的酸性由强到弱的关系是 ,请用原子结构理论解释原因 。
19.化石燃料燃烧时会产生 SO2进入大气,有多种方法可用于 SO2的脱除。
(1)NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收SO2。
①反应离子方程式是 。
②为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如图所示:
a.过程1的离子方程式是Ni2O3+ClO- =2NiO2 +Cl-,则过程2的离子方程式 。
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是 。
(2)碘循环工艺也能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:
则碘循环工艺的总反应为: 。
20.完成下列问题。
(1)在2L的某恒容密闭容器中发生反应: 。某温度下,向该容器中充入、,发生上述反应,末,反应达到平衡,此时测得的物质的量分数为25%。
①内,平均速率 。
②每生成,转移的电子数为 。
③下列说法正确的是 (填标号)。
A.反应进行到一定程度时,的物质的量浓度可能为
B.无论反应进行到何种程度,碳、氢、氧元素的物质的量之比一定为1:6:2
C.加入合适的催化剂,反应速率发生改变的同时,的值也发生改变
(2)在T℃时,将一定物质的量的和置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可是 。
a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【分析】催化剂附着在催化剂载体聚苯胺的表面,空位吸附O2后,与H2O和S2-反应生成S,据此分析解题。
【详解】A.转化a中锰形成的化学键数目发生改变,故化合价发生变化的元素有S和O、Mn;故A错误;
B.据分析可知,第一步反应为转化c,故B正确;
C.反应中生成硫单质,生成的S覆盖在催化剂表面或进入催化剂内空位处,阻碍了反应的进行,导致催化剂使用一段时间后催化效率会下降,故C正确;
D.由图可知,催化氧化过程的总反应为氧气、水、硫离子在催化作用下生成氢氧根离子和硫单质:,故D正确;
故答案选A。
2.B
【详解】A.图中缺少玻璃搅拌器,不能搅拌,则不能准确测定中和热,故A错误;
B.Mg与盐酸反应放热,使饱和石灰水的温度升高,石灰水变浑浊,可验证镁片与稀盐酸反应放热,故B正确;
C.热水中颜色深,可知升高温度平衡向生成二氧化氮的方向移动,则反应2NO2(g) N2O4(g)为放热反应,故C错误;
D.右侧试管的温度高,且加催化剂,两个变量,不能验证FeCl3对H2O2的分解反应有催化作用,故D错误;
故选:B。
3.B
【详解】A.氨水中存在化学平衡:,升高温度促进一水合氨分解,平衡逆向移动,所以能用平衡移动原理解释,故A不符合题意;
B.加压不会使平衡发生移动,颜色变深是由于容器体积缩小导致浓度增大造成的,与平衡移动无关,故B符合题意;
C.工业制取金属钾时,选取适宜的温度使钾变成蒸汽从混合物中分离出来,钾的浓度变小,根据勒夏特列原理,平衡正向移动,利于钾的继续生成,能用勒夏特列原理解释,故C不符合题意;
D.光照新制氯水,,,次氯酸分解,促进氯气和水反应的平衡正向进行,氯气浓度减小,黄绿色逐渐变浅,可以用勒夏特列原理解释,故D不符合题意。
综上所述,答案为B。
4.B
【详解】A.NH3 →NH3的过程为脱附,由图知,氨气脱附后能量升高,则氨气的脱附过程是吸热过程,A正确;
B.催化剂只能改变反应速率,不能改变反应热,B错误;
C.由能量图可知,氮气和氢气被破坏生成1molN和3molH时吸收热量(21-17)kJ、1molN和3molH生成1mol NH3(g)时放热50kJ,则氮气和氢气生成1mol氨气需要放出46kJ的热量,可得合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,C正确;
D.催化剂发挥催化剂的原理为改变反应历程,从而降低活化能,从而使反应速率加快,D正确;
故选B。
5.D
【详解】A.在恒容密闭容器中进行反应,则气体的体积不变,则气体的密度始终不变,A错误;
B.反应刚开始时O2的物质的量为0,则其逆反应速率一开始应该为0,且NO2正反应速率一开始应该不为0,B错误;
C.NO2和O3的初始物质的量比为2:1,化学计量数之比为2:1,则两者的平衡转化率应该相同,C错误;
D.该反应正反应为放热反应,升高温度,化学平衡逆向移动,则K正减小,K逆增大,D正确;
故答案选D。
6.C
【详解】A.升高温度,化学反应速率加快,故A错误;
B.减小N2O4浓度反应速率减慢,故B错误;
C.缩小反应容器的体积,反应物浓度增大,能加快反应速率,故C正确;
D.2NO2(g) N2O4(g)反应可逆,达到化学平衡时,NO2不可能100%转化为N2O4,故D错误;
选C。
7.A
【详解】A.单质硫为黄色固体,不溶于水,微溶于酒精,易溶于CS2,A错误;
B.根据图示可知H2S与Fe2O3·H2O发生脱硫反应产生H2O、Fe2S3·H2O,根据质量守恒定律可知该反应方程式为:3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O,B正确;
C.在再生过程中O2与Fe2S3·H2O反应得到S和Fe2O3·H2O,Fe2S3·H2O为还原剂,1 mol反应失去6 mol电子产生3 mol S,O2为氧化剂,1 mol得到4 mol电子,则根据氧化还原反应中电子得失守恒,可知氧化剂与还原剂的物质的量的比是3:2,则氧化剂与氧化产物的质量比为3:(2×3)=1:2,C正确;
D.脱硫过程中,H2S是气体,Fe2O3·H2O是固体,增大反应物的接触面积可使单位时间内反应消耗更多的H2S,因而可提高脱硫效率,D正确;
故合理选项是A。
8.A
【详解】①mA(g)+nB(g)pC(g)+qD(g),若m+n=p+q,但由于是在一个不传热的固定容积的密闭容器中,则体系的压强不再改变说明体系温度不变,能作为判断是否达到化学平衡状态的依据;若m+n≠p+q,则体系的压强不再改变可作为判断是否达到化学平衡状态的依据,故不管m+n与p+q相不相等,都能说明反应达到化学平衡,①符合题意;
②由题干信息可知,在一个不传热的固定容积的密闭容器中体系的温度不再改变,说明正逆反应的速率相等,反应达平衡状态,②符合题意;
③各组分的浓度相等,不能说明正反应速率等于逆反应速率,故不能说明反应达到平衡状态,③不合题意;
④各组分的质量分数不再改变,是化学反应达到平衡的重要特征,故各物质的量不变,能够说明反应达平衡状态,④符合题意;
⑤反应速率(A)∶(B)=m∶n,未告知正、逆反应,故不能说明反应达到平衡状态,⑤不合题意;
⑥n正(A)=m逆(B),则有:,又根据反应速率之比等于化学计量系数比可知正(A):正(B)=m:n,则有:,故推出正(B)=m逆(B),能说明反应达到化学平衡,⑥符合题意;
⑦若m+n=p+q,体系中气体平均相对分子质量一直不变,不能作为判断是否达到化学平衡状态的依据,若m+n≠p+q,体系中气体平均相对分子质量是变量,现在不变了,能作为判断是否达到化学平衡状态的依据,⑦不合题意;
故一定能够说明反应达到化学平衡状态的是①②④⑥,故答案为:A。
9.C
【详解】A.一定条件下,增大固体反应物的量不会加快化学反应速率,A说法错误;
B.若反应体系中无气体参与的反应,增大压强,化学反应速率不变,B说法错误;
C.升高温度,v正、v逆均增大,与反应吸热还是放热无关,C说法正确;
D.催化剂能降低反应的活化能,能增大单位体积内活化分子百分数,加快反应速率,D说法错误;
答案为C。
10.C
【详解】A.根据反应机理,反应物为丙烷和氧气,生成物为丙烯和水,NO为催化剂,总反应为:,选项A正确;
B.中H为+1价,O为-2价,根据化合物中各元素代数和为0可知,N元素为+3价,选项B正确;
C.NO是催化剂,增大NO的量,丙烷的平衡转化率不变,选项C错误;
D.由A中总反应可知,包含①的历程还是②的历程,最终生成水的量不变,选项D正确;
答案选C。
11.D
【分析】反应I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH =+41.2 kJ·mol-1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) △H = -122.5 kJ·mol-1
由题意可知,反应I正反应方向是吸热反应,反应II正反应方向是放热热反应;
【详解】A.升高温度,反应I平衡正移,CO2转化率升高,反应I平衡逆移,CO2转化率降低,故整体CO2转化率受两个反应共同影响,所以升温CO2转化率不一定上升,描述错误,不符题意;
B.CH3OCH3是反应II产物,故其产量随温度上升一定是逐渐减少,所以曲线a应为CH3OCH3选择性对应图象曲线,曲线b应是CO2转化率曲线,描述错误,不符题意;
C.其他条件不变,只增加H2投入量,理论上两个反应平衡都应正移,都有H2O生成,故对于反应II来说,反应I生成的H2O会抑制反应II的正向移动,不同温度下反应I产生的H2O的量不同,对反应II的影响程度不同,所以CH3OCH3产率不一定增加,描述错误,不符题意;
D.X点未在曲线a上,X点状态处于未平衡状态,更换催化活性更高的催化剂,提高CH3OCH3选择性,使其达到相应温度下的曲线a上的点所对应的的选择性值,描述正确,符合题意;
综上,本题选D。
12.B
【详解】A.由图可得,随着温度的升高,增大,即混合气体中CO2的物质的量减小,CO的物质的量增大,说明温度升高时平衡正向移动,则该反应为吸热反应,A不符合题意。
B.X点对应的平衡体系中,=0,p(CO)=p(CO2)即n(CO2)=n(CO),由于是恒压密闭容器,向X点对应的平衡体系再充入CO、CO2各1mol,该体系与原平衡体系是等效平衡,平衡不移动,B符合题意。
C.980K时,反应达平衡时n(CO2)=n(CO),初始时n(CO2)=0.2mol,设反应过程中消耗CO2的物质的量为xmol,则反应过程中生成的CO的物质的量为2xmol,则有0.2 x=2x,x=mol,则CO2的转化率为,C不符合题意。
D.该反应的正反应为气体体积增大的反应,增大容器的体积,体系的压强减小,化学平衡正向移动,CO2的平衡转化率增大,D不符合题意。
故选B。
13.大于
【详解】根据图象可知,进料浓度比相同时,温度越高HCl平衡转化率越低,说明该反应为放热反应,升高温度平衡向着逆向移动,则温度越高平衡常数越小,所以反应平衡常数K(300℃)大于K(400℃),故答案为大于。
14. 0.4 0.0125mol/(L min) B、C C 逆 增大
【详解】(1)根据题意得:
根据该反应的平衡常数值为,故答案为:0.4;
(2)用O2表示0到8min内该反应的平均速率v==0.0125mol/(L min),故答案为:0.0125mol/(L min);
(3)A.v(SO3)=2v(O2)中没有反应速率的方向,反应不一定达到平衡状态,A错误;
B.正反应是体积增大的,则容器内压强保持不变,说明反应达到平衡状态,B正确;
C.v(SO2)逆=2v(O2)正中正逆反应速率相等,说明反应达到平衡状态,C正确;
D.容积和气体的质量均不变,因此密度是定值,则容器内密度保持不变不能说明反应达到平衡状态,D错误;
故选BC;
(4)在第12min时,容器压缩到1L,三氧化硫的浓度瞬间变为0.2mol/L,压强增大,平衡向逆反应方向进行,三氧化硫的浓度继续增大直至达到平衡状态,因此SO3的变化曲线为c曲线,故选C。
(5)若保持容积不变在第12min时,加入SO3(g),则相当于增大压强,平衡向逆反应方向移动。SO3的体积分数增大,故答案为:增大;
15.(1)0.25
(2)2
(3)75%
(4)1
【分析】若2s后,A的转化率为50%,则A转化的物质的量为2mol×50%=1mol,则 ,v(D)=0.25mol L-1 s-1,即=0.25mol L-1 s-1,解得z=2。
【详解】(1)据分析,z=2,化学反应速率之比等于化学计量数之比,故v(C)=v(D)=0.25mol L-1 s-1;
(2)据分析,计算可知,z=2;
(3)据分析,B的转化率为×100%=75%;
(4)据分析,2 s后反应达到平衡,C平衡时的物质的量为1mol。
16. 吸热 K3= 吸热 增大压强(或使用催化剂) 降低温度(或设法分离出H2)
【详解】(1)由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热;
(2)根据平衡常数的定义可知该反应的平衡常数表达式为K3=;
(3)反应①-反应②=反应③,所以K3=;由图表可知,温度升高K1增大,K2减小,所以K3增大,即温度升高,平衡向正反应方向移动,升高温度平衡吸热方向移动,所以反应③为吸热反应;
(4)①t2时刻改变条件后正逆反应速率均增大,但依然相等,即平衡不移动,所以可能是使用了催化剂,由于该反应前后气体系数之和相等,所以压强不会影响平衡,则也可能是增大压强;
②t2时刻改变条件后CO2的浓度增大,CO的浓度减小,平衡逆向移动,且不是移走CO2或增加CO使平衡逆向移动,该反应为吸热反应,降低温度可以使平衡逆向移动,出现图中变化,或者设法分离出H2,也可以使平衡逆向移动,CO2的浓度增大,CO的浓度减小。
17.(1)0.8 mol·L-1·min-1
(2) 80% 1.25
【详解】(1)利用C、H、O原子守恒计算平衡时各物质的物质的量,再求各物质的平衡浓度:
设平衡时CO为x mol,H2为y mol,CH3OH为z mol,则CH3OCH3为2z mol,H2O为2z mol,根据:
C守恒:x+z+2×2z=4
H守恒:2y+4z+6×2z+2×2z=2×8
O守恒:x+z+2z+2z=4
CO的转化率为=80%,解得x=0.8,y=1.6,z=0.64,v(H2)= =0.8 mol·L-1·min-1;
(2)反应Ⅰ中CO的转化率为80%,则生成的CH3OH的物质的量为4 mol×80%=3.2 mol,反应Ⅱ生成的CH3OCH3的物质的量为2z mol即2×0.64 mol=1.28 mol,则反应Ⅱ转化的CH3OH的物质的量为2×1.28 mol=2.56 mol,则反应Ⅱ中CH3OH的转化率α=×100%=80%。根据之前所解方程,可得平衡时:CH3OH、H2、CO的浓度分别为0.32 mol·L-1、0.8 mol·L-1、0.4 mol·L-1,反应Ⅰ的平衡常数K==1.25。
18. 2NH3+2O2N2O+3H2O > 小于 0.089 a c As2O3+2ClO— +6OH—=2AsO43—+2Cl—+3H2O HNO3>H3PO4>HAsO3 N、P、As三种非金属元素位于同主族,最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱
【分析】(1)①NH3在加热和有催化剂的条件下,与O2反应生成N2O,根据元素守恒,产物还有H2O,据此写出化学方程式;
②升高温度,N2O的转化率增大,平衡正移,结合温度对平衡移动的影响判断△H;温度相同时,P1对应N2O的转化率大,说明P1相对于P2平衡正移,结合该反应为气体体积增大的反应即可得结论;根据已知数据列三段式求解,K= ;
(2)NH3+HCl=NH4Cl,产物NH4Cl可与NaOH溶液反应,NH4Cl含有离子键和极性共价键,NH4Cl水解使溶液呈酸性,联系题意寻找答案;
(3)As2O3被次氯酸钠碱性溶液转化为AsO43-,同时结合化合价升降可知,次氯酸钠转化为Cl-,结合电荷守恒书写离子方程式;
(4)同主族元素最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱。
【详解】(1)①NH3在加热和有催化剂的条件下,与O2反应生成N2O,根据元素守恒,产物还有H2O,化学方程式为:2NH3+2O2=N2O+3H2O,故答案为:2NH3+2O2N2O+3H2O;
②根据图示,升高温度,N2O的转化率增大,平衡正移,说明正反应为吸热反应,△H>0;
温度相同时,P1对应N2O的转化率大,说明P1相对于P2平衡正移,结合该反应为气体体积增大的反应,所以P1<P2;
已知起始量1mol N2O,370℃时,N2O的转化率为40%,则△n(N2O)=1mol×40%=0.4mol,列三段式如下:
平衡常数K==0.089mol/L;故答案为:>;小于;0.089mol/L;
(2)由于PH3和NH3与卤化氢的反应相似,产物的结构与性质也相似,而NH3+HCl=NH4Cl,产物NH4Cl可与NaOH溶液反应,NH4Cl含有离子键和极性共价键,NH4Cl水解使溶液呈酸性,故答案为:ac;
(3)As2O3被次氯酸钠碱性溶液转化为AsO43-,同时结合化合价升降可知,次氯酸钠转化为Cl-,结合电荷守恒书写离子方程式为:As2O3+2ClO-+6OH-=2AsO43-+2Cl-+3H2O,故答案为:As2O3+2ClO-+6OH-=2AsO43-+2Cl-+3H2O;
(4)N、P、As三种非金属元素位于同主族,最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱,所以HNO3、H3PO4、H3AsO4的酸性由强到弱的关系是:HNO3>H3PO4>H3AsO4,故答案为:HNO3>H3PO4>H3AsO4;N、P、As三种非金属元素位于同主族,最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱。
【点睛】信息型氧化还原反应方程式的关键是找到氧化剂和还原剂,继而确定氧化产物和还原产物,再结合电子守恒和元素守恒配平方程式,要求学生平时多积累常见物质的性质,以及常见元素的化合价,同时要注意“类比”思想的运用,同主族元素在化合价变化方面会有相似之处。
19. ClO-+SO2+2OH-=Cl-+SO42-+H2O 2NiO2+ClO- =Ni2O3 +Cl-+2O Ca2+与SO42—结合生成微溶的CaSO4有利于反应的进行 SO2+2H2O H2SO4+H2
【分析】(1)二氧化硫排放到大气中易形成酸雨,需对其进行处理,可根据二氧化硫的还原性,采用氧化还原反应对其进行处理,次氯酸根具有氧化性,在碱性条件下可将二氧化硫氧化为硫酸根离子,催化剂可提高此反应速率,催化剂参加反应,但反应后催化剂没有变化,采用Ca(ClO)2也可吸收二氧化硫并且反应后生成微溶物硫酸钙,效果更好。
(2)通过流程图可看出反应器中发生的反应为:SO2+2H2O+I2 =H2SO4+2HI,在分离器中分离出硫酸后,HI进入到膜反应器中高温分解为氢气和碘单质,反应为2HI=I2+H2,经过一系列反应碘单质没有发生变化,因此可推断碘单质为此反应的催化剂。
【详解】(1)①用NaClO碱性溶液吸收SO2,次氯酸根将二氧化硫氧化生成硫酸根离子,离子方程式是ClO-+SO2+2OH- =Cl-+SO42-+H2O;
②a.为了提高吸收效率,常用Ni2O3作为催化剂,根据催化过程的示意图可知,过程2中NiO2和ClO-反应生成Ni2O3、Cl-、O,离子方程式为2NiO2+ClO- =Ni2O3 +Cl-+2O;
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,是因为Ca2+与SO42—结合生成微溶的CaSO4,有利于反应的进行;
③通过流程图可看出,经过一系列反应碘单质没有发生变化,因此可推断碘单质为此反应的催化剂,二氧化硫与水发生氧化还原反应生成硫酸和氢气,反应方程式为:SO2+2H2O H2SO4+H2。
20.(1) 0.06 0.9 B
(2)c
【详解】(1)①达到平衡时,H2O(g)物质的量的分数为25%,因此有,解得a=0.2,根据化学反应速率数学表达式为c(H2)==0.06mol/(L·min);故答案为0.06;
②根据反应方程式,每生成1molCH3OH,转移电子物质的量为6mol,因此每生成0.15molCH3OH,转移电子物质的量为6mol×0.15=0.9mol;故答案为0.9;
③A.当0.3molCO2与0.9molH2,完全反应时,生成CH3OH的物质的量为0.3mol,此时甲醇的浓度为0.15mol·L-1,因为此反应为可逆反应,不能完全进行到底,反应进行到一定程度时,c(CH3OH)小于0.15mol·L-1,故A错误;
B.根据原子守恒,反应任何程度碳、氢、氧原子物质的量之比一定是n(C)∶n(H) ∶n(O)=0.3∶1.8∶0.6=1∶6∶2,故B正确;
C.使用催化剂,可以加快反应速率,焓变只与始态和终态有关,使用催化剂,对焓变无影响,故C错误;
答案为B;
(2)a.升高温度且同时加压,正逆反应速率均增大,与图示不符合,故a不符合题意;
b.降低温度且同时减压,正逆反应速率均减小,与图示不符合,故b不符合题意;
c.保持温度、压强不变,增大反应物浓度,正反应速率增大,容器的体积增大导致生成物浓度减小,逆反应速率减小,平衡右移,达到新平衡时的正逆反应速率比原平衡大,与图示符合,故c符合题意;
d.保持温度压强不变,减小生成物浓度,逆反应速率减小,容器的体积减小导致反应物浓度增大,正反应速率增大,根据等效平衡知识,达到平衡时的速率比原平衡相同,与图示不符合,故d不符合题意;
答案为c。
答案第1页,共2页
答案第1页,共2页
