2.3 化学平衡的移动 同步练习(含解析) 2023-2024学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 2.3 化学平衡的移动 同步练习(含解析) 2023-2024学年高二上学期化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 432.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 16:35:06 | ||
图片预览




文档简介
2.3 化学平衡的移动 同步练习
一、单选题
1.下列反应的速率受温度影响不大,主要决定于浓度和扩散速率的是( )
A.N2(g)+3H2(g) 2NH3(g) ΔH<0
B.2H2(g)+O2(g) 2H2O(l) ΔH<0
C.H+ (aq)+ OH-(aq)=H2O(l) ΔH<0
D.CaCO3(s)=CaO(s)+ CO2 (g) ΔH >0
2.下列事实不能用勒夏特列原理来解释的是( )
A.往硫化氢水溶液中加碱有利于S2-增加
B.加入催化剂有利于氨氧化反应
C.高压有利于合成氨反应
D.氯气在饱和食盐水中的溶解度小于在水中的溶解度
3.向稀氨水中分别加入以下物质,水的电离平衡会正向移动的是( )
A.NH4Cl B.浓氨水 C.NaOH D.Na2SO4
4.对于某可逆反应平衡体系,下列措施一定会使平衡移动的是( )
A.升高温度 B.使用催化剂
C.改变体系压强 D.增大反应物用量
5.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g),达到平衡时,测得A的浓度为0.5mol·L 1,在温度不变的条件下,将容器的体积扩大到两倍,再达到平衡,测得A的浓度降低为0.3mol·L 1。下列有关判断正确的是( )
A.x+yC.C的体积分数降低 D.B的转化率增大
6.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的体积扩大一倍,测得A的浓度变为0.15 mol/L,下列有关判断正确的是( )
A.x+y<z B.平衡逆向移动
C.A的转化率降低 D.C的体积分数减小
7.对可逆反应,下列叙述正确的是( )
A.若单位时间内生成的同时,消耗,则反应达到平衡状态
B.达到平衡后,保持温度不变,减小容器体积增大压强,平衡逆向移动,减小
C.降低温度,正反应速率增大,逆反应速率减少,平衡正向移动
D.其它条件不变,若增加的量,可以提高的转化率
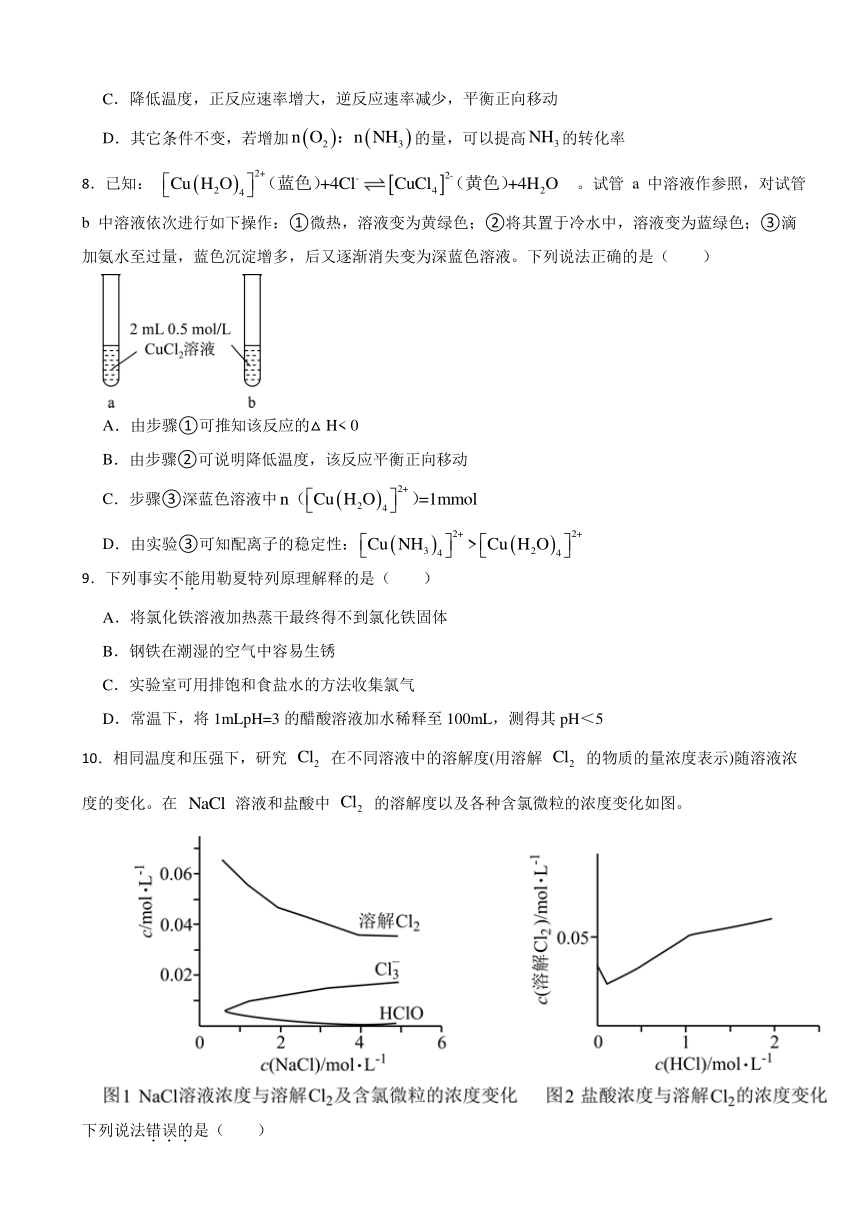
8.已知: 。试管 a 中溶液作参照,对试管 b 中溶液依次进行如下操作:①微热,溶液变为黄绿色;②将其置于冷水中,溶液变为蓝绿色;③滴加氨水至过量,蓝色沉淀增多,后又逐渐消失变为深蓝色溶液。下列说法正确的是( )
A.由步骤①可推知该反应的△H< 0
B.由步骤②可说明降低温度,该反应平衡正向移动
C.步骤③深蓝色溶液中
D.由实验③可知配离子的稳定性:
9.下列事实不能用勒夏特列原理解释的是( )
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C.实验室可用排饱和食盐水的方法收集氯气
D.常温下,将1mLpH=3的醋酸溶液加水稀释至100mL,测得其pH<5
10.相同温度和压强下,研究 在不同溶液中的溶解度(用溶解 的物质的量浓度表示)随溶液浓度的变化。在 溶液和盐酸中 的溶解度以及各种含氯微粒的浓度变化如图。
下列说法错误的是( )
A.由图1可知, 溶于 溶液时还发生了反应
B.随 溶液浓度增大, 平衡逆移, 溶解度减小
C.随盐酸浓度增加 与 的反应被抑制,生成 为主要反应从而促进 溶解
D.由上述实验可知, 浓度增大促进 溶解,由此推知在稀硫酸中,随硫酸浓度增大 的溶解度会增大
11.在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g) 2C(g),反应达平衡,若混合气体中A和B的物质的量之和与C的物质的量相等,此时A的转化率为( )
A.60% B.50% C.40% D.70%
12.向某密闭容器中充入NO2,发生反应:2NO2(g) N2O4(g)(已知:N2O4为无色气体)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:
/℃ 27 35 49 70
NO2% 20 25 40 66
N2O4% 80 75 60 34
下列说法正确的是( )
A.平衡时,v(NO2消耗)=2v(N2O4消耗)
B.27℃时,该平衡体系中NO2的转化率为80%
C.升高温度,该反应的化学平衡常数增大
D.温度不变,缩小容器体积,达平衡时气体颜色变浅
13.下列事实中,不能应用化学平衡移动原理来解释的是( )
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI (g) H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
A.②③⑤ B.②⑤ C.④⑤ D.①②③
14.在一定温度和压强下的密闭容器中,有吸热反应 发生。下列叙述正确的是( )
A.反应达到平衡后,正、逆反应均停止
B.一定时间后, 消耗完全
C.增大 的浓度,该反应的限度不会改变
D.更换高效催化剂,该反应的化学反应速率增大
15.COCl2(g) CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
16.下列叙述或变化,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.加入催化剂有利于氨的合成
D.工业制取金属钾的反应为:Na(l)+KCl(l) NaCl(l)+K(g)
二、综合题
17.石油炼厂气(小分子烷烃和烯烃)的综合利用是当今社会发展的需要。
(1)已知一些物质的燃烧热如下表:
物质
燃烧热 -393.5 -285.8 -890.3 -1559.8 -2219.9
写出丙烷与氢气反应生成甲烷的热化学方程式: 。
(2)1,2-二氯乙烷()常用于制造乙酰纤维、烟草萃取剂、熏蒸剂。工业上可用乙烯加成法制备1,2-二氯乙烷,主要副产物为氯乙烯(),反应原理如下:
I.
II.
下,向某恒容密闭容器中充入等物质的量的和,在催化剂作用下发生反应,容器内气体的压强随时间的变化如图1所示。
①前内用表示的平均反应速率 。
②该温度下,各有机物组分占总有机物的含量随时间的变化曲线如图2所示,表示 (填有机物的结构简式),理由是 。反应II的平衡常数 (为以分压表示的平衡常数,分压=总压×物质的量分数)。
③为提高平衡时的产率,可采取的措施是 (填两条)。
18.甲醇是一种可再生能源,具有广泛的应用前景。工业上采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g) CH3OH(g) + H2O(g) ΔH2
(1)下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 250℃ 300℃ 350℃
K 2.04 0.25 0.012
①由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2
mol CO和6 mol H2充入2 L的密闭容器中,5 min后达到平衡,测得c(CO)=0.2 mol/L,则用H2表示的5min内该反应的反应速率v(H2)= mol·L-1·min-1,该温度下此反应的平衡常数为 ,此时的温度为 (从上表中选择)。
(2)一定条件下,将1 mol CO与 3 mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可提高CO转化率的是________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.恒容条件下充入He D.再充入适量的 H2
(3)为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 温度(℃) n(CO)/n(H2) 压强(MPa)
① a 1/2 0.2
② 200 b 5
③ 350 1/2 0.2
A.则上表中剩余的实验条件数据:a= 、b= 。
B.根据反应I的特点,下图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强py= MPa。
(4)上述反应中需要用到H2做反应物,以甲烷为原料制取氢气是常用的制氢方法。已知:
①CH4(g)
+ H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g)
+ CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
19.实验室利用等物质的量的反应物在恒容容器中模拟工业生产SO3,得到三组实验数据如下表所示:
实验 序号 温度 (℃) SO2浓度(mo1/L)
0min 10min 20min 30min 40min 50min 60min
1 300 2.00 1.70 1.50 1.36 1.25 1.20 1.20
2 300 2.00 1.50 1.28 1.20 1.20 1.20 1.20
3 500 2.00 1.60 1.39 1.29 1.27 1.27 1.27
(1)实验1中,50~60mn时间段,SO2浓度均为1.20mo1/L的原因是 。
(2)实验2中,前20min内以O2的浓度变化表示的化学反应速率为 。
(3)三组实验中,只有1、2中的某组使用了催化剂,则使用催化剂的为第 组,分析实验1、2中的数据,你认为催化剂 (填“能”或“不能”)改变SO2的平衡转化率,理由是 。
(4)分析表格中的数据,温度升高,SO2的平衡转化率会 (填“增大”“不变”或“减小”)。
20.
(1)过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图是与 恰好反应生成和过程中的能量变化示意图。
试写出和 反应的热化学方程式: ,该反应的活化能是 。
图 是某学生模仿图 画出的的能量变化示意图。则图中 , 。
(2)在密闭容器中充入 和 ,压强为,并在一定温度下使其发生反应:保持容器内气体压强不变,向其中加入 ,反应速率 填“变大”、“变小”或“不变”,平衡 移动填“向正反应方向”、“向逆反应方向”或“不”。
(3)T℃,向 密闭容器中加入 ,发生反应,物质的量随时间的变化如图所示。
该温度下,的平衡常数 。
相同温度下,若开始加入的物质的量是原来的倍,则 是原来的2倍。
平衡常数 的平衡浓度 达到平衡的时间 平衡时的体积分数
21.按要求回答下列问题。
氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。研究氮氧化物性质与转化,对于降低氮氧化物对环境的污染有重要意义。
(1)不同温度下,将一定量的NO2放入恒容密闭容器中发生下列反应:2NO2(g) 2NO(g)+O2(g),NO2的物质的量浓度与反应时间的关系如图所示:
①T1温度下,0~10s内,O2的反应速率v(O2)= 。
②在T2温度下,该反应的平衡常数KT2= ,当反应达到平衡时,继续向容器中充入c(NO2)=0.1mol L-1、c(NO)=0.2mol L-1、c(O2)=0.1mol L-1。此时正逆反应的速率大小关系是v正 v逆(填“>”、“<”或“=”)。
③下列说法正确的是 。
A.该反应正反应的活化能小于逆反应的活化能
B.使用合适的催化剂可以提高NO2的平衡转化率
C.平衡状态下,若充入NO,则达到新平衡时,正、逆反应速率都增大
D.平衡状态下,若保持温度不变,将容器体积增加一倍,则平衡逆向移动,反应物浓度增大
(2)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g) △H
上述反应分两步完成,其反应历程如图所示。
请回答下列问题:
反应Ⅰ和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是 (填“反应Ⅰ”或“反应Ⅱ”),请写出判断的理由 。
答案解析部分
1.【答案】C
【解析】【解答】离子反应的速率取决于溶液中离子的浓度和离子的扩散速率,受温度影响不大,是一类不需要活化能来引发的反应,所以答案选C。故答案为:C。
【分析】气体反应温度升高,反应速率加快,故A,B不符合题意。碳酸钙分解在高温条件下才能发生,温度对反应速率影响较大。
2.【答案】B
【解析】【解答】A.硫化氢溶液中存在 、 ,加入碱溶液,消耗氢离子,平衡正向移动S2-增加,所以A能用勒夏特列原理来解释;
B.加入催化剂,平衡不移动,故B不能用勒夏特列原理来解释;
C.加压合成氨反应正向移动,故C能用勒夏特列原理来解释;
D. ,增大氯离子浓度,平衡逆向移动氯气溶解度减小,故D能用勒夏特列原理来解释;
故答案为:B。
【分析】本题主要考查勒夏特列原理的相关知识。催化剂不能改变化学平衡状态反应物的组成,因此不能用勒夏特列原理解释。
3.【答案】A
【解析】【解答】A.在稀氨水中存在电离平衡:NH3·H2O+OH-,NH3·H2O电离产生OH-,对水的电离平衡起抑制作用。向溶液中加入NH4Cl固体,盐电离产生的使溶液中c()增大,NH3·H2O的电离平衡受到抑制作用,NH3·H2O电离程度减小,其对水电离的抑制作用减弱,使水的电离程度增大,故水的电离平衡正向移动,A符合题意;
B.向其中加入浓氨水,NH3·H2O的浓度增大,其电离产生的c(OH-)增大,对水的电离平衡的抑制作用增强,导致水的电离程度减弱,即水的电离平衡逆向移动,B不符合题意;
C.向其中加入NaOH固体,溶液中c(OH-)增大,对水的电离平衡的抑制作用增强,导致水的电离程度减弱,即水的电离平衡逆向移动,C不符合题意;
D.向其中加入Na2SO4,该物质是强酸强碱盐,不水解,对NH3·H2O+OH-的平衡移动无影响,因此对水的电离平衡也不影响,D不符合题意;
故答案为:A。
【分析】稀氨水会抑制水的电离,若想使水的电离平衡朝,即可以通过抑制一水合氨的电离或者和一水合氨发生反应,可以使水的电离平衡朝正向移动。
4.【答案】A
【解析】【解答】A.由于任何化学反应过程中都伴随着能量的变化,因此改变温度,平衡移动发生移动,A符合题意;
B.催化剂能同等程度的改变正逆反应速率,平衡不移动,B不符合题意;
C.若反应前后气体分子数不变,则改变体系压强,平衡不发生移动,C不符合题意;
D.增大反应物用量,若该反应为固体,由于固体的浓度为一常量,因此浓度不变,平衡不移动,D不符合题意;
故答案为:A
【分析】此题是对平衡移动影响因素的考查,结合浓度、温度、压强和催化剂对平衡移动的影响分析。
5.【答案】C
【解析】【解答】在温度不变的条件下,将容器的体积扩大到两倍,若平衡不移动,则A的浓度为0.25 mol·L-1;体积扩大两倍再次达到平衡时A的浓度为0.3 mol·L-1>0.25 mol·L-1,说明体积增大(减小压强),平衡向逆反应方向移动,因此,x+y>z,C的体积分数降低,B的转化率降低。
故答案为:C。
【分析】增大体积为原来的2倍,浓度应该变为原来的一半,即变为0.25mol·L-1,若是变为0.3mol·L-1,即A浓度增大,可以知道平衡朝逆向移动,增大压强,平衡朝气体系数缩小的方向移动。
6.【答案】A
【解析】【解答】若平衡不移动,将容器的体积扩大一倍,A的浓度应变为原来的一半(0.25mol/L),而A的浓度变为0.15 mol/L,即容器的体积扩大一倍(减小压强),A的浓度减小,平衡正向移动。
A.减小压强平衡正向移动,正向是气体体积增大的方向,可知x+yB.减小压强平衡正向移动,故B不符合题意;
C.减小压强平衡正向移动,A的转化率应增大,故C不符合题意;
D.减小压强平衡正向移动,C的体积分数应增大,故D不符合题意。
故答案为:A。
【分析】本题采用设定中间量的方法,
保持温度不变,将容器的体积扩大一倍, 若平衡不移动,则
A的浓度变为0.25 mol/L,但实际上A的浓度变为0.15 mol/L ,所以
将容器的体积扩大一倍 后平衡正移,体积扩大相当于减压,向气体系数之和变大的方向移动,所以A选项正确。
7.【答案】D
【解析】【解答】A.单位时间内生成xmolNO的同时,消耗xmolNH3,都表示正反应速率,不能体现正逆反应速率相等,因此不能说明反应达到平衡状态,A不符合题意;
B.达到平衡后,保持温度不变,减小容器体积,压强减小,平衡逆向移动,但平衡常数保持不变,B不符合题意;
C.降低温度,正逆反应速率都减小,由于该反应为放热反应,降低温度,平衡正向移动,C不符合题意;
D.其他条件不变,增加n(O2):n(NH3),n(O2)增大,平衡正向移动,NH3的转化率增大,D符合题意;
故答案为:D
【分析】A、生成NO的同时消耗NH3,表示的都是正反应;
B、平衡常数只与温度有关,温度不变,平衡常数不变;
C、降低温度,正逆反应速率都减小;
D、增加n(O2):n(NH3),则n(O2)增大,平衡正向移动;
8.【答案】D
【解析】【解答】A、步骤①微热时,溶液变为黄绿色,即反应生成[CuCl4]2-,说明升高温度,平衡正向移动,因此该反应为吸热反应,即ΔH>0,A不符合题意。
B、步骤②中置于冷水,温度降低,溶液变为蓝绿色,则反应生成[Cu(H2O)4]2+,说明降低温度,平衡逆向移动,B不符合题意。
C、由于该反应为可逆反应,因此步骤③深蓝色溶液中n([Cu(H2O)4]2+)<1mmol,C不符合题意。
D、步骤③中形成的深蓝色溶液为[Cu(NH3)4]2+,过程中[Cu(H2O)4]2+转化为[Cu(NH3)4]2+,说明稳定性:[Cu(NH3)4]2+>[Cu(H2O)4]2+,D符合题意。
故答案为:D
【分析】A、微热时温度升高,溶液变为黄绿色,则形成[CuCl4]2-,结合温度变化对平衡移动的影响分析反应的热效应。
B、置于冷水中,温度降低,溶液变为蓝绿色,则反应生成[Cu(H2O)4]2+。
C、该反应为可逆反应,物质无法完全转化。
D、步骤③中沉淀消失形成深蓝色溶液为[Cu(NH3)4]2+。
9.【答案】B
【解析】【解答】A.氯化铁为强酸弱碱盐,水解溶液呈酸性且为吸热过程,加热促进水解,生成氢氧化铁和盐酸,加热促进盐酸挥发,水解平衡正向移动得到氢氧化铁,可以用勒夏特列原理解释,故A不符合题意;
B.钢铁在潮湿的空气中容易生锈是因为形成电化学腐蚀,与勒夏特列原理无关,故B符合题意;
C.氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能用勒夏特列原理解释,故C不符合题意;
D.醋酸为弱电解质,存在弱电解质的电离平衡,加水促进电离,则将1mL pH=3的醋酸溶液加水稀释至100 mL,测得其pH<5,与勒夏特列原理有关,故D不符合题意;
故答案为:B。
【分析】勒夏特列原理即平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等)平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释。
10.【答案】D
【解析】【解答】A.由左图可知有 生成且Cl2含量降低,发生Cl2+Cl- ,A项不符合题意;
B.由图1知HClO浓度减小,Cl2溶解减小,Cl2+H2O H++Cl-+HClO,随Cl-增大,平衡逆向移动,B项不符合题意;
C.由c(HCl)增大,Cl2溶解浓度先微弱减小后增大,生成 促进Cl2溶解为主要反应,C项不符合题意;
D.由图1,2比较氢离子浓度增大,促进氯气溶解,但硫酸中有硫酸根离子,硫酸根离子对氯气溶解的影响未知,随硫酸的浓度增大,氯气溶解度无从判断,D项符合题意;
故答案为:D。
【分析】A.根据粒子 浓度变化的情况即可判断正误
B.根据图示氯化钠浓度增大,氯离子浓度增大,平衡左移
C.根据图1即可判断在盐酸溶液中时,主要形成了Cl3-促进氯气的溶解
D.根据比较1和2氢离子浓度增大以及氯离子浓度对氯气的溶解度的影响,但是硫酸根不确定对氯气溶解是否有影响
11.【答案】C
【解析】【解答】设n(A)=a,n(B)=a,达平衡时消耗n(A)为x。则
A(g)+ 2B(g) 2C(g)
起始 a a 0
转化 x 2x 2x
平衡 a-x a-2x 2x
由题意知:n(A)+n(B)=n(C)
即(a-x)+(a-2x)=2x
解得x= a,所以α(A)= ×100%=40%。
考
故答案为:C。
【分析】转化率也就是在该状态下,已经消耗的物质的量与原物质的量之比,根据三段式可以计算出。
12.【答案】A
【解析】【解答】A. 由2NO2(g) N2O4(g)可知,速率比等于方程式的计量数之比,平衡时,v(NO2消耗)=2v(N2O4消耗),故A符合题意;
B. 27℃时,该平衡体系中NO2的物质的量分数为20%,N2O4的物质的量分数为80%,设物质的量分别为0.2mol、0.8mol,由方程式可知,转化NO2的物质的量为1.6mol,则该平衡体系中NO2的转化率为=88.89%,故B不符合题意;
C. 由表中数据可知升高温度,NO2物质的量分数增大,N2O4物质的量分数减小,则平衡逆向移动,该反应的化学平衡常数减小,故C不符合题意;
D. 温度不变,缩小容器体积,浓度因体积缩小而增大,气体颜色加深,平衡正向移动,又使气体颜色在此基础上变浅,但达平衡时气体颜色比原来的要深,故D不符合题意;
故答案为:A。
【分析】B.根据计算;
C.升温平衡逆向移动;
D.缩小体积浓度增大,气体颜色加深,平衡正向移动,气体颜色逐渐变浅,达到平衡时气体颜色比原来深。
13.【答案】B
【解析】【解答】①浓氨水中存在可逆反应:NH3+H2O NH3·H2O NH4++OH-,加入NaOH固体后,溶液中c(OH-)增大,平衡逆向移动,产生NH3,可用化学平衡移动原理解释,不符合题意;
②合成氨反应为N2(g)+3H2(g)=2NH3(g),该反应为放热反应,升高温度,平衡逆向移动,因此从平衡移动角度分析,700K比室温更不利于合成氨反应,不能用化学平衡移动原理解释,符合题意;
③啤酒内存在可逆反应CO2+H2O H2CO3,开启啤酒瓶后,瓶内压强减小,平衡逆向移动,CO2逸出,产生大量泡沫,可用化学平衡移动原理解释,不符合题意;
④水的电离为H2O H++OH-,为吸热过程,升高温度,平衡正向移动,水的离子积Kw增大,可用化学平衡移动原理解释,不符合题意;
⑤该反应为气体分子数不变的反应,缩小容器体积,压强增大,但平衡不发生移动,体系颜色变深是由于浓度增大引起,不可用化学平衡移动原理解释,符合题意;
综上,不能用化学平衡移动原理解释的是②⑤,B符合题意;
故答案为:B
【分析】能用化学平衡移动原理解释,则需存在可逆反应,且同时存在平衡移动过程,据此分析所给事实是否能用平衡移动原理解释。
14.【答案】D
【解析】【解答】A.化学平衡状态为动态平衡,达到平衡时正、逆反应速率相等,但不等于0,A不符合题意;
B.该反应是可逆反应,反应物不可能完全转化,即 消耗不完全,B不符合题意;
C.增大 的浓度,平衡向正反应方向移动,该反应的限度增大,C不符合题意;
D.更换高效催化剂,增大活化分子百分数,该反应的化学反应速率增大,D符合题意;
故答案为:D。
【分析】A.化学平衡状态为动态平衡,反应速率不为0;
B.该反应是可逆反应,二氧化碳不可能完全消耗;
C.增大氢气浓度,反应正向移动;
D.催化剂可增大反应速率。
15.【答案】B
【解析】【解答】①由于该反应为吸热反应,因此升高温度,平衡正向移动,COCl2的转化率增大,①符合题意;
②恒容通入惰性气体,反应物和生成物的浓度不变,平衡不移动,COCl2的转化率不变,②不符合题意;
③增大CO的浓度,平衡逆向移动,COCl2的转化率减小,③不符合题意;
④由于该反应为气体分子数增大的反应,因此减小压强,平衡正向移动,COCl2的转化率增大,④符合题意;
⑤加入催化剂,反应速率增大,但平衡不移动,COCl2的转化率不变,⑤不符合题意;
⑥恒压通入惰性气体,反应容器的体积增大,相当于减小压强,平衡正向移动,COCl2的转化率增大,⑥不符合题意;
综上,上述操作中,能增大COCl2转化率的操作为①④⑥,B符合题意;
故答案为:B
【分析】能提高COCl2的转化率,则应使反应平衡正向移动,据此结合浓度、温度、压强、催化加对平衡移动的影响分析。
16.【答案】C
【解析】【解答】解:A、加压后体积变小,二氧化氮的浓度变化,平衡移动,使二氧化氮的浓度变小些,颜色变浅,A不符合题意;B、合成三氧化硫的反应是气体体积减小的反应,压强变大,有利于平衡正向移动,有利于合成三氧化硫,B不符合题意;
C、催化剂不会使平衡移动,所以不能用勒夏特列原理解释,C符合题意;
D、反应中钾是气体,移除气体钾,平衡正向移动,能用勒夏特列原理解释,D不符合题意。
故答案为:C
【分析】勒夏特列原理:改变影响化学平衡的一个条件,平衡就向着减弱这种改变的方向移动;
A、2NO2N2O4增大压强,向体积减小的方向移动,即向正反应移动,NO2先由于浓度变大,颜色变深,再由于平衡移动,NO2浓度减小,颜色变浅;
B、2SO2+O22SO3增大压强,平衡向体积减小的方向移动,生成SO3;
C、加催化剂能够提高反应速率,对平衡移动没有影响;
D、生成物中钾单质为气体,移去气体,能够使平衡向正方向移动;
17.【答案】(1)
(2)1.5;;达到平衡后生成的分压是,而总有机物的分压与起始时乙烯相同,为,故占总有机物的含量,对应曲线。;0.36;增大压强、及时移出CH2ClCH2Cl
【解析】【解答】(1)根据燃烧热数据,可写出以下热化学方程式:①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.6kJ·mol-1,②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH2=-890.3kJ·mol-1,③C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH3=-2219.9kJ·mol-1,根据盖斯定律可写出丙烷与氢气反应生成甲烷的热化学方程式:C3H8(g)+2H2(g)=3CH4(g) ΔH=-120.6kJ·mol-1,故答案为:C3H8(g)+2H2(g)=3CH4(g) ΔH=-120.6kJ·mol-1;
(2)①根据反应Ⅰ、Ⅱ,容器中总压的变化值=Δp(CH2ClCH2Cl),则前10min内,Δp(CH2ClCH2Cl)=80kPa-65kPa=15kPa,v(CH2ClCH2Cl)= ,故答案为:1.5;
②根据题意,起始时充入的乙烯与Cl2的物质的量相等,可知起始时乙烯、Cl2的分压均为40kPa,考虑到原子守恒,总有机物的分压始终等于乙烯的分压,即始终为40kPa,又因为容器中总压的变化值=Δp(CH2ClCH2Cl),可知达到平衡后Δp(CH2ClCH2Cl)=80kPa-60kPa=20kPa,即平衡后CH2ClCH2Cl占总有机物的含量为50%,与X曲线对应;同时可知Z曲线表示CH2=CHCl,曲线Y表示CH2=CH2,则平衡时p(CH2=CHCl)=40kPa×18.75%=7.5kPa,p(CH2=CH2)=40kPa×31.25%=12.5kPa,根据反应Ⅱ,平衡时p(HCl)= p(CH2=CHCl)=7.5kPa,根据反应Ⅰ、Ⅱ,平衡时p(Cl2)=p(CH2=CH2)=12.5kPa,反应Ⅱ的Kp= ,故答案为:CH2ClCH2Cl;达到平衡后生成CH2ClCH2Cl的分压是,而总有机物的分压与起始时乙烯相同,为,故CH2ClCH2Cl占总有机物的含量,对应曲线;0.36;
③增大压强、及时移出CH2ClCH2Cl,有利于反应Ⅰ的平衡向右移动,可提高CH2ClCH2Cl的产率,故答案为:增大压强、及时移出CH2ClCH2Cl。
【分析】(1)根据盖斯定律书写;
(2)①根据计算;
②利用“三段式”法计算
③根据影响化学平衡移动的因素分析。
18.【答案】(1)<;0.32;2.04;250℃
(2)B;D
(3)200;1/2;5
(4)CH4(g) + 2H2O(g) = CO2(g) + 4H2(g) ΔH = +165 kJ·mol-1
【解析】【解答】①由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应方向移动,正反应为放热反应,即△H1<0,
故答案为:<;②初始CO的浓度为2mol/2L=1mol/L; ,
;平衡常数 ,列三段式:
;平衡常数只有温度有关,温度相同平衡常数相同,对比表格数据可知此时温度为250℃;
故答案为:0.32;2.04;250℃;(2)①A、该反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应方向移动,甲醇的产率降低,故A错误;
B、将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,甲醇的产率增加,故B错误;
C、充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D、再充入mol H2,平衡向正反应方向移动,甲醇的产率增加,故D正确.
故答案为:BD;(3)A.采取控制变量法,探究合成甲醇的温度和压强的适宜条件,所以温度、压强是变化的,n(CO)/n(H2)应保持不变,所以b=1/2;比较使用1、2,压强不同,所以温度应相同,故a=200。
故答案为:200;1/2;
B.温度相同时,作垂直x轴的辅助线,发现压强为Py的CO的转化率高,反应为前后体积减小的反应,压强增大平衡向体积减小的方向移动,即向正反应移动,所以Px<Py,所以压强px=5MPa.
故答案为:5;(4)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ mol-1
②CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ mol-1
依据盖斯定律计算,①×2-②则CH4和H2O(g)反应生成CO2和H2的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0 kJ mol-1;
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0 kJ mol-1;
【分析】(1)①由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应方向移动,正反应为放热反应;②根据 进行计算;根据 计算平衡常数;(2)容器容积不变,增加CO转化率,平衡向正反应移动,根据外界条件对平衡的影响分析.(3)A. 采取控制变量法,探究合成甲醇的温度和压强的适宜条件,据此判断a、b的值;
B. 根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时CO的转化率,由此判断。(4)根据盖斯定律计算;
19.【答案】(1)反应达到平衡状态
(2)0.018
(3)2;不能;催化剂只缩短了反应达到平衡的时间,二氧化硫的平衡浓度没有改变
(4)减小
【解析】【解答】(1)实验1中,50~60min时间段,SO2浓度不再发生改变,均为1.20mo1/L,原因是反应达到平衡状态;(2)实验2中,前20min内以SO2 浓度变化表示的化学反应速率为 ,以O2的浓度变化表示的化学反应速率为 ;(3)催化剂能够加快反应速率,单位时间内,第二组二氧化硫的减小量更大,故第2组使用了催化剂,催化剂只缩短了反应达到平衡的时间,不能改变平衡转化率;(4)对比实验1和实验3,温度高的实验3达到平衡时,二氧化硫的剩余量更多,可得到结论温度升高,SO2的平衡转化率会减小。
【分析】工业生产SO3的化学方程式为2SO2+O2=2SO3。
20.【答案】(1);134;368;234
(2)变小;不
(3);b
【解析】【解答】(1)结合图1进行判断,根据公式△H=反应物总键能-生成物总键能,带入图1数据,即△H=134kJ·mol-1-368kJ·mol-1=-234kJ·mol-1,即;活化能可以结合反应物能量升高的部分判断,即活化能为 134 kJ·mol-1;两个过程为相反的过程,因此反应物和生成物的键能相反,即E3=368kJ·mol-1,E4=234kJ·mol-1;
(2)恒压条件下,充入不反应的气体,体积增大,速率减小,但是由于左右两边气体的化学计量数相同,则平衡不移动;
(3)①结合图3,可以知道平衡时刻H2的物质的量为0.1mol,结合三段式判断,即
2HI H2+ I2
起始(mol/L) 1 0 0
转化(mol/L) 0.2 0.1 0.1
平衡(mol/L) 0.8 0.1 0.1
结合化学平衡常数K=生成物浓度幂之积/反应物浓度幂之积,可以知道;
② 恒容条件下,左右两边化学计量数相同,充入2倍碘化氢,平衡不移动,浓度为原来的2倍。
【分析】(1)△H=反应物总键能-生成物总键能=生成物总内能-反应物总内能;
(2)恒压条件下,通入不反应的气体,体积增大,平衡朝气体体积增大的反响移动;
(3) ① 化学平衡常数K=生成物浓度幂之积/反应物浓度幂之积;
②左右两边化学计量数相同,因此压强和体积不影响平衡移动。
21.【答案】(1)0.02mol L-1 s-1;0.8;<;C
(2)反应Ⅱ;反应Ⅱ的活化能大于反应Ⅰ的活化能,反应Ⅱ断键时需要更多的能量,反应速率慢
【解析】【解答】①由图可知,T1温度下,0~10s内,O2的反应速率v(O2)= 0.02mol L-1 s-1。
②在T2温度下,该反应的平衡常数KT2= ,当反应达到平衡时,继续向容器中充入c(NO2)=0.1mol L-1、c(NO)=0.2mol L-1、c(O2)=0.1mol L-1,此时浓度商Q=T2,升高温度,二氧化氮转化率升高,反应正向移动,即反应正向为吸热反应,反应物能量小于生成物总能量,即该反应正反应的活化能大于逆反应的活化能,A不正确;
B.使用合适的催化剂不改变平衡转化率,B不正确;
C.平衡状态下,若充入NO,则达到新平衡时,正、逆反应速率都增大,C正确;
D.平衡状态下,若保持温度不变,将容器体积增加一倍,根据勒夏特列原理可知,平衡逆向移动,但反应物浓度增大,D不正确。
综上所述,说法正确的是C。(2)反应Ⅰ和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是反应Ⅱ,反应Ⅱ的活化能大于反应Ⅰ的活化能,反应Ⅱ断键时需要更多的能量,反应速率慢。
【分析】根据平衡常数公式计算K,通过比较浓度商与平衡常数的比较判断反应进行方向;根据NO2的物质的量浓度与反应时间的关系图可知,两体系温度高低进而判断反应热。
一、单选题
1.下列反应的速率受温度影响不大,主要决定于浓度和扩散速率的是( )
A.N2(g)+3H2(g) 2NH3(g) ΔH<0
B.2H2(g)+O2(g) 2H2O(l) ΔH<0
C.H+ (aq)+ OH-(aq)=H2O(l) ΔH<0
D.CaCO3(s)=CaO(s)+ CO2 (g) ΔH >0
2.下列事实不能用勒夏特列原理来解释的是( )
A.往硫化氢水溶液中加碱有利于S2-增加
B.加入催化剂有利于氨氧化反应
C.高压有利于合成氨反应
D.氯气在饱和食盐水中的溶解度小于在水中的溶解度
3.向稀氨水中分别加入以下物质,水的电离平衡会正向移动的是( )
A.NH4Cl B.浓氨水 C.NaOH D.Na2SO4
4.对于某可逆反应平衡体系,下列措施一定会使平衡移动的是( )
A.升高温度 B.使用催化剂
C.改变体系压强 D.增大反应物用量
5.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g),达到平衡时,测得A的浓度为0.5mol·L 1,在温度不变的条件下,将容器的体积扩大到两倍,再达到平衡,测得A的浓度降低为0.3mol·L 1。下列有关判断正确的是( )
A.x+y
6.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的体积扩大一倍,测得A的浓度变为0.15 mol/L,下列有关判断正确的是( )
A.x+y<z B.平衡逆向移动
C.A的转化率降低 D.C的体积分数减小
7.对可逆反应,下列叙述正确的是( )
A.若单位时间内生成的同时,消耗,则反应达到平衡状态
B.达到平衡后,保持温度不变,减小容器体积增大压强,平衡逆向移动,减小
C.降低温度,正反应速率增大,逆反应速率减少,平衡正向移动
D.其它条件不变,若增加的量,可以提高的转化率
8.已知: 。试管 a 中溶液作参照,对试管 b 中溶液依次进行如下操作:①微热,溶液变为黄绿色;②将其置于冷水中,溶液变为蓝绿色;③滴加氨水至过量,蓝色沉淀增多,后又逐渐消失变为深蓝色溶液。下列说法正确的是( )
A.由步骤①可推知该反应的△H< 0
B.由步骤②可说明降低温度,该反应平衡正向移动
C.步骤③深蓝色溶液中
D.由实验③可知配离子的稳定性:
9.下列事实不能用勒夏特列原理解释的是( )
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C.实验室可用排饱和食盐水的方法收集氯气
D.常温下,将1mLpH=3的醋酸溶液加水稀释至100mL,测得其pH<5
10.相同温度和压强下,研究 在不同溶液中的溶解度(用溶解 的物质的量浓度表示)随溶液浓度的变化。在 溶液和盐酸中 的溶解度以及各种含氯微粒的浓度变化如图。
下列说法错误的是( )
A.由图1可知, 溶于 溶液时还发生了反应
B.随 溶液浓度增大, 平衡逆移, 溶解度减小
C.随盐酸浓度增加 与 的反应被抑制,生成 为主要反应从而促进 溶解
D.由上述实验可知, 浓度增大促进 溶解,由此推知在稀硫酸中,随硫酸浓度增大 的溶解度会增大
11.在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g) 2C(g),反应达平衡,若混合气体中A和B的物质的量之和与C的物质的量相等,此时A的转化率为( )
A.60% B.50% C.40% D.70%
12.向某密闭容器中充入NO2,发生反应:2NO2(g) N2O4(g)(已知:N2O4为无色气体)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:
/℃ 27 35 49 70
NO2% 20 25 40 66
N2O4% 80 75 60 34
下列说法正确的是( )
A.平衡时,v(NO2消耗)=2v(N2O4消耗)
B.27℃时,该平衡体系中NO2的转化率为80%
C.升高温度,该反应的化学平衡常数增大
D.温度不变,缩小容器体积,达平衡时气体颜色变浅
13.下列事实中,不能应用化学平衡移动原理来解释的是( )
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI (g) H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
A.②③⑤ B.②⑤ C.④⑤ D.①②③
14.在一定温度和压强下的密闭容器中,有吸热反应 发生。下列叙述正确的是( )
A.反应达到平衡后,正、逆反应均停止
B.一定时间后, 消耗完全
C.增大 的浓度,该反应的限度不会改变
D.更换高效催化剂,该反应的化学反应速率增大
15.COCl2(g) CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
16.下列叙述或变化,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.加入催化剂有利于氨的合成
D.工业制取金属钾的反应为:Na(l)+KCl(l) NaCl(l)+K(g)
二、综合题
17.石油炼厂气(小分子烷烃和烯烃)的综合利用是当今社会发展的需要。
(1)已知一些物质的燃烧热如下表:
物质
燃烧热 -393.5 -285.8 -890.3 -1559.8 -2219.9
写出丙烷与氢气反应生成甲烷的热化学方程式: 。
(2)1,2-二氯乙烷()常用于制造乙酰纤维、烟草萃取剂、熏蒸剂。工业上可用乙烯加成法制备1,2-二氯乙烷,主要副产物为氯乙烯(),反应原理如下:
I.
II.
下,向某恒容密闭容器中充入等物质的量的和,在催化剂作用下发生反应,容器内气体的压强随时间的变化如图1所示。
①前内用表示的平均反应速率 。
②该温度下,各有机物组分占总有机物的含量随时间的变化曲线如图2所示,表示 (填有机物的结构简式),理由是 。反应II的平衡常数 (为以分压表示的平衡常数,分压=总压×物质的量分数)。
③为提高平衡时的产率,可采取的措施是 (填两条)。
18.甲醇是一种可再生能源,具有广泛的应用前景。工业上采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g) CH3OH(g) + H2O(g) ΔH2
(1)下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 250℃ 300℃ 350℃
K 2.04 0.25 0.012
①由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2
mol CO和6 mol H2充入2 L的密闭容器中,5 min后达到平衡,测得c(CO)=0.2 mol/L,则用H2表示的5min内该反应的反应速率v(H2)= mol·L-1·min-1,该温度下此反应的平衡常数为 ,此时的温度为 (从上表中选择)。
(2)一定条件下,将1 mol CO与 3 mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可提高CO转化率的是________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.恒容条件下充入He D.再充入适量的 H2
(3)为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 温度(℃) n(CO)/n(H2) 压强(MPa)
① a 1/2 0.2
② 200 b 5
③ 350 1/2 0.2
A.则上表中剩余的实验条件数据:a= 、b= 。
B.根据反应I的特点,下图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强py= MPa。
(4)上述反应中需要用到H2做反应物,以甲烷为原料制取氢气是常用的制氢方法。已知:
①CH4(g)
+ H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g)
+ CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
19.实验室利用等物质的量的反应物在恒容容器中模拟工业生产SO3,得到三组实验数据如下表所示:
实验 序号 温度 (℃) SO2浓度(mo1/L)
0min 10min 20min 30min 40min 50min 60min
1 300 2.00 1.70 1.50 1.36 1.25 1.20 1.20
2 300 2.00 1.50 1.28 1.20 1.20 1.20 1.20
3 500 2.00 1.60 1.39 1.29 1.27 1.27 1.27
(1)实验1中,50~60mn时间段,SO2浓度均为1.20mo1/L的原因是 。
(2)实验2中,前20min内以O2的浓度变化表示的化学反应速率为 。
(3)三组实验中,只有1、2中的某组使用了催化剂,则使用催化剂的为第 组,分析实验1、2中的数据,你认为催化剂 (填“能”或“不能”)改变SO2的平衡转化率,理由是 。
(4)分析表格中的数据,温度升高,SO2的平衡转化率会 (填“增大”“不变”或“减小”)。
20.
(1)过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图是与 恰好反应生成和过程中的能量变化示意图。
试写出和 反应的热化学方程式: ,该反应的活化能是 。
图 是某学生模仿图 画出的的能量变化示意图。则图中 , 。
(2)在密闭容器中充入 和 ,压强为,并在一定温度下使其发生反应:保持容器内气体压强不变,向其中加入 ,反应速率 填“变大”、“变小”或“不变”,平衡 移动填“向正反应方向”、“向逆反应方向”或“不”。
(3)T℃,向 密闭容器中加入 ,发生反应,物质的量随时间的变化如图所示。
该温度下,的平衡常数 。
相同温度下,若开始加入的物质的量是原来的倍,则 是原来的2倍。
平衡常数 的平衡浓度 达到平衡的时间 平衡时的体积分数
21.按要求回答下列问题。
氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。研究氮氧化物性质与转化,对于降低氮氧化物对环境的污染有重要意义。
(1)不同温度下,将一定量的NO2放入恒容密闭容器中发生下列反应:2NO2(g) 2NO(g)+O2(g),NO2的物质的量浓度与反应时间的关系如图所示:
①T1温度下,0~10s内,O2的反应速率v(O2)= 。
②在T2温度下,该反应的平衡常数KT2= ,当反应达到平衡时,继续向容器中充入c(NO2)=0.1mol L-1、c(NO)=0.2mol L-1、c(O2)=0.1mol L-1。此时正逆反应的速率大小关系是v正 v逆(填“>”、“<”或“=”)。
③下列说法正确的是 。
A.该反应正反应的活化能小于逆反应的活化能
B.使用合适的催化剂可以提高NO2的平衡转化率
C.平衡状态下,若充入NO,则达到新平衡时,正、逆反应速率都增大
D.平衡状态下,若保持温度不变,将容器体积增加一倍,则平衡逆向移动,反应物浓度增大
(2)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g) △H
上述反应分两步完成,其反应历程如图所示。
请回答下列问题:
反应Ⅰ和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是 (填“反应Ⅰ”或“反应Ⅱ”),请写出判断的理由 。
答案解析部分
1.【答案】C
【解析】【解答】离子反应的速率取决于溶液中离子的浓度和离子的扩散速率,受温度影响不大,是一类不需要活化能来引发的反应,所以答案选C。故答案为:C。
【分析】气体反应温度升高,反应速率加快,故A,B不符合题意。碳酸钙分解在高温条件下才能发生,温度对反应速率影响较大。
2.【答案】B
【解析】【解答】A.硫化氢溶液中存在 、 ,加入碱溶液,消耗氢离子,平衡正向移动S2-增加,所以A能用勒夏特列原理来解释;
B.加入催化剂,平衡不移动,故B不能用勒夏特列原理来解释;
C.加压合成氨反应正向移动,故C能用勒夏特列原理来解释;
D. ,增大氯离子浓度,平衡逆向移动氯气溶解度减小,故D能用勒夏特列原理来解释;
故答案为:B。
【分析】本题主要考查勒夏特列原理的相关知识。催化剂不能改变化学平衡状态反应物的组成,因此不能用勒夏特列原理解释。
3.【答案】A
【解析】【解答】A.在稀氨水中存在电离平衡:NH3·H2O+OH-,NH3·H2O电离产生OH-,对水的电离平衡起抑制作用。向溶液中加入NH4Cl固体,盐电离产生的使溶液中c()增大,NH3·H2O的电离平衡受到抑制作用,NH3·H2O电离程度减小,其对水电离的抑制作用减弱,使水的电离程度增大,故水的电离平衡正向移动,A符合题意;
B.向其中加入浓氨水,NH3·H2O的浓度增大,其电离产生的c(OH-)增大,对水的电离平衡的抑制作用增强,导致水的电离程度减弱,即水的电离平衡逆向移动,B不符合题意;
C.向其中加入NaOH固体,溶液中c(OH-)增大,对水的电离平衡的抑制作用增强,导致水的电离程度减弱,即水的电离平衡逆向移动,C不符合题意;
D.向其中加入Na2SO4,该物质是强酸强碱盐,不水解,对NH3·H2O+OH-的平衡移动无影响,因此对水的电离平衡也不影响,D不符合题意;
故答案为:A。
【分析】稀氨水会抑制水的电离,若想使水的电离平衡朝,即可以通过抑制一水合氨的电离或者和一水合氨发生反应,可以使水的电离平衡朝正向移动。
4.【答案】A
【解析】【解答】A.由于任何化学反应过程中都伴随着能量的变化,因此改变温度,平衡移动发生移动,A符合题意;
B.催化剂能同等程度的改变正逆反应速率,平衡不移动,B不符合题意;
C.若反应前后气体分子数不变,则改变体系压强,平衡不发生移动,C不符合题意;
D.增大反应物用量,若该反应为固体,由于固体的浓度为一常量,因此浓度不变,平衡不移动,D不符合题意;
故答案为:A
【分析】此题是对平衡移动影响因素的考查,结合浓度、温度、压强和催化剂对平衡移动的影响分析。
5.【答案】C
【解析】【解答】在温度不变的条件下,将容器的体积扩大到两倍,若平衡不移动,则A的浓度为0.25 mol·L-1;体积扩大两倍再次达到平衡时A的浓度为0.3 mol·L-1>0.25 mol·L-1,说明体积增大(减小压强),平衡向逆反应方向移动,因此,x+y>z,C的体积分数降低,B的转化率降低。
故答案为:C。
【分析】增大体积为原来的2倍,浓度应该变为原来的一半,即变为0.25mol·L-1,若是变为0.3mol·L-1,即A浓度增大,可以知道平衡朝逆向移动,增大压强,平衡朝气体系数缩小的方向移动。
6.【答案】A
【解析】【解答】若平衡不移动,将容器的体积扩大一倍,A的浓度应变为原来的一半(0.25mol/L),而A的浓度变为0.15 mol/L,即容器的体积扩大一倍(减小压强),A的浓度减小,平衡正向移动。
A.减小压强平衡正向移动,正向是气体体积增大的方向,可知x+y
C.减小压强平衡正向移动,A的转化率应增大,故C不符合题意;
D.减小压强平衡正向移动,C的体积分数应增大,故D不符合题意。
故答案为:A。
【分析】本题采用设定中间量的方法,
保持温度不变,将容器的体积扩大一倍, 若平衡不移动,则
A的浓度变为0.25 mol/L,但实际上A的浓度变为0.15 mol/L ,所以
将容器的体积扩大一倍 后平衡正移,体积扩大相当于减压,向气体系数之和变大的方向移动,所以A选项正确。
7.【答案】D
【解析】【解答】A.单位时间内生成xmolNO的同时,消耗xmolNH3,都表示正反应速率,不能体现正逆反应速率相等,因此不能说明反应达到平衡状态,A不符合题意;
B.达到平衡后,保持温度不变,减小容器体积,压强减小,平衡逆向移动,但平衡常数保持不变,B不符合题意;
C.降低温度,正逆反应速率都减小,由于该反应为放热反应,降低温度,平衡正向移动,C不符合题意;
D.其他条件不变,增加n(O2):n(NH3),n(O2)增大,平衡正向移动,NH3的转化率增大,D符合题意;
故答案为:D
【分析】A、生成NO的同时消耗NH3,表示的都是正反应;
B、平衡常数只与温度有关,温度不变,平衡常数不变;
C、降低温度,正逆反应速率都减小;
D、增加n(O2):n(NH3),则n(O2)增大,平衡正向移动;
8.【答案】D
【解析】【解答】A、步骤①微热时,溶液变为黄绿色,即反应生成[CuCl4]2-,说明升高温度,平衡正向移动,因此该反应为吸热反应,即ΔH>0,A不符合题意。
B、步骤②中置于冷水,温度降低,溶液变为蓝绿色,则反应生成[Cu(H2O)4]2+,说明降低温度,平衡逆向移动,B不符合题意。
C、由于该反应为可逆反应,因此步骤③深蓝色溶液中n([Cu(H2O)4]2+)<1mmol,C不符合题意。
D、步骤③中形成的深蓝色溶液为[Cu(NH3)4]2+,过程中[Cu(H2O)4]2+转化为[Cu(NH3)4]2+,说明稳定性:[Cu(NH3)4]2+>[Cu(H2O)4]2+,D符合题意。
故答案为:D
【分析】A、微热时温度升高,溶液变为黄绿色,则形成[CuCl4]2-,结合温度变化对平衡移动的影响分析反应的热效应。
B、置于冷水中,温度降低,溶液变为蓝绿色,则反应生成[Cu(H2O)4]2+。
C、该反应为可逆反应,物质无法完全转化。
D、步骤③中沉淀消失形成深蓝色溶液为[Cu(NH3)4]2+。
9.【答案】B
【解析】【解答】A.氯化铁为强酸弱碱盐,水解溶液呈酸性且为吸热过程,加热促进水解,生成氢氧化铁和盐酸,加热促进盐酸挥发,水解平衡正向移动得到氢氧化铁,可以用勒夏特列原理解释,故A不符合题意;
B.钢铁在潮湿的空气中容易生锈是因为形成电化学腐蚀,与勒夏特列原理无关,故B符合题意;
C.氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能用勒夏特列原理解释,故C不符合题意;
D.醋酸为弱电解质,存在弱电解质的电离平衡,加水促进电离,则将1mL pH=3的醋酸溶液加水稀释至100 mL,测得其pH<5,与勒夏特列原理有关,故D不符合题意;
故答案为:B。
【分析】勒夏特列原理即平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等)平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释。
10.【答案】D
【解析】【解答】A.由左图可知有 生成且Cl2含量降低,发生Cl2+Cl- ,A项不符合题意;
B.由图1知HClO浓度减小,Cl2溶解减小,Cl2+H2O H++Cl-+HClO,随Cl-增大,平衡逆向移动,B项不符合题意;
C.由c(HCl)增大,Cl2溶解浓度先微弱减小后增大,生成 促进Cl2溶解为主要反应,C项不符合题意;
D.由图1,2比较氢离子浓度增大,促进氯气溶解,但硫酸中有硫酸根离子,硫酸根离子对氯气溶解的影响未知,随硫酸的浓度增大,氯气溶解度无从判断,D项符合题意;
故答案为:D。
【分析】A.根据粒子 浓度变化的情况即可判断正误
B.根据图示氯化钠浓度增大,氯离子浓度增大,平衡左移
C.根据图1即可判断在盐酸溶液中时,主要形成了Cl3-促进氯气的溶解
D.根据比较1和2氢离子浓度增大以及氯离子浓度对氯气的溶解度的影响,但是硫酸根不确定对氯气溶解是否有影响
11.【答案】C
【解析】【解答】设n(A)=a,n(B)=a,达平衡时消耗n(A)为x。则
A(g)+ 2B(g) 2C(g)
起始 a a 0
转化 x 2x 2x
平衡 a-x a-2x 2x
由题意知:n(A)+n(B)=n(C)
即(a-x)+(a-2x)=2x
解得x= a,所以α(A)= ×100%=40%。
考
故答案为:C。
【分析】转化率也就是在该状态下,已经消耗的物质的量与原物质的量之比,根据三段式可以计算出。
12.【答案】A
【解析】【解答】A. 由2NO2(g) N2O4(g)可知,速率比等于方程式的计量数之比,平衡时,v(NO2消耗)=2v(N2O4消耗),故A符合题意;
B. 27℃时,该平衡体系中NO2的物质的量分数为20%,N2O4的物质的量分数为80%,设物质的量分别为0.2mol、0.8mol,由方程式可知,转化NO2的物质的量为1.6mol,则该平衡体系中NO2的转化率为=88.89%,故B不符合题意;
C. 由表中数据可知升高温度,NO2物质的量分数增大,N2O4物质的量分数减小,则平衡逆向移动,该反应的化学平衡常数减小,故C不符合题意;
D. 温度不变,缩小容器体积,浓度因体积缩小而增大,气体颜色加深,平衡正向移动,又使气体颜色在此基础上变浅,但达平衡时气体颜色比原来的要深,故D不符合题意;
故答案为:A。
【分析】B.根据计算;
C.升温平衡逆向移动;
D.缩小体积浓度增大,气体颜色加深,平衡正向移动,气体颜色逐渐变浅,达到平衡时气体颜色比原来深。
13.【答案】B
【解析】【解答】①浓氨水中存在可逆反应:NH3+H2O NH3·H2O NH4++OH-,加入NaOH固体后,溶液中c(OH-)增大,平衡逆向移动,产生NH3,可用化学平衡移动原理解释,不符合题意;
②合成氨反应为N2(g)+3H2(g)=2NH3(g),该反应为放热反应,升高温度,平衡逆向移动,因此从平衡移动角度分析,700K比室温更不利于合成氨反应,不能用化学平衡移动原理解释,符合题意;
③啤酒内存在可逆反应CO2+H2O H2CO3,开启啤酒瓶后,瓶内压强减小,平衡逆向移动,CO2逸出,产生大量泡沫,可用化学平衡移动原理解释,不符合题意;
④水的电离为H2O H++OH-,为吸热过程,升高温度,平衡正向移动,水的离子积Kw增大,可用化学平衡移动原理解释,不符合题意;
⑤该反应为气体分子数不变的反应,缩小容器体积,压强增大,但平衡不发生移动,体系颜色变深是由于浓度增大引起,不可用化学平衡移动原理解释,符合题意;
综上,不能用化学平衡移动原理解释的是②⑤,B符合题意;
故答案为:B
【分析】能用化学平衡移动原理解释,则需存在可逆反应,且同时存在平衡移动过程,据此分析所给事实是否能用平衡移动原理解释。
14.【答案】D
【解析】【解答】A.化学平衡状态为动态平衡,达到平衡时正、逆反应速率相等,但不等于0,A不符合题意;
B.该反应是可逆反应,反应物不可能完全转化,即 消耗不完全,B不符合题意;
C.增大 的浓度,平衡向正反应方向移动,该反应的限度增大,C不符合题意;
D.更换高效催化剂,增大活化分子百分数,该反应的化学反应速率增大,D符合题意;
故答案为:D。
【分析】A.化学平衡状态为动态平衡,反应速率不为0;
B.该反应是可逆反应,二氧化碳不可能完全消耗;
C.增大氢气浓度,反应正向移动;
D.催化剂可增大反应速率。
15.【答案】B
【解析】【解答】①由于该反应为吸热反应,因此升高温度,平衡正向移动,COCl2的转化率增大,①符合题意;
②恒容通入惰性气体,反应物和生成物的浓度不变,平衡不移动,COCl2的转化率不变,②不符合题意;
③增大CO的浓度,平衡逆向移动,COCl2的转化率减小,③不符合题意;
④由于该反应为气体分子数增大的反应,因此减小压强,平衡正向移动,COCl2的转化率增大,④符合题意;
⑤加入催化剂,反应速率增大,但平衡不移动,COCl2的转化率不变,⑤不符合题意;
⑥恒压通入惰性气体,反应容器的体积增大,相当于减小压强,平衡正向移动,COCl2的转化率增大,⑥不符合题意;
综上,上述操作中,能增大COCl2转化率的操作为①④⑥,B符合题意;
故答案为:B
【分析】能提高COCl2的转化率,则应使反应平衡正向移动,据此结合浓度、温度、压强、催化加对平衡移动的影响分析。
16.【答案】C
【解析】【解答】解:A、加压后体积变小,二氧化氮的浓度变化,平衡移动,使二氧化氮的浓度变小些,颜色变浅,A不符合题意;B、合成三氧化硫的反应是气体体积减小的反应,压强变大,有利于平衡正向移动,有利于合成三氧化硫,B不符合题意;
C、催化剂不会使平衡移动,所以不能用勒夏特列原理解释,C符合题意;
D、反应中钾是气体,移除气体钾,平衡正向移动,能用勒夏特列原理解释,D不符合题意。
故答案为:C
【分析】勒夏特列原理:改变影响化学平衡的一个条件,平衡就向着减弱这种改变的方向移动;
A、2NO2N2O4增大压强,向体积减小的方向移动,即向正反应移动,NO2先由于浓度变大,颜色变深,再由于平衡移动,NO2浓度减小,颜色变浅;
B、2SO2+O22SO3增大压强,平衡向体积减小的方向移动,生成SO3;
C、加催化剂能够提高反应速率,对平衡移动没有影响;
D、生成物中钾单质为气体,移去气体,能够使平衡向正方向移动;
17.【答案】(1)
(2)1.5;;达到平衡后生成的分压是,而总有机物的分压与起始时乙烯相同,为,故占总有机物的含量,对应曲线。;0.36;增大压强、及时移出CH2ClCH2Cl
【解析】【解答】(1)根据燃烧热数据,可写出以下热化学方程式:①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.6kJ·mol-1,②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH2=-890.3kJ·mol-1,③C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH3=-2219.9kJ·mol-1,根据盖斯定律可写出丙烷与氢气反应生成甲烷的热化学方程式:C3H8(g)+2H2(g)=3CH4(g) ΔH=-120.6kJ·mol-1,故答案为:C3H8(g)+2H2(g)=3CH4(g) ΔH=-120.6kJ·mol-1;
(2)①根据反应Ⅰ、Ⅱ,容器中总压的变化值=Δp(CH2ClCH2Cl),则前10min内,Δp(CH2ClCH2Cl)=80kPa-65kPa=15kPa,v(CH2ClCH2Cl)= ,故答案为:1.5;
②根据题意,起始时充入的乙烯与Cl2的物质的量相等,可知起始时乙烯、Cl2的分压均为40kPa,考虑到原子守恒,总有机物的分压始终等于乙烯的分压,即始终为40kPa,又因为容器中总压的变化值=Δp(CH2ClCH2Cl),可知达到平衡后Δp(CH2ClCH2Cl)=80kPa-60kPa=20kPa,即平衡后CH2ClCH2Cl占总有机物的含量为50%,与X曲线对应;同时可知Z曲线表示CH2=CHCl,曲线Y表示CH2=CH2,则平衡时p(CH2=CHCl)=40kPa×18.75%=7.5kPa,p(CH2=CH2)=40kPa×31.25%=12.5kPa,根据反应Ⅱ,平衡时p(HCl)= p(CH2=CHCl)=7.5kPa,根据反应Ⅰ、Ⅱ,平衡时p(Cl2)=p(CH2=CH2)=12.5kPa,反应Ⅱ的Kp= ,故答案为:CH2ClCH2Cl;达到平衡后生成CH2ClCH2Cl的分压是,而总有机物的分压与起始时乙烯相同,为,故CH2ClCH2Cl占总有机物的含量,对应曲线;0.36;
③增大压强、及时移出CH2ClCH2Cl,有利于反应Ⅰ的平衡向右移动,可提高CH2ClCH2Cl的产率,故答案为:增大压强、及时移出CH2ClCH2Cl。
【分析】(1)根据盖斯定律书写;
(2)①根据计算;
②利用“三段式”法计算
③根据影响化学平衡移动的因素分析。
18.【答案】(1)<;0.32;2.04;250℃
(2)B;D
(3)200;1/2;5
(4)CH4(g) + 2H2O(g) = CO2(g) + 4H2(g) ΔH = +165 kJ·mol-1
【解析】【解答】①由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应方向移动,正反应为放热反应,即△H1<0,
故答案为:<;②初始CO的浓度为2mol/2L=1mol/L; ,
;平衡常数 ,列三段式:
;平衡常数只有温度有关,温度相同平衡常数相同,对比表格数据可知此时温度为250℃;
故答案为:0.32;2.04;250℃;(2)①A、该反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应方向移动,甲醇的产率降低,故A错误;
B、将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,甲醇的产率增加,故B错误;
C、充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D、再充入mol H2,平衡向正反应方向移动,甲醇的产率增加,故D正确.
故答案为:BD;(3)A.采取控制变量法,探究合成甲醇的温度和压强的适宜条件,所以温度、压强是变化的,n(CO)/n(H2)应保持不变,所以b=1/2;比较使用1、2,压强不同,所以温度应相同,故a=200。
故答案为:200;1/2;
B.温度相同时,作垂直x轴的辅助线,发现压强为Py的CO的转化率高,反应为前后体积减小的反应,压强增大平衡向体积减小的方向移动,即向正反应移动,所以Px<Py,所以压强px=5MPa.
故答案为:5;(4)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ mol-1
②CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ mol-1
依据盖斯定律计算,①×2-②则CH4和H2O(g)反应生成CO2和H2的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0 kJ mol-1;
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0 kJ mol-1;
【分析】(1)①由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应方向移动,正反应为放热反应;②根据 进行计算;根据 计算平衡常数;(2)容器容积不变,增加CO转化率,平衡向正反应移动,根据外界条件对平衡的影响分析.(3)A. 采取控制变量法,探究合成甲醇的温度和压强的适宜条件,据此判断a、b的值;
B. 根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时CO的转化率,由此判断。(4)根据盖斯定律计算;
19.【答案】(1)反应达到平衡状态
(2)0.018
(3)2;不能;催化剂只缩短了反应达到平衡的时间,二氧化硫的平衡浓度没有改变
(4)减小
【解析】【解答】(1)实验1中,50~60min时间段,SO2浓度不再发生改变,均为1.20mo1/L,原因是反应达到平衡状态;(2)实验2中,前20min内以SO2 浓度变化表示的化学反应速率为 ,以O2的浓度变化表示的化学反应速率为 ;(3)催化剂能够加快反应速率,单位时间内,第二组二氧化硫的减小量更大,故第2组使用了催化剂,催化剂只缩短了反应达到平衡的时间,不能改变平衡转化率;(4)对比实验1和实验3,温度高的实验3达到平衡时,二氧化硫的剩余量更多,可得到结论温度升高,SO2的平衡转化率会减小。
【分析】工业生产SO3的化学方程式为2SO2+O2=2SO3。
20.【答案】(1);134;368;234
(2)变小;不
(3);b
【解析】【解答】(1)结合图1进行判断,根据公式△H=反应物总键能-生成物总键能,带入图1数据,即△H=134kJ·mol-1-368kJ·mol-1=-234kJ·mol-1,即;活化能可以结合反应物能量升高的部分判断,即活化能为 134 kJ·mol-1;两个过程为相反的过程,因此反应物和生成物的键能相反,即E3=368kJ·mol-1,E4=234kJ·mol-1;
(2)恒压条件下,充入不反应的气体,体积增大,速率减小,但是由于左右两边气体的化学计量数相同,则平衡不移动;
(3)①结合图3,可以知道平衡时刻H2的物质的量为0.1mol,结合三段式判断,即
2HI H2+ I2
起始(mol/L) 1 0 0
转化(mol/L) 0.2 0.1 0.1
平衡(mol/L) 0.8 0.1 0.1
结合化学平衡常数K=生成物浓度幂之积/反应物浓度幂之积,可以知道;
② 恒容条件下,左右两边化学计量数相同,充入2倍碘化氢,平衡不移动,浓度为原来的2倍。
【分析】(1)△H=反应物总键能-生成物总键能=生成物总内能-反应物总内能;
(2)恒压条件下,通入不反应的气体,体积增大,平衡朝气体体积增大的反响移动;
(3) ① 化学平衡常数K=生成物浓度幂之积/反应物浓度幂之积;
②左右两边化学计量数相同,因此压强和体积不影响平衡移动。
21.【答案】(1)0.02mol L-1 s-1;0.8;<;C
(2)反应Ⅱ;反应Ⅱ的活化能大于反应Ⅰ的活化能,反应Ⅱ断键时需要更多的能量,反应速率慢
【解析】【解答】①由图可知,T1温度下,0~10s内,O2的反应速率v(O2)= 0.02mol L-1 s-1。
②在T2温度下,该反应的平衡常数KT2= ,当反应达到平衡时,继续向容器中充入c(NO2)=0.1mol L-1、c(NO)=0.2mol L-1、c(O2)=0.1mol L-1,此时浓度商Q=
B.使用合适的催化剂不改变平衡转化率,B不正确;
C.平衡状态下,若充入NO,则达到新平衡时,正、逆反应速率都增大,C正确;
D.平衡状态下,若保持温度不变,将容器体积增加一倍,根据勒夏特列原理可知,平衡逆向移动,但反应物浓度增大,D不正确。
综上所述,说法正确的是C。(2)反应Ⅰ和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是反应Ⅱ,反应Ⅱ的活化能大于反应Ⅰ的活化能,反应Ⅱ断键时需要更多的能量,反应速率慢。
【分析】根据平衡常数公式计算K,通过比较浓度商与平衡常数的比较判断反应进行方向;根据NO2的物质的量浓度与反应时间的关系图可知,两体系温度高低进而判断反应热。
