1.3金属的腐蚀与防护 同步练习 (含解析)2023-2024学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 1.3金属的腐蚀与防护 同步练习 (含解析)2023-2024学年高二上学期化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 334.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 16:36:22 | ||
图片预览



文档简介
1.3金属的腐蚀与防护 同步练习
一、单选题
1.下列金属防腐的措施中,使用牺牲阳极的阴极保护法的是( )
A.地下钢管连接镁块 B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜 D.水中的钢闸门连接电源的负极
2.2018年10月24日港珠澳大桥正式通车。深埋在海水中的钢管桩易发生腐蚀,但中科院金属研究所研发的技术能保障大桥120年耐久性。下列保护钢管桩的措施不合理的是( )
A.使用抗腐蚀性强的合金钢
B.钢管桩附着铜以增强抗腐蚀性
C.使用防止钢筋锈蚀的海工混凝土
D.在钢筋表面覆盖一层高性能防腐涂料
3.化学在人类社会发展中发挥着重要作用,下列说法错误的是( )
A.双氧水可用于处理泄漏的有毒物质
B.在钢铁设备上连接金属铜保护钢铁
C.高纯硅可用于制作通信设备的芯片
D.可用核磁共振氢谱区分苯甲醇和对甲基苯酚
4.下列做法不利于金属防护的是( )
A.菜刀切菜后不洗净就放回刀架 B.将钢铁制成不锈钢
C.在铁塔的表面喷上一层油漆 D.埋在地下的钢管与锌块连接
5.化学与生产、生活、社会密切相关.下列说法中不正确的是( )
A.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致
B.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
C.绿色化学的核心是从源头上消除工业生产对环境的污染
D.用CO2合成聚碳酸酯可降解塑料,可实现“碳”的循环利用
6.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
A.脱氧过程是吸热反应,可降低温度,延长糕点保质期
B.含2.24g铁粉的脱氧剂,理论上最多能吸收氧气672mL(标准状况)
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4 e﹣=4OH﹣
D.脱氧过程中铁作原电池正极,电极反应为:Fe﹣2e﹣=Fe2+
7.下列有关原电池和金属腐蚀的说法中,不正确的( )
A.铜、锌两电极插入稀H2SO4中组成原电池,铜是正极
B.原电池中e-从负极流出,负极发生氧化反应
C.钢铁的吸氧腐蚀和析氢腐蚀的负极反应均为Fe-3e-=Fe3+
D.电化学腐蚀比化学腐蚀更快更普遍
8.下列关于轮船嵌有锌块实施保护的判断不合理的是( )
A.嵌入锌块后的负极反应:Fe﹣2e- = Fe2+
B.可用镁合金块代替锌块进行保护
C.腐蚀的正极反应:2H2O + O2 + 4e- = 4OH-
D.该方法采用的是牺牲阳极的阴极保护法
9.铁生锈是一种常见的自然现象,其主要的化学反应方程式为:4Fe+3O2+2xH2O=2Fe2O3·xH2O。下图为一放在水槽中的铁架,水位高度如图所示。最容易生锈的铁架横杆是( )
A.① B.② C.③ D.④
10.下列事实与电化学原理无关的是( )
A.金属钠与氧气反应生成过氧化钠
B.铁制器件在潮湿空气中生锈
C.镀锌铁片比镀锡铁片更耐腐蚀
D.远洋海轮的外壳连接锌块可保护轮般不受腐蚀
11.保护钢铁有利于节约资源、保护环境,下列钢铁的保护方法中错误的是
A.铁栅栏上涂上油漆 B.铁闸与直流电源正极相连
C.轮船底部焊接镁块 D.家用铁锅水洗后及时擦干
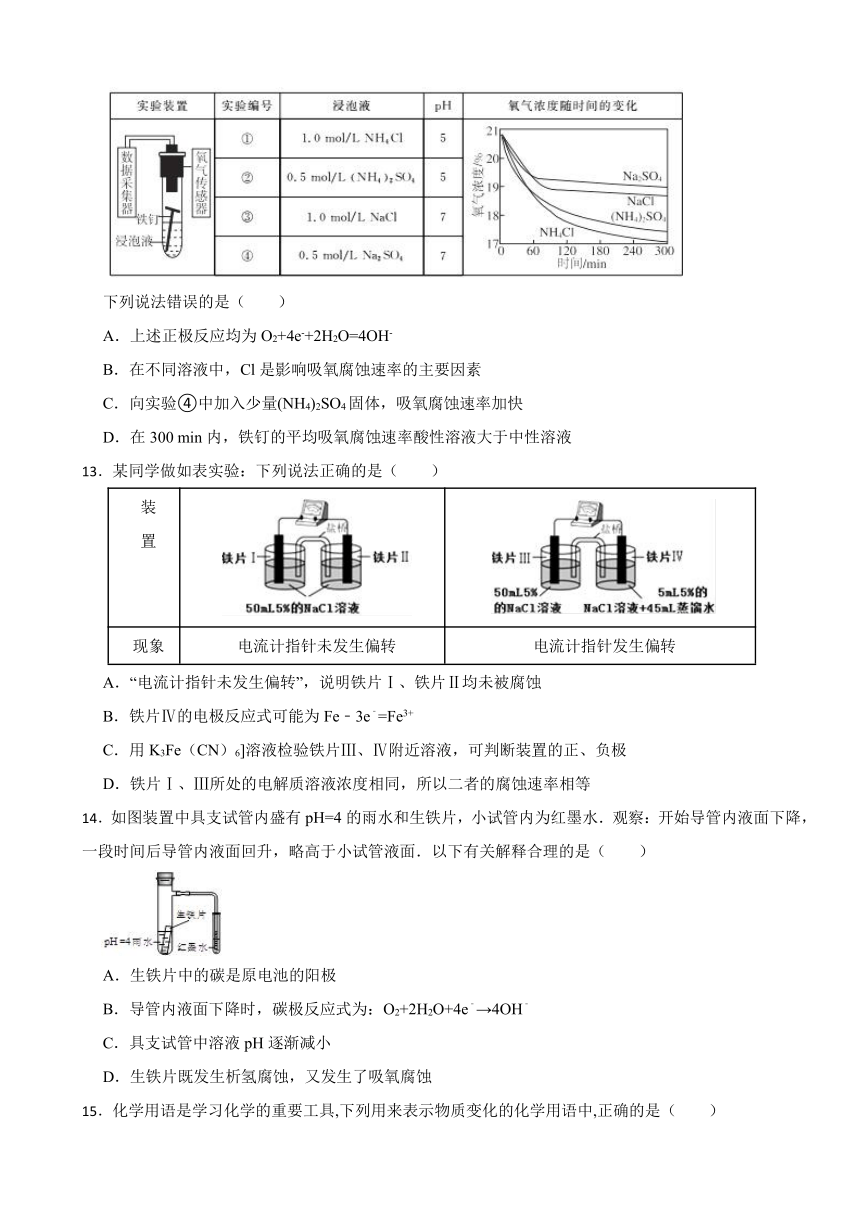
12.利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
下列说法错误的是( )
A.上述正极反应均为O2+4e-+2H2O=4OH-
B.在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C.向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D.在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
13.某同学做如表实验:下列说法正确的是( )
装 置
现象 电流计指针未发生偏转 电流计指针发生偏转
A.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀
B.铁片Ⅳ的电极反应式可能为Fe﹣3e﹣=Fe3+
C.用K3Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断装置的正、负极
D.铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,所以二者的腐蚀速率相等
14.如图装置中具支试管内盛有pH=4的雨水和生铁片,小试管内为红墨水.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
A.生铁片中的碳是原电池的阳极
B.导管内液面下降时,碳极反应式为:O2+2H2O+4e﹣→4OH﹣
C.具支试管中溶液pH逐渐减小
D.生铁片既发生析氢腐蚀,又发生了吸氧腐蚀
15.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应为:2Cl-+2e-=Cl2↑
B.酸性氢氧燃料电池的正极电极反应为:2H2O+O2+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为:Cu-2e-=Cu2+
D.钢铁发生吸氧腐蚀时,铁做负极被氧化:Fe-3e-=Fe3+
16.全世界每年因钢铁锈蚀造成巨大损失,钢铁吸氧腐蚀原理如图所示。下列说法正确的是( )
A.钢铁腐蚀过程只发生化学能与电能的转化
B.钢铁腐蚀的正极反应为:Fe-2e-=Fe2+
C.电解质溶液浓度可影响钢铁腐蚀的速率
D.将地下铁管与铜块连接,可保护铁管
二、综合题
17.银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如右图),一段时间后黑色褪去。回答下列问题:
(1)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于 腐蚀(填“化学”或“电化学”)。
(2)铝质容器作为 极,银器的电极反应式为 。
(3)处理过程中总反应的化学方程式为 。
(4)若将铝质容器中的食盐水用浓硝酸代替,则铝质容器极的电极反应式为 。
18.回答下列问题:
(1)炒菜的铸铁锅长期不用时会因腐蚀而出现红褐色锈斑,铁锅的锈蚀主要是电化学腐蚀中的 腐蚀,正极的电极反应式为 。
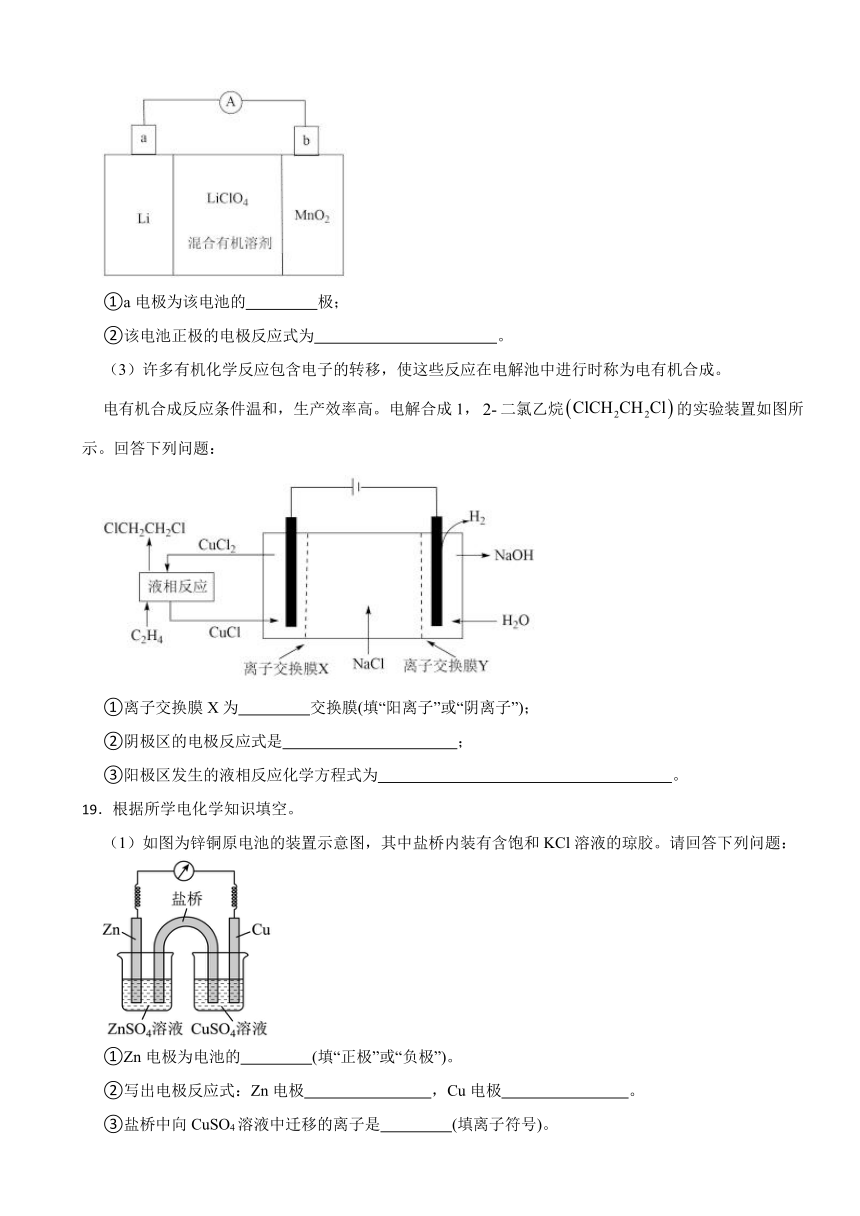
(2)锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备和交通工具的常用电池。一种锂离子电池构造如图所示,其中电解质溶于混合有机溶剂中,通过电解质迁移入晶格中,生成。回答下列问题:
①a电极为该电池的 极;
②该电池正极的电极反应式为 。
(3)许多有机化学反应包含电子的转移,使这些反应在电解池中进行时称为电有机合成。
电有机合成反应条件温和,生产效率高。电解合成1,二氯乙烷的实验装置如图所示。回答下列问题:
①离子交换膜X为 交换膜(填“阳离子”或“阴离子”);
②阴极区的电极反应式是 ;
③阳极区发生的液相反应化学方程式为 。
19.根据所学电化学知识填空。
(1)如图为锌铜原电池的装置示意图,其中盐桥内装有含饱和KCl溶液的琼胶。请回答下列问题:
①Zn电极为电池的 (填“正极”或“负极”)。
②写出电极反应式:Zn电极 ,Cu电极 。
③盐桥中向CuSO4溶液中迁移的离子是 (填离子符号)。
(2)金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答下列问题:
①图1中被腐蚀的金属为 (填化学式);图2中金属腐蚀类型属于 (填字母)。
A.化学腐蚀 B.析氢腐蚀 C.吸氧腐蚀
②图1中Cu的作用是 (填“负极”或“正极”)。
③图2中铁的生锈过程中正极反应式为 。
20.在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:
(1)A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“增大”、“减小”或“不变”)。C中被腐蚀的金属是 ,总反应的离子方程式为 ,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是 。
21.
(1)I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:
(3)II.在如图用石墨作电极的电解池中,放入500mL饱和NaCl溶液并滴入酚酞,进行电解,观察到B电极附近溶液先变红。请回答下列问题:
A接的是电源的 极,B是该装置 。
(4)写出电解时总反应的离子方程式: 。
(5)电解后溶液的pH ;(填 增大、减小或不变)要使电解后溶液恢复到电解前的状态,则需加入 。
(6)若电源为碱性锌锰干电池,负极为 正极为 电解质溶液是
答案解析部分
1.【答案】A
【解析】【解答】A.地下钢管连接镁块,Fe、Mg、电解质溶液构成原电池,Fe失电子能力小于Mg而作正极被保护,所以该保护方法属于牺牲阳极的阴极保护法,故A符合题意;
B.金属护拦表面涂漆,阻止Fe与空气、水接触,从而防止金属被腐蚀,属于物理方法,故B不符合题意;
C.汽车底盘喷涂高分子膜,阻止Fe与空气、水接触,从而防止金属被腐蚀,属于物理方法,故C不符合题意;
D.水中的钢闸门连接电源的负极,充当电解池的阴极,属于外加电流的阴极保护法,故D不符合题意;
故答案为:A。
【分析】金属防腐的措施中,使用牺牲阳极的阴极保护法,说明该装置构成原电池,被保护的金属作正极,据此分析判断。
2.【答案】B
【解析】【解答】A. 合金钢比钢管耐腐蚀性强,大大增加了钢管柱对外界侵蚀的抵抗力,故A项不符合题意;
B. 钢管的金属活动性比铜强,会与铜构成原电池,钢管柱做负极,是腐蚀速率更快,故B项符合题意;
C. 海工混凝土防止钢筋锈蚀,故C项不符合题意;
D. 表面覆盖一层高性能防腐涂料,可使钢管跟周围物质隔离开来,故D项不符合题意;
故答案为:B。
【分析】金属的防护主要从三个方面采取方法:(1)改变金属的内部组织结构,如制成不锈钢,增加耐腐蚀性;(2)在金属表面覆盖保护层,如涂油、喷漆等;(3)电化学保护法,如牺牲阳极的阴极保护法和外加电流的阴极保护法,据此分析作答。
3.【答案】B
【解析】【解答】A.双氧水有氧化性,有还原性,S2-可被氧化成硫单质,A项不符合题意;
B.在钢铁设备上连接金属铜时,会发生电化学腐蚀,铁作负极,铜作正极,会加快铁的腐蚀,应连接比铁更活泼的金属来保护钢铁,B项符合题意;
C.硅单质可用于制作通信设备的芯片,太阳能电池板等,C项不符合题意;
D.核磁共振氢谱可用于测定等效氢的种类,苯甲醇有5种等效氢而对甲基苯酚有4种等效氢,所以可以进行区分,D项不符合题意;
故答案为:B。
【分析】A.双氧水能够氧化硫离子;
B.铜活泼性弱于铁;
C.高纯硅为良好的半导体;
D.核磁共振氢谱可以检测有机物中不同氢原子种类。
4.【答案】A
【解析】【解答】解:A、菜刀切菜后和水接触易生锈,故A正确;
B、将钢铁制成不锈钢后,不锈钢的性能好于钢铁,不易生锈,故C错误;
C、在铁塔的表面喷上一层油漆,可以防止金属和水以及空气接触,故C错误;
D、埋在地下的钢管与锌块相连后,形成原电池,金属铁做正极,该极金属被保护,不易生锈,故D错误.
故选A.
【分析】A、金属生锈的条件:金属和空气以及水接触;
B、不锈钢的性能好于钢铁的;
C、防止金属生锈的条件:防止和水以及空气接触;
D、在原电池中,正极金属被保护,不易生锈.
5.【答案】B
【解析】【解答】解:A、二氧化硫的漂白性,“硫黄姜”在用硫黄熏制的过程中产生的SO2使其漂白,故A正确;
B、钢铁在潮湿的空气中易生锈,是因为空气中有氧气和水蒸气,易发生电化学腐蚀而生锈,故B错误;
C、从源头上消除工业生产对环境的污染是绿色化学的核心,故C正确;
D、CO2合成可降解的聚碳酸酯塑料,聚碳酸酯塑料能降解生成二氧化碳,所以能实现碳的循环利用,故D正确;
故选B.
【分析】A、根据二氧化硫的漂白性分析;
B、铁在潮湿的空气中放置,易发生电化学腐蚀而生锈;
C、从源头上消除工业生产对环境的污染是绿色化学的核心;
D、CO2合成可降解的聚碳酸酯塑料,聚碳酸酯塑料能降解生成二氧化碳.
6.【答案】B
【解析】【解答】解:A.脱氧过程发生氧化还原反应,为放热反应,故A错误;
B.脱氧时,负极反应式为Fe﹣2e﹣=Fe2+,铁失去电子的物质的量= =0.08mol,正极反应式为2H2O+O2+4e﹣=4OH﹣,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧化生成氢氧化铁,
所以实际上铁元素转移电子物质的量= =0.12mol,根据转移电子相等得吸收氧气体积= =672mL,故B正确;
C.铁易失电子作负极、C作正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4 e﹣=4OH﹣,故C错误;
D.铁作负极、C作正极,负极上铁失电子发生氧化反应,电极反应式为Fe﹣2e﹣=Fe2+,故D错误;
故选B.
【分析】A.脱氧过程为放热反应;
B.脱氧时,铁失去电子的物质的量= =0.08mol,根据转移电子相等计算吸收氧气体积;
C.铁易失电子作负极、C作正极,正极上氧气得电子发生还原反应;
D.铁作负极、C作正极,负极上铁失电子发生氧化反应.
7.【答案】C
【解析】【解答】A.铜、锌两电极插入稀H2SO4中组成原电池,锌比铜活泼,活泼金属锌为负极,不活泼金属铜是正极,故A不符合题意;
B.原电池中e-从负极流出,经外电路流向正极,还原剂在负极失电子发生氧化反应,故B不符合题意;
C.钢铁的吸氧腐蚀和析氢腐蚀的负极反应均为铁失电子发生氧化反应生成亚铁离子,电极反应式为Fe-2e-=Fe2+,故C符合题意;
D.电化学腐蚀因发生原电池反应,比化学腐蚀更快更普遍,危害更大,故D不符合题意;
故答案为:C。
【分析】A.B. 在Zn-Cu-稀H2SO4构成的原电池中,锌比铜活泼,活泼金属锌为负极,锌失电子,发生氧化反应,失去的电子经过外电路流向铜电极,不活泼金属铜作正极,氢离子在铜电极上得电子,发生还原反应。
C. 钢铁的吸氧腐蚀和析氢腐蚀都属于电化学腐蚀,构成了原电池,较活泼的铁作负极,失电子,发生氧化反应,其电极方程式均为Fe-2e-=Fe2+;
D. 电化学腐蚀是不纯的金属与电解质溶液接触时,发生原电池反应,比较活泼的金属失去电子而被氧化;化学腐蚀是金属与接触到的干燥气体或非电解质溶液等直接发生化学反应。
8.【答案】A
【解析】【解答】A. 嵌入锌块做负极,负极反应为Zn-2e-=Zn2+,A符合题意;
B. 上述方法为牺牲阳极的阴极保护法,即牺牲做负极的锌块保护做正极的轮船,故可以用镁合金来代替锌块,B不符合题意;
C. 由于海水呈弱碱性,铁发生吸氧腐蚀,故正极反应为2H2O+O2+4e-=4OH-,C不符合题意;
D. 此保护方法是构成了原电池,牺牲了锌块保护轮船,故为牺牲阳极的阴极保护法,D不符合题意;
故答案为:A。
【分析】轮船嵌有锌块后能形成原电池,锌块做负极被腐蚀,电极反应为Zn-2e-=Zn2+,轮船做正极被保护,氧气在正极上放电,电极反应为2H2O+O2+4e-═4OH-,据此分析。
9.【答案】C
【解析】【解答】此处铁生锈属于吸氧腐蚀。④处没有和电解质溶液接触,不能构成原电池,锈蚀速率较慢;①②③处已与电解质溶液接触,但①②处含O2较少,所以③处腐蚀最快。
【分析】吸氧腐蚀在有氧气、溶液的条件下形成原电池腐蚀速率最快,据此解答。
10.【答案】A
【解析】【解答】解:A、金属钠和氧气之间发生化学反应,和电化学无关,故A错误;
B、铁制器件在潮湿空气中因为形成原电池而生锈,和电化学有关,故B错误;
C、原电池的负极金属易被腐蚀,镀锌铁中金属铁是正极,被保护,镀锡铁中铁是负极,易被腐蚀,所以镀锌铁片比镀锡铁片更耐腐,和电化学有关,故C错误;
D、远洋海轮的外壳连接锌块,形成的原电池中,金属锌是负极,铁是正极,正极金属铁被保护,海轮的外壳连接锌块可保护轮般不受腐蚀,和电化学有关,故D错误;
故选A.
【分析】A、金属钠和氧气之间发生化学反应;
B、铁制器件在潮湿空气中因为形成原电池而生锈;
C、原电池的负极金属易被腐蚀;
D、远洋海轮的外壳连接锌块,形成的原电池中,金属锌是负极,铁是正极,正极金属被保护.
11.【答案】B
【解析】【解答】A.铁栅栏上涂上油漆可以防止铁与碳形成原电池,有利于减缓铁栅栏的腐蚀,保护方法正确,故A不符合题意;
B.与直流电源正极相连的铁闸做电解池的阳极,会加快铁闸的腐蚀,保护方法错误,故B符合题意;
C.轮船底部焊接镁块,铁镁在溶液中形成原电池,镁做原电池的负极被损耗,铁做正极被保护,保护方法正确,故C不符合题意;
D.家用铁锅水洗后及时擦干可以防止铁与碳形成原电池,有利于减缓铁锅的腐蚀,保护方法正确,故D不符合题意;
故答案为:B。
【分析】A.隔绝空气,防止铁与碳形成原电池;
B.与直流电源正极相连的铁闸做电解池的阳极,会加快铁闸的腐蚀;
C.利用牺牲阳极的阴极保护法;
D.防止铁与碳形成原电池。
12.【答案】B
【解析】 【解答】A.铁钉发生电化学吸氧腐蚀的正极反应为O
2+4e
-+2H
2O=4OH
-,故A不符合题意;
B.通过右侧图像中曲线对比可以看出,NH4+的存在是影响吸氧腐蚀速率的主要因素,氯离子对吸氧腐蚀速率影响不大,故B符合题意;
C. 根据图像,NH4+存在会加快吸氧腐蚀速率,所以向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快,故C不符合题意;
D. NH4+水解溶液显酸性,结合图像可知酸性溶液中铁钉的平均吸氧腐蚀速率大于中性溶液,故D不符合题意。
故答案为:B
【分析】吸氧腐蚀是指金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化学腐蚀。本题探究铁钉在不同溶液中的吸氧腐蚀。
A、电化学吸氧腐蚀的正极发生还原反应;
B、根据图像中氧气浓度随时间的变化分析;
C、根据图像分析;
D、根据NH4+水解溶液显酸性解答;
13.【答案】C
【解析】【解答】解:A、图1中因两溶液中氯化钠的浓度相等,因此发生的是普通的化学腐蚀,且腐蚀速率相等,电流计指针未发生偏转,铁片Ⅰ、铁片Ⅱ均被腐蚀,故A错误;
B、铁片Ⅳ的电极反应式为Fe﹣2e﹣=Fe2+,故B错误;
C、图2中因两溶液中氯化钠的浓度不相等,因此发生的是电化学腐蚀,且浓度大的一极发生的反应是Fe﹣2e﹣=Fe2+,可以用K3[Fe(CN)6]溶液检验亚铁离子的存在,进而判断电池的正、负极,故C正确;
D、自同一个原电池装置中,铁片Ⅰ、Ⅱ所处的电解质溶液浓度相同,二者的腐蚀速率相等,故D错误;
故选C.
【分析】对比两个盐桥的双液装置,图1中因两溶液中氯化钠的浓度相等,因此发生的是普通的化学腐蚀,且腐蚀速率相等,图2中因两溶液中氯化钠的浓度不相等,因此发
生的是电化学腐蚀,且浓度大的一极发生的反应是Fe﹣2e﹣=Fe2+,可以用K3[Fe(CN)6]溶液检验.
14.【答案】D
【解析】【解答】解:A.生铁片中的碳是原电池的正极,发生还原反应,铁是负极,发生氧化反应,故A错误;
B.导管内液面下降时,说明试管内压强增大,应该为析氢腐蚀,应生成氢气,碳极反应式为:2H+﹣2e﹣=H2↑,故B错误;
C.先发生析氢腐蚀,消耗氢离子,后发生吸氧腐蚀,产生氢氧根离子,U型管中溶液pH逐渐增大,故C错误;
D.试管中雨水的pH=4,酸性较强,开始时生铁片发生析氢腐蚀,一段时间后酸性减弱发生吸氧腐蚀,故D正确;
故选D.
【分析】正常雨水的pH是5.6,试管中雨水的pH=4呈酸性,生铁中含有碳和铁,酸性条件下,生铁发生析氢腐蚀生成氢气,导致具支试管内气体压强大于大气压,导管内液面下降,当溶液呈弱酸性或中性时,生铁发生吸氧腐蚀,导致具支试管中气体压强小于大气压,导管内液面回升,略高于小试管液面,据此进行解答.
15.【答案】A
【解析】【解答】A. 电解饱和食盐水时,阳极不是活泼金属电极时,在该极上放电的是溶液中活泼的阴离子即氯离子得电子的反应,电极反应为2Cl-+2e-=Cl2↑,故A符合题意;
B. 酸性氢氧燃料电池的正极是氧气得电子结合氢离子发生还原反应生成水,则电极反应为4H++O2+4e ═2H2O,故B不符合题意;
C. 粗铜精炼时,粗铜连接电源正极,纯铜连接电源负极,阳极上电极反应式为Cu-2e-=Cu2+,故C不符合题意;
D. 钢铁发生吸氧腐蚀时,铁作负极失电子发生氧化反应生成二价铁离子,电极反应为Fe-2e-=Fe2+,故D不符合题意。
故答案为:A。
【分析】A. 电解饱和食盐水时,阳极上阴离子放电,溶液中有Cl-和OH-,放电顺序Cl->OH-则Cl-得电子生成氯气;
B. 酸性氢氧燃料电池的正极:O2+4H++4e-=2H2O;
C. 粗铜精炼时,粗铜与电源正极相连,纯铜与电源负极相连;
D. 钢铁发生吸氧腐蚀时,Fe作负极失电子生成Fe2+。
16.【答案】C
【解析】【解答】A.钢铁腐蚀过程不仅发生化学能与电能的转化,钢铁的锈蚀过程属于缓慢氧化,还放出热量,所以还发生化学能与热能的转化,A不符合题意;
B.钢铁发生的腐蚀为吸氧腐蚀,负极上金属铁失电子,发生氧化反应,正极上氧气得到电子,发生还原反应,电极反应为:2H2O+O2+4e-=4OH-,B不符合题意;
C.因为反应速率与离子浓度正相关,所以电解质溶液浓度可影响钢铁腐蚀的速率, C符合题意;
D.将地下铁管与铜块连接会构成原电池,铁作负极,铜作正极,所以不能保护铁管,反而会加快铁管的腐蚀,D不符合题意;
故答案为:C。
【分析】钢铁的锈蚀发生的电化学腐蚀,化学腐蚀过程中还释放出了能量,构成原电池时,铁做负极材料,铁失去电子,发生氧化反应变为亚铁离子,正极是氧气得到电子发生还原反应,速率和浓度有关,因此电解质离子的浓度可能影响腐蚀速率,为了保护铁块可以将活泼性强的金属与钢铁连接保护钢铁
17.【答案】(1)化学
(2)负;Ag2S+2e-=2Ag +S2-
(3)3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓
(4)2H++NO +e-=NO2↑+H2O
【解析】【解答】(1)银质器皿日久表面逐渐变黑腐蚀的过程中,没有电流产生,属于化学腐蚀;
(2)由于金属活动性Al>Ag,因此铝质容器作为负极,银器作为正极,由银器上的Ag2S发生得电子的还原反应生成Ag和S2-,其电极反应式为:Ag2S+2e-=2Ag+S2-;
(3)处理过程中,Ag2S、Al和H2O反应生成Ag、H2S气体和AlOOH3沉淀,该反应的化学方程式为:3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓;
(4)若将食盐水用浓硝酸代替,由于常温下浓硝酸能使铝钝化,因此铝质容器做正极,由溶液中的NO3-发生得电子的还原反应,生成NO2,该电极反应式为:2H++NO3-+e-=NO2↑+H2O;
【分析】(1)根据腐蚀过程是否有电流产生分析属于何种腐蚀;
(2)根据金属活动性判断正负极和电极反应式;
(3)根据题干信息确定反应物和生成物,结合原子守恒书写反应的化学方程式;
(4)常温下,浓硝酸能使铝发生钝化,此时铝做正极,溶液中的NO3-发生得电子的还原反应;
18.【答案】(1)吸氧;
(2)负;
(3)阴离子;;
【解析】【解答】(1)红褐色锈斑是氧化铁,是氢氧化铁分解得到的,根据氧元素守恒,故铁锅的锈蚀主要是电化学腐蚀中的吸氧腐蚀,正极是氧气分子和水分子得到电子生成氢氧根离子,故正极反应式是
。
(2)放电过程中,锂失去电子变成
,故a电极是电源负极,
通过电解质迁移入
晶格中,生成
,而
和b电极相连,则b电极是电源的正极。每有一个
进入到
晶格中,则同时通过b电极有一个电子进入到
晶格中,故该电池正极的电极反应式为
。
(3)①从电解合成1,
二氯乙烷
的实验装置图,可知Na+通过离子交换膜Y,进入到阴极区转化为氢氧化钠。在阳极区,氯化亚铜失去电子变成氯化铜,则Cl-通过离子交换膜X进入到阳极区,故离子交换膜X为阴离子交换膜。
②阴极区发生的反应主要是水电离出的氢离子得到电子生成氢气,同时生成氢氧根离子,故发生反应的化学方程式是
。
③根据阳极区域液相反应中的各物质前的箭头符号,可知反应物有乙烯和氯化铜,生成物是1,
二氯乙烷和氯化亚铜,故反应的化学方程式是
,其中氯化亚铜在阳极失去电子又生成氯化铜,如此循环。
【分析】(1)铁在酸性环境中发生析氢腐蚀,在中性和碱性环境中发生吸氧腐蚀;
(2)由图1得,a电极失去电子,为负极,电极反应式为:Li e =Li+,b电极得到电子,为正极,电极反应式为:Li++e +MnO2=LiMnO2;
(3)由图可知,右边电极连接电源负极,为阴极,电极反应式为:2H2O+2e =H2↑+2OH ,左边电极连接电源正极,为阳极,电极反应式为:CuCl e +Cl =CuCl2,电解池中,阳离子移向阴极,阴离子移向阳极,即氯离子移向阳极,钠离子移向阴极,液相反应中,反应物有C2H4、CuCl2,生成物有ClCH2CH2Cl、CuCl。
19.【答案】(1)负极;;;K+
(2)Fe;C;正极;
【解析】【解答】(1)铜锌形成的原电池,比活泼,为负极,发生反应为:,为正极,在溶液中发生反应:,在原电池中,阳离子向正极移动,所以盐桥中向CuSO4溶液中迁移的离子是。
(2)图1中,和形成原电池的两级,比活泼,做负极,被腐蚀;图2在碱性条件下,有参与反应,故该腐蚀为吸氧腐蚀,选C;图1中,和形成原电池的两级,比活泼,做负极,作正极;图2在铁生锈的过程中,正极反应为:。
【分析】(1)电池工作时,负极失电子,发生氧化反应,正极得电子,发生还原反应;溶液中阴离子向负极移动,阳离子向正极定向移动。
(2)中性或弱酸性条件下,金属发生吸氧腐蚀,酸性环境下,金属发生析氢腐蚀;电池工作时,负极失电子,发生氧化反应,正极得电子,发生还原反应。
20.【答案】(1)Fe+2H+=Fe2++H2↑
(2)(2)2H++2e-=H2↑;增大;Zn;Zn+2H+=Zn2++H2↑;B>A>C
【解析】【解答】铁在不同的情况下被腐蚀的速率不同。作原电池的负极时易被腐蚀,作原电池的正极时受到保护不被腐蚀。
【分析】(1)铁与稀硫酸反应生成硫酸亚铁和氢气;
(2)Fe比Sn活泼,Fe作负极(被腐蚀),发生氧化反应;Sn作正极(被保护),发生还原反应;电化学腐蚀的速率大于化学腐蚀的速率,由此即可得出答案。
21.【答案】(1)吸氧
(2)O2+4e-+2H2O=4OH-
(3)正极;阴极
(4)2Cl- + 2H2O =(电解)H2↑+Cl2↑+2OH-
(5)增大;HCl 气体
(6)锌;二氧化锰;氢氧化钾溶液
【解析】【解答】I.(1)炒过菜的铁锅因腐蚀而出现红褐色锈斑,铁锅中电解质溶液一般为弱酸性或者中性,溶解空气中一定量的氧气,发生吸氧腐蚀,故答案为:吸氧。
(2)铁锅发生吸氧腐蚀时,氧气在正极得到电子,发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-。
II.(3)根据题意“B电极附近溶液先变红”,说明B电极生成了NaOH,则B为阴极,A为阳极,与电源正极相连的是电解池的阳极,故答案为:正极,阴极。
(4)根据分析可知,氯化钠和水都被电解,所以总的反应式为2Cl-+2H2O Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O Cl2↑+H2↑+2OH-。
(5)电解后生成了OH-,所以溶液的pH值增大,电解过程中逸出了氢气和氯气,要使电解后溶液恢复到电解前的状态,则需加入HCl气体,故答案为:增大,HCl气体。
(6)碱性锌锰干电池总反应方程式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,由反应方程式可知,Zn为负极,MnO2为正极,电解质溶液是氢氧化钾溶液,故答案为:锌,二氧化锰,氢氧化钾溶液。
【分析】 I .(1)铁在中性溶液中发生吸氧腐蚀;
(2)吸氧腐蚀中正极发生的是氧气得电子被还原生成氢氧根离子;
Ⅱ.(3)电解饱和氯化钠溶液,阴极附近呈碱性,能使酚酞溶液变红色,阴极连接的是电源的负极;
(4)电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠;
(5)电解产物中有氢氧化钠生成,碱性增强,电解过程中脱离反应体系的是HCl,所以再通入HCl可恢复原来的溶液;
(6)根据干电池的构成进行解答。
一、单选题
1.下列金属防腐的措施中,使用牺牲阳极的阴极保护法的是( )
A.地下钢管连接镁块 B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜 D.水中的钢闸门连接电源的负极
2.2018年10月24日港珠澳大桥正式通车。深埋在海水中的钢管桩易发生腐蚀,但中科院金属研究所研发的技术能保障大桥120年耐久性。下列保护钢管桩的措施不合理的是( )
A.使用抗腐蚀性强的合金钢
B.钢管桩附着铜以增强抗腐蚀性
C.使用防止钢筋锈蚀的海工混凝土
D.在钢筋表面覆盖一层高性能防腐涂料
3.化学在人类社会发展中发挥着重要作用,下列说法错误的是( )
A.双氧水可用于处理泄漏的有毒物质
B.在钢铁设备上连接金属铜保护钢铁
C.高纯硅可用于制作通信设备的芯片
D.可用核磁共振氢谱区分苯甲醇和对甲基苯酚
4.下列做法不利于金属防护的是( )
A.菜刀切菜后不洗净就放回刀架 B.将钢铁制成不锈钢
C.在铁塔的表面喷上一层油漆 D.埋在地下的钢管与锌块连接
5.化学与生产、生活、社会密切相关.下列说法中不正确的是( )
A.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致
B.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
C.绿色化学的核心是从源头上消除工业生产对环境的污染
D.用CO2合成聚碳酸酯可降解塑料,可实现“碳”的循环利用
6.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
A.脱氧过程是吸热反应,可降低温度,延长糕点保质期
B.含2.24g铁粉的脱氧剂,理论上最多能吸收氧气672mL(标准状况)
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4 e﹣=4OH﹣
D.脱氧过程中铁作原电池正极,电极反应为:Fe﹣2e﹣=Fe2+
7.下列有关原电池和金属腐蚀的说法中,不正确的( )
A.铜、锌两电极插入稀H2SO4中组成原电池,铜是正极
B.原电池中e-从负极流出,负极发生氧化反应
C.钢铁的吸氧腐蚀和析氢腐蚀的负极反应均为Fe-3e-=Fe3+
D.电化学腐蚀比化学腐蚀更快更普遍
8.下列关于轮船嵌有锌块实施保护的判断不合理的是( )
A.嵌入锌块后的负极反应:Fe﹣2e- = Fe2+
B.可用镁合金块代替锌块进行保护
C.腐蚀的正极反应:2H2O + O2 + 4e- = 4OH-
D.该方法采用的是牺牲阳极的阴极保护法
9.铁生锈是一种常见的自然现象,其主要的化学反应方程式为:4Fe+3O2+2xH2O=2Fe2O3·xH2O。下图为一放在水槽中的铁架,水位高度如图所示。最容易生锈的铁架横杆是( )
A.① B.② C.③ D.④
10.下列事实与电化学原理无关的是( )
A.金属钠与氧气反应生成过氧化钠
B.铁制器件在潮湿空气中生锈
C.镀锌铁片比镀锡铁片更耐腐蚀
D.远洋海轮的外壳连接锌块可保护轮般不受腐蚀
11.保护钢铁有利于节约资源、保护环境,下列钢铁的保护方法中错误的是
A.铁栅栏上涂上油漆 B.铁闸与直流电源正极相连
C.轮船底部焊接镁块 D.家用铁锅水洗后及时擦干
12.利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
下列说法错误的是( )
A.上述正极反应均为O2+4e-+2H2O=4OH-
B.在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C.向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D.在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
13.某同学做如表实验:下列说法正确的是( )
装 置
现象 电流计指针未发生偏转 电流计指针发生偏转
A.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀
B.铁片Ⅳ的电极反应式可能为Fe﹣3e﹣=Fe3+
C.用K3Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断装置的正、负极
D.铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,所以二者的腐蚀速率相等
14.如图装置中具支试管内盛有pH=4的雨水和生铁片,小试管内为红墨水.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
A.生铁片中的碳是原电池的阳极
B.导管内液面下降时,碳极反应式为:O2+2H2O+4e﹣→4OH﹣
C.具支试管中溶液pH逐渐减小
D.生铁片既发生析氢腐蚀,又发生了吸氧腐蚀
15.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应为:2Cl-+2e-=Cl2↑
B.酸性氢氧燃料电池的正极电极反应为:2H2O+O2+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为:Cu-2e-=Cu2+
D.钢铁发生吸氧腐蚀时,铁做负极被氧化:Fe-3e-=Fe3+
16.全世界每年因钢铁锈蚀造成巨大损失,钢铁吸氧腐蚀原理如图所示。下列说法正确的是( )
A.钢铁腐蚀过程只发生化学能与电能的转化
B.钢铁腐蚀的正极反应为:Fe-2e-=Fe2+
C.电解质溶液浓度可影响钢铁腐蚀的速率
D.将地下铁管与铜块连接,可保护铁管
二、综合题
17.银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如右图),一段时间后黑色褪去。回答下列问题:
(1)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于 腐蚀(填“化学”或“电化学”)。
(2)铝质容器作为 极,银器的电极反应式为 。
(3)处理过程中总反应的化学方程式为 。
(4)若将铝质容器中的食盐水用浓硝酸代替,则铝质容器极的电极反应式为 。
18.回答下列问题:
(1)炒菜的铸铁锅长期不用时会因腐蚀而出现红褐色锈斑,铁锅的锈蚀主要是电化学腐蚀中的 腐蚀,正极的电极反应式为 。
(2)锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备和交通工具的常用电池。一种锂离子电池构造如图所示,其中电解质溶于混合有机溶剂中,通过电解质迁移入晶格中,生成。回答下列问题:
①a电极为该电池的 极;
②该电池正极的电极反应式为 。
(3)许多有机化学反应包含电子的转移,使这些反应在电解池中进行时称为电有机合成。
电有机合成反应条件温和,生产效率高。电解合成1,二氯乙烷的实验装置如图所示。回答下列问题:
①离子交换膜X为 交换膜(填“阳离子”或“阴离子”);
②阴极区的电极反应式是 ;
③阳极区发生的液相反应化学方程式为 。
19.根据所学电化学知识填空。
(1)如图为锌铜原电池的装置示意图,其中盐桥内装有含饱和KCl溶液的琼胶。请回答下列问题:
①Zn电极为电池的 (填“正极”或“负极”)。
②写出电极反应式:Zn电极 ,Cu电极 。
③盐桥中向CuSO4溶液中迁移的离子是 (填离子符号)。
(2)金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答下列问题:
①图1中被腐蚀的金属为 (填化学式);图2中金属腐蚀类型属于 (填字母)。
A.化学腐蚀 B.析氢腐蚀 C.吸氧腐蚀
②图1中Cu的作用是 (填“负极”或“正极”)。
③图2中铁的生锈过程中正极反应式为 。
20.在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:
(1)A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“增大”、“减小”或“不变”)。C中被腐蚀的金属是 ,总反应的离子方程式为 ,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是 。
21.
(1)I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:
(3)II.在如图用石墨作电极的电解池中,放入500mL饱和NaCl溶液并滴入酚酞,进行电解,观察到B电极附近溶液先变红。请回答下列问题:
A接的是电源的 极,B是该装置 。
(4)写出电解时总反应的离子方程式: 。
(5)电解后溶液的pH ;(填 增大、减小或不变)要使电解后溶液恢复到电解前的状态,则需加入 。
(6)若电源为碱性锌锰干电池,负极为 正极为 电解质溶液是
答案解析部分
1.【答案】A
【解析】【解答】A.地下钢管连接镁块,Fe、Mg、电解质溶液构成原电池,Fe失电子能力小于Mg而作正极被保护,所以该保护方法属于牺牲阳极的阴极保护法,故A符合题意;
B.金属护拦表面涂漆,阻止Fe与空气、水接触,从而防止金属被腐蚀,属于物理方法,故B不符合题意;
C.汽车底盘喷涂高分子膜,阻止Fe与空气、水接触,从而防止金属被腐蚀,属于物理方法,故C不符合题意;
D.水中的钢闸门连接电源的负极,充当电解池的阴极,属于外加电流的阴极保护法,故D不符合题意;
故答案为:A。
【分析】金属防腐的措施中,使用牺牲阳极的阴极保护法,说明该装置构成原电池,被保护的金属作正极,据此分析判断。
2.【答案】B
【解析】【解答】A. 合金钢比钢管耐腐蚀性强,大大增加了钢管柱对外界侵蚀的抵抗力,故A项不符合题意;
B. 钢管的金属活动性比铜强,会与铜构成原电池,钢管柱做负极,是腐蚀速率更快,故B项符合题意;
C. 海工混凝土防止钢筋锈蚀,故C项不符合题意;
D. 表面覆盖一层高性能防腐涂料,可使钢管跟周围物质隔离开来,故D项不符合题意;
故答案为:B。
【分析】金属的防护主要从三个方面采取方法:(1)改变金属的内部组织结构,如制成不锈钢,增加耐腐蚀性;(2)在金属表面覆盖保护层,如涂油、喷漆等;(3)电化学保护法,如牺牲阳极的阴极保护法和外加电流的阴极保护法,据此分析作答。
3.【答案】B
【解析】【解答】A.双氧水有氧化性,有还原性,S2-可被氧化成硫单质,A项不符合题意;
B.在钢铁设备上连接金属铜时,会发生电化学腐蚀,铁作负极,铜作正极,会加快铁的腐蚀,应连接比铁更活泼的金属来保护钢铁,B项符合题意;
C.硅单质可用于制作通信设备的芯片,太阳能电池板等,C项不符合题意;
D.核磁共振氢谱可用于测定等效氢的种类,苯甲醇有5种等效氢而对甲基苯酚有4种等效氢,所以可以进行区分,D项不符合题意;
故答案为:B。
【分析】A.双氧水能够氧化硫离子;
B.铜活泼性弱于铁;
C.高纯硅为良好的半导体;
D.核磁共振氢谱可以检测有机物中不同氢原子种类。
4.【答案】A
【解析】【解答】解:A、菜刀切菜后和水接触易生锈,故A正确;
B、将钢铁制成不锈钢后,不锈钢的性能好于钢铁,不易生锈,故C错误;
C、在铁塔的表面喷上一层油漆,可以防止金属和水以及空气接触,故C错误;
D、埋在地下的钢管与锌块相连后,形成原电池,金属铁做正极,该极金属被保护,不易生锈,故D错误.
故选A.
【分析】A、金属生锈的条件:金属和空气以及水接触;
B、不锈钢的性能好于钢铁的;
C、防止金属生锈的条件:防止和水以及空气接触;
D、在原电池中,正极金属被保护,不易生锈.
5.【答案】B
【解析】【解答】解:A、二氧化硫的漂白性,“硫黄姜”在用硫黄熏制的过程中产生的SO2使其漂白,故A正确;
B、钢铁在潮湿的空气中易生锈,是因为空气中有氧气和水蒸气,易发生电化学腐蚀而生锈,故B错误;
C、从源头上消除工业生产对环境的污染是绿色化学的核心,故C正确;
D、CO2合成可降解的聚碳酸酯塑料,聚碳酸酯塑料能降解生成二氧化碳,所以能实现碳的循环利用,故D正确;
故选B.
【分析】A、根据二氧化硫的漂白性分析;
B、铁在潮湿的空气中放置,易发生电化学腐蚀而生锈;
C、从源头上消除工业生产对环境的污染是绿色化学的核心;
D、CO2合成可降解的聚碳酸酯塑料,聚碳酸酯塑料能降解生成二氧化碳.
6.【答案】B
【解析】【解答】解:A.脱氧过程发生氧化还原反应,为放热反应,故A错误;
B.脱氧时,负极反应式为Fe﹣2e﹣=Fe2+,铁失去电子的物质的量= =0.08mol,正极反应式为2H2O+O2+4e﹣=4OH﹣,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧化生成氢氧化铁,
所以实际上铁元素转移电子物质的量= =0.12mol,根据转移电子相等得吸收氧气体积= =672mL,故B正确;
C.铁易失电子作负极、C作正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4 e﹣=4OH﹣,故C错误;
D.铁作负极、C作正极,负极上铁失电子发生氧化反应,电极反应式为Fe﹣2e﹣=Fe2+,故D错误;
故选B.
【分析】A.脱氧过程为放热反应;
B.脱氧时,铁失去电子的物质的量= =0.08mol,根据转移电子相等计算吸收氧气体积;
C.铁易失电子作负极、C作正极,正极上氧气得电子发生还原反应;
D.铁作负极、C作正极,负极上铁失电子发生氧化反应.
7.【答案】C
【解析】【解答】A.铜、锌两电极插入稀H2SO4中组成原电池,锌比铜活泼,活泼金属锌为负极,不活泼金属铜是正极,故A不符合题意;
B.原电池中e-从负极流出,经外电路流向正极,还原剂在负极失电子发生氧化反应,故B不符合题意;
C.钢铁的吸氧腐蚀和析氢腐蚀的负极反应均为铁失电子发生氧化反应生成亚铁离子,电极反应式为Fe-2e-=Fe2+,故C符合题意;
D.电化学腐蚀因发生原电池反应,比化学腐蚀更快更普遍,危害更大,故D不符合题意;
故答案为:C。
【分析】A.B. 在Zn-Cu-稀H2SO4构成的原电池中,锌比铜活泼,活泼金属锌为负极,锌失电子,发生氧化反应,失去的电子经过外电路流向铜电极,不活泼金属铜作正极,氢离子在铜电极上得电子,发生还原反应。
C. 钢铁的吸氧腐蚀和析氢腐蚀都属于电化学腐蚀,构成了原电池,较活泼的铁作负极,失电子,发生氧化反应,其电极方程式均为Fe-2e-=Fe2+;
D. 电化学腐蚀是不纯的金属与电解质溶液接触时,发生原电池反应,比较活泼的金属失去电子而被氧化;化学腐蚀是金属与接触到的干燥气体或非电解质溶液等直接发生化学反应。
8.【答案】A
【解析】【解答】A. 嵌入锌块做负极,负极反应为Zn-2e-=Zn2+,A符合题意;
B. 上述方法为牺牲阳极的阴极保护法,即牺牲做负极的锌块保护做正极的轮船,故可以用镁合金来代替锌块,B不符合题意;
C. 由于海水呈弱碱性,铁发生吸氧腐蚀,故正极反应为2H2O+O2+4e-=4OH-,C不符合题意;
D. 此保护方法是构成了原电池,牺牲了锌块保护轮船,故为牺牲阳极的阴极保护法,D不符合题意;
故答案为:A。
【分析】轮船嵌有锌块后能形成原电池,锌块做负极被腐蚀,电极反应为Zn-2e-=Zn2+,轮船做正极被保护,氧气在正极上放电,电极反应为2H2O+O2+4e-═4OH-,据此分析。
9.【答案】C
【解析】【解答】此处铁生锈属于吸氧腐蚀。④处没有和电解质溶液接触,不能构成原电池,锈蚀速率较慢;①②③处已与电解质溶液接触,但①②处含O2较少,所以③处腐蚀最快。
【分析】吸氧腐蚀在有氧气、溶液的条件下形成原电池腐蚀速率最快,据此解答。
10.【答案】A
【解析】【解答】解:A、金属钠和氧气之间发生化学反应,和电化学无关,故A错误;
B、铁制器件在潮湿空气中因为形成原电池而生锈,和电化学有关,故B错误;
C、原电池的负极金属易被腐蚀,镀锌铁中金属铁是正极,被保护,镀锡铁中铁是负极,易被腐蚀,所以镀锌铁片比镀锡铁片更耐腐,和电化学有关,故C错误;
D、远洋海轮的外壳连接锌块,形成的原电池中,金属锌是负极,铁是正极,正极金属铁被保护,海轮的外壳连接锌块可保护轮般不受腐蚀,和电化学有关,故D错误;
故选A.
【分析】A、金属钠和氧气之间发生化学反应;
B、铁制器件在潮湿空气中因为形成原电池而生锈;
C、原电池的负极金属易被腐蚀;
D、远洋海轮的外壳连接锌块,形成的原电池中,金属锌是负极,铁是正极,正极金属被保护.
11.【答案】B
【解析】【解答】A.铁栅栏上涂上油漆可以防止铁与碳形成原电池,有利于减缓铁栅栏的腐蚀,保护方法正确,故A不符合题意;
B.与直流电源正极相连的铁闸做电解池的阳极,会加快铁闸的腐蚀,保护方法错误,故B符合题意;
C.轮船底部焊接镁块,铁镁在溶液中形成原电池,镁做原电池的负极被损耗,铁做正极被保护,保护方法正确,故C不符合题意;
D.家用铁锅水洗后及时擦干可以防止铁与碳形成原电池,有利于减缓铁锅的腐蚀,保护方法正确,故D不符合题意;
故答案为:B。
【分析】A.隔绝空气,防止铁与碳形成原电池;
B.与直流电源正极相连的铁闸做电解池的阳极,会加快铁闸的腐蚀;
C.利用牺牲阳极的阴极保护法;
D.防止铁与碳形成原电池。
12.【答案】B
【解析】 【解答】A.铁钉发生电化学吸氧腐蚀的正极反应为O
2+4e
-+2H
2O=4OH
-,故A不符合题意;
B.通过右侧图像中曲线对比可以看出,NH4+的存在是影响吸氧腐蚀速率的主要因素,氯离子对吸氧腐蚀速率影响不大,故B符合题意;
C. 根据图像,NH4+存在会加快吸氧腐蚀速率,所以向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快,故C不符合题意;
D. NH4+水解溶液显酸性,结合图像可知酸性溶液中铁钉的平均吸氧腐蚀速率大于中性溶液,故D不符合题意。
故答案为:B
【分析】吸氧腐蚀是指金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化学腐蚀。本题探究铁钉在不同溶液中的吸氧腐蚀。
A、电化学吸氧腐蚀的正极发生还原反应;
B、根据图像中氧气浓度随时间的变化分析;
C、根据图像分析;
D、根据NH4+水解溶液显酸性解答;
13.【答案】C
【解析】【解答】解:A、图1中因两溶液中氯化钠的浓度相等,因此发生的是普通的化学腐蚀,且腐蚀速率相等,电流计指针未发生偏转,铁片Ⅰ、铁片Ⅱ均被腐蚀,故A错误;
B、铁片Ⅳ的电极反应式为Fe﹣2e﹣=Fe2+,故B错误;
C、图2中因两溶液中氯化钠的浓度不相等,因此发生的是电化学腐蚀,且浓度大的一极发生的反应是Fe﹣2e﹣=Fe2+,可以用K3[Fe(CN)6]溶液检验亚铁离子的存在,进而判断电池的正、负极,故C正确;
D、自同一个原电池装置中,铁片Ⅰ、Ⅱ所处的电解质溶液浓度相同,二者的腐蚀速率相等,故D错误;
故选C.
【分析】对比两个盐桥的双液装置,图1中因两溶液中氯化钠的浓度相等,因此发生的是普通的化学腐蚀,且腐蚀速率相等,图2中因两溶液中氯化钠的浓度不相等,因此发
生的是电化学腐蚀,且浓度大的一极发生的反应是Fe﹣2e﹣=Fe2+,可以用K3[Fe(CN)6]溶液检验.
14.【答案】D
【解析】【解答】解:A.生铁片中的碳是原电池的正极,发生还原反应,铁是负极,发生氧化反应,故A错误;
B.导管内液面下降时,说明试管内压强增大,应该为析氢腐蚀,应生成氢气,碳极反应式为:2H+﹣2e﹣=H2↑,故B错误;
C.先发生析氢腐蚀,消耗氢离子,后发生吸氧腐蚀,产生氢氧根离子,U型管中溶液pH逐渐增大,故C错误;
D.试管中雨水的pH=4,酸性较强,开始时生铁片发生析氢腐蚀,一段时间后酸性减弱发生吸氧腐蚀,故D正确;
故选D.
【分析】正常雨水的pH是5.6,试管中雨水的pH=4呈酸性,生铁中含有碳和铁,酸性条件下,生铁发生析氢腐蚀生成氢气,导致具支试管内气体压强大于大气压,导管内液面下降,当溶液呈弱酸性或中性时,生铁发生吸氧腐蚀,导致具支试管中气体压强小于大气压,导管内液面回升,略高于小试管液面,据此进行解答.
15.【答案】A
【解析】【解答】A. 电解饱和食盐水时,阳极不是活泼金属电极时,在该极上放电的是溶液中活泼的阴离子即氯离子得电子的反应,电极反应为2Cl-+2e-=Cl2↑,故A符合题意;
B. 酸性氢氧燃料电池的正极是氧气得电子结合氢离子发生还原反应生成水,则电极反应为4H++O2+4e ═2H2O,故B不符合题意;
C. 粗铜精炼时,粗铜连接电源正极,纯铜连接电源负极,阳极上电极反应式为Cu-2e-=Cu2+,故C不符合题意;
D. 钢铁发生吸氧腐蚀时,铁作负极失电子发生氧化反应生成二价铁离子,电极反应为Fe-2e-=Fe2+,故D不符合题意。
故答案为:A。
【分析】A. 电解饱和食盐水时,阳极上阴离子放电,溶液中有Cl-和OH-,放电顺序Cl->OH-则Cl-得电子生成氯气;
B. 酸性氢氧燃料电池的正极:O2+4H++4e-=2H2O;
C. 粗铜精炼时,粗铜与电源正极相连,纯铜与电源负极相连;
D. 钢铁发生吸氧腐蚀时,Fe作负极失电子生成Fe2+。
16.【答案】C
【解析】【解答】A.钢铁腐蚀过程不仅发生化学能与电能的转化,钢铁的锈蚀过程属于缓慢氧化,还放出热量,所以还发生化学能与热能的转化,A不符合题意;
B.钢铁发生的腐蚀为吸氧腐蚀,负极上金属铁失电子,发生氧化反应,正极上氧气得到电子,发生还原反应,电极反应为:2H2O+O2+4e-=4OH-,B不符合题意;
C.因为反应速率与离子浓度正相关,所以电解质溶液浓度可影响钢铁腐蚀的速率, C符合题意;
D.将地下铁管与铜块连接会构成原电池,铁作负极,铜作正极,所以不能保护铁管,反而会加快铁管的腐蚀,D不符合题意;
故答案为:C。
【分析】钢铁的锈蚀发生的电化学腐蚀,化学腐蚀过程中还释放出了能量,构成原电池时,铁做负极材料,铁失去电子,发生氧化反应变为亚铁离子,正极是氧气得到电子发生还原反应,速率和浓度有关,因此电解质离子的浓度可能影响腐蚀速率,为了保护铁块可以将活泼性强的金属与钢铁连接保护钢铁
17.【答案】(1)化学
(2)负;Ag2S+2e-=2Ag +S2-
(3)3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓
(4)2H++NO +e-=NO2↑+H2O
【解析】【解答】(1)银质器皿日久表面逐渐变黑腐蚀的过程中,没有电流产生,属于化学腐蚀;
(2)由于金属活动性Al>Ag,因此铝质容器作为负极,银器作为正极,由银器上的Ag2S发生得电子的还原反应生成Ag和S2-,其电极反应式为:Ag2S+2e-=2Ag+S2-;
(3)处理过程中,Ag2S、Al和H2O反应生成Ag、H2S气体和AlOOH3沉淀,该反应的化学方程式为:3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓;
(4)若将食盐水用浓硝酸代替,由于常温下浓硝酸能使铝钝化,因此铝质容器做正极,由溶液中的NO3-发生得电子的还原反应,生成NO2,该电极反应式为:2H++NO3-+e-=NO2↑+H2O;
【分析】(1)根据腐蚀过程是否有电流产生分析属于何种腐蚀;
(2)根据金属活动性判断正负极和电极反应式;
(3)根据题干信息确定反应物和生成物,结合原子守恒书写反应的化学方程式;
(4)常温下,浓硝酸能使铝发生钝化,此时铝做正极,溶液中的NO3-发生得电子的还原反应;
18.【答案】(1)吸氧;
(2)负;
(3)阴离子;;
【解析】【解答】(1)红褐色锈斑是氧化铁,是氢氧化铁分解得到的,根据氧元素守恒,故铁锅的锈蚀主要是电化学腐蚀中的吸氧腐蚀,正极是氧气分子和水分子得到电子生成氢氧根离子,故正极反应式是
。
(2)放电过程中,锂失去电子变成
,故a电极是电源负极,
通过电解质迁移入
晶格中,生成
,而
和b电极相连,则b电极是电源的正极。每有一个
进入到
晶格中,则同时通过b电极有一个电子进入到
晶格中,故该电池正极的电极反应式为
。
(3)①从电解合成1,
二氯乙烷
的实验装置图,可知Na+通过离子交换膜Y,进入到阴极区转化为氢氧化钠。在阳极区,氯化亚铜失去电子变成氯化铜,则Cl-通过离子交换膜X进入到阳极区,故离子交换膜X为阴离子交换膜。
②阴极区发生的反应主要是水电离出的氢离子得到电子生成氢气,同时生成氢氧根离子,故发生反应的化学方程式是
。
③根据阳极区域液相反应中的各物质前的箭头符号,可知反应物有乙烯和氯化铜,生成物是1,
二氯乙烷和氯化亚铜,故反应的化学方程式是
,其中氯化亚铜在阳极失去电子又生成氯化铜,如此循环。
【分析】(1)铁在酸性环境中发生析氢腐蚀,在中性和碱性环境中发生吸氧腐蚀;
(2)由图1得,a电极失去电子,为负极,电极反应式为:Li e =Li+,b电极得到电子,为正极,电极反应式为:Li++e +MnO2=LiMnO2;
(3)由图可知,右边电极连接电源负极,为阴极,电极反应式为:2H2O+2e =H2↑+2OH ,左边电极连接电源正极,为阳极,电极反应式为:CuCl e +Cl =CuCl2,电解池中,阳离子移向阴极,阴离子移向阳极,即氯离子移向阳极,钠离子移向阴极,液相反应中,反应物有C2H4、CuCl2,生成物有ClCH2CH2Cl、CuCl。
19.【答案】(1)负极;;;K+
(2)Fe;C;正极;
【解析】【解答】(1)铜锌形成的原电池,比活泼,为负极,发生反应为:,为正极,在溶液中发生反应:,在原电池中,阳离子向正极移动,所以盐桥中向CuSO4溶液中迁移的离子是。
(2)图1中,和形成原电池的两级,比活泼,做负极,被腐蚀;图2在碱性条件下,有参与反应,故该腐蚀为吸氧腐蚀,选C;图1中,和形成原电池的两级,比活泼,做负极,作正极;图2在铁生锈的过程中,正极反应为:。
【分析】(1)电池工作时,负极失电子,发生氧化反应,正极得电子,发生还原反应;溶液中阴离子向负极移动,阳离子向正极定向移动。
(2)中性或弱酸性条件下,金属发生吸氧腐蚀,酸性环境下,金属发生析氢腐蚀;电池工作时,负极失电子,发生氧化反应,正极得电子,发生还原反应。
20.【答案】(1)Fe+2H+=Fe2++H2↑
(2)(2)2H++2e-=H2↑;增大;Zn;Zn+2H+=Zn2++H2↑;B>A>C
【解析】【解答】铁在不同的情况下被腐蚀的速率不同。作原电池的负极时易被腐蚀,作原电池的正极时受到保护不被腐蚀。
【分析】(1)铁与稀硫酸反应生成硫酸亚铁和氢气;
(2)Fe比Sn活泼,Fe作负极(被腐蚀),发生氧化反应;Sn作正极(被保护),发生还原反应;电化学腐蚀的速率大于化学腐蚀的速率,由此即可得出答案。
21.【答案】(1)吸氧
(2)O2+4e-+2H2O=4OH-
(3)正极;阴极
(4)2Cl- + 2H2O =(电解)H2↑+Cl2↑+2OH-
(5)增大;HCl 气体
(6)锌;二氧化锰;氢氧化钾溶液
【解析】【解答】I.(1)炒过菜的铁锅因腐蚀而出现红褐色锈斑,铁锅中电解质溶液一般为弱酸性或者中性,溶解空气中一定量的氧气,发生吸氧腐蚀,故答案为:吸氧。
(2)铁锅发生吸氧腐蚀时,氧气在正极得到电子,发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-。
II.(3)根据题意“B电极附近溶液先变红”,说明B电极生成了NaOH,则B为阴极,A为阳极,与电源正极相连的是电解池的阳极,故答案为:正极,阴极。
(4)根据分析可知,氯化钠和水都被电解,所以总的反应式为2Cl-+2H2O Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O Cl2↑+H2↑+2OH-。
(5)电解后生成了OH-,所以溶液的pH值增大,电解过程中逸出了氢气和氯气,要使电解后溶液恢复到电解前的状态,则需加入HCl气体,故答案为:增大,HCl气体。
(6)碱性锌锰干电池总反应方程式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,由反应方程式可知,Zn为负极,MnO2为正极,电解质溶液是氢氧化钾溶液,故答案为:锌,二氧化锰,氢氧化钾溶液。
【分析】 I .(1)铁在中性溶液中发生吸氧腐蚀;
(2)吸氧腐蚀中正极发生的是氧气得电子被还原生成氢氧根离子;
Ⅱ.(3)电解饱和氯化钠溶液,阴极附近呈碱性,能使酚酞溶液变红色,阴极连接的是电源的负极;
(4)电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠;
(5)电解产物中有氢氧化钠生成,碱性增强,电解过程中脱离反应体系的是HCl,所以再通入HCl可恢复原来的溶液;
(6)根据干电池的构成进行解答。
