第三章物质在水溶液中的行为单元测试2023---2024学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第三章物质在水溶液中的行为单元测试2023---2024学年上学期高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 538.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 16:46:26 | ||
图片预览




文档简介
第三章 物质在水溶液中的行为 单元测试
一、单选题(第12题)
1.辛勤劳动才能创造美好生活。下列劳动与所涉及的化学知识不相符的是
选项 劳动项目 化学知识
A 社区服务:回收旧衣物并进行分类 棉、麻和丝主要成分均为纤维素
B 家务劳动:用热的纯碱溶液去除餐具的油污 碳酸钠溶液显碱性
C 校内劳动:用稀硝酸处理做过银镜反应的试管 硝酸具有强氧化性
D 学农活动:利用豆科植物作绿肥进行施肥 豆科植物可实现自然固氮
A.A B.B C.C D.D
2.①已知t ℃时AgCl的Ksp=2.0×10-10;②在t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
A.在t ℃时,Ag2CrO4的Ksp为1.0×10-12
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t ℃时,以0.01 mol·L-1AgNO3溶液滴定20.00 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液,CrO42-后沉淀
D.在t ℃时,反应Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO (aq)的平衡常数K=2.5×107
3.下列实验操作、实验现象和实验结论均正确的是
选项 实验操作 实验现象 实验结论
A 将大小相同的金属钠分别投入水和乙醇中 钠与水反应比钠与乙醇反应剧烈 乙醇羟基中的氢原子比水分子中的氢原子活泼
B 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 溶液变红 稀硫酸能氧化Fe2+
C 室温下,用pH试纸分别测定浓度为0.1 mol L 1NaClO溶液和0.1 mol L 1CH3COONa溶液的pH pH试纸都变成碱色 可以用 pH试纸的颜色与标准比色卡比较,从而判断HClO和CH3COOH的酸性强弱
D 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量Na2S溶液 开始有白色沉淀生成,后有黑色沉淀生成 Ksp(Ag2S) <Ksp(AgCl)
A.A B.B C.C D.D
4.代表阿伏加德罗常数的值。下列说法正确的是
A.1 mol 与3 mol 在一定条件下充分反应,转移的电子数为
B.11.2 L CO和混合气体中含有的质子数为
C.1 L 1 mol·L溴化铵水溶液中与的数量之和大于
D.25℃时,的溶液中含有数为
5.已知25℃时,AgCl的溶度积Ksp=l.8×10 10,则下列说法不正确的是
A.温度一定时,当溶液中c(Ag+)·c(Cl )=Ksp时,此溶液中必有AgCl的沉淀析出
B.AgNO3溶液与NaCl溶液混合后的溶液中,可能有c(Ag+)=c(Cl )
C.向饱和AgCl水溶液中加入盐酸,Ksp不变
D.将AgCl加入到较浓的KI溶液中,部分AgCl可以转化为AgI
6.下表中对离子方程式的评价不合理的是
选项 化学反应及其离子方程式 评价
A 向碳酸钙上滴加稀盐酸: 错误,碳酸钙不应该写成
B 向硫酸铵溶液中加氢氧化钡溶液: 正确
C 铁粉与稀硫酸反应: 错误,H+的氧化性较弱,只能将铁单质氧化为Fe2+
D 碳酸氢钠溶液与过量澄清石灰水反应: 错误,碳酸氢钠溶液少量,书写的离子方程式中的化学计量数应为1
A.A B.B C.C D.D
7.NA为阿伏加德罗常数的值。下列叙述正确的是
A.T℃时,MgCO3的Ksp=4×10-6,则饱和MgCO3溶液中Mg2+的数目为2×10-3NA
B.C4H8和C3H6的混合物的质量为ag,所含C—H键数目为
C.反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4中,生成0.3mol氧化产物时转移的电子数为1.4NA
D.用铅蓄电池电解氯化钠溶液得到标准状况下22.4L氢气时理论上铅蓄电池中消耗氢离子数目为2NA
8.下列有关实验操作、实验现象和得出的结论均正确的是
选项 实验操作 实验现象 结论
A 将通入溴水中 溴水颜色褪去 具有漂白性
B 常温下,用广泛试纸测定0.1溶液的 试纸变为淡蓝色 是弱酸
C 向溶液中同时通入和气体 无沉淀生成 不能和反应生成和
D 向盛有溶液的试管中加入苯和溶液 溶液分层,上层溶液变紫红色,下层有黄色沉淀生成 溶液中存在平衡:
A.A B.B C.C D.D
9.常温下,下列各组离子一定能在指定溶液中大量共存的是
A.能使pH试纸变红的溶液中:、、、
B.在的溶液中:、、、
C.能使甲基橙变红的溶液中:、、、
D.水电离的的溶液中:、、、
10.下列说法正确的是
A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B.HClO是弱酸,所以NaClO是弱电解质
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
11.下列有关电解质溶液的说法正确的是
A.常温下,将盐酸稀释至1000mL,所得溶液的pH约为9
B.等pH的盐酸和醋酸溶液,分别中和等量的NaOH,消耗醋酸的体积多
C.NaCl溶液和溶液均显中性,两溶液中水的电离程度相同
D.物质的量浓度相等的①②③三种溶液中,由大到小的顺序为:②>①>③
12.黄钠铁矾[]用作净水剂。以工业废料铁泥(主要成分是,还含有Fe、FeO、)为原料制取黄钠铁矾的工艺流程如图:
下列说法错误的是
A.“预处理”的目的是除去铁泥中的油污,X可以选用NaOH
B.“酸溶”时,为了提高酸浸率,可以延长时间
C.“氧化”过程中NaClO可以用代替
D.“滤液”的主要成分为
二、填空题(共10题)
13.(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是 。
(2)25℃时,利用pH试纸测得0.1mol L-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为 ;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将 (填“增大”、“减小”或“无法确定”)。
(3)25 ℃时,pH=3的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= (取近似值)
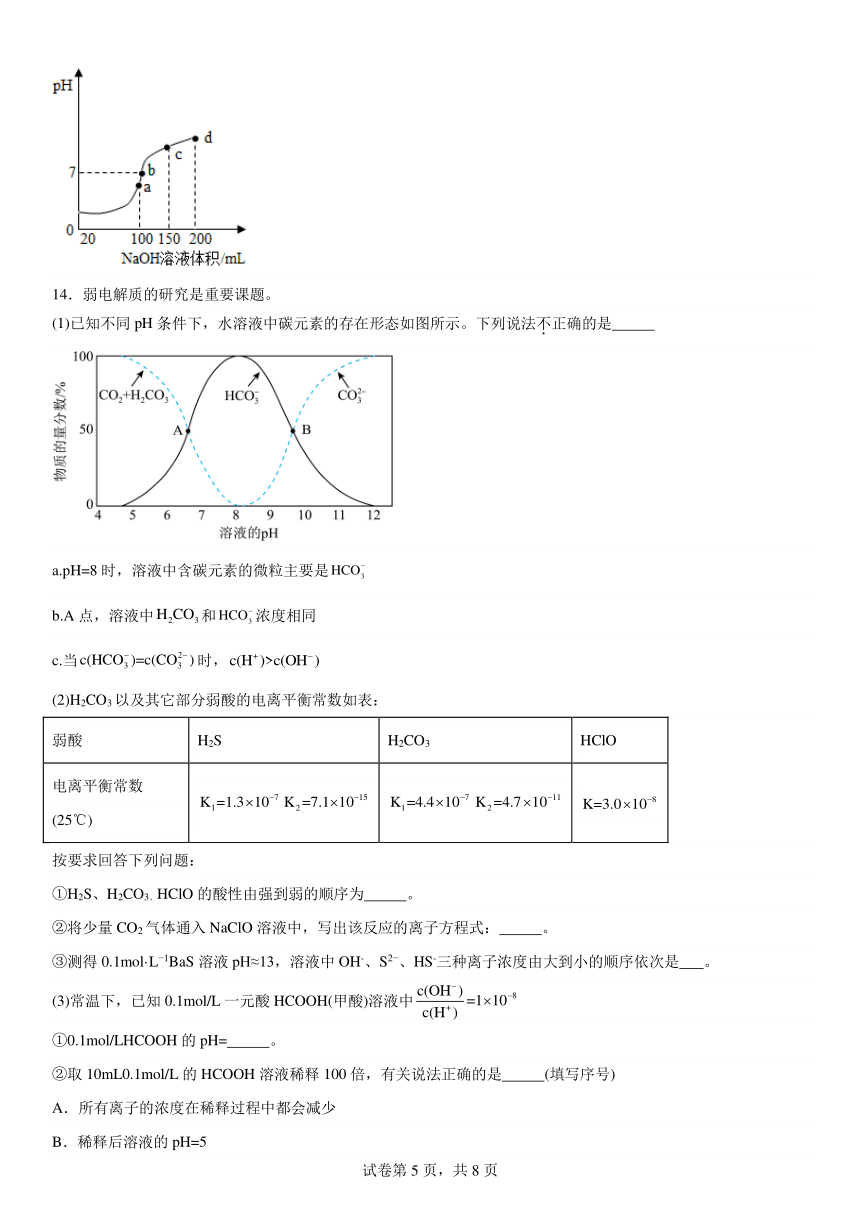
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是 点;在b点,溶液中各离子浓度由大到小的排列顺序是
14.弱电解质的研究是重要课题。
(1)已知不同pH条件下,水溶液中碳元素的存在形态如图所示。下列说法不正确的是
a.pH=8时,溶液中含碳元素的微粒主要是
b.A点,溶液中和浓度相同
c.当时,
(2)H2CO3以及其它部分弱酸的电离平衡常数如表:
弱酸 H2S H2CO3 HClO
电离平衡常数(25℃)
按要求回答下列问题:
①H2S、H2CO3、HClO的酸性由强到弱的顺序为 。
②将少量CO2气体通入NaClO溶液中,写出该反应的离子方程式: 。
③测得0.1mol·L 1BaS溶液pH≈13,溶液中OH-、S2 、HS-三种离子浓度由大到小的顺序依次是 。
(3)常温下,已知0.1mol/L一元酸HCOOH(甲酸)溶液中
①0.1mol/LHCOOH的pH= 。
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是 (填写序号)
A.所有离子的浓度在稀释过程中都会减少
B.稀释后溶液的pH=5
C.稀释后甲酸的电离度会增大
D.与稀释前比较,稀释后水的电离程度增大
15.常温下有浓度均为0.1mol/L的四种溶液:①HCl;②CH3COOH;③NaOH;④Na2CO3。
(1)这四种溶液中水的电离程度由大到小的顺序是 (用序号填写)。
(2)等体积混合②和③的溶液中离子浓度的大小顺序是 。
(3)常温下,0.1 mol/L的CH3COOH溶液pH=3,则CH3COOH溶液的电离平衡常数Ka= 。
(4)用离子方程式表示④的水溶液呈碱性的主要原因: 。
(5)取10 mL溶液①,加水稀释到1000 mL,则该溶液中由水电离出的c(H+)约为 。
16.根据有关知识回答下列问题
(1)25℃时,0.1mol L-1的一元酸HA溶液中c(H+)=1.0×10-4mol L-1,此时溶液的pH= ,HA是 酸(填“强”或“弱”)。
(2)现有NaHCO3、NaHSO3、NaHSO4三种常见的酸式盐,它们在工业生产和日常生活中有着广泛的应用。
①25℃时,NaHCO3的水溶液显 性(填“酸”或“碱”)。
②25℃时,物质的量浓度均为0.01mol L-1的三种酸式盐溶液,pH最小是 。
(3)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(杂质不参与反应)。
实验步骤:准确称取1gNa2C2O4固体样品,配制成100mL溶液,取出20.00mL于锥形瓶中。再向锥形瓶中加入足量稀H2SO4溶液,用0.016mol L-1高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在 滴定管中。(填“酸式”或“碱式”)。
②滴定至终点时的实验现象是: 。
③下列操作可能使测量结果偏高的是 。
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度 。(Na2C2O4的相对分子质量为134)
17.I.某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr (OH)3、H2O、H2O2。 已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目: 。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为 。
II.从定性分析到定量研究是高中生化学学习的重要发展历程。请你根据所学知识对以下化学问题进行定量分析。
(5)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为 , 被氧化的N原子的物质的量为 。
(6)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为 、 、 。
18.溶液的酸碱性溶液的酸碱性的判断标准是溶液中c(H+)与c(OH-)的相对大小,其具体关系为:
c(H+)与c(OH-) 相对大小 c(H+)的范围(25 ℃)
中性溶液 c(OH-) c(H+) c(H+) 1.0×10-7 mol·L-1
酸性溶液 c(OH-) c(H+) c(H+) 1.0×10-7 mol·L-1
碱性溶液 c(OH-) c(H+) c(H+) 1.0×10-7 mol·L-1
19.(1)元素N与Cl的非金属性均较强,但常温下氮气远比氯气稳定,主要原因是 。
(2)CO2的电子式是 。
(3)六亚甲基四胺()的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-8。室温下,0.01mol·L-1六亚甲基四胺水溶液的pH等于 (只考虑六亚甲基四胺的一级电离,忽略H2O的电离)。
(4)比较等浓度的NaHCO3和C6H5ONa溶液的碱性强弱:NaHCO3 C6H5ONa。
(5),请用系统命名法对该有机物命名 。
20.现用蓄电池Fe+NiO2+2H2OFe(OH)2+Ni(OH)2为电源,制取少量高铁酸钾(K2FeO4)。反应装置如图所示:
(1)电解时,石墨电极连接的a极上放电的物质为 (填“Fe”或“NiO2”)。
(2)写出电解池中铁电极发生的电极反应式 。
(3)当消耗掉0.1 mol NiO2时,生成高铁酸钾 g。
(4)Mg和Fe都是生产生活中的常用金属。加热锅炉时,水中的MgCO3可以先转化为Mg(HCO3)2,然后转化为Mg(OH)2,求MgCO3+H2O Mg2+++OH-在80℃时的平衡常数 。(已知:80℃时H2O的Kw=2.5×10 13,Ksp(MgCO3)=8.4×10 6,Ka1(H2CO3)=4.2×10 7、Ka2(H2CO3)=5.6×10 11)。
21.(1)医院里曾用的稀溶液作手术刀的消毒剂。熔点低,熔融时不导电。HgS难溶于水和稀的强酸却易溶于饱和NaCl溶液中生成。据此分析是 化合物(填“离子”或“共价”),HgS溶于饱和NaCl溶液的离子方程式为 。
(2)Cu2S是火法炼铜一种重要的原料,下面是由冶炼铜及制取的流程图:
写出①中火法治铜的化学方程式 。
②中的一系列操作为 。
(3)配制溶液时,需加少量稀盐酸和铁粉,分别用方程式表述原因: 、 。
22.实验和理论是学习化学的两种重要途径,按要求回答下列问题:
Ⅰ.硫酸型酸雨的形成有如下可能的反应途径:
途径①:SO2+H2O=H2SO3,O2+2H2SO32H2SO4;
途径②:2SO2+O22SO3,SO3+H2O=H2SO4。
(1)上述反应中作氧化剂的是 (填化学式)。
(2)已知二氧化硫可与硫化氢气体反应,反应的化学方程式为SO2+2H2S=3S↓+2H2O。请用单线桥法标出电子转移的方向和数目: 。被氧化与被还原的元素的质量之比为 。
(3)SO2与CO2性质相似,均可与澄清石灰水反应,产生白色沉淀,将少量的SO2气体通入澄清石灰水中,写出该反应的离子方程式: 。
Ⅱ.某地有瓶溶液只含C1-、、,Ag+、Na+、Cu2+六种离子中的某几种,为确定离子种类做了如下实验:
①取少量原溶液于试管A中,观察,溶液呈无色。
②试管A中加入足量BaCl2溶液,有白色沉淀生成,再加稀硝酸,沉淀完全溶解。
③取②反应后的澄清溶液于试管B中,加入AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
(4)试分析原溶液中一定含有的离子是 ,一定不含有的离子是 ,可能含有的离子是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.棉、麻的主要成分为纤维素,丝的主要成分是蛋白质,劳动与所涉及的化学知识不相符,故A符合题意;
B.碳酸钠水解显碱性,即+H2O+OH-,+H2OH2CO3+OH-,可除去油污,且水解为吸热反应,加热促进水解,因此可用热的纯碱溶液洗涤餐具上的油污,劳动与所涉及的化学知识相符,故B不符合题意;
C.稀硝酸和Ag反应生成硝酸银、NO和水,即3Ag+4HNO3=3AgNO3+NO↑+2H2O,该反应中N元素化合价由+5价得电子降低到+2价,被还原,HNO3作氧化剂,具有强氧化性,劳动与所涉及的化学知识相符,故C不符合题意;
D.豆科植物与根瘤菌共生,根瘤菌能够固氮,即将空气中的氮气通过生物化学过程转化为含氮化合物,提高土壤中氮肥的含量,劳动与所涉及的化学知识相符,故D不符合题意;
答案为A。
2.B
【详解】A、依据图象曲线上的数据结合溶度积常数概念计算得到,曲线上的点是沉淀溶解平衡。Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4 (s)2Ag+ +CrO42-,Ksp=c2(Ag+)·c(CrO42-)=(10-3)2×10-6=10-12,故A正确;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B错误;
C、依据溶度积常数计算Ksp(Ag2CrO4)= c2(Ag+)·c(CrO42-)=1×10-12;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)==10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)==2×10-8mol/L,所以先析出氯化银沉淀,故C正确;
D、K====2.5×107,故D正确。
答案选B。
3.D
【详解】A.钠与水反应比钠与乙醇反应剧烈,因此水分子中的氢原子比乙醇羟基中的氢原子活泼,故A错误;
B.将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液,主要是硝酸根在酸性条件下氧化亚铁离子变为铁离子而变为红色,故B错误;
C.不能用pH试纸测定浓度为0.1mol·L-1NaClO溶液的pH值,故C错误;
D.向少量AgNO3溶液中滴加适量NaCl溶液,生成白色沉淀,银离子消耗完,再滴加适量Na2S溶液,生成黑色沉淀,说明白色沉淀转化为更难溶的硫化银沉淀,因此Ksp(Ag2S) < Ksp(AgCl),故D正确。
综上所述,答案为D。
4.C
【详解】A.1 mol 与3 mol 若完全反应生成2molNH3,转移6mol电子,转移电子数为,但由于氮气和氢气的反应为可逆反应,反应不能进行完全,转移电子数少于6NA,A错误;
B.未指明气体所处状态,无法计算气体的物质的量,B错误;
C.1L1mol/L溴化铵水溶液中Br-数目为,根据电荷守恒c(Br-)+c(OH-)=c()+c(H+),所以与的数量之和大于,C正确;
D.溶液的体积未知,无法计算的物质的量,D错误;
故选C。
5.A
【详解】A.当溶液中c(Ag+)c(Cl-)=Ksp时,为饱和溶液,不一定有AgCl的沉淀析出,故A错误;
B.AgNO3溶液与NaCl溶液混合后的溶液中,可能存在c(Ag+)=c(Cl-),混合溶液中c(Ag+)和c(Cl-)的大小,取决于硝酸银和氯化钠的相对量的大小,故B正确;
C.向饱和AgCl水溶液中加入盐酸,氯离子浓度增大,沉淀溶解平衡左移生成沉淀,但温度一定,溶度积常数不变,所以Ksp值不变,故C正确;
D.将固体AgCl加入到较浓的KI溶液中,AgCl溶解度大于AgI,部分AgCl转化为AgI,故D正确;
故选A。
6.B
【详解】A.向碳酸钙上滴加稀盐酸,离子方程式:2H++CaCO3=CO2↑+H2O+Ca2+,碳酸钙不应该写成,评价合理,A正确;
B.向硫酸铵溶液中加入氢氧化钡溶液的离子反应为2NH4++2OH-+Ba2++SO42-═BaSO4↓+2NH3 H2O,B错误;
C.铁粉与稀硫酸反应,离子方程式:Fe+2H+═Fe2++H2↑,评价正确,C正确;
D.碳酸氢钠溶液与过量澄清石灰水反应:,评价正确,D正确;
故答案选:B。
7.B
【详解】A.饱和MgCO3溶液中c(Mg2+)=c(CO)==2×10-3mol·L-1,但题中没有说明溶液的体积,无法计算Mg2+物质的量,故A错误;
B.C4H8和C3H6都是烃,有几个H原子就有几个C-H,假设ag全部是C4H8,则C-H的物质的量为mol=mol,假设全部是C3H6,则C-H的物质的量为mol=mol,因此ag该混合物中C-H物质的量为mol,故B正确;
C.FeS2中S显-1价,Fe显+2价,根据反应方程式可知,只有3mol-1价S被氧化成+6价S,根据S元素守恒,得到3mol氧化产物,转移电子物质的量为3mol×[6-(-1)]=21mol,即生成0.3mol氧化产物,转移电子物质的量为2.1mol,故C错误;
D.电解饱和食盐水:2NaCl+2H2O2NaOH+H2↑+Cl2↑,铅酸蓄电池总电极反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,建立关系式为H2~2e-~4H+,产生标准状况下1molH2时,消耗H+物质的量为4mol,故D错误;
答案为B。
8.D
【详解】A.与溴水发生反应:,从而使溴水褪色,体现了的还原性,与漂白性无关,故A错误;
B.试纸遇酸变红遇碱变蓝,故B错误;
C.向溶液中同时通入和,可能发生两种反应:、;若发生第一个反应,生成的不与反应,则无沉淀生成,若发生第二个反应,生成的与反应生成沉淀;无论发生哪个反应,都没有产生,所以不能得出选项所给结论,故C错误;
D.向盛有溶液的试管中加入苯,溶液分层,苯的密度比水的密度小,上层溶液(苯层)变为紫红色,说明苯萃取出了碘单质;加入溶液后,下层溶液(水层)出现黄色沉淀(AgI),说明水层中含有碘离子;因此说明溶液中含有I2和I-,即溶液中存在:,故D正确;
答案选D。
9.D
【详解】A.能使pH试纸变红的溶液,说明溶液中含有:与反应生成二氧化碳和水,故A不符合题意;
B.在的溶液,说明含有大量,与反应生成沉淀而不能大量共存,故B不符合题意;
C.能使甲基橙变红的溶液,溶液中含有:与反应生成HClO而不能大量共存,故C不符合题意;
D.水电离的的溶液中,说明溶液可能是酸溶液,可能是碱溶液:、、、在酸溶液或碱溶液中都大量共存,故D符合题意;
综上所述,答案为D。
10.D
【详解】A.SO3溶于水后能导电,是因为SO3与水反应生成了强电解质H2SO4,H2SO4溶液能导电,和SO3本身无关,SO3是非电解质,故A项错误;
B.次氯酸属于弱酸,溶液中只能部分电离,而次氯酸钠为强电解质,溶液中完全电离出钠离子和次氯酸根离子,故B错误;
C.氯化氢是共价化合物,故C错误;
D.钠盐都是强电解质,所以杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质,故D正确;
故选D。
11.D
【详解】A.酸溶液稀释不能变成碱,溶液中氢离子浓度无限接近与10-7,A错误;
B.pH相同的盐酸和醋酸,醋酸浓度大于盐酸,二者都是一元酸,与等量的NaOH溶液反应,消耗酸的物质的量相等,根据n=CV知,酸的浓度越大需要酸的体积越小,所以消耗酸体积大小关系为V(CH3COOH)C.醋酸氨是弱酸弱碱盐,水溶液中发生水解,CH3COONH4促进水的电离,醋酸根离子水解程度和铵根离子水解程度相近溶液呈中性,NaCl是强酸强碱盐对水的电离无影响,所以两溶液中水的电离程度不同,C错误;
D.铵根水解,① 电离出H+,抑制铵根电离,②中铵根系数最大,浓度最大,③中,水解出的H+抑制铵根电离,故铵根浓度关系为:②>①>③,D正确;
故答案为:D。
12.D
【分析】工业废料铁泥主要含,还含有Fe、FeO、等,由流程可知,预处理阶段加入X除去铁泥中的油污,然后加入稀硫酸,酸浸后的酸性溶液中含有Fe2+,过滤分离出滤渣为,加入NaClO将二价铁离子氧化成三价铁离子,再加入碳酸钠、硫酸钠溶液使铁离子全部沉淀生成黄钠铁矾[]。
【详解】A.油污在碱性条件下能发生水解反应,则X可以选用NaOH,A不符合题意;
B.延长时间可以使废料更充分地溶于酸溶液,提高酸浸率,B不符合题意;
C.可将二价铁离子氧化成三价铁离子,自身被还原为水,不引入新杂质,C不符合题意;
D.“沉铁”过程发生反应:,消耗了硫酸钠和碳酸钠,而“氧化”过程中NaClO被还原为氯离子,滤液中的主要成分应该是氯化钠,D符合题意;
故选D。
13. 1:10 10-5mol·L-1 减小 10-3mol·L-1 a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
【详解】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,则c[Ba(OH)2]=510-3mol/L,c(OH-)=110-2mol/L。pH=3的盐酸中,c(H+)=110-3mol/L。混合后溶液的pH=7,因为c(OH-)=10 c(H+),则氢氧化钡溶液和盐酸的体积之比是1:10。
(2)25℃时,利用pH试纸测得0.1mol L-1醋酸溶液的pH约为3,c(H+)=mol/L,则可以估算出醋酸的电离常数为mol/L;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,因为c(CH3COOH)变大后CH3COOH的电离程度变小,所以溶液中c(H+)/c(CH3COOH)的值将减小。
(3)25 ℃时,pH=3的NH4Al(SO4)2中,c(H+)=10-3mol·L-1、c(OH-)=10-11mol·L-1,由电荷守恒,得2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3mol·L-1-10-11mol·L-110-3mol·L-1.
(4)NH4HSO4溶液中,NH4HSO4完全电离,NH4HSO4= NH4++H++SO42-,溶液的酸性主要由其电离产生的H+决定的,水的电离受到其电离产生H+的抑制;当与反应2NH4HSO4+2NaOH=Na2SO4+ (NH4)2SO4+2H2O恰好完成时,因铵根离子水解溶液仍显酸性,但是铵根水解促进了水的电离,水的电离程度达到最大,此后继续加入NaOH溶液,溶液中铵根离子的浓度逐渐减小,溶液的pH逐渐增大,水的电离程度逐渐减小。由图可知,a、b、c、d四个点中,a点代表的是2NH4HSO4+2NaOH=Na2SO4+ (NH4)2SO4+2H2O恰好完成时,所以水的电离程度最大的是a点;在a点c(Na+)=2c(SO42-)->c(NH4+),则在b点,c(Na+)>2c(SO42-), 由pH=7得c(OH-)=c(H+),所以溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42)->c(NH4+)>c(OH-)=c(H+)。
14.(1)bc
(2) c(OH-)>c(HS-)>c(S2 )
(3) 3 CD
【详解】(1)a.根据图示,pH=8时,溶液中含碳元素的微粒主要是,故a正确;
B.A点,溶液中和CO2的浓度和与浓度相同,故b错误;
C.根据图示,当时,溶液呈碱性,,故c错误;
选bc。
(2)①电离平衡常数越大,酸性越强,H2S、H2CO3、HClO的酸性由强到弱的顺序为。
②酸性,根据强酸制弱酸,将少量CO2气体通入NaClO溶液中生成次氯酸和碳酸氢钠,该反应的离子方程式为。
③测得0.1mol·L 1BaS溶液pH≈13,c(OH-)=10-1,说明S2-水解程度大,水解方程式为、,溶液中OH-、S2 、HS-三种离子浓度由大到小的顺序依次是c(OH-)>c(HS-)>c(S2 )。
(3)①0.1mol/L一元酸HCOOH(甲酸)溶液中,c(H+)=10-3,则0.1mol/LHCOOH的pH=3。
②A.10mL0.1mol/L的HCOOH溶液稀释100倍,氢离子浓度减小,氢氧根离子浓度增大,故A错误;
B.加水稀释,HCOOH的电离平衡正向移动,稀释后溶液的pH<5,故B错误;
C.弱电解质越稀越电离,稀释后甲酸的电离度会增大,故C正确;
D.稀释后氢离子浓度降低,对水电离抑制作用减弱,与稀释前比较,稀释后水的电离程度增大,故D正确;
选CD。
15. ④>②>①=③ c(Na+) > c(CH3COO-) > c(OH-) > c(H+) 10-5 CO+H2OHCO+OH-,HCO+H2OH2CO3+OH- 10 11mol/L
【详解】(1)水电离程度比较:碳酸钠溶液属于强碱弱酸盐,碳酸根离子水解导致溶液显碱性,促进了水的电离;盐酸是强酸溶液,氢氧化钠溶液是强碱溶液,溶液中水的电离都受到了抑制作用,其中盐酸中的氢离子浓度等于氢氧化钠溶液中的氢氧根离子浓度,二者中水的电离程度相等;醋酸溶液为弱酸,发生微弱的电离产生氢离子,抑制了水的电离,但醋酸溶液中氢离子浓度远小于盐酸,故水的电离程度比盐酸和氢氧化钠都强,综合而言这四种溶液中水的电离程度由大到小的顺序是④>②>①=③。故答案为:④>②>①=③。
(2)等体积的醋酸和氢氧化钠混合,混合后溶液恰好为醋酸钠溶液,属于强碱弱酸盐,醋酸根离子发生微弱的水解导致溶液显碱性,所以溶液中离子浓度的大小顺序是c(Na+) > c(CH3COO-) > c(OH-) > c(H+)。故答案为:c(Na+) > c(CH3COO-) > c(OH-) > c(H+)。
(3) 常温下,0.1 mol/L的CH3COOH溶液pH=3,可得溶液中c(H+) = 10-3 mol/L,由醋酸的电离方程式:CH3COOH CH3COO- + H+可得其电离平衡常数为: ,故答案为:10-5。
(4) 碳酸钠溶液属于强碱弱酸盐,碳酸根离子水解导致溶液显碱性,促进了水的电离,其水解方程式为:CO+H2OHCO+OH-,HCO+H2OH2CO3+OH-,故答案为:CO+H2OHCO+OH-,HCO+H2OH2CO3+OH-。
(5) 取10 mL HCl溶液,加水稀释到1000 mL,此时溶液中由HCl电离出的,由此可知,此时溶液中的c(H+)=10-3mol/L,可得该溶液中由水电离出的,故答案为:10 11mol/L。
16.(1) 4 弱
(2) 碱 NaHSO4
(3) 酸式 当滴入最后半滴酸性KMnO4溶液时,溶液颜色恰好由无色变为浅紫色,且半分钟内不褪 B 67%
【解析】(1)
c(H+)=1.0×10-4mol L-1,此时溶液的pH=-lgc(H+)=-lg(1.0×10-4)=4,一元酸HA的浓度为0.1mol L-1,而c(H+)=1.0×10-4mol L-1,说明酸部分电离,为弱酸。
(2)
①25℃时,NaHCO3的水溶液显碱性。
②25C时,物质的量浓度均为0.01mol L-1的三种酸式盐溶液,由于HSO完全电离,而HSO、HCO难电离,所以pH最小的是NaHSO4。
(3)
①为了防止高锰酸钾腐蚀橡胶管,高锰酸钾溶液应装在酸式滴定管中。
②滴定至终点时的实验现象是:加最后一滴酸性高锰酸钾溶液,溶液恰好由无色变为浅紫色,且30s内不褪色。
③A.Na2C2O4溶液被稀释,消耗高锰酸钾溶液体积减小,使测量结果偏低;B.高锰酸钾溶液体积数值增大,使测量结果偏高;C.初读数偏大,终读数偏小,高锰酸钾溶液体积数值减小,使测量结果偏低;D.不影响测量结果。故选B。
④样品中Na2C2O4的纯度为=67%。
17. H2O2 H2CrO4 Cr(OH)3 =2Cr(OH)3↓+3O2↑+2H2O 3.36 L 1.25 NA 3.75 mol 0.24moL 0.64moL 0.02moL
【详解】(1)由信息H2O2→O2中可知O元素的化合价由-1价升高到0,故H2O2为还原剂;
(2)氧化剂发生还原反应,所含元素化合价降低的物质为氧化剂。Cr元素的化合价降低,即还原反应的过程为H2CrO4→Cr(OH)3;
(3)该反应中O元素失电子,Cr元素得到电子,2molH2CrO4反应转移电子为2mol×(6-3)=6mol,则用单线桥法标出电子转移的方向和数目为:=2Cr(OH)3↓+3O2↑+2H2O
(4)由2H2CrO4+3H2O2=2Cr(OH)3↓+3O2↑+2H2O可知生成3mol气体转移6mol电子,转移了0.3mol电子则产生的气体的物质的量为=0.15mol,气体在标准状况下体积为0.15mol×22.4L/mol=3.36L;
(5)在反应10NaN3+2KNO3=K2O+5Na2O+16N2↑中N元素化合价既有升高,又有降低,N2既是氧化产物又是还原产物。根据反应方程式可知,每当生成16molN2,其中氧化产物15mol,还原产物1mol,氧化产物比还原产物多14mol,转移电子的物质的量为10mol。现氧化产物比还原产物多1.75mol,则转移电子的物质的量为=1.25mol,转移电子数为1.25NA(1.25×6.02×1023或7.525×1023);转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为=3.75mol;
(6)1 L内含0.24molK2SO4、0.5molNH4Cl、0.16molKCl的营养液中,n(K+)=0.24mol×2+0.16mol=0.64mol,n()=0.24mol,n()=0.5mol,n(Cl-)=0.5mol+0.16mol=0.66mol,设需用(NH4)2SO4、KCl、NH4Cl的物质的量分别为x、y、z,根据、、K+守恒可得:
,解得,故需要(NH4)2SO4、KCl、NH4Cl的物质的量分别为0.24mol、0.64mol、0.02mol;
18. = = < > > <
【详解】25 ℃水的Kw=10-14,中性溶液氢离子浓度等于氢氧根离子浓度,c(H+)=c(OH-),c(H+)=c(OH-)=1.0×10-7 mol·L-1;酸性溶液氢离子浓度大于氢氧根离子浓度,c(OH-) 1.0×10-7 mol·L-1;碱性溶液氢离子浓度小于氢氧根离子浓度,c(OH-) >c(H+),c(H+)<1.0×10-7 mol·L-1。
19. 氮气分子中两个氮原子间共用三对电子,键能很大,而氯气分子中两个氯原子间只共用一对电子,键能较小,所以常温下氮气远比氯气稳定 9 弱于 2,2,3-三甲基戊烷
【详解】(1)氮气分子中两个氮原子间共用三对电子,键能很大,而氯气分子中两个氯原子间只共用一对电子,键能较小,所以常温下氮气远比氯气稳定。
(2)二氧化碳分子中,碳原子和每个氧原子都共用两对电子,从而使碳原子和氧原子都达到了8电子稳定结构,其电子式为: 。
(3)六亚甲基四胺一级电离产生等物质的量浓度的OH-和相应的阳离子,由于其电离很微弱,所以可以忽略电离的部分,有K1=,解得 c(OH-)=10-5mol/L,所以溶液的pH=9。
(4)由于碳酸的酸性强于苯酚,所以NaHCO3的水解程度弱于C6H5ONa的水解程度,它们水解使溶液呈碱性,所以等浓度的NaHCO3和C6H5ONa溶液的碱性NaHCO3弱于C6H5ONa。
(5)根据烷烃的系统命名原则,选取最长的碳链为主链,从离支链最近的一端给主链编号,该有机物的名称为2,2,3-三甲基戊烷。
20. Fe Fe-6e-+8OH-=+4H2O 6.6 3.75×10-8
【详解】(1)该装置可以通过电解制取高铁酸钾,所以铁电极要被氧化,所以铁电极为阳极,则b为蓄电池的正极,a为蓄电池的负极,蓄电池中负极发生氧化反应,所以a极上放电的物质为Fe;
(2)铁电极上Fe失电子被氧化,碱性环境中生成高铁酸根,电极反应式为Fe-6e-+8OH-=+4H2O;
(3)蓄电池中放电时NiO2转化为Ni(OH)2化合价降低2价,所以消耗掉0.1 mol NiO2时,转移0.2mol电极,再结合铁电极的电极反应可知生成mol高铁酸钾,质量为=6.6g;
(4)MgCO3+H2O Mg2+++OH-的平衡常数K=c(Mg2+) c() c(OH-)===3.75×10-8。
21. 共价 蒸发浓缩、冷却结晶、过滤、洗涤、干燥
【详解】(1)HgCl2熔点低,熔融时不导电,是共价化合物的特征,所以HgCl2是共价化合物。HgS溶于饱和NaCl溶液生成HgCl2,说明HgCl2是弱电解质,写离子方程式时不能拆成离子形式,离子方程式为HgS+2Cl- = HgCl2 + S2-。
(2)火法炼铜是Cu2S在氧气中煅烧,生成铜和SO2,反应的化学方程式为:。从溶液中获得结晶水合物,为了防止失去结晶水,需要进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作步骤。
(3)配制FeCl2溶液时,为了防止Fe2+被空气中的氧气氧化,需要加少量铁粉,为了抑制Fe2+的水解,需要加入少量的盐酸,反应方程式分别为Fe+2Fe3+=3Fe2+、Fe2++2H2OFe(OH)2+2H+。
22.(1)O2
(2) 2:1
(3)Ca2++2OH-+SO2=CaSO3↓+H2O
(4) Na+、 Cu2+、Ag+、 Cl-
【详解】(1)上述反应中,O2+2H2SO32H2SO4、2SO2+O22SO3为氧化还原反应,其中O2的化合价降低得到电子,作氧化剂。
(2)SO2+2H2S=3S↓+2H2O反应中,SO2中S的化合价由+4价变为0价,得4e-,被还原;2H2S中S的化合价由-2价变为0价,失2×2e-,被氧化,则单线桥法为;被氧化与被还原的均为S元素,质量之比2:1。
(3)少量的SO2气体通入澄清石灰水中,反应生成亚硫酸钙沉淀和水,离子方程式为Ca2++2OH-+SO2=CaSO3↓+H2O。
(4)①取少量原溶液于试管A中,观察,溶液呈无色,则一定无Cu2+;
②试管A中加入足量BaCl2溶液,有白色沉淀生成,再加稀硝酸,沉淀完全溶解,则沉淀为碳酸钡,溶液中一定含有,与反应的Ag+及一定不存在;
③取②反应后的澄清溶液于试管B中,加入AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,因加入氯化钡,则不能判断是否含有C1-;溶液中必然存在阳离子,则一定存在Na+;
根据以上分析,原溶液中一定含有的离子、Na+;一定不含有的离子Cu2+、Ag+、;可能含有的离子是C1-。
答案第1页,共2页
答案第1页,共2页
一、单选题(第12题)
1.辛勤劳动才能创造美好生活。下列劳动与所涉及的化学知识不相符的是
选项 劳动项目 化学知识
A 社区服务:回收旧衣物并进行分类 棉、麻和丝主要成分均为纤维素
B 家务劳动:用热的纯碱溶液去除餐具的油污 碳酸钠溶液显碱性
C 校内劳动:用稀硝酸处理做过银镜反应的试管 硝酸具有强氧化性
D 学农活动:利用豆科植物作绿肥进行施肥 豆科植物可实现自然固氮
A.A B.B C.C D.D
2.①已知t ℃时AgCl的Ksp=2.0×10-10;②在t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
A.在t ℃时,Ag2CrO4的Ksp为1.0×10-12
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t ℃时,以0.01 mol·L-1AgNO3溶液滴定20.00 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液,CrO42-后沉淀
D.在t ℃时,反应Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO (aq)的平衡常数K=2.5×107
3.下列实验操作、实验现象和实验结论均正确的是
选项 实验操作 实验现象 实验结论
A 将大小相同的金属钠分别投入水和乙醇中 钠与水反应比钠与乙醇反应剧烈 乙醇羟基中的氢原子比水分子中的氢原子活泼
B 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 溶液变红 稀硫酸能氧化Fe2+
C 室温下,用pH试纸分别测定浓度为0.1 mol L 1NaClO溶液和0.1 mol L 1CH3COONa溶液的pH pH试纸都变成碱色 可以用 pH试纸的颜色与标准比色卡比较,从而判断HClO和CH3COOH的酸性强弱
D 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量Na2S溶液 开始有白色沉淀生成,后有黑色沉淀生成 Ksp(Ag2S) <Ksp(AgCl)
A.A B.B C.C D.D
4.代表阿伏加德罗常数的值。下列说法正确的是
A.1 mol 与3 mol 在一定条件下充分反应,转移的电子数为
B.11.2 L CO和混合气体中含有的质子数为
C.1 L 1 mol·L溴化铵水溶液中与的数量之和大于
D.25℃时,的溶液中含有数为
5.已知25℃时,AgCl的溶度积Ksp=l.8×10 10,则下列说法不正确的是
A.温度一定时,当溶液中c(Ag+)·c(Cl )=Ksp时,此溶液中必有AgCl的沉淀析出
B.AgNO3溶液与NaCl溶液混合后的溶液中,可能有c(Ag+)=c(Cl )
C.向饱和AgCl水溶液中加入盐酸,Ksp不变
D.将AgCl加入到较浓的KI溶液中,部分AgCl可以转化为AgI
6.下表中对离子方程式的评价不合理的是
选项 化学反应及其离子方程式 评价
A 向碳酸钙上滴加稀盐酸: 错误,碳酸钙不应该写成
B 向硫酸铵溶液中加氢氧化钡溶液: 正确
C 铁粉与稀硫酸反应: 错误,H+的氧化性较弱,只能将铁单质氧化为Fe2+
D 碳酸氢钠溶液与过量澄清石灰水反应: 错误,碳酸氢钠溶液少量,书写的离子方程式中的化学计量数应为1
A.A B.B C.C D.D
7.NA为阿伏加德罗常数的值。下列叙述正确的是
A.T℃时,MgCO3的Ksp=4×10-6,则饱和MgCO3溶液中Mg2+的数目为2×10-3NA
B.C4H8和C3H6的混合物的质量为ag,所含C—H键数目为
C.反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4中,生成0.3mol氧化产物时转移的电子数为1.4NA
D.用铅蓄电池电解氯化钠溶液得到标准状况下22.4L氢气时理论上铅蓄电池中消耗氢离子数目为2NA
8.下列有关实验操作、实验现象和得出的结论均正确的是
选项 实验操作 实验现象 结论
A 将通入溴水中 溴水颜色褪去 具有漂白性
B 常温下,用广泛试纸测定0.1溶液的 试纸变为淡蓝色 是弱酸
C 向溶液中同时通入和气体 无沉淀生成 不能和反应生成和
D 向盛有溶液的试管中加入苯和溶液 溶液分层,上层溶液变紫红色,下层有黄色沉淀生成 溶液中存在平衡:
A.A B.B C.C D.D
9.常温下,下列各组离子一定能在指定溶液中大量共存的是
A.能使pH试纸变红的溶液中:、、、
B.在的溶液中:、、、
C.能使甲基橙变红的溶液中:、、、
D.水电离的的溶液中:、、、
10.下列说法正确的是
A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B.HClO是弱酸,所以NaClO是弱电解质
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
11.下列有关电解质溶液的说法正确的是
A.常温下,将盐酸稀释至1000mL,所得溶液的pH约为9
B.等pH的盐酸和醋酸溶液,分别中和等量的NaOH,消耗醋酸的体积多
C.NaCl溶液和溶液均显中性,两溶液中水的电离程度相同
D.物质的量浓度相等的①②③三种溶液中,由大到小的顺序为:②>①>③
12.黄钠铁矾[]用作净水剂。以工业废料铁泥(主要成分是,还含有Fe、FeO、)为原料制取黄钠铁矾的工艺流程如图:
下列说法错误的是
A.“预处理”的目的是除去铁泥中的油污,X可以选用NaOH
B.“酸溶”时,为了提高酸浸率,可以延长时间
C.“氧化”过程中NaClO可以用代替
D.“滤液”的主要成分为
二、填空题(共10题)
13.(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是 。
(2)25℃时,利用pH试纸测得0.1mol L-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为 ;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将 (填“增大”、“减小”或“无法确定”)。
(3)25 ℃时,pH=3的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= (取近似值)
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是 点;在b点,溶液中各离子浓度由大到小的排列顺序是
14.弱电解质的研究是重要课题。
(1)已知不同pH条件下,水溶液中碳元素的存在形态如图所示。下列说法不正确的是
a.pH=8时,溶液中含碳元素的微粒主要是
b.A点,溶液中和浓度相同
c.当时,
(2)H2CO3以及其它部分弱酸的电离平衡常数如表:
弱酸 H2S H2CO3 HClO
电离平衡常数(25℃)
按要求回答下列问题:
①H2S、H2CO3、HClO的酸性由强到弱的顺序为 。
②将少量CO2气体通入NaClO溶液中,写出该反应的离子方程式: 。
③测得0.1mol·L 1BaS溶液pH≈13,溶液中OH-、S2 、HS-三种离子浓度由大到小的顺序依次是 。
(3)常温下,已知0.1mol/L一元酸HCOOH(甲酸)溶液中
①0.1mol/LHCOOH的pH= 。
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是 (填写序号)
A.所有离子的浓度在稀释过程中都会减少
B.稀释后溶液的pH=5
C.稀释后甲酸的电离度会增大
D.与稀释前比较,稀释后水的电离程度增大
15.常温下有浓度均为0.1mol/L的四种溶液:①HCl;②CH3COOH;③NaOH;④Na2CO3。
(1)这四种溶液中水的电离程度由大到小的顺序是 (用序号填写)。
(2)等体积混合②和③的溶液中离子浓度的大小顺序是 。
(3)常温下,0.1 mol/L的CH3COOH溶液pH=3,则CH3COOH溶液的电离平衡常数Ka= 。
(4)用离子方程式表示④的水溶液呈碱性的主要原因: 。
(5)取10 mL溶液①,加水稀释到1000 mL,则该溶液中由水电离出的c(H+)约为 。
16.根据有关知识回答下列问题
(1)25℃时,0.1mol L-1的一元酸HA溶液中c(H+)=1.0×10-4mol L-1,此时溶液的pH= ,HA是 酸(填“强”或“弱”)。
(2)现有NaHCO3、NaHSO3、NaHSO4三种常见的酸式盐,它们在工业生产和日常生活中有着广泛的应用。
①25℃时,NaHCO3的水溶液显 性(填“酸”或“碱”)。
②25℃时,物质的量浓度均为0.01mol L-1的三种酸式盐溶液,pH最小是 。
(3)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(杂质不参与反应)。
实验步骤:准确称取1gNa2C2O4固体样品,配制成100mL溶液,取出20.00mL于锥形瓶中。再向锥形瓶中加入足量稀H2SO4溶液,用0.016mol L-1高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在 滴定管中。(填“酸式”或“碱式”)。
②滴定至终点时的实验现象是: 。
③下列操作可能使测量结果偏高的是 。
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度 。(Na2C2O4的相对分子质量为134)
17.I.某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr (OH)3、H2O、H2O2。 已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目: 。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为 。
II.从定性分析到定量研究是高中生化学学习的重要发展历程。请你根据所学知识对以下化学问题进行定量分析。
(5)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为 , 被氧化的N原子的物质的量为 。
(6)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为 、 、 。
18.溶液的酸碱性溶液的酸碱性的判断标准是溶液中c(H+)与c(OH-)的相对大小,其具体关系为:
c(H+)与c(OH-) 相对大小 c(H+)的范围(25 ℃)
中性溶液 c(OH-) c(H+) c(H+) 1.0×10-7 mol·L-1
酸性溶液 c(OH-) c(H+) c(H+) 1.0×10-7 mol·L-1
碱性溶液 c(OH-) c(H+) c(H+) 1.0×10-7 mol·L-1
19.(1)元素N与Cl的非金属性均较强,但常温下氮气远比氯气稳定,主要原因是 。
(2)CO2的电子式是 。
(3)六亚甲基四胺()的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-8。室温下,0.01mol·L-1六亚甲基四胺水溶液的pH等于 (只考虑六亚甲基四胺的一级电离,忽略H2O的电离)。
(4)比较等浓度的NaHCO3和C6H5ONa溶液的碱性强弱:NaHCO3 C6H5ONa。
(5),请用系统命名法对该有机物命名 。
20.现用蓄电池Fe+NiO2+2H2OFe(OH)2+Ni(OH)2为电源,制取少量高铁酸钾(K2FeO4)。反应装置如图所示:
(1)电解时,石墨电极连接的a极上放电的物质为 (填“Fe”或“NiO2”)。
(2)写出电解池中铁电极发生的电极反应式 。
(3)当消耗掉0.1 mol NiO2时,生成高铁酸钾 g。
(4)Mg和Fe都是生产生活中的常用金属。加热锅炉时,水中的MgCO3可以先转化为Mg(HCO3)2,然后转化为Mg(OH)2,求MgCO3+H2O Mg2+++OH-在80℃时的平衡常数 。(已知:80℃时H2O的Kw=2.5×10 13,Ksp(MgCO3)=8.4×10 6,Ka1(H2CO3)=4.2×10 7、Ka2(H2CO3)=5.6×10 11)。
21.(1)医院里曾用的稀溶液作手术刀的消毒剂。熔点低,熔融时不导电。HgS难溶于水和稀的强酸却易溶于饱和NaCl溶液中生成。据此分析是 化合物(填“离子”或“共价”),HgS溶于饱和NaCl溶液的离子方程式为 。
(2)Cu2S是火法炼铜一种重要的原料,下面是由冶炼铜及制取的流程图:
写出①中火法治铜的化学方程式 。
②中的一系列操作为 。
(3)配制溶液时,需加少量稀盐酸和铁粉,分别用方程式表述原因: 、 。
22.实验和理论是学习化学的两种重要途径,按要求回答下列问题:
Ⅰ.硫酸型酸雨的形成有如下可能的反应途径:
途径①:SO2+H2O=H2SO3,O2+2H2SO32H2SO4;
途径②:2SO2+O22SO3,SO3+H2O=H2SO4。
(1)上述反应中作氧化剂的是 (填化学式)。
(2)已知二氧化硫可与硫化氢气体反应,反应的化学方程式为SO2+2H2S=3S↓+2H2O。请用单线桥法标出电子转移的方向和数目: 。被氧化与被还原的元素的质量之比为 。
(3)SO2与CO2性质相似,均可与澄清石灰水反应,产生白色沉淀,将少量的SO2气体通入澄清石灰水中,写出该反应的离子方程式: 。
Ⅱ.某地有瓶溶液只含C1-、、,Ag+、Na+、Cu2+六种离子中的某几种,为确定离子种类做了如下实验:
①取少量原溶液于试管A中,观察,溶液呈无色。
②试管A中加入足量BaCl2溶液,有白色沉淀生成,再加稀硝酸,沉淀完全溶解。
③取②反应后的澄清溶液于试管B中,加入AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
(4)试分析原溶液中一定含有的离子是 ,一定不含有的离子是 ,可能含有的离子是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.棉、麻的主要成分为纤维素,丝的主要成分是蛋白质,劳动与所涉及的化学知识不相符,故A符合题意;
B.碳酸钠水解显碱性,即+H2O+OH-,+H2OH2CO3+OH-,可除去油污,且水解为吸热反应,加热促进水解,因此可用热的纯碱溶液洗涤餐具上的油污,劳动与所涉及的化学知识相符,故B不符合题意;
C.稀硝酸和Ag反应生成硝酸银、NO和水,即3Ag+4HNO3=3AgNO3+NO↑+2H2O,该反应中N元素化合价由+5价得电子降低到+2价,被还原,HNO3作氧化剂,具有强氧化性,劳动与所涉及的化学知识相符,故C不符合题意;
D.豆科植物与根瘤菌共生,根瘤菌能够固氮,即将空气中的氮气通过生物化学过程转化为含氮化合物,提高土壤中氮肥的含量,劳动与所涉及的化学知识相符,故D不符合题意;
答案为A。
2.B
【详解】A、依据图象曲线上的数据结合溶度积常数概念计算得到,曲线上的点是沉淀溶解平衡。Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4 (s)2Ag+ +CrO42-,Ksp=c2(Ag+)·c(CrO42-)=(10-3)2×10-6=10-12,故A正确;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B错误;
C、依据溶度积常数计算Ksp(Ag2CrO4)= c2(Ag+)·c(CrO42-)=1×10-12;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)==10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)==2×10-8mol/L,所以先析出氯化银沉淀,故C正确;
D、K====2.5×107,故D正确。
答案选B。
3.D
【详解】A.钠与水反应比钠与乙醇反应剧烈,因此水分子中的氢原子比乙醇羟基中的氢原子活泼,故A错误;
B.将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液,主要是硝酸根在酸性条件下氧化亚铁离子变为铁离子而变为红色,故B错误;
C.不能用pH试纸测定浓度为0.1mol·L-1NaClO溶液的pH值,故C错误;
D.向少量AgNO3溶液中滴加适量NaCl溶液,生成白色沉淀,银离子消耗完,再滴加适量Na2S溶液,生成黑色沉淀,说明白色沉淀转化为更难溶的硫化银沉淀,因此Ksp(Ag2S) < Ksp(AgCl),故D正确。
综上所述,答案为D。
4.C
【详解】A.1 mol 与3 mol 若完全反应生成2molNH3,转移6mol电子,转移电子数为,但由于氮气和氢气的反应为可逆反应,反应不能进行完全,转移电子数少于6NA,A错误;
B.未指明气体所处状态,无法计算气体的物质的量,B错误;
C.1L1mol/L溴化铵水溶液中Br-数目为,根据电荷守恒c(Br-)+c(OH-)=c()+c(H+),所以与的数量之和大于,C正确;
D.溶液的体积未知,无法计算的物质的量,D错误;
故选C。
5.A
【详解】A.当溶液中c(Ag+)c(Cl-)=Ksp时,为饱和溶液,不一定有AgCl的沉淀析出,故A错误;
B.AgNO3溶液与NaCl溶液混合后的溶液中,可能存在c(Ag+)=c(Cl-),混合溶液中c(Ag+)和c(Cl-)的大小,取决于硝酸银和氯化钠的相对量的大小,故B正确;
C.向饱和AgCl水溶液中加入盐酸,氯离子浓度增大,沉淀溶解平衡左移生成沉淀,但温度一定,溶度积常数不变,所以Ksp值不变,故C正确;
D.将固体AgCl加入到较浓的KI溶液中,AgCl溶解度大于AgI,部分AgCl转化为AgI,故D正确;
故选A。
6.B
【详解】A.向碳酸钙上滴加稀盐酸,离子方程式:2H++CaCO3=CO2↑+H2O+Ca2+,碳酸钙不应该写成,评价合理,A正确;
B.向硫酸铵溶液中加入氢氧化钡溶液的离子反应为2NH4++2OH-+Ba2++SO42-═BaSO4↓+2NH3 H2O,B错误;
C.铁粉与稀硫酸反应,离子方程式:Fe+2H+═Fe2++H2↑,评价正确,C正确;
D.碳酸氢钠溶液与过量澄清石灰水反应:,评价正确,D正确;
故答案选:B。
7.B
【详解】A.饱和MgCO3溶液中c(Mg2+)=c(CO)==2×10-3mol·L-1,但题中没有说明溶液的体积,无法计算Mg2+物质的量,故A错误;
B.C4H8和C3H6都是烃,有几个H原子就有几个C-H,假设ag全部是C4H8,则C-H的物质的量为mol=mol,假设全部是C3H6,则C-H的物质的量为mol=mol,因此ag该混合物中C-H物质的量为mol,故B正确;
C.FeS2中S显-1价,Fe显+2价,根据反应方程式可知,只有3mol-1价S被氧化成+6价S,根据S元素守恒,得到3mol氧化产物,转移电子物质的量为3mol×[6-(-1)]=21mol,即生成0.3mol氧化产物,转移电子物质的量为2.1mol,故C错误;
D.电解饱和食盐水:2NaCl+2H2O2NaOH+H2↑+Cl2↑,铅酸蓄电池总电极反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,建立关系式为H2~2e-~4H+,产生标准状况下1molH2时,消耗H+物质的量为4mol,故D错误;
答案为B。
8.D
【详解】A.与溴水发生反应:,从而使溴水褪色,体现了的还原性,与漂白性无关,故A错误;
B.试纸遇酸变红遇碱变蓝,故B错误;
C.向溶液中同时通入和,可能发生两种反应:、;若发生第一个反应,生成的不与反应,则无沉淀生成,若发生第二个反应,生成的与反应生成沉淀;无论发生哪个反应,都没有产生,所以不能得出选项所给结论,故C错误;
D.向盛有溶液的试管中加入苯,溶液分层,苯的密度比水的密度小,上层溶液(苯层)变为紫红色,说明苯萃取出了碘单质;加入溶液后,下层溶液(水层)出现黄色沉淀(AgI),说明水层中含有碘离子;因此说明溶液中含有I2和I-,即溶液中存在:,故D正确;
答案选D。
9.D
【详解】A.能使pH试纸变红的溶液,说明溶液中含有:与反应生成二氧化碳和水,故A不符合题意;
B.在的溶液,说明含有大量,与反应生成沉淀而不能大量共存,故B不符合题意;
C.能使甲基橙变红的溶液,溶液中含有:与反应生成HClO而不能大量共存,故C不符合题意;
D.水电离的的溶液中,说明溶液可能是酸溶液,可能是碱溶液:、、、在酸溶液或碱溶液中都大量共存,故D符合题意;
综上所述,答案为D。
10.D
【详解】A.SO3溶于水后能导电,是因为SO3与水反应生成了强电解质H2SO4,H2SO4溶液能导电,和SO3本身无关,SO3是非电解质,故A项错误;
B.次氯酸属于弱酸,溶液中只能部分电离,而次氯酸钠为强电解质,溶液中完全电离出钠离子和次氯酸根离子,故B错误;
C.氯化氢是共价化合物,故C错误;
D.钠盐都是强电解质,所以杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质,故D正确;
故选D。
11.D
【详解】A.酸溶液稀释不能变成碱,溶液中氢离子浓度无限接近与10-7,A错误;
B.pH相同的盐酸和醋酸,醋酸浓度大于盐酸,二者都是一元酸,与等量的NaOH溶液反应,消耗酸的物质的量相等,根据n=CV知,酸的浓度越大需要酸的体积越小,所以消耗酸体积大小关系为V(CH3COOH)
D.铵根水解,① 电离出H+,抑制铵根电离,②中铵根系数最大,浓度最大,③中,水解出的H+抑制铵根电离,故铵根浓度关系为:②>①>③,D正确;
故答案为:D。
12.D
【分析】工业废料铁泥主要含,还含有Fe、FeO、等,由流程可知,预处理阶段加入X除去铁泥中的油污,然后加入稀硫酸,酸浸后的酸性溶液中含有Fe2+,过滤分离出滤渣为,加入NaClO将二价铁离子氧化成三价铁离子,再加入碳酸钠、硫酸钠溶液使铁离子全部沉淀生成黄钠铁矾[]。
【详解】A.油污在碱性条件下能发生水解反应,则X可以选用NaOH,A不符合题意;
B.延长时间可以使废料更充分地溶于酸溶液,提高酸浸率,B不符合题意;
C.可将二价铁离子氧化成三价铁离子,自身被还原为水,不引入新杂质,C不符合题意;
D.“沉铁”过程发生反应:,消耗了硫酸钠和碳酸钠,而“氧化”过程中NaClO被还原为氯离子,滤液中的主要成分应该是氯化钠,D符合题意;
故选D。
13. 1:10 10-5mol·L-1 减小 10-3mol·L-1 a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
【详解】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,则c[Ba(OH)2]=510-3mol/L,c(OH-)=110-2mol/L。pH=3的盐酸中,c(H+)=110-3mol/L。混合后溶液的pH=7,因为c(OH-)=10 c(H+),则氢氧化钡溶液和盐酸的体积之比是1:10。
(2)25℃时,利用pH试纸测得0.1mol L-1醋酸溶液的pH约为3,c(H+)=mol/L,则可以估算出醋酸的电离常数为mol/L;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,因为c(CH3COOH)变大后CH3COOH的电离程度变小,所以溶液中c(H+)/c(CH3COOH)的值将减小。
(3)25 ℃时,pH=3的NH4Al(SO4)2中,c(H+)=10-3mol·L-1、c(OH-)=10-11mol·L-1,由电荷守恒,得2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3mol·L-1-10-11mol·L-110-3mol·L-1.
(4)NH4HSO4溶液中,NH4HSO4完全电离,NH4HSO4= NH4++H++SO42-,溶液的酸性主要由其电离产生的H+决定的,水的电离受到其电离产生H+的抑制;当与反应2NH4HSO4+2NaOH=Na2SO4+ (NH4)2SO4+2H2O恰好完成时,因铵根离子水解溶液仍显酸性,但是铵根水解促进了水的电离,水的电离程度达到最大,此后继续加入NaOH溶液,溶液中铵根离子的浓度逐渐减小,溶液的pH逐渐增大,水的电离程度逐渐减小。由图可知,a、b、c、d四个点中,a点代表的是2NH4HSO4+2NaOH=Na2SO4+ (NH4)2SO4+2H2O恰好完成时,所以水的电离程度最大的是a点;在a点c(Na+)=2c(SO42-)->c(NH4+),则在b点,c(Na+)>2c(SO42-), 由pH=7得c(OH-)=c(H+),所以溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42)->c(NH4+)>c(OH-)=c(H+)。
14.(1)bc
(2) c(OH-)>c(HS-)>c(S2 )
(3) 3 CD
【详解】(1)a.根据图示,pH=8时,溶液中含碳元素的微粒主要是,故a正确;
B.A点,溶液中和CO2的浓度和与浓度相同,故b错误;
C.根据图示,当时,溶液呈碱性,,故c错误;
选bc。
(2)①电离平衡常数越大,酸性越强,H2S、H2CO3、HClO的酸性由强到弱的顺序为。
②酸性,根据强酸制弱酸,将少量CO2气体通入NaClO溶液中生成次氯酸和碳酸氢钠,该反应的离子方程式为。
③测得0.1mol·L 1BaS溶液pH≈13,c(OH-)=10-1,说明S2-水解程度大,水解方程式为、,溶液中OH-、S2 、HS-三种离子浓度由大到小的顺序依次是c(OH-)>c(HS-)>c(S2 )。
(3)①0.1mol/L一元酸HCOOH(甲酸)溶液中,c(H+)=10-3,则0.1mol/LHCOOH的pH=3。
②A.10mL0.1mol/L的HCOOH溶液稀释100倍,氢离子浓度减小,氢氧根离子浓度增大,故A错误;
B.加水稀释,HCOOH的电离平衡正向移动,稀释后溶液的pH<5,故B错误;
C.弱电解质越稀越电离,稀释后甲酸的电离度会增大,故C正确;
D.稀释后氢离子浓度降低,对水电离抑制作用减弱,与稀释前比较,稀释后水的电离程度增大,故D正确;
选CD。
15. ④>②>①=③ c(Na+) > c(CH3COO-) > c(OH-) > c(H+) 10-5 CO+H2OHCO+OH-,HCO+H2OH2CO3+OH- 10 11mol/L
【详解】(1)水电离程度比较:碳酸钠溶液属于强碱弱酸盐,碳酸根离子水解导致溶液显碱性,促进了水的电离;盐酸是强酸溶液,氢氧化钠溶液是强碱溶液,溶液中水的电离都受到了抑制作用,其中盐酸中的氢离子浓度等于氢氧化钠溶液中的氢氧根离子浓度,二者中水的电离程度相等;醋酸溶液为弱酸,发生微弱的电离产生氢离子,抑制了水的电离,但醋酸溶液中氢离子浓度远小于盐酸,故水的电离程度比盐酸和氢氧化钠都强,综合而言这四种溶液中水的电离程度由大到小的顺序是④>②>①=③。故答案为:④>②>①=③。
(2)等体积的醋酸和氢氧化钠混合,混合后溶液恰好为醋酸钠溶液,属于强碱弱酸盐,醋酸根离子发生微弱的水解导致溶液显碱性,所以溶液中离子浓度的大小顺序是c(Na+) > c(CH3COO-) > c(OH-) > c(H+)。故答案为:c(Na+) > c(CH3COO-) > c(OH-) > c(H+)。
(3) 常温下,0.1 mol/L的CH3COOH溶液pH=3,可得溶液中c(H+) = 10-3 mol/L,由醋酸的电离方程式:CH3COOH CH3COO- + H+可得其电离平衡常数为: ,故答案为:10-5。
(4) 碳酸钠溶液属于强碱弱酸盐,碳酸根离子水解导致溶液显碱性,促进了水的电离,其水解方程式为:CO+H2OHCO+OH-,HCO+H2OH2CO3+OH-,故答案为:CO+H2OHCO+OH-,HCO+H2OH2CO3+OH-。
(5) 取10 mL HCl溶液,加水稀释到1000 mL,此时溶液中由HCl电离出的,由此可知,此时溶液中的c(H+)=10-3mol/L,可得该溶液中由水电离出的,故答案为:10 11mol/L。
16.(1) 4 弱
(2) 碱 NaHSO4
(3) 酸式 当滴入最后半滴酸性KMnO4溶液时,溶液颜色恰好由无色变为浅紫色,且半分钟内不褪 B 67%
【解析】(1)
c(H+)=1.0×10-4mol L-1,此时溶液的pH=-lgc(H+)=-lg(1.0×10-4)=4,一元酸HA的浓度为0.1mol L-1,而c(H+)=1.0×10-4mol L-1,说明酸部分电离,为弱酸。
(2)
①25℃时,NaHCO3的水溶液显碱性。
②25C时,物质的量浓度均为0.01mol L-1的三种酸式盐溶液,由于HSO完全电离,而HSO、HCO难电离,所以pH最小的是NaHSO4。
(3)
①为了防止高锰酸钾腐蚀橡胶管,高锰酸钾溶液应装在酸式滴定管中。
②滴定至终点时的实验现象是:加最后一滴酸性高锰酸钾溶液,溶液恰好由无色变为浅紫色,且30s内不褪色。
③A.Na2C2O4溶液被稀释,消耗高锰酸钾溶液体积减小,使测量结果偏低;B.高锰酸钾溶液体积数值增大,使测量结果偏高;C.初读数偏大,终读数偏小,高锰酸钾溶液体积数值减小,使测量结果偏低;D.不影响测量结果。故选B。
④样品中Na2C2O4的纯度为=67%。
17. H2O2 H2CrO4 Cr(OH)3 =2Cr(OH)3↓+3O2↑+2H2O 3.36 L 1.25 NA 3.75 mol 0.24moL 0.64moL 0.02moL
【详解】(1)由信息H2O2→O2中可知O元素的化合价由-1价升高到0,故H2O2为还原剂;
(2)氧化剂发生还原反应,所含元素化合价降低的物质为氧化剂。Cr元素的化合价降低,即还原反应的过程为H2CrO4→Cr(OH)3;
(3)该反应中O元素失电子,Cr元素得到电子,2molH2CrO4反应转移电子为2mol×(6-3)=6mol,则用单线桥法标出电子转移的方向和数目为:=2Cr(OH)3↓+3O2↑+2H2O
(4)由2H2CrO4+3H2O2=2Cr(OH)3↓+3O2↑+2H2O可知生成3mol气体转移6mol电子,转移了0.3mol电子则产生的气体的物质的量为=0.15mol,气体在标准状况下体积为0.15mol×22.4L/mol=3.36L;
(5)在反应10NaN3+2KNO3=K2O+5Na2O+16N2↑中N元素化合价既有升高,又有降低,N2既是氧化产物又是还原产物。根据反应方程式可知,每当生成16molN2,其中氧化产物15mol,还原产物1mol,氧化产物比还原产物多14mol,转移电子的物质的量为10mol。现氧化产物比还原产物多1.75mol,则转移电子的物质的量为=1.25mol,转移电子数为1.25NA(1.25×6.02×1023或7.525×1023);转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为=3.75mol;
(6)1 L内含0.24molK2SO4、0.5molNH4Cl、0.16molKCl的营养液中,n(K+)=0.24mol×2+0.16mol=0.64mol,n()=0.24mol,n()=0.5mol,n(Cl-)=0.5mol+0.16mol=0.66mol,设需用(NH4)2SO4、KCl、NH4Cl的物质的量分别为x、y、z,根据、、K+守恒可得:
,解得,故需要(NH4)2SO4、KCl、NH4Cl的物质的量分别为0.24mol、0.64mol、0.02mol;
18. = = < > > <
【详解】25 ℃水的Kw=10-14,中性溶液氢离子浓度等于氢氧根离子浓度,c(H+)=c(OH-),c(H+)=c(OH-)=1.0×10-7 mol·L-1;酸性溶液氢离子浓度大于氢氧根离子浓度,c(OH-)
19. 氮气分子中两个氮原子间共用三对电子,键能很大,而氯气分子中两个氯原子间只共用一对电子,键能较小,所以常温下氮气远比氯气稳定 9 弱于 2,2,3-三甲基戊烷
【详解】(1)氮气分子中两个氮原子间共用三对电子,键能很大,而氯气分子中两个氯原子间只共用一对电子,键能较小,所以常温下氮气远比氯气稳定。
(2)二氧化碳分子中,碳原子和每个氧原子都共用两对电子,从而使碳原子和氧原子都达到了8电子稳定结构,其电子式为: 。
(3)六亚甲基四胺一级电离产生等物质的量浓度的OH-和相应的阳离子,由于其电离很微弱,所以可以忽略电离的部分,有K1=,解得 c(OH-)=10-5mol/L,所以溶液的pH=9。
(4)由于碳酸的酸性强于苯酚,所以NaHCO3的水解程度弱于C6H5ONa的水解程度,它们水解使溶液呈碱性,所以等浓度的NaHCO3和C6H5ONa溶液的碱性NaHCO3弱于C6H5ONa。
(5)根据烷烃的系统命名原则,选取最长的碳链为主链,从离支链最近的一端给主链编号,该有机物的名称为2,2,3-三甲基戊烷。
20. Fe Fe-6e-+8OH-=+4H2O 6.6 3.75×10-8
【详解】(1)该装置可以通过电解制取高铁酸钾,所以铁电极要被氧化,所以铁电极为阳极,则b为蓄电池的正极,a为蓄电池的负极,蓄电池中负极发生氧化反应,所以a极上放电的物质为Fe;
(2)铁电极上Fe失电子被氧化,碱性环境中生成高铁酸根,电极反应式为Fe-6e-+8OH-=+4H2O;
(3)蓄电池中放电时NiO2转化为Ni(OH)2化合价降低2价,所以消耗掉0.1 mol NiO2时,转移0.2mol电极,再结合铁电极的电极反应可知生成mol高铁酸钾,质量为=6.6g;
(4)MgCO3+H2O Mg2+++OH-的平衡常数K=c(Mg2+) c() c(OH-)===3.75×10-8。
21. 共价 蒸发浓缩、冷却结晶、过滤、洗涤、干燥
【详解】(1)HgCl2熔点低,熔融时不导电,是共价化合物的特征,所以HgCl2是共价化合物。HgS溶于饱和NaCl溶液生成HgCl2,说明HgCl2是弱电解质,写离子方程式时不能拆成离子形式,离子方程式为HgS+2Cl- = HgCl2 + S2-。
(2)火法炼铜是Cu2S在氧气中煅烧,生成铜和SO2,反应的化学方程式为:。从溶液中获得结晶水合物,为了防止失去结晶水,需要进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作步骤。
(3)配制FeCl2溶液时,为了防止Fe2+被空气中的氧气氧化,需要加少量铁粉,为了抑制Fe2+的水解,需要加入少量的盐酸,反应方程式分别为Fe+2Fe3+=3Fe2+、Fe2++2H2OFe(OH)2+2H+。
22.(1)O2
(2) 2:1
(3)Ca2++2OH-+SO2=CaSO3↓+H2O
(4) Na+、 Cu2+、Ag+、 Cl-
【详解】(1)上述反应中,O2+2H2SO32H2SO4、2SO2+O22SO3为氧化还原反应,其中O2的化合价降低得到电子,作氧化剂。
(2)SO2+2H2S=3S↓+2H2O反应中,SO2中S的化合价由+4价变为0价,得4e-,被还原;2H2S中S的化合价由-2价变为0价,失2×2e-,被氧化,则单线桥法为;被氧化与被还原的均为S元素,质量之比2:1。
(3)少量的SO2气体通入澄清石灰水中,反应生成亚硫酸钙沉淀和水,离子方程式为Ca2++2OH-+SO2=CaSO3↓+H2O。
(4)①取少量原溶液于试管A中,观察,溶液呈无色,则一定无Cu2+;
②试管A中加入足量BaCl2溶液,有白色沉淀生成,再加稀硝酸,沉淀完全溶解,则沉淀为碳酸钡,溶液中一定含有,与反应的Ag+及一定不存在;
③取②反应后的澄清溶液于试管B中,加入AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,因加入氯化钡,则不能判断是否含有C1-;溶液中必然存在阳离子,则一定存在Na+;
根据以上分析,原溶液中一定含有的离子、Na+;一定不含有的离子Cu2+、Ag+、;可能含有的离子是C1-。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
