8单元课题2金属的化学性质课时3专题:金属与酸反应图像题【2023秋人教九下化学课件】(共19张PPT)
文档属性
| 名称 | 8单元课题2金属的化学性质课时3专题:金属与酸反应图像题【2023秋人教九下化学课件】(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 00:00:00 | ||
图片预览





文档简介
(共19张PPT)
人教九下化学同步精品课件
人教版九年级下册
第八单元 金属与金属材料
课题2 金属的化学性质
课时3 专题:
金属与酸反应图像题
分类突破
典例精析
巩固练习
1
2
3
一、等量金属足量酸(酸过量)
等质量的镁、铝、锌、铁与足量酸反应的坐标曲线图分析
1.当横坐标表示反应时间
(1)产生氢气的速率:
v(Mg)>v(Al)>v(Zn)>v(Fe)
分析:金属活动性________________
Mg>Al>Zn>Fe
氢气的质量/g
Mg
Al
Zn
反应时间/s
O
Fe
①根据四种金属的金属活动性顺序确定反应完全的时间
②根据四种氢气产生的质量大小排序确定“平台”,生成的氢气质量越大,平台越高,得到拐点,将O点与拐点连接,得到图像
分类突破
(2)产生氢气的质量计算比较:
m(Al)>m(Mg)>m(Fe)>m(Zn)
计算:
点击进入
③
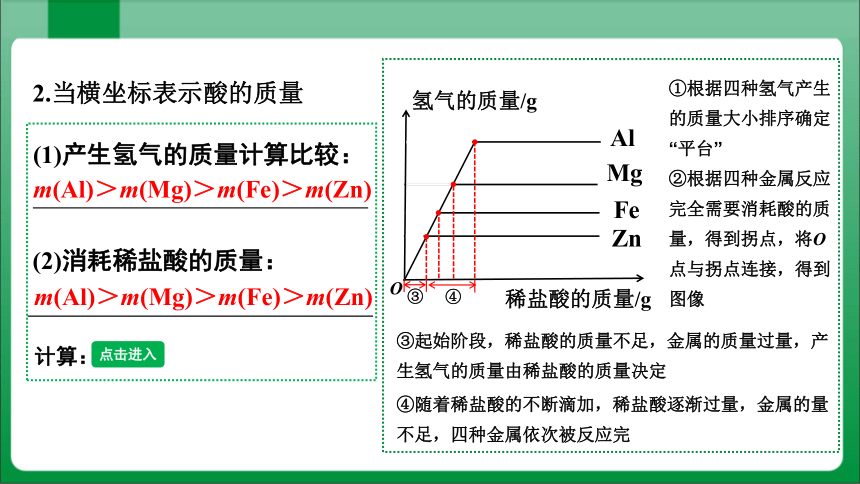
2.当横坐标表示酸的质量
(1)产生氢气的质量计算比较:
m(Al)>m(Mg)>m(Fe)>m(Zn)
计算:
点击进入
m(Al)>m(Mg)>m(Fe)>m(Zn)
(2)消耗稀盐酸的质量:
氢气的质量/g
稀盐酸的质量/g
Mg
Al
Zn
③起始阶段,稀盐酸的质量不足,金属的质量过量,产生氢气的质量由稀盐酸的质量决定
O
④随着稀盐酸的不断滴加,稀盐酸逐渐过量,金属的量不足,四种金属依次被反应完
Fe
①根据四种氢气产生的质量大小排序确定“平台”
②根据四种金属反应完全需要消耗酸的质量,得到拐点,将O点与拐点连接,得到图像
③
④
二、足量金属等量酸(酸不足)
以镁、铝、锌三种金属与等质量、等浓度的盐酸反应为例
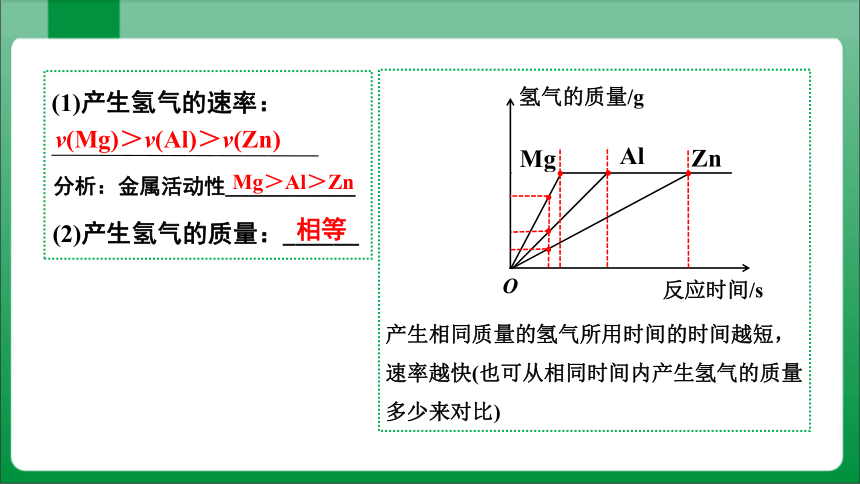
1. 当横坐标表示反应时间
三种金属与等质量、等浓度的盐酸反应时,哪种金属产生的氢气最多?
金属过量,酸不足,产生氢气的质量与金属质量无关,由酸决定。
所以三种金属与等质量、等浓度的盐酸反应产生氢气的质量是相等的。
设:参与反应的HCl的质量为7.3g, 与三种金属反应产生氢气的质量为x,结合反应的质量关系可知:
2HCl ~ H2↑
73 2
7.3g x
(2)产生氢气的质量:______
相等
v(Mg)>v(Al)>v(Zn)
氢气的质量/g
反应时间/s
Mg
Al
Zn
产生相同质量的氢气所用时间的时间越短,速率越快(也可从相同时间内产生氢气的质量多少来对比)
(1)产生氢气的速率:
O
分析:金属活动性____________
Mg>Al>Zn
2.当横坐标表示金属的质量
氢气的质量/g
金属的质量/g
Mg
Al
Zn
m(Zn)>m(Mg)>m(Al)
消耗金属的质量:
产生氢气的质量:
m(Al)=m(Mg)=m(Zn)
分析:
点击进入
①反应未完全时,产生氢气的质量由消耗金属的质量决定
O
②反应完全时,酸消耗完,最终生成氢气的质量由酸的质量决定
①
②
三、同种金属与不同浓度的稀酸反应
以相同质量、形状、大小的锌粉与等质量浓度为10%、20%的稀盐酸反应为例
氢气的质量/g
反应时间/s
20%盐酸
反应时间/s
20%盐酸
10%盐酸
①金属不足(酸过量)时,产生氢气由金属的质量决定,锌粉的质量相等,所以产生氢气的质量相同
氢气的质量/g
O
O
②浓度大的酸产生氢气的速率快
①酸不足时(金属过量),产生氢气的质量由酸的浓度决定,浓度大的酸产生氢气的质量大于浓度小的酸
②浓度大的酸产生氢气的速率快
10%盐酸
典例精析
1.如图所示的四个图像,分别对应四种过程,其中正确的是 ( )
反应时间/s
Mg
氢气的质量/g
O
Zn
反应时间/s
Mg
氢气的质量/g
O
Zn
① ② ③ ④
A.①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B.②分别向等质量的Zn中加入等质量、不同浓度的稀硫酸
C.③分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D.④分别向等质量的 Mg 和 Zn 中加入等质量、等浓度且足量的稀硫酸
反应时间/s
10%硫酸
氢气的质量/g
O
20%硫酸
反应时间/s
Cu
氢气的质量/g
O
Mg
×
Cu与硫酸不反应
请你判断其他选项,错误的选项请给出正确图像
×
反应时间/s
Mg
氢气的质量/g
O
Zn
稀盐酸的质量/g
Mg
气体的质量/g
O
Zn
B.②分别向等质量的Zn中加入等质量、不同浓度的稀硫酸
C.③分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D.④分别向等质量的Mg和Zn中加入等质量、等浓度的稀硫酸
金属质量/g
10%硫酸
气体的质量/g
O
20%硫酸
酸的浓度不同,浓度大的与金属反应速率快、产生的氢气多
×
10%硫酸
20%硫酸
酸不足时,产生氢气的质量由酸决定,产生氢气的速率由金属的活动性顺序决定,Mg>Zn
酸过量时,产生氢气的质量由金属的相对原子质量决定,Mg>Zn
产生氢气的速率由金属的活动性顺序决定,Mg>Zn
√
×
Mg
反应时间/s
Cu
氢气的质量/g
O
Mg
① ② ③ ④
×
C
1.如图所示的四个图像,分别对应四种过程,其中正确的是 ( )
反应时间/s
Mg
氢气的质量/g
O
Zn
稀盐酸的质量/g
Mg
气体的质量/g
O
Zn
① ② ③ ④
A.①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B.②分别向等质量的Zn中加入等质量、不同浓度的稀硫酸
C.③分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D.④分别向等质量的 Mg 和 Zn 中加入等质量、等浓度且足量的稀硫酸
金属质量/g
10%硫酸
气体的质量/g
O
20%硫酸
反应时间/s
Cu
氢气的质量/g
O
Mg
巩固练习
1. 向两个分别装有等质量的锌和镁的烧杯中,分别逐滴加入相同溶质质量分数的稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示。下列说法正确的是( )
A. b点时,消耗稀硫酸的质量Mg<Zn
B. c点时,两个烧杯中的金属都有剩余
C. d点时,产生氢气的质量Mg=Zn
D.由图可得,镁的金属活动性比锌强
b点时, Zn已经反应完全,Mg还在与稀硫酸反应消耗稀硫酸
c点时,Zn刚好反应完全,装有锌的烧杯中已无金属剩余
酸不足时,产生氢气的质量由酸决定
C
×
×
√
请你根据题中信息做出能判断镁和锌金属活动性强弱的坐标图像。
2.某化学兴趣小组的同学将生锈的铁钉放入盛有稀盐酸的密闭容器中,利用压强传感器、数据采集器和计算机等数字化实验设备,测定容器内气体压强和反应时间的变化曲线如图,下列说法正确的是( )
A. CD段压强变化的主要因素是反应速度减慢
B. BC段的化学反应是: Fe+2HCl === FeCl2+H2↑
C. D点反应结束
D. E点温度大于A点
B
图像分析:
AB段:稀盐酸与铁锈反应
BC段:稀盐酸与铁钉发生反应,压强增大的原因:
1. 反应有气体生成 2. 反应放热导致密闭容器温度升高
CD段压强变化的原因是什么?
设15.12g镁、铝、锌、铁四种金属分别与足量稀盐酸反应,产生氢气的质量分别为m(Mg)、m(Al)、m(Zn)、m(Fe)
Mg+2HCl===MgCl2+H2↑
24 2
15.12g m(Mg)
2Al+6HCl===2AlCl3+3H2↑
54 6
15.12g m(Al)
Fe+2HCl===FeCl2+H2↑
56 2
15.12g m(Fe)
Zn+2HCl===ZnCl2+H2↑
65 2
15.12g m(Zn)
1.68g>1.26g>0.54g>0.46g
氢气的计算公式:
产生氢气质量大小的比较:
等质量镁、铝、锌、铁分别与足量等浓度的酸反应,产生氢气的质量:____________________________
m(Al)>m(Mg)>m(Fe)>m(Zn)
返 回
m(Mg)=
m(Al)=
m(Fe)=
m(Zn)=
氢气的质量
= 金属的质量×
设15.12g镁、铝、锌、铁四种金属分别与足量稀盐酸反应,消耗盐酸的质量分别为m(Mg)、m(Al)、m(Zn)、m(Fe)
Mg+2HCl===MgCl2+H2↑
24 73
15.12g m(Mg)
2Al+6HCl===2AlCl3+3H2↑
54 219
15.12g m(Al)
Fe + 2HCl===FeCl2+H2↑
56 73
15.12g m(Fe)
Zn+2HCl===ZnCl2+H2↑
65 73
15.12g m(Zn)
61.32g>45.99g>19.71g>16.98g
消耗酸质量大小的比较:
等质量镁、铝、锌分别与足量等浓度的酸反应,消耗酸的质量:____________________________
m(Al)>m(Mg)>m(Fe)>m(Zn)
返 回
m(Mg)=
m(Al)=
m(Fe)=
m(Zn)=
设2.19g盐酸与镁、铝、锌三种金属分反应,消耗金属的质量分别为m(Mg)、m(Al)、m(Zn)
Mg + 2HCl===MgCl2 + H2↑
24 73
m(Mg) 2.19g
2Al + 6HCl===2AlCl3 + 3H2↑
54 219
m(Al) 2.19g
Zn + 2HCl===ZnCl2 + H2↑
65 73
m(Zn) 2.19g
m(Mg)=
m(Al)=
m(Zn)=
1.95g>0.72g>0.54g
最终消耗金属的质量:
______________________
m(Al)>m(Mg)>m(Zn)
返 回
消耗金属质量大小的比较:
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
人教九下化学同步精品课件
人教版九年级下册
第八单元 金属与金属材料
课题2 金属的化学性质
课时3 专题:
金属与酸反应图像题
分类突破
典例精析
巩固练习
1
2
3
一、等量金属足量酸(酸过量)
等质量的镁、铝、锌、铁与足量酸反应的坐标曲线图分析
1.当横坐标表示反应时间
(1)产生氢气的速率:
v(Mg)>v(Al)>v(Zn)>v(Fe)
分析:金属活动性________________
Mg>Al>Zn>Fe
氢气的质量/g
Mg
Al
Zn
反应时间/s
O
Fe
①根据四种金属的金属活动性顺序确定反应完全的时间
②根据四种氢气产生的质量大小排序确定“平台”,生成的氢气质量越大,平台越高,得到拐点,将O点与拐点连接,得到图像
分类突破
(2)产生氢气的质量计算比较:
m(Al)>m(Mg)>m(Fe)>m(Zn)
计算:
点击进入
③
2.当横坐标表示酸的质量
(1)产生氢气的质量计算比较:
m(Al)>m(Mg)>m(Fe)>m(Zn)
计算:
点击进入
m(Al)>m(Mg)>m(Fe)>m(Zn)
(2)消耗稀盐酸的质量:
氢气的质量/g
稀盐酸的质量/g
Mg
Al
Zn
③起始阶段,稀盐酸的质量不足,金属的质量过量,产生氢气的质量由稀盐酸的质量决定
O
④随着稀盐酸的不断滴加,稀盐酸逐渐过量,金属的量不足,四种金属依次被反应完
Fe
①根据四种氢气产生的质量大小排序确定“平台”
②根据四种金属反应完全需要消耗酸的质量,得到拐点,将O点与拐点连接,得到图像
③
④
二、足量金属等量酸(酸不足)
以镁、铝、锌三种金属与等质量、等浓度的盐酸反应为例
1. 当横坐标表示反应时间
三种金属与等质量、等浓度的盐酸反应时,哪种金属产生的氢气最多?
金属过量,酸不足,产生氢气的质量与金属质量无关,由酸决定。
所以三种金属与等质量、等浓度的盐酸反应产生氢气的质量是相等的。
设:参与反应的HCl的质量为7.3g, 与三种金属反应产生氢气的质量为x,结合反应的质量关系可知:
2HCl ~ H2↑
73 2
7.3g x
(2)产生氢气的质量:______
相等
v(Mg)>v(Al)>v(Zn)
氢气的质量/g
反应时间/s
Mg
Al
Zn
产生相同质量的氢气所用时间的时间越短,速率越快(也可从相同时间内产生氢气的质量多少来对比)
(1)产生氢气的速率:
O
分析:金属活动性____________
Mg>Al>Zn
2.当横坐标表示金属的质量
氢气的质量/g
金属的质量/g
Mg
Al
Zn
m(Zn)>m(Mg)>m(Al)
消耗金属的质量:
产生氢气的质量:
m(Al)=m(Mg)=m(Zn)
分析:
点击进入
①反应未完全时,产生氢气的质量由消耗金属的质量决定
O
②反应完全时,酸消耗完,最终生成氢气的质量由酸的质量决定
①
②
三、同种金属与不同浓度的稀酸反应
以相同质量、形状、大小的锌粉与等质量浓度为10%、20%的稀盐酸反应为例
氢气的质量/g
反应时间/s
20%盐酸
反应时间/s
20%盐酸
10%盐酸
①金属不足(酸过量)时,产生氢气由金属的质量决定,锌粉的质量相等,所以产生氢气的质量相同
氢气的质量/g
O
O
②浓度大的酸产生氢气的速率快
①酸不足时(金属过量),产生氢气的质量由酸的浓度决定,浓度大的酸产生氢气的质量大于浓度小的酸
②浓度大的酸产生氢气的速率快
10%盐酸
典例精析
1.如图所示的四个图像,分别对应四种过程,其中正确的是 ( )
反应时间/s
Mg
氢气的质量/g
O
Zn
反应时间/s
Mg
氢气的质量/g
O
Zn
① ② ③ ④
A.①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B.②分别向等质量的Zn中加入等质量、不同浓度的稀硫酸
C.③分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D.④分别向等质量的 Mg 和 Zn 中加入等质量、等浓度且足量的稀硫酸
反应时间/s
10%硫酸
氢气的质量/g
O
20%硫酸
反应时间/s
Cu
氢气的质量/g
O
Mg
×
Cu与硫酸不反应
请你判断其他选项,错误的选项请给出正确图像
×
反应时间/s
Mg
氢气的质量/g
O
Zn
稀盐酸的质量/g
Mg
气体的质量/g
O
Zn
B.②分别向等质量的Zn中加入等质量、不同浓度的稀硫酸
C.③分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D.④分别向等质量的Mg和Zn中加入等质量、等浓度的稀硫酸
金属质量/g
10%硫酸
气体的质量/g
O
20%硫酸
酸的浓度不同,浓度大的与金属反应速率快、产生的氢气多
×
10%硫酸
20%硫酸
酸不足时,产生氢气的质量由酸决定,产生氢气的速率由金属的活动性顺序决定,Mg>Zn
酸过量时,产生氢气的质量由金属的相对原子质量决定,Mg>Zn
产生氢气的速率由金属的活动性顺序决定,Mg>Zn
√
×
Mg
反应时间/s
Cu
氢气的质量/g
O
Mg
① ② ③ ④
×
C
1.如图所示的四个图像,分别对应四种过程,其中正确的是 ( )
反应时间/s
Mg
氢气的质量/g
O
Zn
稀盐酸的质量/g
Mg
气体的质量/g
O
Zn
① ② ③ ④
A.①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B.②分别向等质量的Zn中加入等质量、不同浓度的稀硫酸
C.③分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D.④分别向等质量的 Mg 和 Zn 中加入等质量、等浓度且足量的稀硫酸
金属质量/g
10%硫酸
气体的质量/g
O
20%硫酸
反应时间/s
Cu
氢气的质量/g
O
Mg
巩固练习
1. 向两个分别装有等质量的锌和镁的烧杯中,分别逐滴加入相同溶质质量分数的稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示。下列说法正确的是( )
A. b点时,消耗稀硫酸的质量Mg<Zn
B. c点时,两个烧杯中的金属都有剩余
C. d点时,产生氢气的质量Mg=Zn
D.由图可得,镁的金属活动性比锌强
b点时, Zn已经反应完全,Mg还在与稀硫酸反应消耗稀硫酸
c点时,Zn刚好反应完全,装有锌的烧杯中已无金属剩余
酸不足时,产生氢气的质量由酸决定
C
×
×
√
请你根据题中信息做出能判断镁和锌金属活动性强弱的坐标图像。
2.某化学兴趣小组的同学将生锈的铁钉放入盛有稀盐酸的密闭容器中,利用压强传感器、数据采集器和计算机等数字化实验设备,测定容器内气体压强和反应时间的变化曲线如图,下列说法正确的是( )
A. CD段压强变化的主要因素是反应速度减慢
B. BC段的化学反应是: Fe+2HCl === FeCl2+H2↑
C. D点反应结束
D. E点温度大于A点
B
图像分析:
AB段:稀盐酸与铁锈反应
BC段:稀盐酸与铁钉发生反应,压强增大的原因:
1. 反应有气体生成 2. 反应放热导致密闭容器温度升高
CD段压强变化的原因是什么?
设15.12g镁、铝、锌、铁四种金属分别与足量稀盐酸反应,产生氢气的质量分别为m(Mg)、m(Al)、m(Zn)、m(Fe)
Mg+2HCl===MgCl2+H2↑
24 2
15.12g m(Mg)
2Al+6HCl===2AlCl3+3H2↑
54 6
15.12g m(Al)
Fe+2HCl===FeCl2+H2↑
56 2
15.12g m(Fe)
Zn+2HCl===ZnCl2+H2↑
65 2
15.12g m(Zn)
1.68g>1.26g>0.54g>0.46g
氢气的计算公式:
产生氢气质量大小的比较:
等质量镁、铝、锌、铁分别与足量等浓度的酸反应,产生氢气的质量:____________________________
m(Al)>m(Mg)>m(Fe)>m(Zn)
返 回
m(Mg)=
m(Al)=
m(Fe)=
m(Zn)=
氢气的质量
= 金属的质量×
设15.12g镁、铝、锌、铁四种金属分别与足量稀盐酸反应,消耗盐酸的质量分别为m(Mg)、m(Al)、m(Zn)、m(Fe)
Mg+2HCl===MgCl2+H2↑
24 73
15.12g m(Mg)
2Al+6HCl===2AlCl3+3H2↑
54 219
15.12g m(Al)
Fe + 2HCl===FeCl2+H2↑
56 73
15.12g m(Fe)
Zn+2HCl===ZnCl2+H2↑
65 73
15.12g m(Zn)
61.32g>45.99g>19.71g>16.98g
消耗酸质量大小的比较:
等质量镁、铝、锌分别与足量等浓度的酸反应,消耗酸的质量:____________________________
m(Al)>m(Mg)>m(Fe)>m(Zn)
返 回
m(Mg)=
m(Al)=
m(Fe)=
m(Zn)=
设2.19g盐酸与镁、铝、锌三种金属分反应,消耗金属的质量分别为m(Mg)、m(Al)、m(Zn)
Mg + 2HCl===MgCl2 + H2↑
24 73
m(Mg) 2.19g
2Al + 6HCl===2AlCl3 + 3H2↑
54 219
m(Al) 2.19g
Zn + 2HCl===ZnCl2 + H2↑
65 73
m(Zn) 2.19g
m(Mg)=
m(Al)=
m(Zn)=
1.95g>0.72g>0.54g
最终消耗金属的质量:
______________________
m(Al)>m(Mg)>m(Zn)
返 回
消耗金属质量大小的比较:
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
