2024届高三化学一轮复习 离子反应 课件(共38张PPT)
文档属性
| 名称 | 2024届高三化学一轮复习 离子反应 课件(共38张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 00:00:00 | ||
图片预览









文档简介
(共38张PPT)
离子反应
1揭示了反应的实质
2不仅可以表示一个反应,而且
可以表示同一类型的反应
基础检测1.
以下八种物质:
①铜 ②盐酸 ③硝酸 ④氯化氢
⑤氟化氢 ⑥碳酸钙 ⑦Al2O3 ⑧氯化钠气体属于强电解质的是_________________
1离子化合物和部分共价化合物
2与状态和溶解性无关
③ ④ ⑥ ⑦ ⑧
常见的强电解质:
常见的弱电解质:
强酸:HCl、H2SO4、HNO3 、HBr、HI、HClO4等
强碱:KOH、Ca(OH)2、NaOH、Ba(OH)2等
大多数盐:NaCl、NH4Cl、BaSO4等
活泼金属氧化物和氢化物:MgO、Al2O3、NaH等
弱酸:H2C2O4、H2SO3、H3PO4、HNO2、HF(中强)、CH3COOH、H2CO3、H2S、HClO、H2SiO3
弱碱:Mg(OH)2(中强)、NH3·H2O、Fe(OH)2、
Cu(OH)2、Fe(OH)3、Al(OH)3(两性)
少数盐:醋酸铅(CH3COO)2Pb(可溶)等
H2O
由CaCO3(s) Ca2+(aq) + CO32-(aq)能否得出 CaCO3是弱电解质的结论?
基础检测2:写出下列物质溶于水的电离方程式:
亚硫酸、氢氧化铁、
氢氧化铝、硫酸钡、
硫酸氢钠、碳酸氢钠
硫酸氢钠、氧化铝加热融化
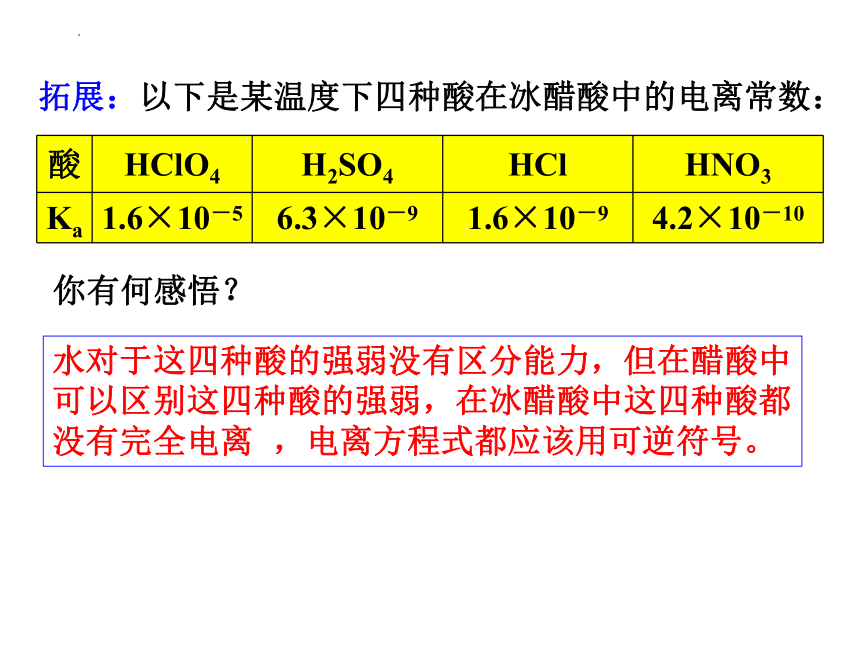
拓展:以下是某温度下四种酸在冰醋酸中的电离常数:
酸 HClO4 H2SO4 HCl HNO3
Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10
水对于这四种酸的强弱没有区分能力,但在醋酸中可以区别这四种酸的强弱,在冰醋酸中这四种酸都没有完全电离 ,电离方程式都应该用可逆符号。
你有何感悟?
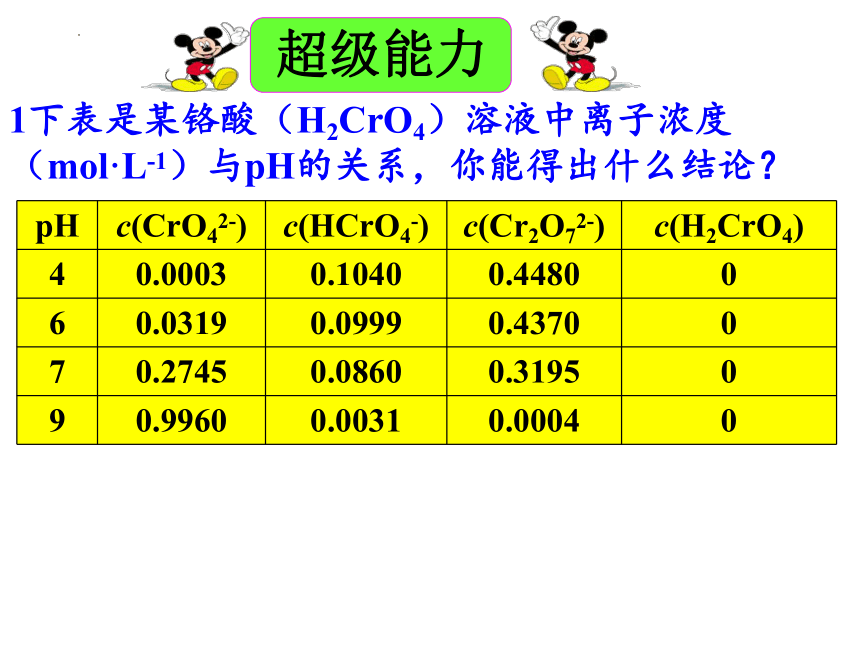
1下表是某铬酸(H2CrO4)溶液中离子浓度(mol·L-1)与pH的关系,你能得出什么结论?
pH c(CrO42-) c(HCrO4-) c(Cr2O72-) c(H2CrO4)
4 0.0003 0.1040 0.4480 0
6 0.0319 0.0999 0.4370 0
7 0.2745 0.0860 0.3195 0
9 0.9960 0.0031 0.0004 0
超级能力
离子反应发生的条件:
Cu2+ + 2OH- = Cu(OH)2↓
H+ + CH3COO- = CH3COOH
一 非氧化还原反应型:
二. 氧化还原反应型:
Fe2++2H2O2+4H+=Fe3++4H2O
三.络合反应
2Al+2OH- +2H2O=2AlO2-+3H2↑
2Fe3+ + Cu = 2Fe2+ + Cu2+
Fe3+ + SCN - = [Fe(SCN)]2+
NH4+ + AlO2- +H2O = Al(OH)3↓+ NH3↑
(1)强酸、强碱、可溶盐在水溶液中一般可以拆成离子形式。
2NH4Cl(固)+Ca(OH)2(固) = CaCl2+2NH3↑+2H2O
NaCl(固) + H2SO4(浓) = NaHSO4 + HCl ↑
△
△
(2)非溶液中进行的反应一般不能写离子方程式。如:
Cu+2H2SO4 (浓) = CuSO4+SO2 ↑ +2H2O
△
*醋酸铅(CH3COO)2Pb(可溶)弱电解质
离子反应知识准备1:
OH- Cl- SO42- CO32-
Ag+
Ca2+
Mg2+
Ba2+
Zn2+
Cu2+
Fe2+
Fe3+
Al3+
难 难 微 难
微 溶 微 难
难 溶 溶 微
溶 溶 难 难
难 溶 溶 难
难 溶 溶 难
难 溶 溶 难
难 溶 溶 完全水解
难 溶 溶 完全水解
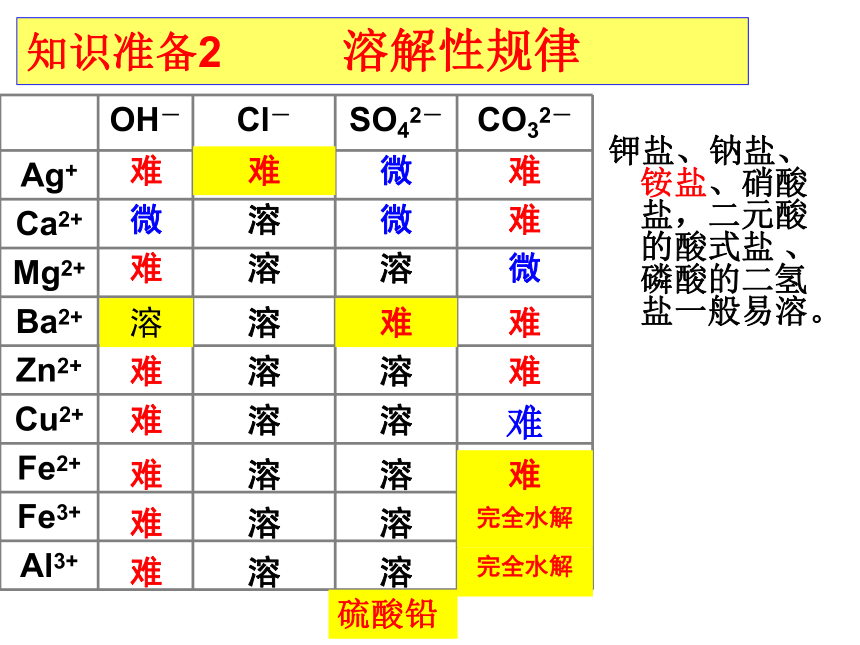
知识准备2 溶解性规律
钾盐、钠盐、铵盐、硝酸盐,二元酸的酸式盐 、磷酸的二氢盐一般易溶。
硫酸铅
2S2-+O2+2H2O = 4OH-+2S↓
(4)Na2S溶液长期放置有硫析出,原因为(用离子方程式表示):
例1:氯气与水反应的离子方程式:
3:H2O2和酸性KMnO4反应的离子方程式:
离子方程式的书写
2:向FeCl3溶液中滴入KSCN溶液时反应的离子方程式为
2MnO4- +16H++10C1- = 2Mn2+ + 5C12↑+8H2O
基本功(1):KMnO4和浓盐酸反应:
(2):在草酸(H2C2O4)中加入酸性KMnO4溶液:
2MnO4- + 5H2C2O4 +6H+ = 2Mn2+ + 10CO2↑+8H2O
能力提升:酸性 KMnO4 溶液可与FeSO4溶液反应生成两种沉淀:
MnO4- + 3Fe2+ + 7H2O = MnO2↓+ 3Fe(OH)3↓+ 5H+
重点突破三:离子反应方程式正误判断
1、看是否符合客观事实。
3 、看是否漏掉离子反应。
①Ba(OH)2溶液与CuSO4溶液:
②注意第二步的氧化还原反应:
Ca(ClO)2溶液中通SO2;FeO溶于稀HNO3溶液;Fe2O3溶于HI溶液等
用惰性电极电解熔融氯化钠: 2Cl-+2H2O=Cl2↑+H2↑+2OH-
2、看是否守恒
硫化亚铁溶于稀硝酸中: FeS + 2H+ = Fe2+ + H2S↑
5 看比例是否失调。
如稀H2SO4与Ba(OH)2溶液反应:
H++OH-+SO42-+Ba2+= BaSO4↓+H2O
6看是否符合题设条件及要求.
①注意“过量”、“少量”等反应物用量以及滴加顺序等对反应方式或产物的影响。
②看“=”“↑”、“↓”等是否正确。
4 看是否该拆
D
例1:下列反应对应的离子方程式正确的是( )
A.将少量SO2气体通入NaClO溶液中:
SO2+2ClO-+H2O = SO32-+2HClO
B.向FeBr2溶液中通入过量Cl2:
2Fe2++2Br-+2Cl2 =2Fe3++Br2+4Cl-
D.用碳酸钠溶液吸收少量二氧化硫:
2CO32-+SO2+H2O=2HCO3-+SO32-
C.用铁棒作电极电解NaCl饱和溶液
2Cl-+2H2O = 2OH-+Cl2↑+H2↑
通电
B.碳酸钠中加入等物质的量的乙酸
CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
D. NaHCO3溶液中加入过量的Ba(OH)2溶液:
2HCO3-+Ba2++2OH- = BaCO3↓+2H2O+CO32-
A.碳酸氢铵溶液与热NaOH浓溶液混合
NH4+ + OH- = NH3↑ + H2O
C.硫酸氢铵溶液和过量的氢氧化钡溶液混合: H++SO42-+Ba2++OH- = BaSO4↓+H2O
例2:下列反应对应的离子方程式正确的是( )
无
E.将ICl通入KOH溶液中:
ICl+2OH-= I-+ ClO-+H2O
3解释下列反应原理的离子方程式正确的是 ( )
A.用加热的方法降低自来水中钙离子浓度:
Ca2++2HCO3- CaCO3↓+H2O+CO2↑
B.向CH2BrCOOH中加入足量的NaOH溶液并加热:
CH2BrCOOH+OH- CH2BrCOO-+H2O
C.向Mg(HCO3)2溶液中加入足量的NaOH溶液:
Mg2++2HCO3- +2OH- = MgCO3↓+CO32- +2H2O
D.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3 =2FeO42- +3Cl-+H2O+4H+
A
2由于发生复分解反应,不能大量共存
例:①与 H+ 不能大量共存:
CH3COO-、PO43-、HPO42-、F-、ClO-、C17H35COO-等
②与OH-不能大量共存:
HCO3-、HPO42-、HS-、H2PO4 - NH4+
1、离子间发生络合反应不能大量共存Fe3+ SCN-
3在溶液中会发生氧化还原反应的离子而不能大量共存。
Fe3+
4能发生完全双水解反应的离子不能大量共存
Al3++3AlO2-+6H2O = 4Al(OH)3↓
Al3++3HCO3-=Al(OH)3↓+3CO2↑
离子反应重点突破4:离子共存问题
审题时应注意题中给出的附加条件
1酸/碱性:
加入铝粉后放出H2的溶液、
由水电离出的H+=1×10-10mol/L的溶液、
甲基橙显黄色、
C(H+)/C(OH-)=10-4 、
含有大量Fe3+的溶液等 。
2无色透明溶液:Cr2O72- MnO4- Fe3+ Fe2+ Cu2+
3因氧化还原反应不能大量共存
S2O32-+2H+ = S↓+SO2↑+H2O
1. 下列各组离子一定能大量共存的是
A、含有大量Fe3+的溶液中:
NH4+、Na+、CI-、SCN-
B、NH4+、CO32- 、NO3- 、K+
C、在c(H+)=10-13mol·L-1的溶液中:
NH4+、 Al3+、SO42-、NO3-
D、在pH=1的溶液中:
K+、Fe2+、Cl-、NO3-
B
2下列离子组能在指定环境中大量共存的是 ( )
A.在c(HCO3-)=0.1mol/L的溶液中:
NH4+ Al3+ Cl- NO 3-
B.在加入Al粉产生氢气的溶液中:
Fe2+ Na+ NO 3-
C.在pH=2的溶液中:
SO42- NO3 - Na+ Fe2+
D.在使红色石蕊试纸变蓝的溶液中:
SO32 - S2- Na+ K+
D
3有一份澄清溶液, 可能含有 Na+、 K+、 NH4+、 Ca2+、 Fe3+、 SO42-、 CO32-、 SO32-、 Cl-、
I-中的若干种, 且离子的物质的量浓度均为 0.1 mol·L-1(不考虑水解和水的电离)。 往该溶液中加入过量的盐酸酸化的 BaCl2 溶液, 无沉淀生成。 另取少量原溶液, 设计并完成如下实验:
实验步骤 实验现象
(1)取少量该溶液,加几滴甲基橙 溶液变红色
(2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 有无色气体产生,气体遇空气可以变成红棕色
(3)取少量该溶液,加BaCl2溶液 有白色沉淀生成
(4)取(3)中上层清液,加AgNO3溶液 有稳定的白色沉淀生成,且不溶于HNO3
(5)取少量该溶液,加NaOH溶液 有白色沉淀生成,当NaOH过量时沉淀部分溶解
H+
×
√
×
√
×
√
√
×
由此判断:
(1)溶液中肯定存在的离子是_____________________________________,
溶液中肯定不存在的离子是_______________________________________。
(2)为进一步确定其他离子,写出应该补充的实验及对应欲检验离子的名称(如为溶液反应,说明使用试剂的名称,不必写详细操作步骤):
K+、Cl-
【小试牛刀】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.
①若加入锌粒,产生无色无味的气体;
②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示,则溶液中含有的离子以及各自物质的量为多少?
√
×
×
×
√
√
√
NH4+、H+、Mg2+、Al3+ 、 SO42-
√
0.2、 0.1、 0.05、 0.1 、 0.35mol
重点突破:量的问题
① 以少量物质为标准 :
Ca(HCO3)2溶液与少(过)量NaOH溶液反应
对比练习:碳酸氢镁溶液与氢氧化钠溶液反应
1少量与过量型:
“少定多变”
②分步反应:AlCl3与NaOH、Na2CO3与盐酸、NaAlO2与盐酸、氨水与硝酸银等.
回马枪:按要求写出FeCl3溶液与Na2S溶液反应的离子方程式。
(1)Na2S少量:
(2)Na2S过量:
2Fe3++S2-=2Fe2++S↓
2Fe3++3S2-=2FeS↓+S↓
③选择性反应:
碳酸氢铵溶液与氢氧化钠溶液,
硫酸铝铵溶液与氢氧化钠溶液;
氯水与溴化亚铁溶液,
氯水与碘化亚铁溶液。
将Fe(NO3)3溶液与过量HI混合
Fe3++3NO3-+10I-+12H+=Fe2++5I2+6H2O+3NO↑
NH4++ OH- = NH3·H2O
H++OH- = H2O
Al3+ +3OH- = Al(OH)3↓
Al(OH)3 + OH- = AlO2- + 2H2O
O A D
B C
O→A
A→B
B→C
C→D
n(NaOH)
n(沉淀量)
[典例1]含H+、NH4+、Al3+溶液中滴入稀NaOH
例:写出Cl2通入FeBr2溶液的离子方程式
(1)当Cl2与FeBr2物质的量之比为1:2时
__________________________________
(2)当Cl2与FeBr2物质的量之比为1:1时
__________________________________
2定量型:
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
2Cl2+2Fe2++2Br-=2Fe3++Br2+2Cl-
例 1 ①往NaHSO4溶液中滴加少量Ba(OH)2溶液
②往NaHSO4溶液中滴加过量Ba(OH)2溶液
③往NaHSO4溶液中滴加Ba(OH)2溶液至 SO42-完全沉淀。
④往NaHSO4溶液中滴加Ba(OH)2溶液至中性。
3目标型:
例2:明矾中滴入Ba(OH)2溶液至Al3+完全沉淀
(1).氢氧化钠溶液与少量(过量)的二氧化碳反应
(2).向饱和的碳酸钠溶液中通入过量CO2
(3).次氯酸钠溶液与少量(过量)的二氧化碳反应
(4).次氯酸钙溶液与少量(过量)的二氧化碳反应
(5).苯酚钠溶液中通入少量(过量)的CO2
CO2经典练习1:
变式练习1:少量(过量)SO2通入苯酚钠溶液中:
(6).偏铝酸钠溶液与少量(过量)的二氧化碳反应
CO2经典练习2:
变式练习1:Na2ZnO2溶液过量通入过量的CO2
ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-
问题延伸1:NaHCO3溶液与NaAlO2溶液混合:
HCO3- + AlO2- + H2O=CO32- + Al(OH)3↓
Fe2++2HCO3- =FeCO3↓+CO2↑+H2O
Fe2++HCO3- =FeCO3↓+ H+
延伸2:NaHCO3溶液与与少量(过量)的FeCl2溶液混合:
迁移应用
问题1:沉锰过程中反应方程式:
问题2:为什么不直接选择碳酸钠沉锰:
例1 以低品位铜矿砂(主要成分为CuS)为原料制备氯化亚铜的路线如下:
写出酸溶1发生反应的离子方程式:
(1)“瞻前”确定反应物:CuS+MnO2+H2SO4。
(2)“顾后”确定生成物:酸溶1生成的是S和MnSO4。
CuS+MnO2+4H+=Mn2++S+2H2O+Cu2+
高考片段
Fe3++3HCO3- =Fe (OH)3↓+3CO2↑
2Cu2++4HCO3- =Cu2(OH)2CO3↓+CO2↑+H2O
Mn2++2HCO3- = MnCO3↓+CO2 ↑+H2O
例2 [2020·国卷Ⅲ)]硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式:
高考片段
离子反应
1揭示了反应的实质
2不仅可以表示一个反应,而且
可以表示同一类型的反应
基础检测1.
以下八种物质:
①铜 ②盐酸 ③硝酸 ④氯化氢
⑤氟化氢 ⑥碳酸钙 ⑦Al2O3 ⑧氯化钠气体属于强电解质的是_________________
1离子化合物和部分共价化合物
2与状态和溶解性无关
③ ④ ⑥ ⑦ ⑧
常见的强电解质:
常见的弱电解质:
强酸:HCl、H2SO4、HNO3 、HBr、HI、HClO4等
强碱:KOH、Ca(OH)2、NaOH、Ba(OH)2等
大多数盐:NaCl、NH4Cl、BaSO4等
活泼金属氧化物和氢化物:MgO、Al2O3、NaH等
弱酸:H2C2O4、H2SO3、H3PO4、HNO2、HF(中强)、CH3COOH、H2CO3、H2S、HClO、H2SiO3
弱碱:Mg(OH)2(中强)、NH3·H2O、Fe(OH)2、
Cu(OH)2、Fe(OH)3、Al(OH)3(两性)
少数盐:醋酸铅(CH3COO)2Pb(可溶)等
H2O
由CaCO3(s) Ca2+(aq) + CO32-(aq)能否得出 CaCO3是弱电解质的结论?
基础检测2:写出下列物质溶于水的电离方程式:
亚硫酸、氢氧化铁、
氢氧化铝、硫酸钡、
硫酸氢钠、碳酸氢钠
硫酸氢钠、氧化铝加热融化
拓展:以下是某温度下四种酸在冰醋酸中的电离常数:
酸 HClO4 H2SO4 HCl HNO3
Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10
水对于这四种酸的强弱没有区分能力,但在醋酸中可以区别这四种酸的强弱,在冰醋酸中这四种酸都没有完全电离 ,电离方程式都应该用可逆符号。
你有何感悟?
1下表是某铬酸(H2CrO4)溶液中离子浓度(mol·L-1)与pH的关系,你能得出什么结论?
pH c(CrO42-) c(HCrO4-) c(Cr2O72-) c(H2CrO4)
4 0.0003 0.1040 0.4480 0
6 0.0319 0.0999 0.4370 0
7 0.2745 0.0860 0.3195 0
9 0.9960 0.0031 0.0004 0
超级能力
离子反应发生的条件:
Cu2+ + 2OH- = Cu(OH)2↓
H+ + CH3COO- = CH3COOH
一 非氧化还原反应型:
二. 氧化还原反应型:
Fe2++2H2O2+4H+=Fe3++4H2O
三.络合反应
2Al+2OH- +2H2O=2AlO2-+3H2↑
2Fe3+ + Cu = 2Fe2+ + Cu2+
Fe3+ + SCN - = [Fe(SCN)]2+
NH4+ + AlO2- +H2O = Al(OH)3↓+ NH3↑
(1)强酸、强碱、可溶盐在水溶液中一般可以拆成离子形式。
2NH4Cl(固)+Ca(OH)2(固) = CaCl2+2NH3↑+2H2O
NaCl(固) + H2SO4(浓) = NaHSO4 + HCl ↑
△
△
(2)非溶液中进行的反应一般不能写离子方程式。如:
Cu+2H2SO4 (浓) = CuSO4+SO2 ↑ +2H2O
△
*醋酸铅(CH3COO)2Pb(可溶)弱电解质
离子反应知识准备1:
OH- Cl- SO42- CO32-
Ag+
Ca2+
Mg2+
Ba2+
Zn2+
Cu2+
Fe2+
Fe3+
Al3+
难 难 微 难
微 溶 微 难
难 溶 溶 微
溶 溶 难 难
难 溶 溶 难
难 溶 溶 难
难 溶 溶 难
难 溶 溶 完全水解
难 溶 溶 完全水解
知识准备2 溶解性规律
钾盐、钠盐、铵盐、硝酸盐,二元酸的酸式盐 、磷酸的二氢盐一般易溶。
硫酸铅
2S2-+O2+2H2O = 4OH-+2S↓
(4)Na2S溶液长期放置有硫析出,原因为(用离子方程式表示):
例1:氯气与水反应的离子方程式:
3:H2O2和酸性KMnO4反应的离子方程式:
离子方程式的书写
2:向FeCl3溶液中滴入KSCN溶液时反应的离子方程式为
2MnO4- +16H++10C1- = 2Mn2+ + 5C12↑+8H2O
基本功(1):KMnO4和浓盐酸反应:
(2):在草酸(H2C2O4)中加入酸性KMnO4溶液:
2MnO4- + 5H2C2O4 +6H+ = 2Mn2+ + 10CO2↑+8H2O
能力提升:酸性 KMnO4 溶液可与FeSO4溶液反应生成两种沉淀:
MnO4- + 3Fe2+ + 7H2O = MnO2↓+ 3Fe(OH)3↓+ 5H+
重点突破三:离子反应方程式正误判断
1、看是否符合客观事实。
3 、看是否漏掉离子反应。
①Ba(OH)2溶液与CuSO4溶液:
②注意第二步的氧化还原反应:
Ca(ClO)2溶液中通SO2;FeO溶于稀HNO3溶液;Fe2O3溶于HI溶液等
用惰性电极电解熔融氯化钠: 2Cl-+2H2O=Cl2↑+H2↑+2OH-
2、看是否守恒
硫化亚铁溶于稀硝酸中: FeS + 2H+ = Fe2+ + H2S↑
5 看比例是否失调。
如稀H2SO4与Ba(OH)2溶液反应:
H++OH-+SO42-+Ba2+= BaSO4↓+H2O
6看是否符合题设条件及要求.
①注意“过量”、“少量”等反应物用量以及滴加顺序等对反应方式或产物的影响。
②看“=”“↑”、“↓”等是否正确。
4 看是否该拆
D
例1:下列反应对应的离子方程式正确的是( )
A.将少量SO2气体通入NaClO溶液中:
SO2+2ClO-+H2O = SO32-+2HClO
B.向FeBr2溶液中通入过量Cl2:
2Fe2++2Br-+2Cl2 =2Fe3++Br2+4Cl-
D.用碳酸钠溶液吸收少量二氧化硫:
2CO32-+SO2+H2O=2HCO3-+SO32-
C.用铁棒作电极电解NaCl饱和溶液
2Cl-+2H2O = 2OH-+Cl2↑+H2↑
通电
B.碳酸钠中加入等物质的量的乙酸
CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
D. NaHCO3溶液中加入过量的Ba(OH)2溶液:
2HCO3-+Ba2++2OH- = BaCO3↓+2H2O+CO32-
A.碳酸氢铵溶液与热NaOH浓溶液混合
NH4+ + OH- = NH3↑ + H2O
C.硫酸氢铵溶液和过量的氢氧化钡溶液混合: H++SO42-+Ba2++OH- = BaSO4↓+H2O
例2:下列反应对应的离子方程式正确的是( )
无
E.将ICl通入KOH溶液中:
ICl+2OH-= I-+ ClO-+H2O
3解释下列反应原理的离子方程式正确的是 ( )
A.用加热的方法降低自来水中钙离子浓度:
Ca2++2HCO3- CaCO3↓+H2O+CO2↑
B.向CH2BrCOOH中加入足量的NaOH溶液并加热:
CH2BrCOOH+OH- CH2BrCOO-+H2O
C.向Mg(HCO3)2溶液中加入足量的NaOH溶液:
Mg2++2HCO3- +2OH- = MgCO3↓+CO32- +2H2O
D.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3 =2FeO42- +3Cl-+H2O+4H+
A
2由于发生复分解反应,不能大量共存
例:①与 H+ 不能大量共存:
CH3COO-、PO43-、HPO42-、F-、ClO-、C17H35COO-等
②与OH-不能大量共存:
HCO3-、HPO42-、HS-、H2PO4 - NH4+
1、离子间发生络合反应不能大量共存Fe3+ SCN-
3在溶液中会发生氧化还原反应的离子而不能大量共存。
Fe3+
4能发生完全双水解反应的离子不能大量共存
Al3++3AlO2-+6H2O = 4Al(OH)3↓
Al3++3HCO3-=Al(OH)3↓+3CO2↑
离子反应重点突破4:离子共存问题
审题时应注意题中给出的附加条件
1酸/碱性:
加入铝粉后放出H2的溶液、
由水电离出的H+=1×10-10mol/L的溶液、
甲基橙显黄色、
C(H+)/C(OH-)=10-4 、
含有大量Fe3+的溶液等 。
2无色透明溶液:Cr2O72- MnO4- Fe3+ Fe2+ Cu2+
3因氧化还原反应不能大量共存
S2O32-+2H+ = S↓+SO2↑+H2O
1. 下列各组离子一定能大量共存的是
A、含有大量Fe3+的溶液中:
NH4+、Na+、CI-、SCN-
B、NH4+、CO32- 、NO3- 、K+
C、在c(H+)=10-13mol·L-1的溶液中:
NH4+、 Al3+、SO42-、NO3-
D、在pH=1的溶液中:
K+、Fe2+、Cl-、NO3-
B
2下列离子组能在指定环境中大量共存的是 ( )
A.在c(HCO3-)=0.1mol/L的溶液中:
NH4+ Al3+ Cl- NO 3-
B.在加入Al粉产生氢气的溶液中:
Fe2+ Na+ NO 3-
C.在pH=2的溶液中:
SO42- NO3 - Na+ Fe2+
D.在使红色石蕊试纸变蓝的溶液中:
SO32 - S2- Na+ K+
D
3有一份澄清溶液, 可能含有 Na+、 K+、 NH4+、 Ca2+、 Fe3+、 SO42-、 CO32-、 SO32-、 Cl-、
I-中的若干种, 且离子的物质的量浓度均为 0.1 mol·L-1(不考虑水解和水的电离)。 往该溶液中加入过量的盐酸酸化的 BaCl2 溶液, 无沉淀生成。 另取少量原溶液, 设计并完成如下实验:
实验步骤 实验现象
(1)取少量该溶液,加几滴甲基橙 溶液变红色
(2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 有无色气体产生,气体遇空气可以变成红棕色
(3)取少量该溶液,加BaCl2溶液 有白色沉淀生成
(4)取(3)中上层清液,加AgNO3溶液 有稳定的白色沉淀生成,且不溶于HNO3
(5)取少量该溶液,加NaOH溶液 有白色沉淀生成,当NaOH过量时沉淀部分溶解
H+
×
√
×
√
×
√
√
×
由此判断:
(1)溶液中肯定存在的离子是_____________________________________,
溶液中肯定不存在的离子是_______________________________________。
(2)为进一步确定其他离子,写出应该补充的实验及对应欲检验离子的名称(如为溶液反应,说明使用试剂的名称,不必写详细操作步骤):
K+、Cl-
【小试牛刀】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.
①若加入锌粒,产生无色无味的气体;
②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示,则溶液中含有的离子以及各自物质的量为多少?
√
×
×
×
√
√
√
NH4+、H+、Mg2+、Al3+ 、 SO42-
√
0.2、 0.1、 0.05、 0.1 、 0.35mol
重点突破:量的问题
① 以少量物质为标准 :
Ca(HCO3)2溶液与少(过)量NaOH溶液反应
对比练习:碳酸氢镁溶液与氢氧化钠溶液反应
1少量与过量型:
“少定多变”
②分步反应:AlCl3与NaOH、Na2CO3与盐酸、NaAlO2与盐酸、氨水与硝酸银等.
回马枪:按要求写出FeCl3溶液与Na2S溶液反应的离子方程式。
(1)Na2S少量:
(2)Na2S过量:
2Fe3++S2-=2Fe2++S↓
2Fe3++3S2-=2FeS↓+S↓
③选择性反应:
碳酸氢铵溶液与氢氧化钠溶液,
硫酸铝铵溶液与氢氧化钠溶液;
氯水与溴化亚铁溶液,
氯水与碘化亚铁溶液。
将Fe(NO3)3溶液与过量HI混合
Fe3++3NO3-+10I-+12H+=Fe2++5I2+6H2O+3NO↑
NH4++ OH- = NH3·H2O
H++OH- = H2O
Al3+ +3OH- = Al(OH)3↓
Al(OH)3 + OH- = AlO2- + 2H2O
O A D
B C
O→A
A→B
B→C
C→D
n(NaOH)
n(沉淀量)
[典例1]含H+、NH4+、Al3+溶液中滴入稀NaOH
例:写出Cl2通入FeBr2溶液的离子方程式
(1)当Cl2与FeBr2物质的量之比为1:2时
__________________________________
(2)当Cl2与FeBr2物质的量之比为1:1时
__________________________________
2定量型:
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
2Cl2+2Fe2++2Br-=2Fe3++Br2+2Cl-
例 1 ①往NaHSO4溶液中滴加少量Ba(OH)2溶液
②往NaHSO4溶液中滴加过量Ba(OH)2溶液
③往NaHSO4溶液中滴加Ba(OH)2溶液至 SO42-完全沉淀。
④往NaHSO4溶液中滴加Ba(OH)2溶液至中性。
3目标型:
例2:明矾中滴入Ba(OH)2溶液至Al3+完全沉淀
(1).氢氧化钠溶液与少量(过量)的二氧化碳反应
(2).向饱和的碳酸钠溶液中通入过量CO2
(3).次氯酸钠溶液与少量(过量)的二氧化碳反应
(4).次氯酸钙溶液与少量(过量)的二氧化碳反应
(5).苯酚钠溶液中通入少量(过量)的CO2
CO2经典练习1:
变式练习1:少量(过量)SO2通入苯酚钠溶液中:
(6).偏铝酸钠溶液与少量(过量)的二氧化碳反应
CO2经典练习2:
变式练习1:Na2ZnO2溶液过量通入过量的CO2
ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-
问题延伸1:NaHCO3溶液与NaAlO2溶液混合:
HCO3- + AlO2- + H2O=CO32- + Al(OH)3↓
Fe2++2HCO3- =FeCO3↓+CO2↑+H2O
Fe2++HCO3- =FeCO3↓+ H+
延伸2:NaHCO3溶液与与少量(过量)的FeCl2溶液混合:
迁移应用
问题1:沉锰过程中反应方程式:
问题2:为什么不直接选择碳酸钠沉锰:
例1 以低品位铜矿砂(主要成分为CuS)为原料制备氯化亚铜的路线如下:
写出酸溶1发生反应的离子方程式:
(1)“瞻前”确定反应物:CuS+MnO2+H2SO4。
(2)“顾后”确定生成物:酸溶1生成的是S和MnSO4。
CuS+MnO2+4H+=Mn2++S+2H2O+Cu2+
高考片段
Fe3++3HCO3- =Fe (OH)3↓+3CO2↑
2Cu2++4HCO3- =Cu2(OH)2CO3↓+CO2↑+H2O
Mn2++2HCO3- = MnCO3↓+CO2 ↑+H2O
例2 [2020·国卷Ⅲ)]硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式:
高考片段
同课章节目录
