第八单元课题3金属资源的冶炼和保护课时1铁的冶炼【2023秋人教九下化学课件】(共46张PPT内嵌视频)
文档属性
| 名称 | 第八单元课题3金属资源的冶炼和保护课时1铁的冶炼【2023秋人教九下化学课件】(共46张PPT内嵌视频) |

|
|
| 格式 | pptx | ||
| 文件大小 | 131.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 21:34:10 | ||
图片预览











文档简介
(共46张PPT)
人教九下化学同步精品课件
人教版九年级下册
第八单元 金属与金属材料
课题3 金属资源的利用和保护
课时1 铁的冶炼
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1.知道一些常见的金属如铁、铝、铜等的矿石
2.了解从铁矿石中将铁还原出来的方法
3.会根据化学方程式对含有某些杂质的反应物或生成物进行有关计算
学习目标
难点
重点
新课引入
人类生活离不开金属
社会的进步与发展也需要大量的金属
金属有广泛的用途,我们可以从自然界中直接获取金属单质吗?
新知学习
Ⅰ 金属资源的存在形式
除少数不活泼的金属如金、银等有单质形式存在外,其余大多数都以化合物形式存在(如各种铁矿石) 。
自然界以单质形式存在的金
自然界以单质形式存在的银
常见的金属矿石
磁铁矿
主要成分(Fe3O4)
赤铁矿
主要成分(Fe2O3)
菱铁矿
主要成分(FeCO3)
矿石:能用来提炼金属的矿物。
黄铜矿
主要成分(CuFeS2)
辉铜矿
主要成分(Cu2S)
铝土矿
主要成分(Al2O3)
常见的金属矿石
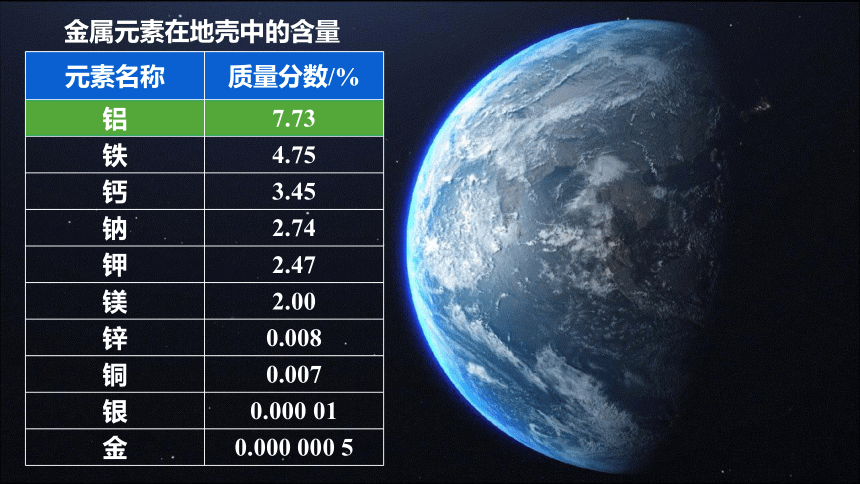
元素名称 质量分数/%
铝 7.73
铁 4.75
钙 3.45
钠 2.74
钾 2.47
镁 2.00
锌 0.008
铜 0.007
银 0.000 01
金 0.000 000 5
金属元素在地壳中的含量
我国是世界上已知矿物种类比较齐全的少数国家之一,矿物储量丰富,其中钨、钼、钛、锡、锑等储量居世界前列,铜、铝、锰等储量在世界上也占有重要地位。
大自然向人类提供了丰富的金属矿物资源,人类每年要提取数以亿吨计的金属,用于工农业生产和其他领域。其中,目前提取量最大的金属是铁。
1. 写出下列矿石的主要成分的化学式:
①赤铁矿__________,②磁铁矿__________,
③菱铁矿__________,④铝土矿__________。
其中主要成分是氧化物的是___________(填序号)。
针对训练
Fe2O3
Fe3O4
FeCO3
Al2O3
①②④
Ⅱ 铁的冶炼
早在春秋战国时期,我国就开始生产和使用铁器,从1世纪起,铁便成了一种最主要的金属材料。
为纪念1996年中国钢产量突破1亿吨而发行的邮票
宝钢炼铁高炉
铁矿石
矿石如何变成金属?
铁
?
一氧化碳还原氧化铁实验
实验药品
实验仪器
实验装置
氧化铁粉末、澄清石灰水、一氧化碳气体
铁架台(2套)、硬质玻璃管、单孔橡皮塞(2个)、酒精喷灯、酒精灯、试管、双孔橡皮塞、导气管若干
实验步骤:
检查装置气密性
装药品,固定仪器
通入CO气体
验纯后点燃酒精灯
熄灭酒精灯
冷却后停止通CO
反应结束后熄灭酒精喷灯
点燃酒精喷灯
一氧化碳还原氧化铁实验
实验现象
1.红棕色粉末逐渐变为黑色;
2.试管中的澄清石灰水变浑浊;
3.尾气燃烧并产生蓝色火焰。
2CO + O2 2CO2
点燃
高温
Fe2O3 + 3CO 2Fe + 3CO2
Ca(OH)2 + CO2 CaCO3↓ + H2O
氧化铁在高温下被CO还原成单质铁,同时产生CO2。
实验结论
想一想
1.先通CO的目的:
排出装置内的空气,以免加热时CO与空气混合发生爆炸;
2.实验完毕后继续通入CO直到硬质玻璃管冷却的目的:
防止还原生成的铁粉在较高温度下被重新氧化,防止石灰水倒流使硬质玻璃管炸裂。
CO为什么要“早出晚归”呢?
CO有毒,会污染空气,因此实验尾气中的CO要经过点燃处理或收集起来再利用。
小 组 讨 论
检验一氧化碳还原氧化铁固体生成物的方法
2.取适量反应后的黑色粉末于试管中,加入足量的稀盐酸,若黑色粉末溶解,产生气泡,溶液变为浅绿色,则黑色粉末为铁。
1.取适量反应后的黑色粉末,看是否能被磁铁完全吸引;
工业炼铁
观看工业炼铁的视频,思考以下问题:
工业炼铁的原料、设备和产品分别是什么?
2. 各原料分别起什么作用?
3. 主要反应有哪些?
产物:
生铁(是混合物,主要含铁)
原理:
Fe2O3 + 3CO 2Fe + 3CO2
高温
原料:
铁矿石(磁铁矿或赤铁矿):提供铁元素
焦炭:提供还原剂(CO),提供能量(高温)
空气:提供反应所需氧气
石灰石:将矿石中的二氧化硅转变为炉渣
设备:
高炉
炼铁高炉及炉内化学
反应过程示意图
高炉内发生的有关化学反应:
1.以赤铁矿为原料,主要反应为:
Fe2O3 + 3CO 2Fe + 3CO2
高温
2.焦炭的作用:
高温
①提供热量: C + O2 CO2
高温
②提供还原剂:C + CO2 2CO
3.石灰石的主要作用是将矿石中的二氧化硅转变为炉渣除去:
高温
CaCO3 CaO + CO2↑
高温
CaO + SiO2 CaSiO3(炉渣)
1. 电解法:如2Al2O3(熔融) 4Al + 3O2↑。
其他常见金属的冶炼方法
高温
冰晶石
2. 热还原法(氧化还原法):很多金属(如铜、锌、锡、铅等)的冶炼跟铁类似,在加热(或高温)条件下,将金属化合物与焦炭或氢气或一氧化碳发生反应,还原得到金属单质。
如CuO + CO Cu + CO2
3.热分解法:如2HgO 2Hg + O2↑。
1. 下列有关高炉炼铁的说法中正确的一组是( )
①高炉中焦炭的作用是产生一氧化碳和供热;
②高炉炼铁原料只有铁矿石、焦炭和石灰石;
③高炉中把铁矿石冶炼成铁的主要反应原理:
Fe2O3 + 3CO 2Fe + 3CO2。
A. ①② B. ②③ C. ①②③ D. ①③
D
针对训练
还有空气
Ⅲ 有关化学反应中杂质问题的计算
例题:用1 000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少吨?
分析:代入化学方程式计算的数据应是纯净物的质量:
赤铁矿石 氧化铁 铁 生铁
方法1:根据化学式:
1 000t × 80% × 70% ÷ 96% = 583 t (铁元素质量守恒)
方法2:根据化学方程式计算:
解法1:1 000t赤铁矿石中含氧化铁的质量为1 000t ×80%=800t。
设800t氧化铁理论上可以炼出铁的质量为x。
160 112
800t x
160
800t
=
112
x
x=560t
折合含铁96%的生铁的质量为 560t ÷ 96%=583t(纯化杂 )
答: 1 000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼出含铁96%的生铁的质量为583t。
Fe2O3 + 3CO 2Fe + 3CO2
解法2:1 000t赤铁矿石中含氧化铁的质量为1 000t ×80%=800t。
或设800t氧化铁理论上可以炼含铁96%的生铁的质量为x。
160 112
800t x×96%
160
800t
=
112
x×96%
x=583t
答: 1 000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼出含铁96%的生铁的质量为583t。
Fe2O3 + 3CO 2Fe + 3CO2
总结
不纯物质、纯物质、物质纯度之间的关系
1.纯度 = = 1 - 杂质的质量分数
2.纯物质的质量 = 含杂质的物质的质量 × 纯度(纯物质的质量分数)
4.杂质的质量 = 含杂质的物质的质量 ×(1 - 纯度)
3.含杂质的物质的质量 =
总结
含杂质物质的化学反应计算的一般步骤
1.将含有杂质物质的质量换算成纯净物的质量。
2.将纯净物的质量代入化学方程式进行计算。
3.将计算得到的纯净物质量换算成含杂质物质的质量。
计算时一般假定杂质不发生反应,因此只能将纯净物的质量代入化学方程式进行计算
针对训练
(1)该3000t生铁中含纯铁多少吨?
(2)该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多少吨?(计算结果保留整数)
某炼钢厂日产含杂质5%的生铁3000t,试计算:
解:(1)生铁中含纯铁的质量 = 3000 t × (1-5%) = 2850 t。
解得 x ≈ 4790t
解:(2)设需含Fe2O3质量分数为85%的赤铁矿石的质量为x。
160 112
x×85% 2850t
160
x×85%
=
112
2850t
答:(1)该3000 t生铁中含纯铁2850t。
(2)该炼钢厂每天需含 Fe2O3 质量分数为 85% 的赤铁矿石4790 t。
Fe2O3 + 3CO 2Fe + 3CO2
课堂小结
铁的冶炼
铁的冶炼
矿石的种类
原料:铁矿石、焦炭、石灰石、空气
计算:含杂质物质的相关计算
赤铁矿(主要成分Fe2O3)、磁铁矿(主要成分Fe3O4)、铝土矿(主要成分Al2O3)
原理:
Fe2O3+3CO 2Fe+3CO2
高温
1.下列有关金属的说法,正确的是( )
A.多数金属以单质的形式存在
B.在地壳中含量最高的金属元素是铁
C.常见的铁矿石有赤铁矿和磁铁矿
D.人类每年从自然界提取量最大的金属是铝
C
随堂检测
化合物
铝
铁
2.下列铁矿石中不宜用来炼铁的是( )
A. 赤铁矿 B. 黄铁矿
C. 菱铁矿 D. 磁铁矿
B
赤铁矿的主要成分是 Fe2O3,黄铁矿的主要成分是 FeS2,菱铁矿的主要成分是 FeCO3,磁铁矿的主要成分是 Fe3O4。黄铁矿中含有硫元素,炼铁时会产生二氧化硫,形成酸雨,且其中铁元素的含量较低,因此不宜用来炼铁。
3. (2022福建改编)我国古代常用灰吹法炼银,其过程为:将矿物银熔于铅形成银铅块,通过焙烧使铅氧化成 PbO进入炉灰,灰吹得银。下列说法错误的是( )
A. 银是活泼金属 B. 银铅块属于混合物
C. PbO中 Pb的化合价为 +2 D. 灰吹法炼银过程含有化学变化
A
中华优秀传统文化
4.(2022玉林)如图是模拟工业炼铁的实
验,下列叙述正确的是( )
A. 甲中的反应是置换反应
B. 甲中硬质玻璃管内红色固体变为银白色
C. 用乙装置可防止液体倒吸和防止CO污染空气
D. 实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却
D
5. (2022湘潭)金属材料在人类文明的发展中起着重要作用,古代冶金技术彰显了我国劳动人民的智慧。
Ⅰ.战国《韩非子·内储说上》提到,早期采金技术均是“沙里淘金”。金在自然界中主要以_____(填“单质”或“化合物”)形式存在。
Ⅱ.北宋沈括所著的《梦溪笔谈》中记载了“湿法炼铜”的方法:“熬胆矾铁釜,久之亦化为铜”。即在硫酸铜溶液中加入铁,则可得到铜。该反应的化学方程式是_____________________________,该反应属于_____反应(填基本反应类型)。
单质
中华优秀传统文化
Fe + CuSO4 ===== FeSO4 + Cu
置换
Ⅲ. 明代宋应星所著的《天工开物》一书,介绍了“火法炼锌”的方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐如下图所示,泥封,“其底铺薪,发火煅红”“冷定毁罐取出”。
(1)炉甘石(ZnCO3)加入锌罐之前,先将其粉碎的
目的是___________________________________。
(2)反应区中,炉甘石(ZnCO3)在高温下分解生成
氧化锌和另一种氧化物,该氧化物的化学式是
_____。
增大反应物间接触面积,使反应更充分
CO2
炼锌罐示意图
(3)反应区中,煤炭中的碳与氧化锌反应生成锌和二氧化碳,该反应的化学方程式是__________________________,该
反应中体现了碳的________(填“还原性”或“氧
化性”)。
(4)必须“冷定”后才能“毁罐”取锌,请从化学变
化的角度解释其原因________________________________。
还原性
炼锌罐示意图
2ZnO+C 2Zn+CO2↑
防止较高温度下还原出的锌被氧化
6. 我国高铁建设走在世界前列,修建高铁
需要大量铁矿石来炼铁,进而炼钢。
(1)下列三种铁矿石的主要成分Fe2O3、
Fe3O4、FeCO3中,含铁量最高的是______。
高炉炼铁需要的原料有铁矿石、焦炭、______和石灰石。
(2)要炼出含铁96%的生铁1000t,至少需要含氧化铁80%的赤铁矿多少吨?若高炉气体不加处理,理论上会向大气中排放CO2多少吨(计算结果保留整数)?
Fe3O4
空气
x ≈1714t
解:设需要赤铁矿石的质量为x,产生CO2的质量为y。
160 112 132
x×80% 1000t×96% y
答:至少需要含氧化铁80%的赤铁矿1714t,理论上会向大气中排放CO2的质量为1131t。
y ≈1131t
160
112
x×80%
1000t×96%
=
112
132
1000t×96%
y
=
Fe2O3 + 3CO 2Fe + 3CO2
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
人教九下化学同步精品课件
人教版九年级下册
第八单元 金属与金属材料
课题3 金属资源的利用和保护
课时1 铁的冶炼
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1.知道一些常见的金属如铁、铝、铜等的矿石
2.了解从铁矿石中将铁还原出来的方法
3.会根据化学方程式对含有某些杂质的反应物或生成物进行有关计算
学习目标
难点
重点
新课引入
人类生活离不开金属
社会的进步与发展也需要大量的金属
金属有广泛的用途,我们可以从自然界中直接获取金属单质吗?
新知学习
Ⅰ 金属资源的存在形式
除少数不活泼的金属如金、银等有单质形式存在外,其余大多数都以化合物形式存在(如各种铁矿石) 。
自然界以单质形式存在的金
自然界以单质形式存在的银
常见的金属矿石
磁铁矿
主要成分(Fe3O4)
赤铁矿
主要成分(Fe2O3)
菱铁矿
主要成分(FeCO3)
矿石:能用来提炼金属的矿物。
黄铜矿
主要成分(CuFeS2)
辉铜矿
主要成分(Cu2S)
铝土矿
主要成分(Al2O3)
常见的金属矿石
元素名称 质量分数/%
铝 7.73
铁 4.75
钙 3.45
钠 2.74
钾 2.47
镁 2.00
锌 0.008
铜 0.007
银 0.000 01
金 0.000 000 5
金属元素在地壳中的含量
我国是世界上已知矿物种类比较齐全的少数国家之一,矿物储量丰富,其中钨、钼、钛、锡、锑等储量居世界前列,铜、铝、锰等储量在世界上也占有重要地位。
大自然向人类提供了丰富的金属矿物资源,人类每年要提取数以亿吨计的金属,用于工农业生产和其他领域。其中,目前提取量最大的金属是铁。
1. 写出下列矿石的主要成分的化学式:
①赤铁矿__________,②磁铁矿__________,
③菱铁矿__________,④铝土矿__________。
其中主要成分是氧化物的是___________(填序号)。
针对训练
Fe2O3
Fe3O4
FeCO3
Al2O3
①②④
Ⅱ 铁的冶炼
早在春秋战国时期,我国就开始生产和使用铁器,从1世纪起,铁便成了一种最主要的金属材料。
为纪念1996年中国钢产量突破1亿吨而发行的邮票
宝钢炼铁高炉
铁矿石
矿石如何变成金属?
铁
?
一氧化碳还原氧化铁实验
实验药品
实验仪器
实验装置
氧化铁粉末、澄清石灰水、一氧化碳气体
铁架台(2套)、硬质玻璃管、单孔橡皮塞(2个)、酒精喷灯、酒精灯、试管、双孔橡皮塞、导气管若干
实验步骤:
检查装置气密性
装药品,固定仪器
通入CO气体
验纯后点燃酒精灯
熄灭酒精灯
冷却后停止通CO
反应结束后熄灭酒精喷灯
点燃酒精喷灯
一氧化碳还原氧化铁实验
实验现象
1.红棕色粉末逐渐变为黑色;
2.试管中的澄清石灰水变浑浊;
3.尾气燃烧并产生蓝色火焰。
2CO + O2 2CO2
点燃
高温
Fe2O3 + 3CO 2Fe + 3CO2
Ca(OH)2 + CO2 CaCO3↓ + H2O
氧化铁在高温下被CO还原成单质铁,同时产生CO2。
实验结论
想一想
1.先通CO的目的:
排出装置内的空气,以免加热时CO与空气混合发生爆炸;
2.实验完毕后继续通入CO直到硬质玻璃管冷却的目的:
防止还原生成的铁粉在较高温度下被重新氧化,防止石灰水倒流使硬质玻璃管炸裂。
CO为什么要“早出晚归”呢?
CO有毒,会污染空气,因此实验尾气中的CO要经过点燃处理或收集起来再利用。
小 组 讨 论
检验一氧化碳还原氧化铁固体生成物的方法
2.取适量反应后的黑色粉末于试管中,加入足量的稀盐酸,若黑色粉末溶解,产生气泡,溶液变为浅绿色,则黑色粉末为铁。
1.取适量反应后的黑色粉末,看是否能被磁铁完全吸引;
工业炼铁
观看工业炼铁的视频,思考以下问题:
工业炼铁的原料、设备和产品分别是什么?
2. 各原料分别起什么作用?
3. 主要反应有哪些?
产物:
生铁(是混合物,主要含铁)
原理:
Fe2O3 + 3CO 2Fe + 3CO2
高温
原料:
铁矿石(磁铁矿或赤铁矿):提供铁元素
焦炭:提供还原剂(CO),提供能量(高温)
空气:提供反应所需氧气
石灰石:将矿石中的二氧化硅转变为炉渣
设备:
高炉
炼铁高炉及炉内化学
反应过程示意图
高炉内发生的有关化学反应:
1.以赤铁矿为原料,主要反应为:
Fe2O3 + 3CO 2Fe + 3CO2
高温
2.焦炭的作用:
高温
①提供热量: C + O2 CO2
高温
②提供还原剂:C + CO2 2CO
3.石灰石的主要作用是将矿石中的二氧化硅转变为炉渣除去:
高温
CaCO3 CaO + CO2↑
高温
CaO + SiO2 CaSiO3(炉渣)
1. 电解法:如2Al2O3(熔融) 4Al + 3O2↑。
其他常见金属的冶炼方法
高温
冰晶石
2. 热还原法(氧化还原法):很多金属(如铜、锌、锡、铅等)的冶炼跟铁类似,在加热(或高温)条件下,将金属化合物与焦炭或氢气或一氧化碳发生反应,还原得到金属单质。
如CuO + CO Cu + CO2
3.热分解法:如2HgO 2Hg + O2↑。
1. 下列有关高炉炼铁的说法中正确的一组是( )
①高炉中焦炭的作用是产生一氧化碳和供热;
②高炉炼铁原料只有铁矿石、焦炭和石灰石;
③高炉中把铁矿石冶炼成铁的主要反应原理:
Fe2O3 + 3CO 2Fe + 3CO2。
A. ①② B. ②③ C. ①②③ D. ①③
D
针对训练
还有空气
Ⅲ 有关化学反应中杂质问题的计算
例题:用1 000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少吨?
分析:代入化学方程式计算的数据应是纯净物的质量:
赤铁矿石 氧化铁 铁 生铁
方法1:根据化学式:
1 000t × 80% × 70% ÷ 96% = 583 t (铁元素质量守恒)
方法2:根据化学方程式计算:
解法1:1 000t赤铁矿石中含氧化铁的质量为1 000t ×80%=800t。
设800t氧化铁理论上可以炼出铁的质量为x。
160 112
800t x
160
800t
=
112
x
x=560t
折合含铁96%的生铁的质量为 560t ÷ 96%=583t(纯化杂 )
答: 1 000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼出含铁96%的生铁的质量为583t。
Fe2O3 + 3CO 2Fe + 3CO2
解法2:1 000t赤铁矿石中含氧化铁的质量为1 000t ×80%=800t。
或设800t氧化铁理论上可以炼含铁96%的生铁的质量为x。
160 112
800t x×96%
160
800t
=
112
x×96%
x=583t
答: 1 000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼出含铁96%的生铁的质量为583t。
Fe2O3 + 3CO 2Fe + 3CO2
总结
不纯物质、纯物质、物质纯度之间的关系
1.纯度 = = 1 - 杂质的质量分数
2.纯物质的质量 = 含杂质的物质的质量 × 纯度(纯物质的质量分数)
4.杂质的质量 = 含杂质的物质的质量 ×(1 - 纯度)
3.含杂质的物质的质量 =
总结
含杂质物质的化学反应计算的一般步骤
1.将含有杂质物质的质量换算成纯净物的质量。
2.将纯净物的质量代入化学方程式进行计算。
3.将计算得到的纯净物质量换算成含杂质物质的质量。
计算时一般假定杂质不发生反应,因此只能将纯净物的质量代入化学方程式进行计算
针对训练
(1)该3000t生铁中含纯铁多少吨?
(2)该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多少吨?(计算结果保留整数)
某炼钢厂日产含杂质5%的生铁3000t,试计算:
解:(1)生铁中含纯铁的质量 = 3000 t × (1-5%) = 2850 t。
解得 x ≈ 4790t
解:(2)设需含Fe2O3质量分数为85%的赤铁矿石的质量为x。
160 112
x×85% 2850t
160
x×85%
=
112
2850t
答:(1)该3000 t生铁中含纯铁2850t。
(2)该炼钢厂每天需含 Fe2O3 质量分数为 85% 的赤铁矿石4790 t。
Fe2O3 + 3CO 2Fe + 3CO2
课堂小结
铁的冶炼
铁的冶炼
矿石的种类
原料:铁矿石、焦炭、石灰石、空气
计算:含杂质物质的相关计算
赤铁矿(主要成分Fe2O3)、磁铁矿(主要成分Fe3O4)、铝土矿(主要成分Al2O3)
原理:
Fe2O3+3CO 2Fe+3CO2
高温
1.下列有关金属的说法,正确的是( )
A.多数金属以单质的形式存在
B.在地壳中含量最高的金属元素是铁
C.常见的铁矿石有赤铁矿和磁铁矿
D.人类每年从自然界提取量最大的金属是铝
C
随堂检测
化合物
铝
铁
2.下列铁矿石中不宜用来炼铁的是( )
A. 赤铁矿 B. 黄铁矿
C. 菱铁矿 D. 磁铁矿
B
赤铁矿的主要成分是 Fe2O3,黄铁矿的主要成分是 FeS2,菱铁矿的主要成分是 FeCO3,磁铁矿的主要成分是 Fe3O4。黄铁矿中含有硫元素,炼铁时会产生二氧化硫,形成酸雨,且其中铁元素的含量较低,因此不宜用来炼铁。
3. (2022福建改编)我国古代常用灰吹法炼银,其过程为:将矿物银熔于铅形成银铅块,通过焙烧使铅氧化成 PbO进入炉灰,灰吹得银。下列说法错误的是( )
A. 银是活泼金属 B. 银铅块属于混合物
C. PbO中 Pb的化合价为 +2 D. 灰吹法炼银过程含有化学变化
A
中华优秀传统文化
4.(2022玉林)如图是模拟工业炼铁的实
验,下列叙述正确的是( )
A. 甲中的反应是置换反应
B. 甲中硬质玻璃管内红色固体变为银白色
C. 用乙装置可防止液体倒吸和防止CO污染空气
D. 实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却
D
5. (2022湘潭)金属材料在人类文明的发展中起着重要作用,古代冶金技术彰显了我国劳动人民的智慧。
Ⅰ.战国《韩非子·内储说上》提到,早期采金技术均是“沙里淘金”。金在自然界中主要以_____(填“单质”或“化合物”)形式存在。
Ⅱ.北宋沈括所著的《梦溪笔谈》中记载了“湿法炼铜”的方法:“熬胆矾铁釜,久之亦化为铜”。即在硫酸铜溶液中加入铁,则可得到铜。该反应的化学方程式是_____________________________,该反应属于_____反应(填基本反应类型)。
单质
中华优秀传统文化
Fe + CuSO4 ===== FeSO4 + Cu
置换
Ⅲ. 明代宋应星所著的《天工开物》一书,介绍了“火法炼锌”的方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐如下图所示,泥封,“其底铺薪,发火煅红”“冷定毁罐取出”。
(1)炉甘石(ZnCO3)加入锌罐之前,先将其粉碎的
目的是___________________________________。
(2)反应区中,炉甘石(ZnCO3)在高温下分解生成
氧化锌和另一种氧化物,该氧化物的化学式是
_____。
增大反应物间接触面积,使反应更充分
CO2
炼锌罐示意图
(3)反应区中,煤炭中的碳与氧化锌反应生成锌和二氧化碳,该反应的化学方程式是__________________________,该
反应中体现了碳的________(填“还原性”或“氧
化性”)。
(4)必须“冷定”后才能“毁罐”取锌,请从化学变
化的角度解释其原因________________________________。
还原性
炼锌罐示意图
2ZnO+C 2Zn+CO2↑
防止较高温度下还原出的锌被氧化
6. 我国高铁建设走在世界前列,修建高铁
需要大量铁矿石来炼铁,进而炼钢。
(1)下列三种铁矿石的主要成分Fe2O3、
Fe3O4、FeCO3中,含铁量最高的是______。
高炉炼铁需要的原料有铁矿石、焦炭、______和石灰石。
(2)要炼出含铁96%的生铁1000t,至少需要含氧化铁80%的赤铁矿多少吨?若高炉气体不加处理,理论上会向大气中排放CO2多少吨(计算结果保留整数)?
Fe3O4
空气
x ≈1714t
解:设需要赤铁矿石的质量为x,产生CO2的质量为y。
160 112 132
x×80% 1000t×96% y
答:至少需要含氧化铁80%的赤铁矿1714t,理论上会向大气中排放CO2的质量为1131t。
y ≈1131t
160
112
x×80%
1000t×96%
=
112
132
1000t×96%
y
=
Fe2O3 + 3CO 2Fe + 3CO2
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
