化学人教版(2019)必修第一册2.3.2气体摩尔体积 物质的量浓度(共16张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.2气体摩尔体积 物质的量浓度(共16张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 00:00:00 | ||
图片预览



文档简介
(共16张PPT)
组织建设
第三节 物质的量
第2课时 气体摩尔体积 物质的量浓度
第二章 海水中的重要元素--钠和氯
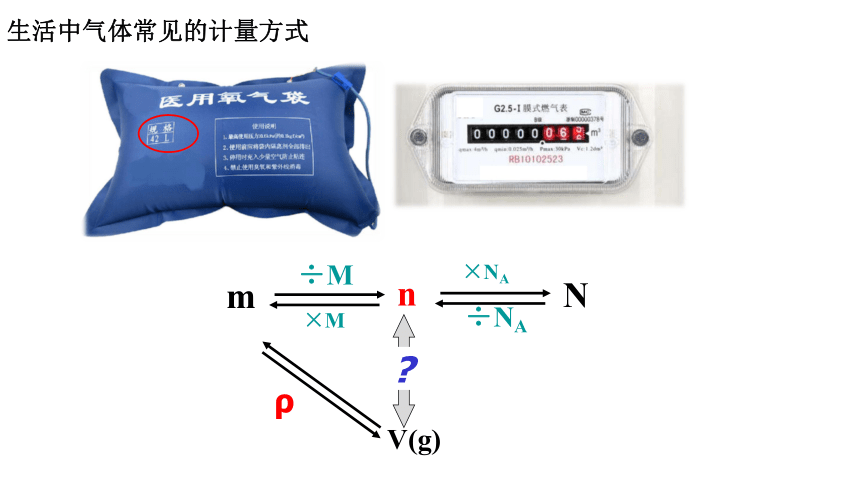
生活中气体常见的计量方式
m
n
N
÷M
×M
×NA
÷NA
V(g)
ρ
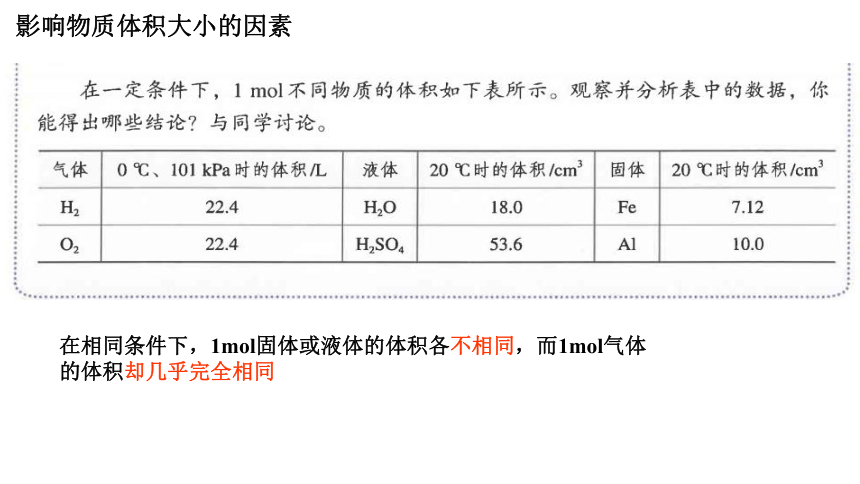
在相同条件下,1mol固体或液体的体积各不相同,而1mol气体的体积却几乎完全相同
影响物质体积大小的因素
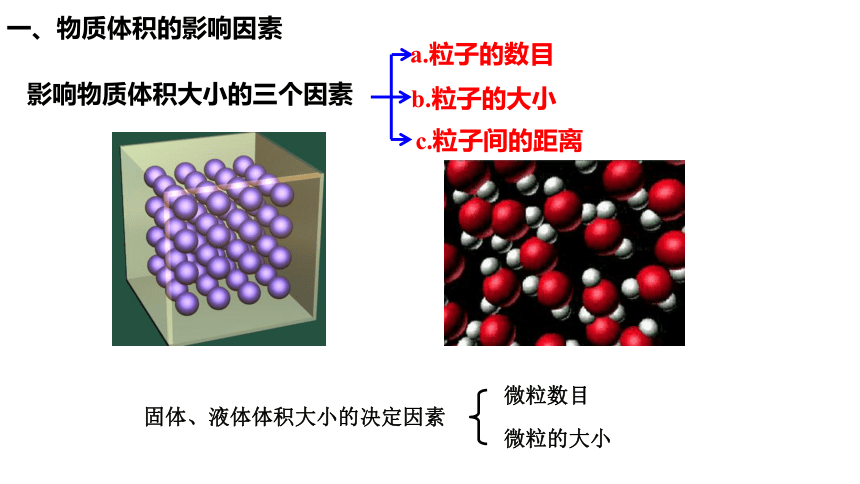
一、物质体积的影响因素
影响物质体积大小的三个因素
a.粒子的数目
b.粒子的大小
c.粒子间的距离
固体、液体体积大小的决定因素
微粒数目
微粒的大小
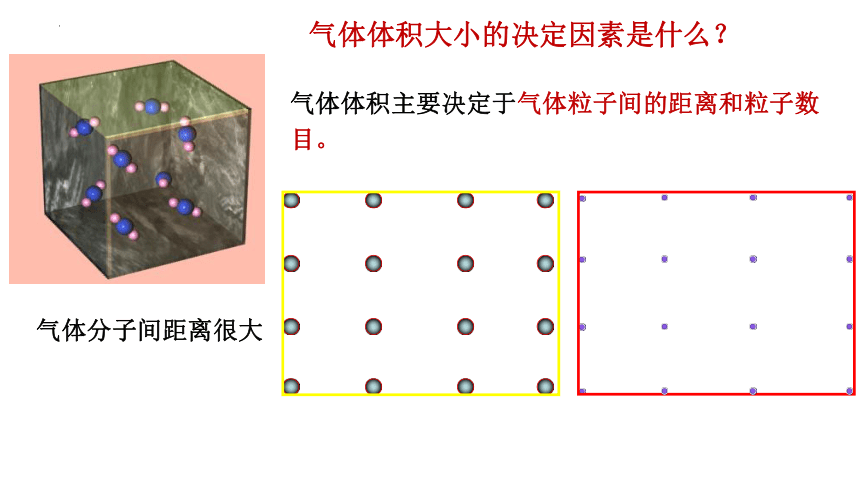
气体分子间距离很大
气体体积大小的决定因素是什么?
气体体积主要决定于气体粒子间的距离和粒子数
目。
气体体积大小的决定因素
分子间平均距离
分子数目
压强
温度
同温同压下,任何气体分子的间距相同
同温同压条件下,粒子数相同的任何气体都具有相同的体积
结论:
单位物质的量的气体所占的体积 。
符号为Vm ,单位为 L/mol
即:
注意:① 物质状态---气态;
② 在不同的温度、压强下, Vm 的值可能不同。
气体摩尔体积(Vm)
气体摩尔体积:
标准状况(0℃,101KPa)下,HF、H2O、NO2、SO3、CCl4、酒精等不属于气态。
即:标准状况下,Vm≈ 22.4 L/mol
在标准状况下,1 mol任何气体所占的体积都约为22.4 L。
气体分子间平均距离与分子种类基本无关。
标准状况下,1摩尔O2和N2的混合气体(任意比)的体积一定约为22.4L吗?为什么?
÷NA
m n N
÷M
×M
×NA
质量
物质的量
粒子数目
V(气体体积)
÷Vm
×Vm
溶质质量分数
体积分数=
溶液的体积
溶质的体积
×100%
质量-体积浓度=
溶液的体积
溶质的质量
m
n
N
÷ M
× M
× NA
÷ NA
V(g)
ρ
× Vm
÷ Vm
V(溶液)
【知识回顾】
物质的量浓度
单位体积的溶液里所含溶质B的物质的量,叫做溶质B的物质的量浓度。
(= )
n质
V液
符号为c(B),常用单位为mol/L
n(溶质) V(溶液)
C
V液= n(B) / c(B)
注意:1、溶液体积不等于溶剂体积。
2、同一溶液,溶质的物质的量浓度与所取溶液体积无关。
下列溶液中的物质的量浓度为1 mol/L的是( )
B. 将40 g NaOH溶于1L水中配成溶液
C. 从1 L1 mol/L的NaOH溶液中取出50 mL,则取出
的溶液中溶质的物质的量浓度
A. 将10 g NaOH溶解于水中配成250 ml 溶液
D. 将22.4 L氯化氢气体溶于水配成1 L溶液
E. 将1 L10 mol/L的浓盐酸与9 L水混合
讨论:
AC
若在50 mL溶液中溶解有9.5 g MgCl2,则该溶液中MgCl2的
物质的量浓度为多少?
2
4
)
(
2
)
(
=
=
/L
mol
MgCl
c
Cl-
c
2
2
2
2
05
.
0
1
.
0
)]
(
[
)
(
)
(
=
=
=
/L
mol
L
mol
aq
MgCl
V
MgCl
n
MgCl
c
溶液中Cl -的物质的量浓度为多少?
微粒数之比
物质的量之比
物质的量浓度之比
1 : 1 : 2
1 : 1 : 2
1 : 1 : 2
电荷守恒关系
2 c(Mg2+) =1 c(Cl-)
MgCl2 = Mg2+ + 2 Cl-
练习1:将5.85 g NaCl 溶解于水,配制成250 mL溶液,从中取
50 mL,这50 mL溶液中含NaCl 物质的量浓度为( )
A、2 mol·L-1 B、0.08 mol·L-1
C、0.4 mol·L-1 D、0.2 mol·L-1
C
练习2:V L硫酸铝溶液中,测知含铝元素(设均以Al3+ 离子形式存在)m g,这种溶液中含SO42-离子物质的量浓度为( )
C
课堂练习
m
n
N
÷ M
× M
× NA
÷ NA
V(g)
ρ
× Vm
÷ Vm
V(溶液)
×C
÷ C
组织建设
第三节 物质的量
第2课时 气体摩尔体积 物质的量浓度
第二章 海水中的重要元素--钠和氯
生活中气体常见的计量方式
m
n
N
÷M
×M
×NA
÷NA
V(g)
ρ
在相同条件下,1mol固体或液体的体积各不相同,而1mol气体的体积却几乎完全相同
影响物质体积大小的因素
一、物质体积的影响因素
影响物质体积大小的三个因素
a.粒子的数目
b.粒子的大小
c.粒子间的距离
固体、液体体积大小的决定因素
微粒数目
微粒的大小
气体分子间距离很大
气体体积大小的决定因素是什么?
气体体积主要决定于气体粒子间的距离和粒子数
目。
气体体积大小的决定因素
分子间平均距离
分子数目
压强
温度
同温同压下,任何气体分子的间距相同
同温同压条件下,粒子数相同的任何气体都具有相同的体积
结论:
单位物质的量的气体所占的体积 。
符号为Vm ,单位为 L/mol
即:
注意:① 物质状态---气态;
② 在不同的温度、压强下, Vm 的值可能不同。
气体摩尔体积(Vm)
气体摩尔体积:
标准状况(0℃,101KPa)下,HF、H2O、NO2、SO3、CCl4、酒精等不属于气态。
即:标准状况下,Vm≈ 22.4 L/mol
在标准状况下,1 mol任何气体所占的体积都约为22.4 L。
气体分子间平均距离与分子种类基本无关。
标准状况下,1摩尔O2和N2的混合气体(任意比)的体积一定约为22.4L吗?为什么?
÷NA
m n N
÷M
×M
×NA
质量
物质的量
粒子数目
V(气体体积)
÷Vm
×Vm
溶质质量分数
体积分数=
溶液的体积
溶质的体积
×100%
质量-体积浓度=
溶液的体积
溶质的质量
m
n
N
÷ M
× M
× NA
÷ NA
V(g)
ρ
× Vm
÷ Vm
V(溶液)
【知识回顾】
物质的量浓度
单位体积的溶液里所含溶质B的物质的量,叫做溶质B的物质的量浓度。
(= )
n质
V液
符号为c(B),常用单位为mol/L
n(溶质) V(溶液)
C
V液= n(B) / c(B)
注意:1、溶液体积不等于溶剂体积。
2、同一溶液,溶质的物质的量浓度与所取溶液体积无关。
下列溶液中的物质的量浓度为1 mol/L的是( )
B. 将40 g NaOH溶于1L水中配成溶液
C. 从1 L1 mol/L的NaOH溶液中取出50 mL,则取出
的溶液中溶质的物质的量浓度
A. 将10 g NaOH溶解于水中配成250 ml 溶液
D. 将22.4 L氯化氢气体溶于水配成1 L溶液
E. 将1 L10 mol/L的浓盐酸与9 L水混合
讨论:
AC
若在50 mL溶液中溶解有9.5 g MgCl2,则该溶液中MgCl2的
物质的量浓度为多少?
2
4
)
(
2
)
(
=
=
/L
mol
MgCl
c
Cl-
c
2
2
2
2
05
.
0
1
.
0
)]
(
[
)
(
)
(
=
=
=
/L
mol
L
mol
aq
MgCl
V
MgCl
n
MgCl
c
溶液中Cl -的物质的量浓度为多少?
微粒数之比
物质的量之比
物质的量浓度之比
1 : 1 : 2
1 : 1 : 2
1 : 1 : 2
电荷守恒关系
2 c(Mg2+) =1 c(Cl-)
MgCl2 = Mg2+ + 2 Cl-
练习1:将5.85 g NaCl 溶解于水,配制成250 mL溶液,从中取
50 mL,这50 mL溶液中含NaCl 物质的量浓度为( )
A、2 mol·L-1 B、0.08 mol·L-1
C、0.4 mol·L-1 D、0.2 mol·L-1
C
练习2:V L硫酸铝溶液中,测知含铝元素(设均以Al3+ 离子形式存在)m g,这种溶液中含SO42-离子物质的量浓度为( )
C
课堂练习
m
n
N
÷ M
× M
× NA
÷ NA
V(g)
ρ
× Vm
÷ Vm
V(溶液)
×C
÷ C
