第二章 化学反应的方向、限度与速率 测试题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第二章 化学反应的方向、限度与速率 测试题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 | 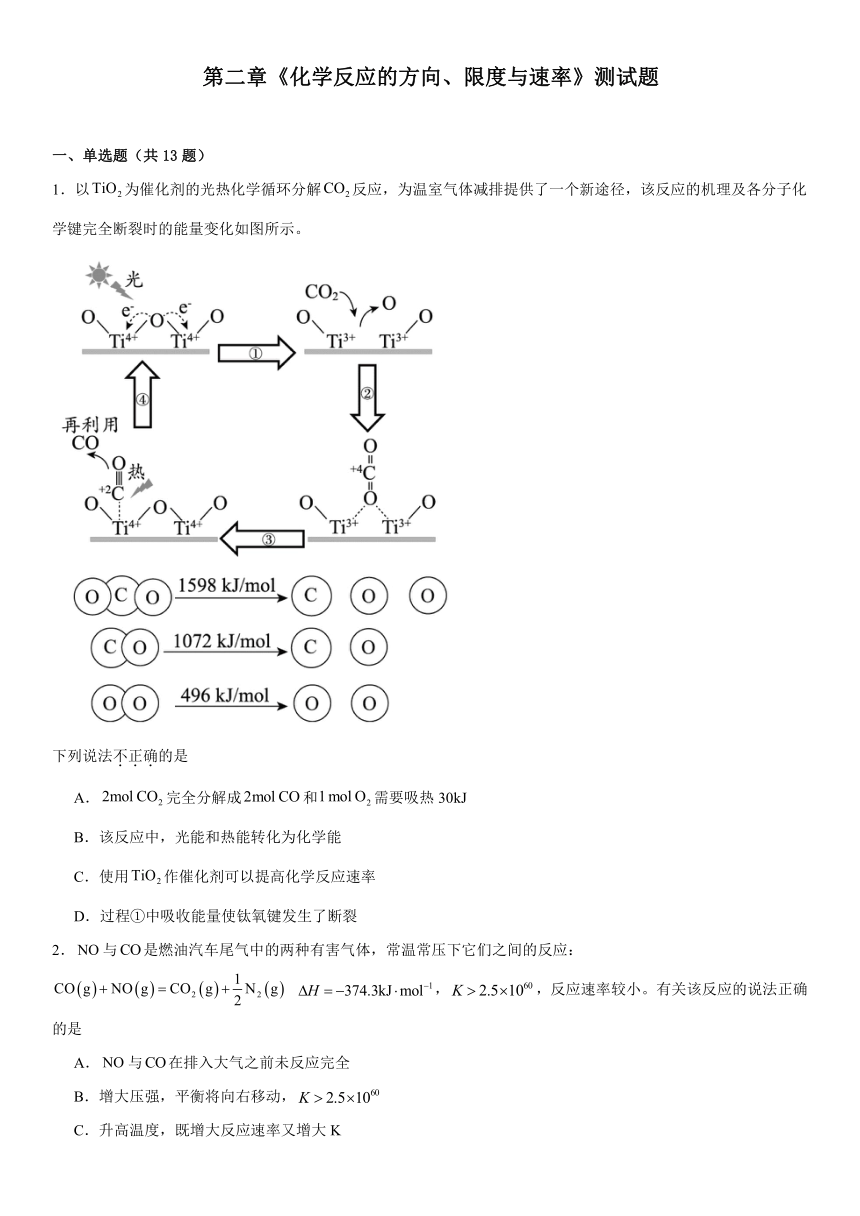 | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 06:18:13 | ||
图片预览



文档简介
第二章《化学反应的方向、限度与速率》测试题
一、单选题(共13题)
1.以为催化剂的光热化学循环分解反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
下列说法不正确的是
A.完全分解成和需要吸热30kJ
B.该反应中,光能和热能转化为化学能
C.使用作催化剂可以提高化学反应速率
D.过程①中吸收能量使钛氧键发生了断裂
2.与是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应: ,,反应速率较小。有关该反应的说法正确的是
A.与在排入大气之前未反应完全
B.增大压强,平衡将向右移动,
C.升高温度,既增大反应速率又增大K
D.选用适宜催化剂,可以增大K,使尾气排放达到标准
3.在密闭容器中发生反应:aA(g) cC(g)+dD(g)反应达平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍。下列叙述正确的是
A.A的转化率变大
B.平衡向逆反应方向移动
C.D的体积分数变大
D.a>c+d
4.某温度下,在2L恒容密闭容器中加入1molN2(g)和3molH2(g)发生反应:N2(g)+3H2(g)2NH3(g) △H<0,NH3的物质的量与时间的关系见表,下列说法正确的是
时间(min) 0 t1 t2 t3
NH3物质的量(mol) 0 0.2 0.3 0.3
A.0~t1min,v(NH3)=mol·L-1·min-1
B.升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆向移动
C.t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.425mol·L-1
D.N2(g)+3H2(g)2NH3(g)的活化能大于2NH3(g)N2(g)+3H2(g)的活化能
5.如图为二氧化硫与氧气反应的速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是
A.增大O2的浓度 B.扩大容器体积 C.升高温度 D.加入催化剂
6.NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,11.2L 所含的分子数为0.5NA
B.0.1mol/L 溶液中,含有的数目小于0.1NA
C.2 mol NO与1 mol 在密闭容器中充分反应后的分子数小于2NA
D.常温下,1 mol Fe与足量的浓硝酸反应转移的电子数为3NA
7.光照条件下,甲烷氯化反应是一个自由基型的取代反应。在链转移反应过程中,经历两步反应:(·CH3和Cl·分别表示甲基和氯原子)
反应1:CH4(g)+Cl·(g)→·CH3(g)+HCl(g);
反应2:·CH3(g)+Cl2(g)→CH3Cl(g)+Cl·(g)。
各物质的相对能量变化如图所示。下列说法不正确的是
A.链转移反应的反应速率由第1步反应决定
B.反应1的活化能Ea=16.7 kJ·mol—1
C.链转移反应的反应热ΔH=—105.4 kJ·mol—1
D.由图可知,过渡态结构的稳定性:1>2
8.和在催化剂表面合成氨的微观历程及能量变化的示意图如下,用、、分别表示、、,已知: 。下列说法正确的是
A.使用催化剂,合成氨反应正向进行的程度增大
B.②→③过程,是吸热过程且只有H-H键的断裂
C.③→④过程,N原子和H原子形成了含有非极性键的
D.合成氨反应中,反应物断键吸收能量小于生成物形成新键释放的能量
9.以二氧化碳和氢气为原料制取乙醇的反应为2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
A.a点的平衡常数小于b点
B.b点,v正(CO2)=v逆(H2O)
C.a点,H2和H2O物质的量相等
D.其他条件恒定,充入更多H2,v(CO2)不变
10.以下说法不正确的是( )
A.升温可提高活化分子百分数,加快反应速率
B.使用催化剂可降低反应活化能,加快反应速
C.增大反应物的浓度可增大活化分子百分数,从而加快反应速率
D.对于有气体参与的反应,温度不变时压强的变化可以看作改变浓度
11.化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是
选项 化学反应 测量依据(单位时间内)
A CO(g)+H2O(g)=CO2(g)+H2(g) 压强变化
B Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) 氢气体积
C 2NO2(g)N2O4(g) 颜色深浅
D Ca(OH)2(aq)+Na2CO3(aq)=CaCO3(s)+2NaOH(aq) 沉淀质量
A.A B.B C.C D.D
12.向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[阶段c(B)未画出]。图乙为改变条件平衡体系中化学反应速率随时间变化的情况,、、、时刻均改变一种条件,且改变的条件均不同。已知时刻为使用催化剂。下列说法正确的是
A.B的起始物质的量为0.02 mol
B.若s,生成物C在段的化学反应速率为
C.时刻改变的条件可能为降温
D.时刻改变的条件可能为充入0.1 mol B
13.一定量的与足量的碳在体积可变的恒压密闭容器中反应:。平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压气体总压体积分数。下列说法不正确的是
A.该反应,
B.时,若充入惰性气体,,均减小,平衡向正反应方向移动
C.时,若充入等体积的和,平衡向逆反应方向移动
D.时,反应达平衡后的转化率为
二、填空题(共10题)
14.按要求完成下列问题。
在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)2X(g)Y(g)+Z(s)
(乙)A(s)+2B(g)C(g)+D(g)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是 ;能表明(乙)达到化学平衡状态是 。
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
15.【化学---化学与技术】工业上以黄铁矿为原料,采用接触法生产硫酸。
(1)在炉气制造中,生成SO2的化学方程式为 。
(2)炉气精制的作用是将含SO2的炉气 、 及干燥,如果炉气不经过精制,对SO2催化氧化的影响是 。
(3)精制炉气(含SO2体积分数为7%、O2为ll%、N2为82%)中SO2平衡转化率与温度及压强关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压、450 ℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 、 。
(4)在SO2催化氧化设备中设置热交换器的目的是 、 ,从而充分利用能源。
16.催化加氢合成二甲醚是资源化利用的有效途径之一,合成二甲醚的总反应可表示为:总反应:(表示平衡常数,下同)
该反应可通过如下步骤来实现:
反应Ⅰ:
反应Ⅱ:
请回答:
(1) (用表示), (用表示)。
(2)、的条件下,平衡时转化率和的选择性随温度变化如图1所示。
其中:的选择性
①下列说法正确的是 。
A.
B.若反应在恒容密闭容器中进行,当体系压强不再变化,则反应Ⅰ、Ⅱ均达到平衡状态
C.提高氢碳比,平衡时的转化率增大,的选择性减小
②时,不考虑其他副反应,反应Ⅰ的平衡常数为 。
③、的条件下,催化加氢反应一段时间,不同温度下实际转化率和实际选择性数据如表:
温度/ 220 240 260 280 300
实际转化率% 7.6 12.4 14.8 18.6 22.9
二甲醚实际选择性% 68.7 77.2 61.0 41.5 27.5
该体系合成二甲醚的最佳反应温度为 。
④由上表数据可知,二甲醚的实际选择性逐渐减小,从化学反应速率角度分析原因 。
(3)、、,平衡时转化率和的收率与进料气中体积分数有关,其变化如图2所示,其中:
的收率
的收率
请在图2中选出在之间平衡收率的变化趋势 (填“a”或“b”或“c”)
17.自发过程和自发反应的比较
自发过程 自发反应
含义 在一定条件下, ,就能自发进行的过程。 在给定的条件下,可以 进行到显著程度的化学反应。
特征 具有 ,即过程的某个方向在一定条件下自发进行,而该过程逆方向在该条件下肯定
举例 高山流水,自由落体,冰雪融化 钢铁生锈
应用 可被用来完成有用功。如H2燃烧可设计成 。 非自发过程要想发生,必须对它做功。如通电将水分解为 。
18.T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。
已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
(1)容器中反应的化学方程式为 。
(2)前2 min,v(A)= mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是 。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K= (保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是 (填选项字母)。
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
19.反应A(g)+B(g)C(g)+D(g)过程中的能量变化如下图所示,回答下列问题。
(1)该反应是 反应(填“吸热”或“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”或“不变”)
(3)反应体系中加入催化剂对反应热是否有影响? (填“有”、或“无”)
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”、“减小”或“不变”)。
20.氮氧化物是主要的大气污染物之一,可用一氧化碳或活性炭还原氮氧化物,减少大气污染。回答下列问题:
(1)一定条件下,用CO与NO反应生成和,反应的化学方程式:。
①为提高该反应的速率,下列措施可行的是 (填标号)。
A.压缩容器体积 B.降低温度 C.使用合适催化剂 D.恒温恒容充入稀有气体
②该反应的能量变化关系如图所示:
判断其属于 (填“放热反应”或“吸热反应”)。
(2)两个10L的密闭容器中分别都加入活性炭(足量)和1.0molNO,发生反应:。实验测得,两容器中在不同温度下NO和的物质的量变化见下表:
物质的量/mol 容器1 容器2
0 5min 9min 10min 12min 0 5min 9min 10min
NO 1.0 0.58 0.42 0.40 0.40 1.0 0.50 0.34 0.34
0 0.21 0.29 0.30 0.30 0 0.25 0.33 0.33
①时,0~5min内,反应速率 ;
②时,按表中数据,反应一定达到化学平衡状态的时间段是 min~10min,此时,容器中的物质的量浓度是 mo/L;
③两容器中温度关系为 (填“>”“<”或“=”)。
21.在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) 0 1 2 3 4 5
n(NO)(mol) 0.020 0.01. 0.008 0.007 0.007 0.007
(1)已知:K300℃>K350℃,写出该反应的平衡常数表达式:K= 。关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)下图中表示NO2的变化的曲线是 。用O2表示从0-2s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v 逆(NO)=2v正 (O2) D.容器内密度保持不变
(4)下列措施中能使n(NO2)/n(NO)增大的有 。(填字母)
A.升高温度 B.加入催化剂
C.不断充入O2 D.充入He(g),使体系总压强增大
22.用和合成在三种不同实验条件下,在密闭容器中进行反应 。已知起始浓度:,。的浓度随时间的变化如图所示:回答下列问题:
(1)实验1,该反应进行到时, 。
(2)与实验1比较,实验2所改变的条件是 ,判断的理由是 。
(3)甲同学认为,与实验1比较,实验3所改变的条件是提高反应温度,乙同学认为该观点是错误的,乙同学的理由是 。
(4)实验3中,的平衡转化率为 ,平衡常数的代数式为:
(5)和在一定条件下可以合成甲醇:。在密闭容器中按物质的量之比为充入和,测得平衡混合气体中的平衡转化率随温度。压强的变化关系如图所示。
由图可知 (填“>”“<”); (填“>”“<”)0;
23.氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物。综合治理其污染是化学家研究的主要内容。根据题意完成下列各题:
(1)用甲烷催化还原一氧化氮,可以消除一氧化氮对大气的污染。反应方程式如下:该反应平衡常数表达式为 。
(2)硫酸生产中,接触室内的反应:;SO2的平衡转化率与体系总压强的关系如图所示。某温度下,将2.0mol SO2和1.0mol O2置于30L刚性密闭容器中,30秒反应达平衡后,体系总压强为2.70MPa。用氧气表示该反应的平均速率是 mol·L-1·min-1。
(3)上图平衡状态由A变到B时,改变的外界条件是 。
a 又加入一些催化剂 b 又加入一些氧气
c 降低了体系的温度 d 升高了外界的大气压
(4)新型纳米材料氧缺位铁酸盐MFe2Ox在常温下,能将氮的氧化物和SO2等废气分解除去。转化流程如图所示,
若x=3.5,M为Zn,请写出ZnFe2O3.5分解SO2的化学方程式
试卷第1页,共3页
参考答案:
1.A
【详解】A.由信息可知的键能和为1598kJ/mol,CO的键能为1072kJ/mol,的键能为496kJ/mol,根据焓变=反应物键能和-生成物键能和,则,=2×1598kJ/mol-2×1072kJ/mol-496kJ/mol=+556 kJ/mol,即完全分解成和需要吸热556kJ,故A错误;
B.由图中信息可知,光照和受热条件下均有反应发生,光能和热能转化为化学能,故B正确;
C.催化剂参与反应过程,降低反应活化能加快反应速率,故C正确;
D.由图中信息可知过程①中钛氧键发生了断裂,断裂化学键吸收能量,故D正确;
故选:A。
2.A
【详解】A.根据已知信息,对于反应,存在平衡常数,说明该反应为可逆反应,反应物不能完全转化为生成物,故A正确;
B.该反应为分子数减少的反应,增大压强,平衡正向移动,但是平衡常数只与温度有关,温度不变,平衡常数不变,故B错误;
C.根据题意,该反应,为放热反应,升高温度,反应速率增大,平衡逆向移动,平衡常数减小,故C错误;
D.催化剂只能加快反应速率,对平衡常数无影响,故D错误;
故选A。
3.B
【分析】气体体积刚压缩平衡还未移动时D的浓度是原来的2倍,当再次达到平衡时,D的浓度为原平衡的1.8倍,D的浓度减小,所以压缩体积使平衡向逆反应方向移动。
【详解】A.平衡向逆反应方向移动,A的转化率变小,A错误;
B.平衡向逆反应方向移动,B正确;
C.平衡向逆反应方向移动,D的体积分数减小,C错误;
D.增大压强,平衡向气体体积减小的方向移动,该平衡向逆反应方向移动,所以a<c+d,D错误。
答案选B。
4.C
【详解】A.t1时NH3的物质的量为0.2mol,即生成了0.2molNH3,容器体积为2L,则变化的NH3的浓度为0.1mol/L,所以v(NH3)= mol·L-1·min-1,故A错误;
B.升高温度,正逆反应速率都增大,正反应速率增大的程度没有逆反应速率增大的程度大,故平衡逆向移动,故B错误;
C.t3时反应已达平衡,再加入1mol的N2(g)和3molH2(g),相当于增大压强,N2的体积分数降低,但N2的物质的量增大,容器体积不变,所以反应达新平衡时,c(N2)>0.425mol·L-1,故C正确;
D.该反应的正反应是放热的,正反应的活化能小于逆反应的活化能,故D错误;
故选C。
5.D
【详解】二氧化硫的催化氧化反应是气体体积减小的放热反应,改变反应温度、压强和反应物的浓度,平衡均会发生移动,出现正逆反应速率差,由图可知,t1时刻条件变化的瞬间,正逆反应速率增大的倍数相等,没有出现速率差,化学平衡不移动,则改变的条件只可能为加入催化剂,故选D。
6.C
【详解】A.已知标准状况下SO3为固体,则无法计算11.2L SO3所含的分子数,A错误;
B.由于题干未告知溶液的体积,故无法计算0.1mol/L 溶液中,含有的数目,B错误;
C.已知反应2NO+O2=2NO2和2NO2N2O4可知,2 mol NO与1 mol 在密闭容器中充分反应后的分子数小于2NA,C正确;
D.常温下,Fe在浓硝酸中发生钝化,故无法计算1 mol Fe与足量的浓硝酸反应转移的电子数,D错误;
故答案为:C。
7.D
【详解】A.化学反应取决于化学反应速率慢的一步反应,由图可知,反应1的活化能大于反应2的活化能,则反应1的反应速率小于反应2,链转移反应的反应速率由第1步反应决定,故A正确;
B.由图可知,反应1的活化能Ea=16.7 kJ·mol—1,故B正确;
C.由图可知,链转移反应的反应物总能量高于生成物总能量,该反应为放热反应,反应热ΔH=—105.4 kJ·mol—1,故C正确;
D.由图可知,过渡态1的能量高于由图过渡态2,则过渡态结构2的稳定性强于过渡态结构1,故D错误;
故选D。
8.D
【详解】A.催化剂不能使平衡移动,使用催化剂,合成氨反应进行的程度不变,故A错误;
B.②→③过程,H-H键、键断裂,是吸热过程,故B错误;
C.③→④过程,N原子和H原子形成了只含有极性键的,故C错误;
D.合成氨反应放热,反应物断键吸收能量小于生成物形成新键释放的能量,故D正确;
选D。
9.C
【详解】A. 因为平衡常数仅与温度有关,该反应为放热反应,升高温度平衡向逆反应移动,所以温度越低,K越大,所以Ka>Kb,故A错误;
B. b点为该温度下的平衡状态,根据方程式可知v正(CO2)≠v逆(H2O),故B错误;
C. 根据图象分析结合方程式可知a点为H2和H2O物质的量的交点,所以相等,故C正确;
D. 其他条件恒定,充入更多H2,增大反应物的浓度平衡正向移动,所以v(CO2)也改变,故D错误;
故选C。
10.C
【详解】A.升高温度,使单位体积内活化分子数增多,活化分子的百分数增大,从而使有效碰撞次数增大,使化学反应速率增大,故A正确;
B.催化剂能降低反应的活化能,活化分子的百分数增大,从而使有效碰撞次数增大,化学反应速率增大,故B正确;
C.加入反应物,活化分子百分数不变,但活化分子总数增加,化学反应速率增大,故C错误;
D.对于有气体参与的反应,温度不变时,压强的变化相当于浓度的变化,故D正确;
故选C。
11.A
【详解】A.该反应是气体分子数保持不变的反应,所以反应过程中气体的压强始终保持不变,测量依据不可行,A符合题意;
B.若单位时间内氢气的体积变多,则证明反应速率加快,反之,则反应速率减慢,测量依据可行,B不符合题意;
C.二氧化氮是红棕色气体,四氧化二氮为无色气体,则单位时间内颜色的深浅坎可代表二氧化氮的浓度多少,符合反应速率的测量依据,C不符合题意;
D.单位时间内产生沉淀的质量越多,反应速率越快,反之则速率减慢,测量依据可行,D不符合题意;
故选A。
12.B
【分析】由题中图象可知,反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有3A(g)B(g)+2C(g);据此解答。
【详解】A.由上述分析可知,该反应的方程式为3A(g)B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为2L,生成B的物质的量为0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,故A错误;
B.若t1=15s,生成物C在t0~t1时间段的平均反应速率为v(C)==0.004mol·L-1·s-1,故B正确;
C.由上述分析可知,若t4~t5阶段改变的条件为降低反应温度,平衡会发生移动,则正逆反应速率不相等,所以t4时刻改变的条件应为降低压强,故C错误;
D.由题中图象可知,t5时该正逆反应速率均增大且增大的倍数不同,此时改变的条件为升高温度或增大压强,若增大压强,对于此反应平衡不移动,正逆反应速率增大是一样的,所以时刻改变的条件为升高温度,故D错误;
答案为B。
13.C
【详解】A.由化学方程式可知,该反应,升高温度CO2的体积分数减小,CO的体积分数增加,说明升高温度,平衡正向移动,则,A项正确;
B.可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,则v正,v逆均减小,又该反应是气体体积增大的反应,则平衡正向移动,B项正确;
C.由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%,所以充入等体积的CO2和CO后依然是平衡状态,平衡不移动,C项错误;
D.由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,则剩余的CO2为(1-x)mol,生成的CO为2xmol,所以有,解得x=0.25mol,所以CO2的转化率为25.0%,D项正确;
答案选C。
14. ①②③④⑤⑥ ①②③⑤
【详解】①混合气体密度不变,甲反应是气体体积减小的反应,甲容器中气体体积不变,质量会变,密度也变,能判断达到平衡,由于乙反应的两边气体的体积相同,但气体的质量是变化的,所以密度始终不变可判断乙是否达到平衡状态;
②反应容器中生成物的百分含量不变是平衡标志;
③反应物的消耗速率与生成物的消耗速率之比等于系数之比,说明正逆反应速率相同,反应甲、乙达到平衡状态;
④恒温时,气体压强不再改变,乙反应的两边气体的体积相同且都是气体,压强始终不变,所以压强不变无法判断乙是否达到平衡状态,可以判断甲达到平衡状态;
⑤混合气体的平均相对分子质量不变,甲反应前后气体物质的量变化,质量变化,混合气体的平均相对分子质量不变,说明反应达到平衡状态,乙反应是反应前后气体物质的量不变,质量增大,当混合气体的平均相对分子质量不变,说明反应达到平衡状态;
⑥甲反应是气体体积减小的反应,乙是气体体积不变的反应,混合气体的总物质的量不变说明甲达到平衡状态,乙不能判断是否达到平衡状态;
能表明(甲)达到化学平衡状态是①②③④⑤⑥,能表明(乙)达到化学平衡状态是①②③⑤,故答案为:①②③④⑤⑥;①②③⑤。
15. 4FeS2+ 11O2 2Fe2O3+ 8SO2 除尘 洗涤 催化剂容易中毒,水蒸气对设备和生产有不良影响。 不选B点,因为压强越大对设备的投资大,消耗的动能大;SO2原料的转化率在1个大气压下的转化率已是97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压。 不选择C点,因为温度越低,SO2转化率虽然更高,但催化剂的催化作用受影响,450 ℃时,催化剂的催化效率最高。故不选C点。 充分利用反应放出的热量,预热原料气体 上层反应气经热交换器温度降到400 ℃ ~ 500℃ 进入下层使反应更加完全
【详解】试题分析:(1)在炉气制造中,生成SO2的化学方程式为4FeS2+ 11O2 2Fe2O3+ 8SO2。
(2)将含SO2的炉气经过除尘、洗涤及干燥可以得到精制的炉气,如果炉气不经过精制,会使得催化剂中毒,同时水蒸气对设备和生产有不良影响。
(3)在实际生产中,SO2催化氧化反应的条件选择常压、450 ℃左右,而没有选择SO2转化率更高的B或C点对应的反应条件,原因是压强越大对设备的投资大,消耗的动能大;SO2原料的转化率在1个大气压下的转化率已是97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压。温度越低,SO2转化率虽然更高,但催化剂的催化作用受影响,450℃时,催化剂的催化效率最高。
(4)在SO2催化氧化设备中设置热交换器的目的是充分利用反应放出的热量,预热原料气体;上层反应气经热交换器温度降到400 ℃ ~ 500℃ 进入下层使反应更加完全,从而充分利用能源。
考点:考查了硫酸的工业制法的相关知识。
16.(1)
(2) AB 0.052 ,在催化剂作用下,随着温度升高,反应Ⅰ速率加快的程度比反应Ⅱ大,故二甲醚的实际选择性逐渐减小
(3)a
【详解】(1)反应Ⅰ:
反应Ⅱ:根据盖斯定律分析,有Ⅰ×2+Ⅱ得热化学方程式,则平衡常数有K=。
(2)①从图分析,随着温度升高,甲醚的平衡选择性降低,说明生成甲醚的反应为放热反应,二氧化碳的平衡转化率先降低后升高,说明反应Ⅰ为吸热反应,而反应Ⅱ为放热反应,但总反应为放热反应,故A正确;若反应在恒容密闭容器中进行,当体系压强不再变化,因为反应Ⅱ为前后气体总物质的量不同的反应,故反应Ⅱ达到平衡,进而推知反应Ⅰ、Ⅱ也达到平衡状态,故B正确;若提高氢碳比,从反应Ⅰ分析,二氧化碳的转化率应该降低,但平衡时的转化率增大,说明反应Ⅱ进行的程度较大,故的选择性增大。故选AB。
②从图中(360,35)点分析,二氧化碳的转化率为35%,此时没有生成甲醚,故有
,则平衡常数K=。
③从表中数据分析,在二甲醚的实际选择性最大,故最佳反应温度为。
④,在催化剂作用下,随着温度升高,反应Ⅰ速率加快的程度比反应Ⅱ大,故二甲醚的实际选择性逐渐减小。
(3)从图分析,二氧化碳的转化率降低,而二甲醚的平衡收率增大,故一氧化碳的平衡收率应逐渐降低且降低程度比二氧化碳大,故选择a曲线。
17. 不用借助外力 自发 方向性 不能自发进行 原电池 H2和O2
【详解】含义:在一定条件下不用借助外力就能自动进行的过程叫自发过程;在给定条件下可以自发进行到显著的程度的化学反应叫自发反应。
特征:具有方向性,即过程的某个方向在一定条件下自发进行,而该过程逆方向在该条件下肯定不能自发进行。
应用:自发过程可被用来完成有用功,如H2燃烧可设计成原电池。非自发过程要想发生,必须对它做功,如通电将水分解为H2和O2。
18. 0.4 BD 1.69 C
【详解】试题分析:(1)根据所给信息分析,相同的时间内A减少了0.8-0.4=0.4摩尔,B减少了1.0-0.8=0.2摩尔,C增加了0.6-0=0.6摩尔,D增加了0.2-0=0.2摩尔,物质的量比等于化学方程式的系数比,所以AB为反应物,CD为生成物,方程式为:2A+B3C+D。(2)A的速率=(0.8-0.4)/0.5/2=0.4mol·(min·L)-1。(3)A、反应为前后气体的体积相等的反应,所以压强始终不变,所以压强不变不能说明反应已经达到平衡;B、由于反应中有非气体物质,所以混合气体的密度比不变说明反应达到平衡;C、消耗B和生成D都是说明正反应的速率,不能说明反应达到平衡;D、B的物质的量不变说明反应达到平衡。所以选BD。(4)平衡时A的浓度为0.4/0.5=0.8mol/L,B的浓度.8/0.5=1.6mol/L,C的浓度为0.6/.05=1.2mol/L,化学平衡常数=c(C)3/c(A)2c(B)=1.69。(5)A、只增加A的量,平衡正向移动,但A的转化率减小;B、移走一部分D,不影响平衡;C、升高温度,平衡正向移动,A的转化率增大;D、将体积缩小,平衡不移动。所以选C。
考点:化学平衡。
19. 放热 减小 无 减小 减小
【详解】(1)由反应过程中的能量变化图可以知道,反应物的总能量高于生成物的总能量,故反应为放热反应,因此,本题正确答案是:放热;
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,A的转化率减小,因此,本题正确答案是:减小;
(3)加入催化剂改变了反应的途径,降低反应所需的活化能,但催化剂不改变反应物总能量与生成物总能量之差即反应热不变,所以对该反应的反应热无影响;
因此,本题正确答案是:无影响;催化剂不改变反应物总能量与生成物总能量之差;
(4)加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2的变化都减小,
因此,本题正确答案是:减小;减小;催化剂改变了反应的途径,降低了反应所需的活化能;
【点睛】(1)由反应过程中的能量变化图可以知道,反应物的总能量高于生成物的总能量,故反应为放热反应;
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,据此解答;
(3)加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变;
(4)加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2的变化都减小。
20.(1) AC 放热反应
(2) 0.0042 9 0.033 <
【详解】(1)①A.该反应有气体参与反应,增大压强,化学反应速率增大,A符合题意;
B.降低温度,化学反应速率减小,B不符合题意;
C.使用合适催化剂,化学反应速率增大,C符合题意;
D.恒温恒容冲稀有气体,反应速率不改变,D不符合题意;
答案选AC;
②如图所示,反应物CO、NO的总能量高于生成物N2、CO2的总能量,该反应属于放热反应;
(2)①T1时,0~5min内,Δn(N2)=0.21mol,v(N2)===0.0042mol·L-1·min-1,v(CO2)=v(N2)= 0.0042mol·L-1·min-1;
②T2时,9min之后,NO和N2的物质的量不再变化,说明此时反应达到了化学平衡状态;此时,Δn(N2)=0.33mol,则n(CO2)=Δn(CO2)=Δn(N2)=0.33mol,c(CO2)===0.033mol/L;
③0~5min内,T1时,N2的物质的量的变化量Δn(N2)=0.21mol,T2时,N2的物质的量的变化量Δn(N2)=0.25mol,0.21mol<0.25mol,说明T1时的反应速率小于T2时的反应速率,则T1<T2。
21. C b BC C
【详解】(1)在2L密闭容器内,800℃时反应为:2NO(g)+O2(g) 2NO2(g),此反应的平衡常数表达式为K=c2(NO2)/ c2(NO) ·c(O2);已知:K300℃>K350℃,升高温度,平衡常数减小,则平衡逆向移动,说明正反应是放热反应(△H<0),由方程式前后气体分子数减小,说明正反应是熵减过程(△S<0),所以选C。
(2)NO2的计量数与NO的计量数相等,则它们的浓度变化量相等,由图中数据分析可知图中表示NO2的变化的曲线是b;从0-2s,O2的浓度由0.005mol/L变化到0.002mol/L,ν(O2)== Δc(O2)/ Δt==0.003mol/L÷2s== 0.0015mol·L—1·s—1;
(3)A.v(NO2)=2v(O2),速率没有正、逆,无法比较,A错误;在2L密闭容器内,发生2NO(g)+O2(g) 2NO2(g),气体分子数前后不同,压强不同,当压强一定时能说明该反应已达到平衡状态,B正确;C.v逆 (NO)=2v正 (O2),NO的正、逆反应速率相等,达到平衡状态,C正确;整个反应体系都气体,则气体总质量不变,容积不变,密度就不变,所以密度不能作为反应平衡标志,D错误。
(4)2NO(g)+O2(g) 2NO2(g),△H<0,升高温度,平衡逆向移动,n(NO2)/n(NO)减小;加入催化剂,平衡不移动,n(NO2)/n(NO)不变;恒容容器中不断充入O2,平衡正向移动,n(NO2)/n(NO)变大;恒容容器中充入He(g),参与反应物质浓度不变,平衡不移动,n(NO2)/n(NO)不变。
22.(1)
(2) 催化剂 实验2达平衡所需的时间比实验1短(或实验2反应速率快),而最终达到的平衡状态一致(或最终X的平衡浓度相同)
(3)因该反应放热,提高反应温度,平衡向左移动,X的平衡浓度应大于
(4) 60%
(5) > <
【详解】(1)根据速率的计算公式和图象变化趋势可知,实验1,该反应进行到时,,根据反应速率之比等于化学计量数之比可知,该时间段内的平均速率为;
(2)与实验1比较,实验2显著缩短了达到平衡所用的时间,提高了反应速率,但并没有改变达到平衡时物质的浓度,应是加入了催化剂;
(3)根据反应 可知,该反应为放热反应,若与实验1比较,实验3所改变的条件是提高反应温度,则正逆反应速率会加快,达到平衡所用时间会缩短,但提高温度,不利于X的转化,所用最终平衡时X的浓度会增大,即因该反应放热,提高反应温度,平衡向左移动X的平衡浓度应大于,这与图象变化趋势不符,所以该观点错误;
(4)根据图象可知,实验3中,转化浓度为,所以转化浓度为,则其平衡转化率为;达平衡时,X的浓度为0.040mol/L,则Y的浓度为0.200mol/L-0.120mol/L=0.080mol/L,Z的浓度为0.060mol/L,则平衡常数的代数式为;
(5)由p1→p2,CO的平衡转化率降低,说明平衡逆向移动,反应为气体分子数减小的反应,降低压强,平衡逆向移动,则p1>p2;由图可知,温度升高,CO的平衡转化率降低,说明平衡逆向移动,则反应的<0;
23. 0.0533 b 4ZnFe2O3.5 +SO2 = 4ZnFe2O4 + S
【分析】⑴根据平衡常数表达式完成。
⑵根据反应得出氧气的转化率,再计算出用氧气表示的反应速率。
⑶状态由A变到B时,二氧化硫转化率升高,压强增大,根据平衡移动原理分析。
⑷从氧化还原反应的角度判断反应产物,根据氧原子个数守恒写出相关反应的方程式。
【详解】⑴该反应平衡常数表达式为:;故答案为:。
⑵图中信息得出二氧化硫的转化率是0.8,根据加入量之比等于计量系数之比,转化率相等得出氧气转化率也为0.8,消耗氧气的物质的量是:n(O2)=1.0mol×0.8=0.8mol,用氧气表示反应速率为:;故答案是:0.0533。
⑶a. 又加入一些催化剂,催化剂不影响化学平衡,故a不符合题意;b. 加入一些氧气,压强增大,增加氧气浓度,平衡正向移动,二氧化硫的转化率升高,故b符合题意;c. 反应是放热反应,降低温度,平衡向着正向移动,气体的物质的量减少,压强减小,故c不符合题意;d. 升高了外界的大气压,化学平衡不移动,故d不符合题意;综上所述,答案为:b。
⑷由题意可知,铁酸盐(MFe2O4)经高温还原而得,则反应物中MFe2Ox为还原剂,SO2为氧化剂,生成物为MFe2O4和S,根据氧原子守恒得到反应的关系式为4ZnFe2O3.5 + SO2 = 4ZnFe2O4+S;故答案为:4ZnFe2O3.5 +SO2 = 4ZnFe2O4 + S
一、单选题(共13题)
1.以为催化剂的光热化学循环分解反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
下列说法不正确的是
A.完全分解成和需要吸热30kJ
B.该反应中,光能和热能转化为化学能
C.使用作催化剂可以提高化学反应速率
D.过程①中吸收能量使钛氧键发生了断裂
2.与是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应: ,,反应速率较小。有关该反应的说法正确的是
A.与在排入大气之前未反应完全
B.增大压强,平衡将向右移动,
C.升高温度,既增大反应速率又增大K
D.选用适宜催化剂,可以增大K,使尾气排放达到标准
3.在密闭容器中发生反应:aA(g) cC(g)+dD(g)反应达平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍。下列叙述正确的是
A.A的转化率变大
B.平衡向逆反应方向移动
C.D的体积分数变大
D.a>c+d
4.某温度下,在2L恒容密闭容器中加入1molN2(g)和3molH2(g)发生反应:N2(g)+3H2(g)2NH3(g) △H<0,NH3的物质的量与时间的关系见表,下列说法正确的是
时间(min) 0 t1 t2 t3
NH3物质的量(mol) 0 0.2 0.3 0.3
A.0~t1min,v(NH3)=mol·L-1·min-1
B.升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆向移动
C.t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.425mol·L-1
D.N2(g)+3H2(g)2NH3(g)的活化能大于2NH3(g)N2(g)+3H2(g)的活化能
5.如图为二氧化硫与氧气反应的速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是
A.增大O2的浓度 B.扩大容器体积 C.升高温度 D.加入催化剂
6.NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,11.2L 所含的分子数为0.5NA
B.0.1mol/L 溶液中,含有的数目小于0.1NA
C.2 mol NO与1 mol 在密闭容器中充分反应后的分子数小于2NA
D.常温下,1 mol Fe与足量的浓硝酸反应转移的电子数为3NA
7.光照条件下,甲烷氯化反应是一个自由基型的取代反应。在链转移反应过程中,经历两步反应:(·CH3和Cl·分别表示甲基和氯原子)
反应1:CH4(g)+Cl·(g)→·CH3(g)+HCl(g);
反应2:·CH3(g)+Cl2(g)→CH3Cl(g)+Cl·(g)。
各物质的相对能量变化如图所示。下列说法不正确的是
A.链转移反应的反应速率由第1步反应决定
B.反应1的活化能Ea=16.7 kJ·mol—1
C.链转移反应的反应热ΔH=—105.4 kJ·mol—1
D.由图可知,过渡态结构的稳定性:1>2
8.和在催化剂表面合成氨的微观历程及能量变化的示意图如下,用、、分别表示、、,已知: 。下列说法正确的是
A.使用催化剂,合成氨反应正向进行的程度增大
B.②→③过程,是吸热过程且只有H-H键的断裂
C.③→④过程,N原子和H原子形成了含有非极性键的
D.合成氨反应中,反应物断键吸收能量小于生成物形成新键释放的能量
9.以二氧化碳和氢气为原料制取乙醇的反应为2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
A.a点的平衡常数小于b点
B.b点,v正(CO2)=v逆(H2O)
C.a点,H2和H2O物质的量相等
D.其他条件恒定,充入更多H2,v(CO2)不变
10.以下说法不正确的是( )
A.升温可提高活化分子百分数,加快反应速率
B.使用催化剂可降低反应活化能,加快反应速
C.增大反应物的浓度可增大活化分子百分数,从而加快反应速率
D.对于有气体参与的反应,温度不变时压强的变化可以看作改变浓度
11.化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是
选项 化学反应 测量依据(单位时间内)
A CO(g)+H2O(g)=CO2(g)+H2(g) 压强变化
B Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) 氢气体积
C 2NO2(g)N2O4(g) 颜色深浅
D Ca(OH)2(aq)+Na2CO3(aq)=CaCO3(s)+2NaOH(aq) 沉淀质量
A.A B.B C.C D.D
12.向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[阶段c(B)未画出]。图乙为改变条件平衡体系中化学反应速率随时间变化的情况,、、、时刻均改变一种条件,且改变的条件均不同。已知时刻为使用催化剂。下列说法正确的是
A.B的起始物质的量为0.02 mol
B.若s,生成物C在段的化学反应速率为
C.时刻改变的条件可能为降温
D.时刻改变的条件可能为充入0.1 mol B
13.一定量的与足量的碳在体积可变的恒压密闭容器中反应:。平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压气体总压体积分数。下列说法不正确的是
A.该反应,
B.时,若充入惰性气体,,均减小,平衡向正反应方向移动
C.时,若充入等体积的和,平衡向逆反应方向移动
D.时,反应达平衡后的转化率为
二、填空题(共10题)
14.按要求完成下列问题。
在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)2X(g)Y(g)+Z(s)
(乙)A(s)+2B(g)C(g)+D(g)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是 ;能表明(乙)达到化学平衡状态是 。
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
15.【化学---化学与技术】工业上以黄铁矿为原料,采用接触法生产硫酸。
(1)在炉气制造中,生成SO2的化学方程式为 。
(2)炉气精制的作用是将含SO2的炉气 、 及干燥,如果炉气不经过精制,对SO2催化氧化的影响是 。
(3)精制炉气(含SO2体积分数为7%、O2为ll%、N2为82%)中SO2平衡转化率与温度及压强关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压、450 ℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 、 。
(4)在SO2催化氧化设备中设置热交换器的目的是 、 ,从而充分利用能源。
16.催化加氢合成二甲醚是资源化利用的有效途径之一,合成二甲醚的总反应可表示为:总反应:(表示平衡常数,下同)
该反应可通过如下步骤来实现:
反应Ⅰ:
反应Ⅱ:
请回答:
(1) (用表示), (用表示)。
(2)、的条件下,平衡时转化率和的选择性随温度变化如图1所示。
其中:的选择性
①下列说法正确的是 。
A.
B.若反应在恒容密闭容器中进行,当体系压强不再变化,则反应Ⅰ、Ⅱ均达到平衡状态
C.提高氢碳比,平衡时的转化率增大,的选择性减小
②时,不考虑其他副反应,反应Ⅰ的平衡常数为 。
③、的条件下,催化加氢反应一段时间,不同温度下实际转化率和实际选择性数据如表:
温度/ 220 240 260 280 300
实际转化率% 7.6 12.4 14.8 18.6 22.9
二甲醚实际选择性% 68.7 77.2 61.0 41.5 27.5
该体系合成二甲醚的最佳反应温度为 。
④由上表数据可知,二甲醚的实际选择性逐渐减小,从化学反应速率角度分析原因 。
(3)、、,平衡时转化率和的收率与进料气中体积分数有关,其变化如图2所示,其中:
的收率
的收率
请在图2中选出在之间平衡收率的变化趋势 (填“a”或“b”或“c”)
17.自发过程和自发反应的比较
自发过程 自发反应
含义 在一定条件下, ,就能自发进行的过程。 在给定的条件下,可以 进行到显著程度的化学反应。
特征 具有 ,即过程的某个方向在一定条件下自发进行,而该过程逆方向在该条件下肯定
举例 高山流水,自由落体,冰雪融化 钢铁生锈
应用 可被用来完成有用功。如H2燃烧可设计成 。 非自发过程要想发生,必须对它做功。如通电将水分解为 。
18.T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。
已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
(1)容器中反应的化学方程式为 。
(2)前2 min,v(A)= mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是 。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K= (保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是 (填选项字母)。
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
19.反应A(g)+B(g)C(g)+D(g)过程中的能量变化如下图所示,回答下列问题。
(1)该反应是 反应(填“吸热”或“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”或“不变”)
(3)反应体系中加入催化剂对反应热是否有影响? (填“有”、或“无”)
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”、“减小”或“不变”)。
20.氮氧化物是主要的大气污染物之一,可用一氧化碳或活性炭还原氮氧化物,减少大气污染。回答下列问题:
(1)一定条件下,用CO与NO反应生成和,反应的化学方程式:。
①为提高该反应的速率,下列措施可行的是 (填标号)。
A.压缩容器体积 B.降低温度 C.使用合适催化剂 D.恒温恒容充入稀有气体
②该反应的能量变化关系如图所示:
判断其属于 (填“放热反应”或“吸热反应”)。
(2)两个10L的密闭容器中分别都加入活性炭(足量)和1.0molNO,发生反应:。实验测得,两容器中在不同温度下NO和的物质的量变化见下表:
物质的量/mol 容器1 容器2
0 5min 9min 10min 12min 0 5min 9min 10min
NO 1.0 0.58 0.42 0.40 0.40 1.0 0.50 0.34 0.34
0 0.21 0.29 0.30 0.30 0 0.25 0.33 0.33
①时,0~5min内,反应速率 ;
②时,按表中数据,反应一定达到化学平衡状态的时间段是 min~10min,此时,容器中的物质的量浓度是 mo/L;
③两容器中温度关系为 (填“>”“<”或“=”)。
21.在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) 0 1 2 3 4 5
n(NO)(mol) 0.020 0.01. 0.008 0.007 0.007 0.007
(1)已知:K300℃>K350℃,写出该反应的平衡常数表达式:K= 。关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)下图中表示NO2的变化的曲线是 。用O2表示从0-2s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v 逆(NO)=2v正 (O2) D.容器内密度保持不变
(4)下列措施中能使n(NO2)/n(NO)增大的有 。(填字母)
A.升高温度 B.加入催化剂
C.不断充入O2 D.充入He(g),使体系总压强增大
22.用和合成在三种不同实验条件下,在密闭容器中进行反应 。已知起始浓度:,。的浓度随时间的变化如图所示:回答下列问题:
(1)实验1,该反应进行到时, 。
(2)与实验1比较,实验2所改变的条件是 ,判断的理由是 。
(3)甲同学认为,与实验1比较,实验3所改变的条件是提高反应温度,乙同学认为该观点是错误的,乙同学的理由是 。
(4)实验3中,的平衡转化率为 ,平衡常数的代数式为:
(5)和在一定条件下可以合成甲醇:。在密闭容器中按物质的量之比为充入和,测得平衡混合气体中的平衡转化率随温度。压强的变化关系如图所示。
由图可知 (填“>”“<”); (填“>”“<”)0;
23.氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物。综合治理其污染是化学家研究的主要内容。根据题意完成下列各题:
(1)用甲烷催化还原一氧化氮,可以消除一氧化氮对大气的污染。反应方程式如下:该反应平衡常数表达式为 。
(2)硫酸生产中,接触室内的反应:;SO2的平衡转化率与体系总压强的关系如图所示。某温度下,将2.0mol SO2和1.0mol O2置于30L刚性密闭容器中,30秒反应达平衡后,体系总压强为2.70MPa。用氧气表示该反应的平均速率是 mol·L-1·min-1。
(3)上图平衡状态由A变到B时,改变的外界条件是 。
a 又加入一些催化剂 b 又加入一些氧气
c 降低了体系的温度 d 升高了外界的大气压
(4)新型纳米材料氧缺位铁酸盐MFe2Ox在常温下,能将氮的氧化物和SO2等废气分解除去。转化流程如图所示,
若x=3.5,M为Zn,请写出ZnFe2O3.5分解SO2的化学方程式
试卷第1页,共3页
参考答案:
1.A
【详解】A.由信息可知的键能和为1598kJ/mol,CO的键能为1072kJ/mol,的键能为496kJ/mol,根据焓变=反应物键能和-生成物键能和,则,=2×1598kJ/mol-2×1072kJ/mol-496kJ/mol=+556 kJ/mol,即完全分解成和需要吸热556kJ,故A错误;
B.由图中信息可知,光照和受热条件下均有反应发生,光能和热能转化为化学能,故B正确;
C.催化剂参与反应过程,降低反应活化能加快反应速率,故C正确;
D.由图中信息可知过程①中钛氧键发生了断裂,断裂化学键吸收能量,故D正确;
故选:A。
2.A
【详解】A.根据已知信息,对于反应,存在平衡常数,说明该反应为可逆反应,反应物不能完全转化为生成物,故A正确;
B.该反应为分子数减少的反应,增大压强,平衡正向移动,但是平衡常数只与温度有关,温度不变,平衡常数不变,故B错误;
C.根据题意,该反应,为放热反应,升高温度,反应速率增大,平衡逆向移动,平衡常数减小,故C错误;
D.催化剂只能加快反应速率,对平衡常数无影响,故D错误;
故选A。
3.B
【分析】气体体积刚压缩平衡还未移动时D的浓度是原来的2倍,当再次达到平衡时,D的浓度为原平衡的1.8倍,D的浓度减小,所以压缩体积使平衡向逆反应方向移动。
【详解】A.平衡向逆反应方向移动,A的转化率变小,A错误;
B.平衡向逆反应方向移动,B正确;
C.平衡向逆反应方向移动,D的体积分数减小,C错误;
D.增大压强,平衡向气体体积减小的方向移动,该平衡向逆反应方向移动,所以a<c+d,D错误。
答案选B。
4.C
【详解】A.t1时NH3的物质的量为0.2mol,即生成了0.2molNH3,容器体积为2L,则变化的NH3的浓度为0.1mol/L,所以v(NH3)= mol·L-1·min-1,故A错误;
B.升高温度,正逆反应速率都增大,正反应速率增大的程度没有逆反应速率增大的程度大,故平衡逆向移动,故B错误;
C.t3时反应已达平衡,再加入1mol的N2(g)和3molH2(g),相当于增大压强,N2的体积分数降低,但N2的物质的量增大,容器体积不变,所以反应达新平衡时,c(N2)>0.425mol·L-1,故C正确;
D.该反应的正反应是放热的,正反应的活化能小于逆反应的活化能,故D错误;
故选C。
5.D
【详解】二氧化硫的催化氧化反应是气体体积减小的放热反应,改变反应温度、压强和反应物的浓度,平衡均会发生移动,出现正逆反应速率差,由图可知,t1时刻条件变化的瞬间,正逆反应速率增大的倍数相等,没有出现速率差,化学平衡不移动,则改变的条件只可能为加入催化剂,故选D。
6.C
【详解】A.已知标准状况下SO3为固体,则无法计算11.2L SO3所含的分子数,A错误;
B.由于题干未告知溶液的体积,故无法计算0.1mol/L 溶液中,含有的数目,B错误;
C.已知反应2NO+O2=2NO2和2NO2N2O4可知,2 mol NO与1 mol 在密闭容器中充分反应后的分子数小于2NA,C正确;
D.常温下,Fe在浓硝酸中发生钝化,故无法计算1 mol Fe与足量的浓硝酸反应转移的电子数,D错误;
故答案为:C。
7.D
【详解】A.化学反应取决于化学反应速率慢的一步反应,由图可知,反应1的活化能大于反应2的活化能,则反应1的反应速率小于反应2,链转移反应的反应速率由第1步反应决定,故A正确;
B.由图可知,反应1的活化能Ea=16.7 kJ·mol—1,故B正确;
C.由图可知,链转移反应的反应物总能量高于生成物总能量,该反应为放热反应,反应热ΔH=—105.4 kJ·mol—1,故C正确;
D.由图可知,过渡态1的能量高于由图过渡态2,则过渡态结构2的稳定性强于过渡态结构1,故D错误;
故选D。
8.D
【详解】A.催化剂不能使平衡移动,使用催化剂,合成氨反应进行的程度不变,故A错误;
B.②→③过程,H-H键、键断裂,是吸热过程,故B错误;
C.③→④过程,N原子和H原子形成了只含有极性键的,故C错误;
D.合成氨反应放热,反应物断键吸收能量小于生成物形成新键释放的能量,故D正确;
选D。
9.C
【详解】A. 因为平衡常数仅与温度有关,该反应为放热反应,升高温度平衡向逆反应移动,所以温度越低,K越大,所以Ka>Kb,故A错误;
B. b点为该温度下的平衡状态,根据方程式可知v正(CO2)≠v逆(H2O),故B错误;
C. 根据图象分析结合方程式可知a点为H2和H2O物质的量的交点,所以相等,故C正确;
D. 其他条件恒定,充入更多H2,增大反应物的浓度平衡正向移动,所以v(CO2)也改变,故D错误;
故选C。
10.C
【详解】A.升高温度,使单位体积内活化分子数增多,活化分子的百分数增大,从而使有效碰撞次数增大,使化学反应速率增大,故A正确;
B.催化剂能降低反应的活化能,活化分子的百分数增大,从而使有效碰撞次数增大,化学反应速率增大,故B正确;
C.加入反应物,活化分子百分数不变,但活化分子总数增加,化学反应速率增大,故C错误;
D.对于有气体参与的反应,温度不变时,压强的变化相当于浓度的变化,故D正确;
故选C。
11.A
【详解】A.该反应是气体分子数保持不变的反应,所以反应过程中气体的压强始终保持不变,测量依据不可行,A符合题意;
B.若单位时间内氢气的体积变多,则证明反应速率加快,反之,则反应速率减慢,测量依据可行,B不符合题意;
C.二氧化氮是红棕色气体,四氧化二氮为无色气体,则单位时间内颜色的深浅坎可代表二氧化氮的浓度多少,符合反应速率的测量依据,C不符合题意;
D.单位时间内产生沉淀的质量越多,反应速率越快,反之则速率减慢,测量依据可行,D不符合题意;
故选A。
12.B
【分析】由题中图象可知,反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有3A(g)B(g)+2C(g);据此解答。
【详解】A.由上述分析可知,该反应的方程式为3A(g)B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为2L,生成B的物质的量为0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,故A错误;
B.若t1=15s,生成物C在t0~t1时间段的平均反应速率为v(C)==0.004mol·L-1·s-1,故B正确;
C.由上述分析可知,若t4~t5阶段改变的条件为降低反应温度,平衡会发生移动,则正逆反应速率不相等,所以t4时刻改变的条件应为降低压强,故C错误;
D.由题中图象可知,t5时该正逆反应速率均增大且增大的倍数不同,此时改变的条件为升高温度或增大压强,若增大压强,对于此反应平衡不移动,正逆反应速率增大是一样的,所以时刻改变的条件为升高温度,故D错误;
答案为B。
13.C
【详解】A.由化学方程式可知,该反应,升高温度CO2的体积分数减小,CO的体积分数增加,说明升高温度,平衡正向移动,则,A项正确;
B.可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,则v正,v逆均减小,又该反应是气体体积增大的反应,则平衡正向移动,B项正确;
C.由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%,所以充入等体积的CO2和CO后依然是平衡状态,平衡不移动,C项错误;
D.由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,则剩余的CO2为(1-x)mol,生成的CO为2xmol,所以有,解得x=0.25mol,所以CO2的转化率为25.0%,D项正确;
答案选C。
14. ①②③④⑤⑥ ①②③⑤
【详解】①混合气体密度不变,甲反应是气体体积减小的反应,甲容器中气体体积不变,质量会变,密度也变,能判断达到平衡,由于乙反应的两边气体的体积相同,但气体的质量是变化的,所以密度始终不变可判断乙是否达到平衡状态;
②反应容器中生成物的百分含量不变是平衡标志;
③反应物的消耗速率与生成物的消耗速率之比等于系数之比,说明正逆反应速率相同,反应甲、乙达到平衡状态;
④恒温时,气体压强不再改变,乙反应的两边气体的体积相同且都是气体,压强始终不变,所以压强不变无法判断乙是否达到平衡状态,可以判断甲达到平衡状态;
⑤混合气体的平均相对分子质量不变,甲反应前后气体物质的量变化,质量变化,混合气体的平均相对分子质量不变,说明反应达到平衡状态,乙反应是反应前后气体物质的量不变,质量增大,当混合气体的平均相对分子质量不变,说明反应达到平衡状态;
⑥甲反应是气体体积减小的反应,乙是气体体积不变的反应,混合气体的总物质的量不变说明甲达到平衡状态,乙不能判断是否达到平衡状态;
能表明(甲)达到化学平衡状态是①②③④⑤⑥,能表明(乙)达到化学平衡状态是①②③⑤,故答案为:①②③④⑤⑥;①②③⑤。
15. 4FeS2+ 11O2 2Fe2O3+ 8SO2 除尘 洗涤 催化剂容易中毒,水蒸气对设备和生产有不良影响。 不选B点,因为压强越大对设备的投资大,消耗的动能大;SO2原料的转化率在1个大气压下的转化率已是97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压。 不选择C点,因为温度越低,SO2转化率虽然更高,但催化剂的催化作用受影响,450 ℃时,催化剂的催化效率最高。故不选C点。 充分利用反应放出的热量,预热原料气体 上层反应气经热交换器温度降到400 ℃ ~ 500℃ 进入下层使反应更加完全
【详解】试题分析:(1)在炉气制造中,生成SO2的化学方程式为4FeS2+ 11O2 2Fe2O3+ 8SO2。
(2)将含SO2的炉气经过除尘、洗涤及干燥可以得到精制的炉气,如果炉气不经过精制,会使得催化剂中毒,同时水蒸气对设备和生产有不良影响。
(3)在实际生产中,SO2催化氧化反应的条件选择常压、450 ℃左右,而没有选择SO2转化率更高的B或C点对应的反应条件,原因是压强越大对设备的投资大,消耗的动能大;SO2原料的转化率在1个大气压下的转化率已是97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压。温度越低,SO2转化率虽然更高,但催化剂的催化作用受影响,450℃时,催化剂的催化效率最高。
(4)在SO2催化氧化设备中设置热交换器的目的是充分利用反应放出的热量,预热原料气体;上层反应气经热交换器温度降到400 ℃ ~ 500℃ 进入下层使反应更加完全,从而充分利用能源。
考点:考查了硫酸的工业制法的相关知识。
16.(1)
(2) AB 0.052 ,在催化剂作用下,随着温度升高,反应Ⅰ速率加快的程度比反应Ⅱ大,故二甲醚的实际选择性逐渐减小
(3)a
【详解】(1)反应Ⅰ:
反应Ⅱ:根据盖斯定律分析,有Ⅰ×2+Ⅱ得热化学方程式,则平衡常数有K=。
(2)①从图分析,随着温度升高,甲醚的平衡选择性降低,说明生成甲醚的反应为放热反应,二氧化碳的平衡转化率先降低后升高,说明反应Ⅰ为吸热反应,而反应Ⅱ为放热反应,但总反应为放热反应,故A正确;若反应在恒容密闭容器中进行,当体系压强不再变化,因为反应Ⅱ为前后气体总物质的量不同的反应,故反应Ⅱ达到平衡,进而推知反应Ⅰ、Ⅱ也达到平衡状态,故B正确;若提高氢碳比,从反应Ⅰ分析,二氧化碳的转化率应该降低,但平衡时的转化率增大,说明反应Ⅱ进行的程度较大,故的选择性增大。故选AB。
②从图中(360,35)点分析,二氧化碳的转化率为35%,此时没有生成甲醚,故有
,则平衡常数K=。
③从表中数据分析,在二甲醚的实际选择性最大,故最佳反应温度为。
④,在催化剂作用下,随着温度升高,反应Ⅰ速率加快的程度比反应Ⅱ大,故二甲醚的实际选择性逐渐减小。
(3)从图分析,二氧化碳的转化率降低,而二甲醚的平衡收率增大,故一氧化碳的平衡收率应逐渐降低且降低程度比二氧化碳大,故选择a曲线。
17. 不用借助外力 自发 方向性 不能自发进行 原电池 H2和O2
【详解】含义:在一定条件下不用借助外力就能自动进行的过程叫自发过程;在给定条件下可以自发进行到显著的程度的化学反应叫自发反应。
特征:具有方向性,即过程的某个方向在一定条件下自发进行,而该过程逆方向在该条件下肯定不能自发进行。
应用:自发过程可被用来完成有用功,如H2燃烧可设计成原电池。非自发过程要想发生,必须对它做功,如通电将水分解为H2和O2。
18. 0.4 BD 1.69 C
【详解】试题分析:(1)根据所给信息分析,相同的时间内A减少了0.8-0.4=0.4摩尔,B减少了1.0-0.8=0.2摩尔,C增加了0.6-0=0.6摩尔,D增加了0.2-0=0.2摩尔,物质的量比等于化学方程式的系数比,所以AB为反应物,CD为生成物,方程式为:2A+B3C+D。(2)A的速率=(0.8-0.4)/0.5/2=0.4mol·(min·L)-1。(3)A、反应为前后气体的体积相等的反应,所以压强始终不变,所以压强不变不能说明反应已经达到平衡;B、由于反应中有非气体物质,所以混合气体的密度比不变说明反应达到平衡;C、消耗B和生成D都是说明正反应的速率,不能说明反应达到平衡;D、B的物质的量不变说明反应达到平衡。所以选BD。(4)平衡时A的浓度为0.4/0.5=0.8mol/L,B的浓度.8/0.5=1.6mol/L,C的浓度为0.6/.05=1.2mol/L,化学平衡常数=c(C)3/c(A)2c(B)=1.69。(5)A、只增加A的量,平衡正向移动,但A的转化率减小;B、移走一部分D,不影响平衡;C、升高温度,平衡正向移动,A的转化率增大;D、将体积缩小,平衡不移动。所以选C。
考点:化学平衡。
19. 放热 减小 无 减小 减小
【详解】(1)由反应过程中的能量变化图可以知道,反应物的总能量高于生成物的总能量,故反应为放热反应,因此,本题正确答案是:放热;
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,A的转化率减小,因此,本题正确答案是:减小;
(3)加入催化剂改变了反应的途径,降低反应所需的活化能,但催化剂不改变反应物总能量与生成物总能量之差即反应热不变,所以对该反应的反应热无影响;
因此,本题正确答案是:无影响;催化剂不改变反应物总能量与生成物总能量之差;
(4)加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2的变化都减小,
因此,本题正确答案是:减小;减小;催化剂改变了反应的途径,降低了反应所需的活化能;
【点睛】(1)由反应过程中的能量变化图可以知道,反应物的总能量高于生成物的总能量,故反应为放热反应;
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,据此解答;
(3)加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变;
(4)加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2的变化都减小。
20.(1) AC 放热反应
(2) 0.0042 9 0.033 <
【详解】(1)①A.该反应有气体参与反应,增大压强,化学反应速率增大,A符合题意;
B.降低温度,化学反应速率减小,B不符合题意;
C.使用合适催化剂,化学反应速率增大,C符合题意;
D.恒温恒容冲稀有气体,反应速率不改变,D不符合题意;
答案选AC;
②如图所示,反应物CO、NO的总能量高于生成物N2、CO2的总能量,该反应属于放热反应;
(2)①T1时,0~5min内,Δn(N2)=0.21mol,v(N2)===0.0042mol·L-1·min-1,v(CO2)=v(N2)= 0.0042mol·L-1·min-1;
②T2时,9min之后,NO和N2的物质的量不再变化,说明此时反应达到了化学平衡状态;此时,Δn(N2)=0.33mol,则n(CO2)=Δn(CO2)=Δn(N2)=0.33mol,c(CO2)===0.033mol/L;
③0~5min内,T1时,N2的物质的量的变化量Δn(N2)=0.21mol,T2时,N2的物质的量的变化量Δn(N2)=0.25mol,0.21mol<0.25mol,说明T1时的反应速率小于T2时的反应速率,则T1<T2。
21. C b BC C
【详解】(1)在2L密闭容器内,800℃时反应为:2NO(g)+O2(g) 2NO2(g),此反应的平衡常数表达式为K=c2(NO2)/ c2(NO) ·c(O2);已知:K300℃>K350℃,升高温度,平衡常数减小,则平衡逆向移动,说明正反应是放热反应(△H<0),由方程式前后气体分子数减小,说明正反应是熵减过程(△S<0),所以选C。
(2)NO2的计量数与NO的计量数相等,则它们的浓度变化量相等,由图中数据分析可知图中表示NO2的变化的曲线是b;从0-2s,O2的浓度由0.005mol/L变化到0.002mol/L,ν(O2)== Δc(O2)/ Δt==0.003mol/L÷2s== 0.0015mol·L—1·s—1;
(3)A.v(NO2)=2v(O2),速率没有正、逆,无法比较,A错误;在2L密闭容器内,发生2NO(g)+O2(g) 2NO2(g),气体分子数前后不同,压强不同,当压强一定时能说明该反应已达到平衡状态,B正确;C.v逆 (NO)=2v正 (O2),NO的正、逆反应速率相等,达到平衡状态,C正确;整个反应体系都气体,则气体总质量不变,容积不变,密度就不变,所以密度不能作为反应平衡标志,D错误。
(4)2NO(g)+O2(g) 2NO2(g),△H<0,升高温度,平衡逆向移动,n(NO2)/n(NO)减小;加入催化剂,平衡不移动,n(NO2)/n(NO)不变;恒容容器中不断充入O2,平衡正向移动,n(NO2)/n(NO)变大;恒容容器中充入He(g),参与反应物质浓度不变,平衡不移动,n(NO2)/n(NO)不变。
22.(1)
(2) 催化剂 实验2达平衡所需的时间比实验1短(或实验2反应速率快),而最终达到的平衡状态一致(或最终X的平衡浓度相同)
(3)因该反应放热,提高反应温度,平衡向左移动,X的平衡浓度应大于
(4) 60%
(5) > <
【详解】(1)根据速率的计算公式和图象变化趋势可知,实验1,该反应进行到时,,根据反应速率之比等于化学计量数之比可知,该时间段内的平均速率为;
(2)与实验1比较,实验2显著缩短了达到平衡所用的时间,提高了反应速率,但并没有改变达到平衡时物质的浓度,应是加入了催化剂;
(3)根据反应 可知,该反应为放热反应,若与实验1比较,实验3所改变的条件是提高反应温度,则正逆反应速率会加快,达到平衡所用时间会缩短,但提高温度,不利于X的转化,所用最终平衡时X的浓度会增大,即因该反应放热,提高反应温度,平衡向左移动X的平衡浓度应大于,这与图象变化趋势不符,所以该观点错误;
(4)根据图象可知,实验3中,转化浓度为,所以转化浓度为,则其平衡转化率为;达平衡时,X的浓度为0.040mol/L,则Y的浓度为0.200mol/L-0.120mol/L=0.080mol/L,Z的浓度为0.060mol/L,则平衡常数的代数式为;
(5)由p1→p2,CO的平衡转化率降低,说明平衡逆向移动,反应为气体分子数减小的反应,降低压强,平衡逆向移动,则p1>p2;由图可知,温度升高,CO的平衡转化率降低,说明平衡逆向移动,则反应的<0;
23. 0.0533 b 4ZnFe2O3.5 +SO2 = 4ZnFe2O4 + S
【分析】⑴根据平衡常数表达式完成。
⑵根据反应得出氧气的转化率,再计算出用氧气表示的反应速率。
⑶状态由A变到B时,二氧化硫转化率升高,压强增大,根据平衡移动原理分析。
⑷从氧化还原反应的角度判断反应产物,根据氧原子个数守恒写出相关反应的方程式。
【详解】⑴该反应平衡常数表达式为:;故答案为:。
⑵图中信息得出二氧化硫的转化率是0.8,根据加入量之比等于计量系数之比,转化率相等得出氧气转化率也为0.8,消耗氧气的物质的量是:n(O2)=1.0mol×0.8=0.8mol,用氧气表示反应速率为:;故答案是:0.0533。
⑶a. 又加入一些催化剂,催化剂不影响化学平衡,故a不符合题意;b. 加入一些氧气,压强增大,增加氧气浓度,平衡正向移动,二氧化硫的转化率升高,故b符合题意;c. 反应是放热反应,降低温度,平衡向着正向移动,气体的物质的量减少,压强减小,故c不符合题意;d. 升高了外界的大气压,化学平衡不移动,故d不符合题意;综上所述,答案为:b。
⑷由题意可知,铁酸盐(MFe2O4)经高温还原而得,则反应物中MFe2Ox为还原剂,SO2为氧化剂,生成物为MFe2O4和S,根据氧原子守恒得到反应的关系式为4ZnFe2O3.5 + SO2 = 4ZnFe2O4+S;故答案为:4ZnFe2O3.5 +SO2 = 4ZnFe2O4 + S
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
