高中化学苏教版必修第一册专题3 第1单元 第1课时 氯气的发现与制备 同步练习(含解析)
文档属性
| 名称 | 高中化学苏教版必修第一册专题3 第1单元 第1课时 氯气的发现与制备 同步练习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 889.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 09:11:55 | ||
图片预览


文档简介
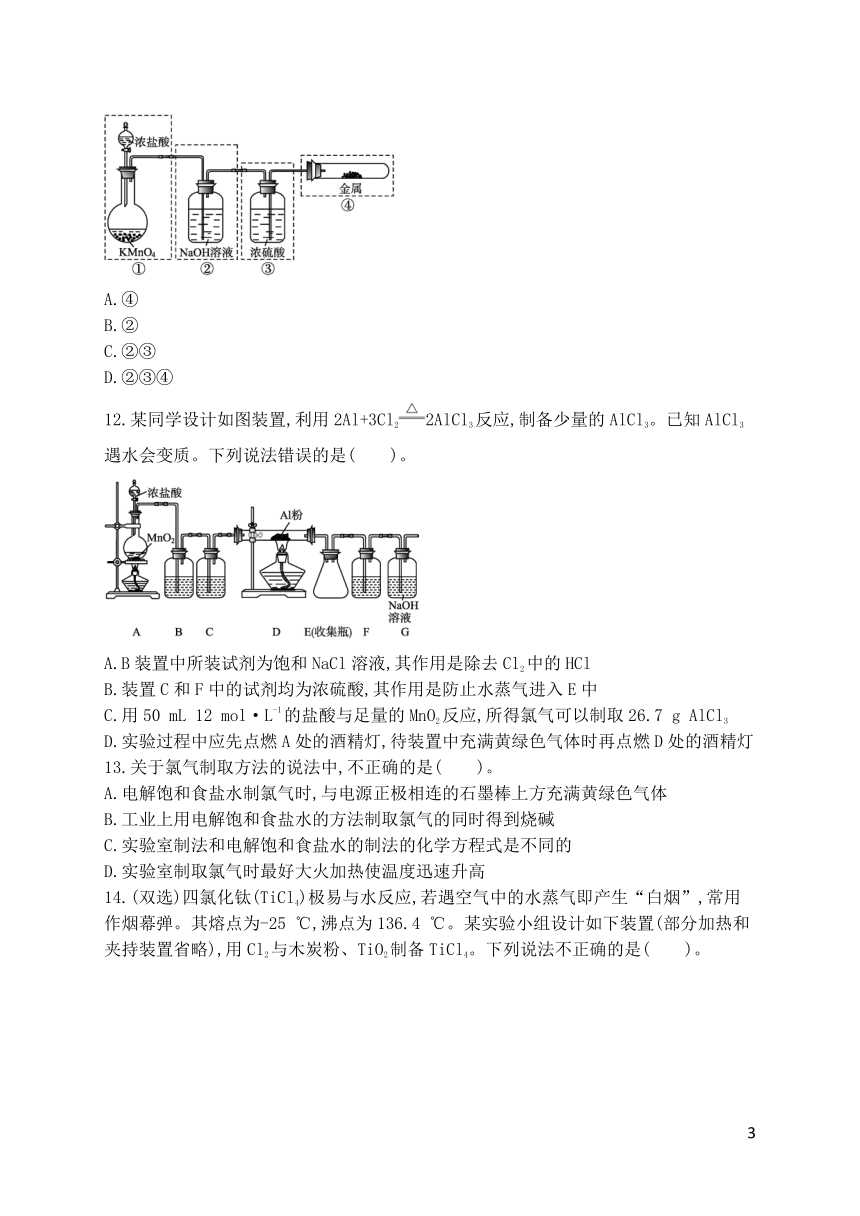
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
第1课时 氯气的发现与制备
1.下列关于氯的说法不正确的是( )
A.氯元素在自然界中存在游离态,只是量极少
B.一般通过结晶的方式获得海水中的含氯物质
C.氯气是一种黄绿色、有刺激性气味的气体
D.氯是重要的“成盐元素”,主要以NaCl、MgCl2等氯化物的形式存在于海水中
2.下列反应与人类最早发现氯气的化学反应原理相关的是( )
A.MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
B.4HCl+O22Cl2+2H2O
C.2NaCl+2H2O2NaOH+Cl2↑+H2↑
D.2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
3.已知:氯气能与NaOH溶液反应。下列装置能达到实验目的的是( )
4.在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是( )
5.某化学兴趣小组利用MnO2和浓盐酸及如图装置制备氯气。下列分析中不正确的是( )
A.①中可用分液漏斗代替长颈漏斗
B.①中缺少加热装置
C.②中盛放的NaOH溶液可以净化氯气
D.④中盛放的NaOH溶液可以吸收尾气
6.下列有关实验室制取氯气的说法不正确的是( )
A.二氧化锰和稀盐酸在加热条件下反应生成氯气
B.常用浓硫酸作Cl2的干燥剂
C.多余的氯气可用氢氧化钠溶液吸收
D.收集氯气用向上排空气法
7.欲除去Cl2中少量的HCl气体,可选用( )。
A.NaOH溶液 B.饱和食盐水
C.浓硫酸 D.石灰水
8.某实验室的尾气中含有较多的氯气,要吸收这些尾气,下列试剂最适合的是( )。
A.饱和石灰水 B.饱和食盐水
C.自来水 D.烧碱溶液
9.含2 mol HCl的浓盐酸与足量的二氧化锰共热制氯气,生成的氯气在标准状况下的体积为( )。
A.11.2 L B.22.4 L
C.小于11.2 L D.大于11.2 L
10.下图是电解饱和食盐水制取氯气的实验装置,相关叙述不正确的是( )。
A.装置中,a管处产生氢气
B.b管导出的是氯气
C.在石墨棒电极区域有NaOH生成
D.以电解饱和食盐水为基础制取氯气、烧碱等产品的工业称为“氯碱工业”
11.已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用图示的实验装置来制备纯净、干燥的氯气,并检验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是(不考虑①单元装置)( )。
A.④
B.②
C.②③
D.②③④
12.某同学设计如图装置,利用2Al+3Cl22AlCl3反应,制备少量的AlCl3。已知AlCl3遇水会变质。下列说法错误的是( )。
A.B装置中所装试剂为饱和NaCl溶液,其作用是除去Cl2中的HCl
B.装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进入E中
C.用50 mL 12 mol·L-1的盐酸与足量的MnO2反应,所得氯气可以制取26.7 g AlCl3
D.实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
13.关于氯气制取方法的说法中,不正确的是( )。
A.电解饱和食盐水制氯气时,与电源正极相连的石墨棒上方充满黄绿色气体
B.工业上用电解饱和食盐水的方法制取氯气的同时得到烧碱
C.实验室制法和电解饱和食盐水的制法的化学方程式是不同的
D.实验室制取氯气时最好大火加热使温度迅速升高
14.(双选)四氯化钛(TiCl4)极易与水反应,若遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为-25 ℃,沸点为136.4 ℃。某实验小组设计如下装置(部分加热和夹持装置省略),用Cl2与木炭粉、TiO2制备TiCl4。下列说法不正确的是( )。
A.②中应盛装饱和食盐水
B.冷凝管有冷凝、回流和导气的作用
C.反应结束时,应先停止①处的加热,后停止③处的加热
D.该设计存在不足,如④、⑤之间缺少防止水蒸气进入④的装置
15.实验室中常用MnO2与浓盐酸反应制取氯气,实验装置如下图所示:
(1)圆底烧瓶中发生反应的化学方程式是 。
(2)如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因有:① ,
② 。
(3)为了提高浓盐酸的利用率,你对实验的建议是 。
(4)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是 。
16.某校化学兴趣小组的同学用如图所示仪器设计一个包括电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的实验装置。(提示:Cl2可与KI反应生成I2,淀粉遇I2变蓝)
(1)所选仪器连接时,各接口的顺序是(填各接口的字母代号):A接 、 接 ;B接 、 接 。
(2)证明产物是Cl2的实验现象是 。
(3)实验测得产生的氢气体积(已折算成标准状况)为5.60 mL,电解后溶液的体积恰好为50.0 mL,则溶液中NaOH的物质的量浓度为 。
17.工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 ,装置B中加入的试剂是 。
(2)制取无水氯化亚铁的实验中,装置A用来制取 。尾气的成分是 。若仍用D的装置进行尾气处理,存在的问题是 、 。
(3)若操作不当,制得的FeCl2会含有少量FeCl3,欲制得纯净的FeCl2,在实验操作中应先 ,再 。
1.答案:A
解析:氯元素在自然界中只以化合态的形式存在,A错误;海水中的含氯物质均易溶于水,通常通过蒸发结晶或蒸发浓缩后再结晶的方式获得,B正确;氯气是一种黄绿色、有刺激性气味的气体,C正确;海水中氯元素主要以NaCl、MgCl2等氯化物的形式存在,D正确。
2.答案:A
解析:1774年,瑞典化学家舍勒用软锰矿和浓盐酸在加热条件下反应制得氯气,这是人类第一次发现游离态的氯,A正确。
3.答案:D
解析:实验室用MnO2和浓盐酸共热制氯气,A项错误;Cl2和HCl的混合气体通过饱和NaHCO3溶液时,HCl会和NaHCO3反应生成CO2,引入新的杂质,B项错误;氯气的密度比空气的大,用C项装置收集氯气时,应是长管进、短管出,C项错误。
4.答案:C
解析:集气瓶中使用单孔橡胶塞塞紧,只能进气,不能排气,则瓶内压强增大到一定程度,可能将橡胶塞压出,A错误;因为Cl2比空气的密度大,Cl2应从短管进,B错误;该装置既能收集Cl2,又能进行尾气处理且防倒吸,C正确;由于Cl2和NaOH溶液反应,所以不能收集到Cl2,D错误。
5.答案:C
解析:①中可用分液漏斗代替长颈漏斗,避免盐酸挥发,气体逸出,同时便于控制反应速率,A正确;二氧化锰和浓盐酸需要加热才能反应生成氯气,需要添加加热装置,B正确;②中盛放的NaOH溶液吸收氯气,不能净化Cl2,可以用饱和食盐水净化氯气,C错误;氢氧化钠溶液与氯气反应,可以吸收氯气,防止污染空气,D正确。
6.答案:A
解析:实验室制备氯气用浓盐酸,二氧化锰和稀盐酸不反应,A错误;浓硫酸能吸收水蒸气且和氯气不反应,所以实验室制取氯气时用浓硫酸作干燥剂,B正确;氯气和氢氧化钠反应生成水、氯化钠和次氯酸钠,可用氢氧化钠溶液吸收氯气,防止污染环境,C正确;氯气的密度大于空气,用向上排空气法收集,D正确。
7.答案:B
解析:HCl极易溶于水,而Cl2在饱和食盐水中溶解度很小,利用饱和食盐水可除去Cl2中少量的HCl气体。
8.答案:D
解析:虽然氯气能与饱和石灰水反应,但相同条件下,氢氧化钠的溶解度大于氢氧化钙的溶解度,烧碱溶液吸收效果更好,A项错误、D项正确;饱和食盐水中氯离子浓度大,抑制氯气的溶解,则吸收效果不好,B项错误;自来水中含有氯离子,将抑制氯气的溶解,且氯气的溶解度较小,用水吸收效果不好,C项错误。
9.答案:C
解析:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
4 mol 22.4 L
2 mol 11.2 L
如果HCl完全参加反应,则生成的气体在标准状况下的体积为11.2 L,但随着反应的进行,盐酸的浓度变小,稀盐酸与MnO2不反应,由此可知2 mol HCl不可能全部参加反应,则生成的气体体积在标准状况下应小于11.2 L。
10.答案:C
解析:直流电源负极一端产生氢气,A项正确;根据题中实验装置可知,b管导出的气体可用NaOH溶液吸收,则b管中导出的气体应为氯气,B项正确;铁棒电极区域产生NaOH,C项错误;由氯碱工业的定义可知,D项正确。
11.答案:D
解析:氢氧化钠溶液不能放在②处,它不仅能与氯化氢反应,也能与氯气反应;洗气瓶中浓硫酸用于除去杂质水蒸气,导管要做到长进短出,氯气与金属反应时,气体应通到试管底部,并用双孔橡皮塞,否则会使试管内压强过大导致橡皮塞被顶开,并应有尾气处理装置。
12.答案:C
解析:实验室利用二氧化锰与浓盐酸在加热条件下反应生成Cl2,制得的Cl2中混有HCl和水蒸气,HCl极易溶于水,而Cl2在饱和NaCl溶液中溶解度很小,因此B装置中所装试剂为饱和NaCl溶液,用于除去Cl2中的HCl,A项正确;因为AlCl3遇水会变质,所以铝与氯气反应必须在干燥的环境下进行,因此装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进入E中,B项正确;50 mL 12 mol·L-1的盐酸与足量的MnO2反应,由于浓盐酸不断消耗,变为稀盐酸后,不再与二氧化锰反应,所以50 mL 12 mol·L-1的盐酸产生氯气的量小于0.15 mol,因此氯气与铝反应生成AlCl3的量小于0.1 mol,质量小于13.35 g,C项错误;实验过程中应先点燃A处的酒精灯,反应产生氯气,利用氯气排净装置内的空气,再点燃D处的酒精灯,D项正确。
13.答案:D
解析:电解饱和食盐水制氯气时,Cl2在与电源正极相连的石墨棒上生成,A项正确;浓盐酸具有挥发性,实验室制取氯气时应缓缓加热以减少浓盐酸的损失,D项错误。
14.答案:AC
解析:已知四氯化钛极易与水反应,遇空气中的水蒸气即产生“白烟”,而制得的氯气中混有水蒸气,所以②中应盛装浓硫酸,A项错误;TiCl4的熔点、沸点较低,制得的TiCl4应经过冷凝处理,则该装置中冷凝管具有冷凝、回流和导气的作用,B项正确;反应结束时,应先停止③处加热,后停止①处加热,可以使制得的TiCl4在氯气氛围中冷却,防止空气进入装置中使TiCl4变质,C项错误;因四氯化钛极易与水反应,所以应在装置④和⑤之间增加一个防止水蒸气进入④的装置,D项正确。
15.答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)①加热使HCl大量挥发 ②盐酸浓度变小后不再发生反应
(3)将浓盐酸慢慢滴下;加热时用小火
(4)NaOH溶液
解析:题目所给盐酸中HCl的物质的量是0.24 mol,但由于浓盐酸具有挥发性,且随着反应的不断进行,盐酸的浓度越来越小,变为稀盐酸后不再与MnO2反应,所以产生的Cl2的物质的量小于0.06 mol。
16.答案:(1)G F H D E C (2)淀粉KI溶液变蓝 (3)0.010 0 mol·L-1
解析:反应器两边所选用的各仪器接口连接顺序为A接G,把水压入量筒中,用量筒测量排出的水的体积,以测定产生H2的体积;B接D,生成的Cl2使淀粉KI溶液变蓝,多余的Cl2通入烧杯里的NaOH溶液中。已知电解产生的H2的物质的量为n(H2)==0.000 250 mol,由电解反应的化学方程式知n(NaOH)=2n(H2)=0.000 500 mol,则c(NaOH)==0.010 0 mol·L-1。
17.答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 浓硫酸
(2)HCl HCl和H2 易发生倒吸 H2不能被吸收
(3)通入氯化氢(赶尽装置中的空气) 点燃C处的酒精灯
解析:(1)制取无水氯化铁的实验中,A装置为氯气的制备装置,发生的反应为二氧化锰与浓盐酸共热生成氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,装置B的作用是除去氯气中的水蒸气,B中加入的试剂是浓硫酸。(2)根据题给信息知制取无水氯化亚铁的实验中,装置A用来制取HCl;尾气的成分是HCl和H2;若仍用D的装置进行尾气处理,氯化氢气体极易溶于水,氢气与氢氧化钠溶液不反应,则存在的问题是发生倒吸、可燃性气体H2不能被吸收。(3)欲制得纯净的FeCl2,应防止装置中氧气的干扰,在实验操作中应先通入氯化氢,利用产生的氯化氢气体排出装置中的空气,再点燃C处的酒精灯。
6
第一单元 氯气及氯的化合物
第1课时 氯气的发现与制备
1.下列关于氯的说法不正确的是( )
A.氯元素在自然界中存在游离态,只是量极少
B.一般通过结晶的方式获得海水中的含氯物质
C.氯气是一种黄绿色、有刺激性气味的气体
D.氯是重要的“成盐元素”,主要以NaCl、MgCl2等氯化物的形式存在于海水中
2.下列反应与人类最早发现氯气的化学反应原理相关的是( )
A.MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
B.4HCl+O22Cl2+2H2O
C.2NaCl+2H2O2NaOH+Cl2↑+H2↑
D.2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
3.已知:氯气能与NaOH溶液反应。下列装置能达到实验目的的是( )
4.在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是( )
5.某化学兴趣小组利用MnO2和浓盐酸及如图装置制备氯气。下列分析中不正确的是( )
A.①中可用分液漏斗代替长颈漏斗
B.①中缺少加热装置
C.②中盛放的NaOH溶液可以净化氯气
D.④中盛放的NaOH溶液可以吸收尾气
6.下列有关实验室制取氯气的说法不正确的是( )
A.二氧化锰和稀盐酸在加热条件下反应生成氯气
B.常用浓硫酸作Cl2的干燥剂
C.多余的氯气可用氢氧化钠溶液吸收
D.收集氯气用向上排空气法
7.欲除去Cl2中少量的HCl气体,可选用( )。
A.NaOH溶液 B.饱和食盐水
C.浓硫酸 D.石灰水
8.某实验室的尾气中含有较多的氯气,要吸收这些尾气,下列试剂最适合的是( )。
A.饱和石灰水 B.饱和食盐水
C.自来水 D.烧碱溶液
9.含2 mol HCl的浓盐酸与足量的二氧化锰共热制氯气,生成的氯气在标准状况下的体积为( )。
A.11.2 L B.22.4 L
C.小于11.2 L D.大于11.2 L
10.下图是电解饱和食盐水制取氯气的实验装置,相关叙述不正确的是( )。
A.装置中,a管处产生氢气
B.b管导出的是氯气
C.在石墨棒电极区域有NaOH生成
D.以电解饱和食盐水为基础制取氯气、烧碱等产品的工业称为“氯碱工业”
11.已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用图示的实验装置来制备纯净、干燥的氯气,并检验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是(不考虑①单元装置)( )。
A.④
B.②
C.②③
D.②③④
12.某同学设计如图装置,利用2Al+3Cl22AlCl3反应,制备少量的AlCl3。已知AlCl3遇水会变质。下列说法错误的是( )。
A.B装置中所装试剂为饱和NaCl溶液,其作用是除去Cl2中的HCl
B.装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进入E中
C.用50 mL 12 mol·L-1的盐酸与足量的MnO2反应,所得氯气可以制取26.7 g AlCl3
D.实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
13.关于氯气制取方法的说法中,不正确的是( )。
A.电解饱和食盐水制氯气时,与电源正极相连的石墨棒上方充满黄绿色气体
B.工业上用电解饱和食盐水的方法制取氯气的同时得到烧碱
C.实验室制法和电解饱和食盐水的制法的化学方程式是不同的
D.实验室制取氯气时最好大火加热使温度迅速升高
14.(双选)四氯化钛(TiCl4)极易与水反应,若遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为-25 ℃,沸点为136.4 ℃。某实验小组设计如下装置(部分加热和夹持装置省略),用Cl2与木炭粉、TiO2制备TiCl4。下列说法不正确的是( )。
A.②中应盛装饱和食盐水
B.冷凝管有冷凝、回流和导气的作用
C.反应结束时,应先停止①处的加热,后停止③处的加热
D.该设计存在不足,如④、⑤之间缺少防止水蒸气进入④的装置
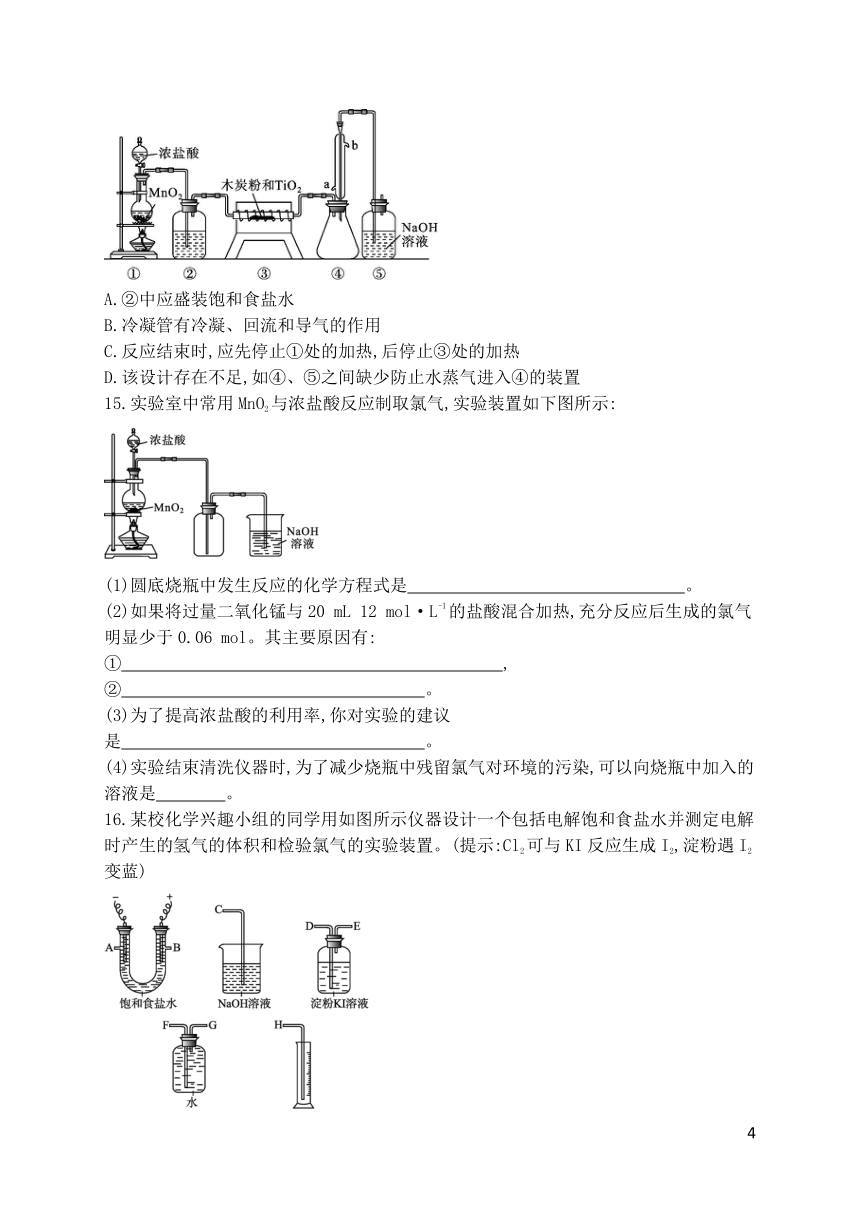
15.实验室中常用MnO2与浓盐酸反应制取氯气,实验装置如下图所示:
(1)圆底烧瓶中发生反应的化学方程式是 。
(2)如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因有:① ,
② 。
(3)为了提高浓盐酸的利用率,你对实验的建议是 。
(4)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是 。
16.某校化学兴趣小组的同学用如图所示仪器设计一个包括电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的实验装置。(提示:Cl2可与KI反应生成I2,淀粉遇I2变蓝)
(1)所选仪器连接时,各接口的顺序是(填各接口的字母代号):A接 、 接 ;B接 、 接 。
(2)证明产物是Cl2的实验现象是 。
(3)实验测得产生的氢气体积(已折算成标准状况)为5.60 mL,电解后溶液的体积恰好为50.0 mL,则溶液中NaOH的物质的量浓度为 。
17.工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 ,装置B中加入的试剂是 。
(2)制取无水氯化亚铁的实验中,装置A用来制取 。尾气的成分是 。若仍用D的装置进行尾气处理,存在的问题是 、 。
(3)若操作不当,制得的FeCl2会含有少量FeCl3,欲制得纯净的FeCl2,在实验操作中应先 ,再 。
1.答案:A
解析:氯元素在自然界中只以化合态的形式存在,A错误;海水中的含氯物质均易溶于水,通常通过蒸发结晶或蒸发浓缩后再结晶的方式获得,B正确;氯气是一种黄绿色、有刺激性气味的气体,C正确;海水中氯元素主要以NaCl、MgCl2等氯化物的形式存在,D正确。
2.答案:A
解析:1774年,瑞典化学家舍勒用软锰矿和浓盐酸在加热条件下反应制得氯气,这是人类第一次发现游离态的氯,A正确。
3.答案:D
解析:实验室用MnO2和浓盐酸共热制氯气,A项错误;Cl2和HCl的混合气体通过饱和NaHCO3溶液时,HCl会和NaHCO3反应生成CO2,引入新的杂质,B项错误;氯气的密度比空气的大,用C项装置收集氯气时,应是长管进、短管出,C项错误。
4.答案:C
解析:集气瓶中使用单孔橡胶塞塞紧,只能进气,不能排气,则瓶内压强增大到一定程度,可能将橡胶塞压出,A错误;因为Cl2比空气的密度大,Cl2应从短管进,B错误;该装置既能收集Cl2,又能进行尾气处理且防倒吸,C正确;由于Cl2和NaOH溶液反应,所以不能收集到Cl2,D错误。
5.答案:C
解析:①中可用分液漏斗代替长颈漏斗,避免盐酸挥发,气体逸出,同时便于控制反应速率,A正确;二氧化锰和浓盐酸需要加热才能反应生成氯气,需要添加加热装置,B正确;②中盛放的NaOH溶液吸收氯气,不能净化Cl2,可以用饱和食盐水净化氯气,C错误;氢氧化钠溶液与氯气反应,可以吸收氯气,防止污染空气,D正确。
6.答案:A
解析:实验室制备氯气用浓盐酸,二氧化锰和稀盐酸不反应,A错误;浓硫酸能吸收水蒸气且和氯气不反应,所以实验室制取氯气时用浓硫酸作干燥剂,B正确;氯气和氢氧化钠反应生成水、氯化钠和次氯酸钠,可用氢氧化钠溶液吸收氯气,防止污染环境,C正确;氯气的密度大于空气,用向上排空气法收集,D正确。
7.答案:B
解析:HCl极易溶于水,而Cl2在饱和食盐水中溶解度很小,利用饱和食盐水可除去Cl2中少量的HCl气体。
8.答案:D
解析:虽然氯气能与饱和石灰水反应,但相同条件下,氢氧化钠的溶解度大于氢氧化钙的溶解度,烧碱溶液吸收效果更好,A项错误、D项正确;饱和食盐水中氯离子浓度大,抑制氯气的溶解,则吸收效果不好,B项错误;自来水中含有氯离子,将抑制氯气的溶解,且氯气的溶解度较小,用水吸收效果不好,C项错误。
9.答案:C
解析:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
4 mol 22.4 L
2 mol 11.2 L
如果HCl完全参加反应,则生成的气体在标准状况下的体积为11.2 L,但随着反应的进行,盐酸的浓度变小,稀盐酸与MnO2不反应,由此可知2 mol HCl不可能全部参加反应,则生成的气体体积在标准状况下应小于11.2 L。
10.答案:C
解析:直流电源负极一端产生氢气,A项正确;根据题中实验装置可知,b管导出的气体可用NaOH溶液吸收,则b管中导出的气体应为氯气,B项正确;铁棒电极区域产生NaOH,C项错误;由氯碱工业的定义可知,D项正确。
11.答案:D
解析:氢氧化钠溶液不能放在②处,它不仅能与氯化氢反应,也能与氯气反应;洗气瓶中浓硫酸用于除去杂质水蒸气,导管要做到长进短出,氯气与金属反应时,气体应通到试管底部,并用双孔橡皮塞,否则会使试管内压强过大导致橡皮塞被顶开,并应有尾气处理装置。
12.答案:C
解析:实验室利用二氧化锰与浓盐酸在加热条件下反应生成Cl2,制得的Cl2中混有HCl和水蒸气,HCl极易溶于水,而Cl2在饱和NaCl溶液中溶解度很小,因此B装置中所装试剂为饱和NaCl溶液,用于除去Cl2中的HCl,A项正确;因为AlCl3遇水会变质,所以铝与氯气反应必须在干燥的环境下进行,因此装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进入E中,B项正确;50 mL 12 mol·L-1的盐酸与足量的MnO2反应,由于浓盐酸不断消耗,变为稀盐酸后,不再与二氧化锰反应,所以50 mL 12 mol·L-1的盐酸产生氯气的量小于0.15 mol,因此氯气与铝反应生成AlCl3的量小于0.1 mol,质量小于13.35 g,C项错误;实验过程中应先点燃A处的酒精灯,反应产生氯气,利用氯气排净装置内的空气,再点燃D处的酒精灯,D项正确。
13.答案:D
解析:电解饱和食盐水制氯气时,Cl2在与电源正极相连的石墨棒上生成,A项正确;浓盐酸具有挥发性,实验室制取氯气时应缓缓加热以减少浓盐酸的损失,D项错误。
14.答案:AC
解析:已知四氯化钛极易与水反应,遇空气中的水蒸气即产生“白烟”,而制得的氯气中混有水蒸气,所以②中应盛装浓硫酸,A项错误;TiCl4的熔点、沸点较低,制得的TiCl4应经过冷凝处理,则该装置中冷凝管具有冷凝、回流和导气的作用,B项正确;反应结束时,应先停止③处加热,后停止①处加热,可以使制得的TiCl4在氯气氛围中冷却,防止空气进入装置中使TiCl4变质,C项错误;因四氯化钛极易与水反应,所以应在装置④和⑤之间增加一个防止水蒸气进入④的装置,D项正确。
15.答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)①加热使HCl大量挥发 ②盐酸浓度变小后不再发生反应
(3)将浓盐酸慢慢滴下;加热时用小火
(4)NaOH溶液
解析:题目所给盐酸中HCl的物质的量是0.24 mol,但由于浓盐酸具有挥发性,且随着反应的不断进行,盐酸的浓度越来越小,变为稀盐酸后不再与MnO2反应,所以产生的Cl2的物质的量小于0.06 mol。
16.答案:(1)G F H D E C (2)淀粉KI溶液变蓝 (3)0.010 0 mol·L-1
解析:反应器两边所选用的各仪器接口连接顺序为A接G,把水压入量筒中,用量筒测量排出的水的体积,以测定产生H2的体积;B接D,生成的Cl2使淀粉KI溶液变蓝,多余的Cl2通入烧杯里的NaOH溶液中。已知电解产生的H2的物质的量为n(H2)==0.000 250 mol,由电解反应的化学方程式知n(NaOH)=2n(H2)=0.000 500 mol,则c(NaOH)==0.010 0 mol·L-1。
17.答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 浓硫酸
(2)HCl HCl和H2 易发生倒吸 H2不能被吸收
(3)通入氯化氢(赶尽装置中的空气) 点燃C处的酒精灯
解析:(1)制取无水氯化铁的实验中,A装置为氯气的制备装置,发生的反应为二氧化锰与浓盐酸共热生成氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,装置B的作用是除去氯气中的水蒸气,B中加入的试剂是浓硫酸。(2)根据题给信息知制取无水氯化亚铁的实验中,装置A用来制取HCl;尾气的成分是HCl和H2;若仍用D的装置进行尾气处理,氯化氢气体极易溶于水,氢气与氢氧化钠溶液不反应,则存在的问题是发生倒吸、可燃性气体H2不能被吸收。(3)欲制得纯净的FeCl2,应防止装置中氧气的干扰,在实验操作中应先通入氯化氢,利用产生的氯化氢气体排出装置中的空气,再点燃C处的酒精灯。
6
