山西省阳泉市第一名校2023-2024学年高二上学期11月期中考试化学试题(含答案)
文档属性
| 名称 | 山西省阳泉市第一名校2023-2024学年高二上学期11月期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 197.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 10:07:41 | ||
图片预览

文档简介
阳泉一中2023-2024学年第一学期 高二 年级期中考试试题
学科: 化学 考试时间: 75 分钟 分值: 100 分
可能用到的相对原子量:K:39 I:127 O:16
客观题
一、选择题:本题共14小题,每小题3分,共42分。每个小题只有一个正确答案。
1. 下列有关说法不正确的是( )
A. 固体与固体反应是吸热反应
B. 化学反应中的能量变化主要由化学键变化引起
C. 放热反应不需要加热就能发生,吸热反应不加热就不能发生
D. 节约能源不是简单减少能源的使用,更重要的是要充分有效地利用能源
2. 硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
实验 反应温度/℃ Na2S2O3溶液 稀H2SO4
V/mL c/mol·L-1 V/mL c/mol·L-1
A 25 5 0.1 10 0.1
B 25 5 02 10 0.2
C 35 5 0.1 10 0.1
D 35 5 0.2 10 0.2
3. 下列事实不能用勒夏特列原理解释的是
A. Fe(SCN)3溶液中加入少量固体KSCN后颜色变深
B. 把食品存放在冰箱里可延长保质期
C. 合成氨反应,为提高原料转化率,理论上应采取降低温度的措施
D. 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
4. 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L.下列有关判断正确的是( )
A. C的体积分数增大了 B. 平衡向正反应方向移动
C. A的转化率降低了 D. x+y<z
5. 下列图示与对应叙述不相符的是
A. (a)图可表示锌和稀硫酸反应过程中的能量变化
B. 通过(b)图可知石墨比金刚石稳定
C. 由(c)图可知,
(d)图是某反应A→C的能量变化曲线图(E表示能量),反应中
6. 在一定温度的恒容密闭容器中发生:,下列不能说明反应一定达到平衡状态的是
A. 的质量保持不变
B. 、、、的物质的量之比为1:3:1:1
C.
D. 容器内气体压强不再变化
7. 下列实验事实不能证明醋酸是弱电解质的是
A. 用醋酸溶液做导电实验时,灯泡很暗
B. 常温下,测得0.1醋酸溶液的
C. 常温下,将的醋酸溶液稀释1000倍测得
D. 等氢离子浓度、等体积的盐酸和醋酸溶液中和碱时,醋酸中和碱的量更多
8. 下列有关热化学方程式说法不正确的是
A. 25℃,101kPa时 ,则氢能源是一种理想的绿色能源
B. 密闭容器中进行 ,投入时,则充分反应吸收akJ热量
C. 25℃,101kPa时 ,则的燃烧热为890.3kJ/mol
D. 已知 , ,则
9. 一定温度下,向2L真空密闭容器中加入固体,发生反应,反应过程如图,下列说法正确的是
A. 0~2min用表示的平均反应速率为1mol/min
B. NO的体积分数不再变化,说明反应达到平衡状态
C. 第3min时反应达到平衡状态,往体系中添加一定量,平衡正向移动
D. 第4min时,保持温度和容积不变,向容器中充入,混合气体颜色不变
10. 下列有关实验的说法不正确的是
A. 用盐酸和NaOH溶液进行中和热测定时,应将NaOH溶液迅速加入盛有盐酸的量热计,立即盖上杯盖
B. 用醋酸溶液和NaOH溶液进行中和热测定时,测得生成时所放出的热量小于57.3kJ
C. 比较和对分解催化效果时,应在等浓度、等体积的溶液中加入等浓度、等体积的溶液和溶液
D. 用0.100mol/L盐酸滴定未知浓度稀氨水时,采用甲基橙做指示剂比酚酞做指示剂时误差小
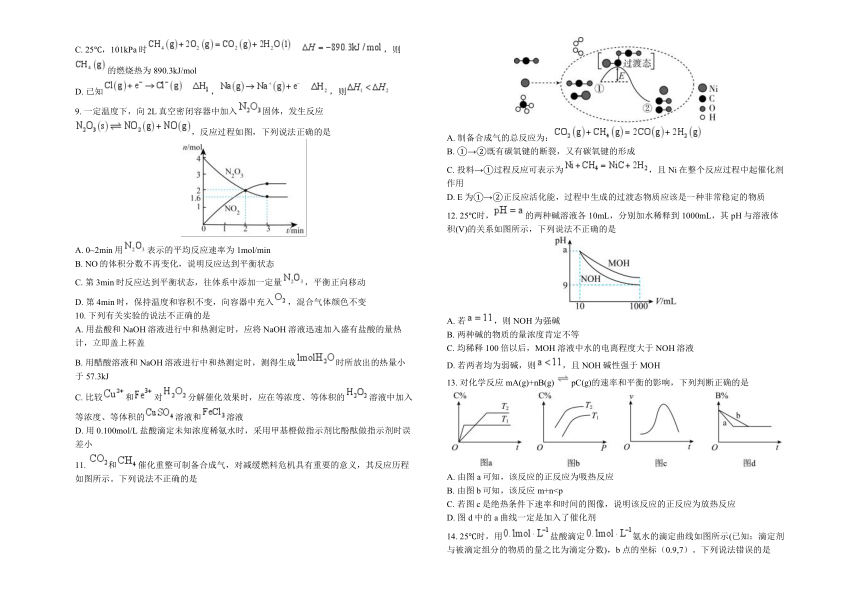
11. 和催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程如图所示。下列说法不正确的是
A. 制备合成气的总反应为:
B. ①→②既有碳氧键的断裂,又有碳氧键的形成
C. 投料→①过程反应可表示为,且Ni在整个反应过程中起催化剂作用
D. E为①→②正反应活化能,过程中生成的过渡态物质应该是一种非常稳定的物质
12. 25℃时,的两种碱溶液各10mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是
A. 若,则NOH为强碱
B. 两种碱的物质的量浓度肯定不等
C. 均稀释100倍以后,MOH溶液中水的电离程度大于NOH溶液
D. 若两者均为弱碱,则,且NOH碱性强于MOH
13. 对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响,下列判断正确的是
A. 由图a可知,该反应的正反应为吸热反应
B. 由图b可知,该反应m+nC. 若图c是绝热条件下速率和时间的图像,说明该反应的正反应为放热反应
D. 图d中的a曲线一定是加入了催化剂
14. 25℃时,用盐酸滴定氨水的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数),b点的坐标(0.9,7)。下列说法错误的是
A. 起点溶液中水电离出小于
B. 温度升高,氨水的电离平衡向右移动
C. 滴定过程,溶液中不变
D. 25℃时,的数量级为
主观题
二、非选择题:本题共4小题,共58分。
15.(16分)参考下列图表和有关要求回答问题:
图Ⅰ
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 ,ΔH的变化是 (填“增大”、“减小”、“不变”)。请写出NO2和CO反应的热化学方程式: 。
(2)在一定体积的密闭容器中,进行如下化学反应:,其化学平衡常数K和温度t的关系如表所示:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
①该反应的化学平衡常数表达式为K= 。
②该反应为反应 (填“吸热”或“放热)。
③某温度下,平衡浓度符合下式:,试判断此时的温度为 ℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为,,,,则下一时刻,反应向 (填“正向”、“逆向”或“平衡”)进行。
(3)已知常温时红磷比白磷稳定,比较下列反应中的大小: (填“>”或“<”)。
①
②
16. (12分)水溶液中存在离子平衡,请回答下列问题:
(1)已知T℃时,纯水中,则
①该温度时0.1mol/LNaOH溶液的pH为_____。
②该温度下,将pH=2的溶液与pH=9的NaOH溶液按体积比1∶9混合(忽略溶液体积变化),所得混合溶液的pH为_____。
③该温度下,若1体积的某强酸溶液与10体积的某强碱溶液混合后溶液呈中性(忽略溶液体积变化),则混合前,a与b之间应满足的关系是_____。
(2)25℃时,三种酸的电离平衡常数如表:
化学式
电离平衡常数
试回答下列问题:
①一般情况下,当温度升高时, (填“增大”、“减小”或“不变”)。
②下列四种离子结合质子能力由大到小的顺序是 (填序号);
a. b. c. d.
③下列反应不能发生的是_______(填序号)
A.
B.
C.-
D.
17. (16分)将二氧化碳转化为绿色液体燃料甲醇(CH3OH)是实现碳中和的一个重要途径。
I.我国科学家在含铂高效催化剂作用下把二氧化碳高效转化为清洁液态燃料――甲醇。
(1)该法利用CO 制取甲醇的有关化学反应如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) =-178kJ/mol
②2CO(g)+O2(g)2CO2(g) =-566kJ/mol
③2H2(g)+O2(g)2H2O(g) =-483.6kJ/mol
_____
Ⅱ.甲醇的制备原理为:CO2(g)+3H2(g)CH3OH(g)+H2O(g) =-178kJ/mol
(2)对于该反应,可以同时提高反应速率和CH3OH产率的措施有_____(填字母序号)。
A. 升高反应温度 B. 使用高效催化剂
C. 增大体系压强 D. 移走CH3OH
(3)为探究CO2(g)+3H2(g)CH3OH(g)+H2O(g)的反应原理,进行如下实验:在一恒温,体积为2L恒容密闭容器中,充入1molCO2和4molH2,初始压强为8MPa,进行该反应(不考虑其它副反应)。10min时测得体系的压强为6.4MPa且不再随时间变化。回答下列问题:
①反应开始到10min时,= _____。
②10min时,体系中CH OH的物质的量分数为_____%。
③该温度下的压强平衡常数_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)某科研小组研究不同催化剂对反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)的影响,按:n(CO2):n(H2)=1:3投料,不同催化剂作用下,反应tmin时,CH3OH的产率随温度的变化如图所示:
①催化剂效果最佳的是_____(填“催化剂I”、“催化剂Ⅱ”),理由是_____。
②d点(逆)_____a点(逆)(填“>”、“<”或“=”)。
18. (14分)滴定法是化学分析常用方法,是一种简便、快速和应用广泛的定量分析方法。
I.(1)某实验小组用已知浓度的NaOH标准液来滴定未知浓度的醋酸溶液。
取25.00mL待测液于250mL锥形瓶中,加入2~3滴指示剂,用0.1000mol/LNaOH标准溶液滴定至终点,按上述操作重复3次。回答下列问题。
①滴定过程中加入的指示剂为_____;
②滴定时边滴边摇动锥形瓶,眼睛注视_____;
③三次实验数据记录如表所示:
滴定次数 滴定前碱式滴定管读数/mL 滴定后碱式滴定管读数/mL
1 1.00 30.95
2 2.03 29.23
3 0.56 30.61
根据表中数据计算出醋酸待测液的浓度为_____。
④在上述实验过程中,出现下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有_____(填序号)。
a.量取标准液的碱式滴定管未用标准液润洗
b.取醋酸的酸式滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失
c.锥形瓶用蒸馏水洗涤后,水未倒尽,仍残留一定量水
d.当滴定结束时,俯视碱式滴定管读数
II.氧化还原滴定与酸碱中和滴定类似,可用于KIO 粗产品的纯度测定。
称取mg产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀硫酸,充分反应后加入淀粉溶液作指示剂,用标准溶液滴定至终点(),平均消耗标准溶液的体积为VmL。
(2)加入KI和稀H2SO 后发生反应的离子方程式为_____。
(3)滴定终点的现象为_____,则产品中KIO3的质量分数为_____%。
阳泉一中2023-2024学年第一学期高二年级期中考试
化学试题答案
1-5 CDBCA 6-10 BABAC 11-14DCCD
15、(16分,每空2分)
(1) 减小 不变 NO2(g)+CO(g)=NO(g)+CO2(g) ΔH= -234 kJ·mol-1
c(CO) c(H2O)
(2) K= 吸热 830 逆向
c(CO2) c(H2)
<
16、(12分,每空2分)
(1) ① 11 ② 4 ③
(2) ① 增大 ② a>b>d>c ③ CD
17、(16分,每空2分)
(1) -219.2 (2) C
(3) ① 0.025mol·L-1·min-1 ② 12.5 ③ 0.0125
(4) ① 催化剂I 在温度较低的条件下催化效率更高 ② <
18、(14分,每空2分)
Ⅰ:(1) ① 酚酞 ② 锥形瓶内溶液颜色变化 ③ 0.1200mol/L ④ bd
Ⅱ:(2)
(3) 滴入最后半滴标准液时,溶液由蓝色变为无色,且半分钟内不恢复
学科: 化学 考试时间: 75 分钟 分值: 100 分
可能用到的相对原子量:K:39 I:127 O:16
客观题
一、选择题:本题共14小题,每小题3分,共42分。每个小题只有一个正确答案。
1. 下列有关说法不正确的是( )
A. 固体与固体反应是吸热反应
B. 化学反应中的能量变化主要由化学键变化引起
C. 放热反应不需要加热就能发生,吸热反应不加热就不能发生
D. 节约能源不是简单减少能源的使用,更重要的是要充分有效地利用能源
2. 硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
实验 反应温度/℃ Na2S2O3溶液 稀H2SO4
V/mL c/mol·L-1 V/mL c/mol·L-1
A 25 5 0.1 10 0.1
B 25 5 02 10 0.2
C 35 5 0.1 10 0.1
D 35 5 0.2 10 0.2
3. 下列事实不能用勒夏特列原理解释的是
A. Fe(SCN)3溶液中加入少量固体KSCN后颜色变深
B. 把食品存放在冰箱里可延长保质期
C. 合成氨反应,为提高原料转化率,理论上应采取降低温度的措施
D. 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
4. 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L.下列有关判断正确的是( )
A. C的体积分数增大了 B. 平衡向正反应方向移动
C. A的转化率降低了 D. x+y<z
5. 下列图示与对应叙述不相符的是
A. (a)图可表示锌和稀硫酸反应过程中的能量变化
B. 通过(b)图可知石墨比金刚石稳定
C. 由(c)图可知,
(d)图是某反应A→C的能量变化曲线图(E表示能量),反应中
6. 在一定温度的恒容密闭容器中发生:,下列不能说明反应一定达到平衡状态的是
A. 的质量保持不变
B. 、、、的物质的量之比为1:3:1:1
C.
D. 容器内气体压强不再变化
7. 下列实验事实不能证明醋酸是弱电解质的是
A. 用醋酸溶液做导电实验时,灯泡很暗
B. 常温下,测得0.1醋酸溶液的
C. 常温下,将的醋酸溶液稀释1000倍测得
D. 等氢离子浓度、等体积的盐酸和醋酸溶液中和碱时,醋酸中和碱的量更多
8. 下列有关热化学方程式说法不正确的是
A. 25℃,101kPa时 ,则氢能源是一种理想的绿色能源
B. 密闭容器中进行 ,投入时,则充分反应吸收akJ热量
C. 25℃,101kPa时 ,则的燃烧热为890.3kJ/mol
D. 已知 , ,则
9. 一定温度下,向2L真空密闭容器中加入固体,发生反应,反应过程如图,下列说法正确的是
A. 0~2min用表示的平均反应速率为1mol/min
B. NO的体积分数不再变化,说明反应达到平衡状态
C. 第3min时反应达到平衡状态,往体系中添加一定量,平衡正向移动
D. 第4min时,保持温度和容积不变,向容器中充入,混合气体颜色不变
10. 下列有关实验的说法不正确的是
A. 用盐酸和NaOH溶液进行中和热测定时,应将NaOH溶液迅速加入盛有盐酸的量热计,立即盖上杯盖
B. 用醋酸溶液和NaOH溶液进行中和热测定时,测得生成时所放出的热量小于57.3kJ
C. 比较和对分解催化效果时,应在等浓度、等体积的溶液中加入等浓度、等体积的溶液和溶液
D. 用0.100mol/L盐酸滴定未知浓度稀氨水时,采用甲基橙做指示剂比酚酞做指示剂时误差小
11. 和催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程如图所示。下列说法不正确的是
A. 制备合成气的总反应为:
B. ①→②既有碳氧键的断裂,又有碳氧键的形成
C. 投料→①过程反应可表示为,且Ni在整个反应过程中起催化剂作用
D. E为①→②正反应活化能,过程中生成的过渡态物质应该是一种非常稳定的物质
12. 25℃时,的两种碱溶液各10mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是
A. 若,则NOH为强碱
B. 两种碱的物质的量浓度肯定不等
C. 均稀释100倍以后,MOH溶液中水的电离程度大于NOH溶液
D. 若两者均为弱碱,则,且NOH碱性强于MOH
13. 对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响,下列判断正确的是
A. 由图a可知,该反应的正反应为吸热反应
B. 由图b可知,该反应m+n
D. 图d中的a曲线一定是加入了催化剂
14. 25℃时,用盐酸滴定氨水的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数),b点的坐标(0.9,7)。下列说法错误的是
A. 起点溶液中水电离出小于
B. 温度升高,氨水的电离平衡向右移动
C. 滴定过程,溶液中不变
D. 25℃时,的数量级为
主观题
二、非选择题:本题共4小题,共58分。
15.(16分)参考下列图表和有关要求回答问题:
图Ⅰ
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 ,ΔH的变化是 (填“增大”、“减小”、“不变”)。请写出NO2和CO反应的热化学方程式: 。
(2)在一定体积的密闭容器中,进行如下化学反应:,其化学平衡常数K和温度t的关系如表所示:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
①该反应的化学平衡常数表达式为K= 。
②该反应为反应 (填“吸热”或“放热)。
③某温度下,平衡浓度符合下式:,试判断此时的温度为 ℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为,,,,则下一时刻,反应向 (填“正向”、“逆向”或“平衡”)进行。
(3)已知常温时红磷比白磷稳定,比较下列反应中的大小: (填“>”或“<”)。
①
②
16. (12分)水溶液中存在离子平衡,请回答下列问题:
(1)已知T℃时,纯水中,则
①该温度时0.1mol/LNaOH溶液的pH为_____。
②该温度下,将pH=2的溶液与pH=9的NaOH溶液按体积比1∶9混合(忽略溶液体积变化),所得混合溶液的pH为_____。
③该温度下,若1体积的某强酸溶液与10体积的某强碱溶液混合后溶液呈中性(忽略溶液体积变化),则混合前,a与b之间应满足的关系是_____。
(2)25℃时,三种酸的电离平衡常数如表:
化学式
电离平衡常数
试回答下列问题:
①一般情况下,当温度升高时, (填“增大”、“减小”或“不变”)。
②下列四种离子结合质子能力由大到小的顺序是 (填序号);
a. b. c. d.
③下列反应不能发生的是_______(填序号)
A.
B.
C.-
D.
17. (16分)将二氧化碳转化为绿色液体燃料甲醇(CH3OH)是实现碳中和的一个重要途径。
I.我国科学家在含铂高效催化剂作用下把二氧化碳高效转化为清洁液态燃料――甲醇。
(1)该法利用CO 制取甲醇的有关化学反应如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) =-178kJ/mol
②2CO(g)+O2(g)2CO2(g) =-566kJ/mol
③2H2(g)+O2(g)2H2O(g) =-483.6kJ/mol
_____
Ⅱ.甲醇的制备原理为:CO2(g)+3H2(g)CH3OH(g)+H2O(g) =-178kJ/mol
(2)对于该反应,可以同时提高反应速率和CH3OH产率的措施有_____(填字母序号)。
A. 升高反应温度 B. 使用高效催化剂
C. 增大体系压强 D. 移走CH3OH
(3)为探究CO2(g)+3H2(g)CH3OH(g)+H2O(g)的反应原理,进行如下实验:在一恒温,体积为2L恒容密闭容器中,充入1molCO2和4molH2,初始压强为8MPa,进行该反应(不考虑其它副反应)。10min时测得体系的压强为6.4MPa且不再随时间变化。回答下列问题:
①反应开始到10min时,= _____。
②10min时,体系中CH OH的物质的量分数为_____%。
③该温度下的压强平衡常数_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)某科研小组研究不同催化剂对反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)的影响,按:n(CO2):n(H2)=1:3投料,不同催化剂作用下,反应tmin时,CH3OH的产率随温度的变化如图所示:
①催化剂效果最佳的是_____(填“催化剂I”、“催化剂Ⅱ”),理由是_____。
②d点(逆)_____a点(逆)(填“>”、“<”或“=”)。
18. (14分)滴定法是化学分析常用方法,是一种简便、快速和应用广泛的定量分析方法。
I.(1)某实验小组用已知浓度的NaOH标准液来滴定未知浓度的醋酸溶液。
取25.00mL待测液于250mL锥形瓶中,加入2~3滴指示剂,用0.1000mol/LNaOH标准溶液滴定至终点,按上述操作重复3次。回答下列问题。
①滴定过程中加入的指示剂为_____;
②滴定时边滴边摇动锥形瓶,眼睛注视_____;
③三次实验数据记录如表所示:
滴定次数 滴定前碱式滴定管读数/mL 滴定后碱式滴定管读数/mL
1 1.00 30.95
2 2.03 29.23
3 0.56 30.61
根据表中数据计算出醋酸待测液的浓度为_____。
④在上述实验过程中,出现下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有_____(填序号)。
a.量取标准液的碱式滴定管未用标准液润洗
b.取醋酸的酸式滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失
c.锥形瓶用蒸馏水洗涤后,水未倒尽,仍残留一定量水
d.当滴定结束时,俯视碱式滴定管读数
II.氧化还原滴定与酸碱中和滴定类似,可用于KIO 粗产品的纯度测定。
称取mg产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀硫酸,充分反应后加入淀粉溶液作指示剂,用标准溶液滴定至终点(),平均消耗标准溶液的体积为VmL。
(2)加入KI和稀H2SO 后发生反应的离子方程式为_____。
(3)滴定终点的现象为_____,则产品中KIO3的质量分数为_____%。
阳泉一中2023-2024学年第一学期高二年级期中考试
化学试题答案
1-5 CDBCA 6-10 BABAC 11-14DCCD
15、(16分,每空2分)
(1) 减小 不变 NO2(g)+CO(g)=NO(g)+CO2(g) ΔH= -234 kJ·mol-1
c(CO) c(H2O)
(2) K= 吸热 830 逆向
c(CO2) c(H2)
<
16、(12分,每空2分)
(1) ① 11 ② 4 ③
(2) ① 增大 ② a>b>d>c ③ CD
17、(16分,每空2分)
(1) -219.2 (2) C
(3) ① 0.025mol·L-1·min-1 ② 12.5 ③ 0.0125
(4) ① 催化剂I 在温度较低的条件下催化效率更高 ② <
18、(14分,每空2分)
Ⅰ:(1) ① 酚酞 ② 锥形瓶内溶液颜色变化 ③ 0.1200mol/L ④ bd
Ⅱ:(2)
(3) 滴入最后半滴标准液时,溶液由蓝色变为无色,且半分钟内不恢复
同课章节目录
