2.2 氯及其化合物 同步测试 2023-2024学年高一上学期化学人教版(2019)必修第一册(含解析)
文档属性
| 名称 | 2.2 氯及其化合物 同步测试 2023-2024学年高一上学期化学人教版(2019)必修第一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 225.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 11:13:47 | ||
图片预览



文档简介
2.2 氯及其化合物 同步测试
一、单选题
1.日常生活和工业生产中常用到漂白剂。下列物质没有漂白作用的是( )
A.HClO B.NaClO溶液 C.新制氯水 D.CaCl2
2.下列关于氯气性质的描述错误的是( )
A.Fe在氯气中燃烧生成 B.能溶于水
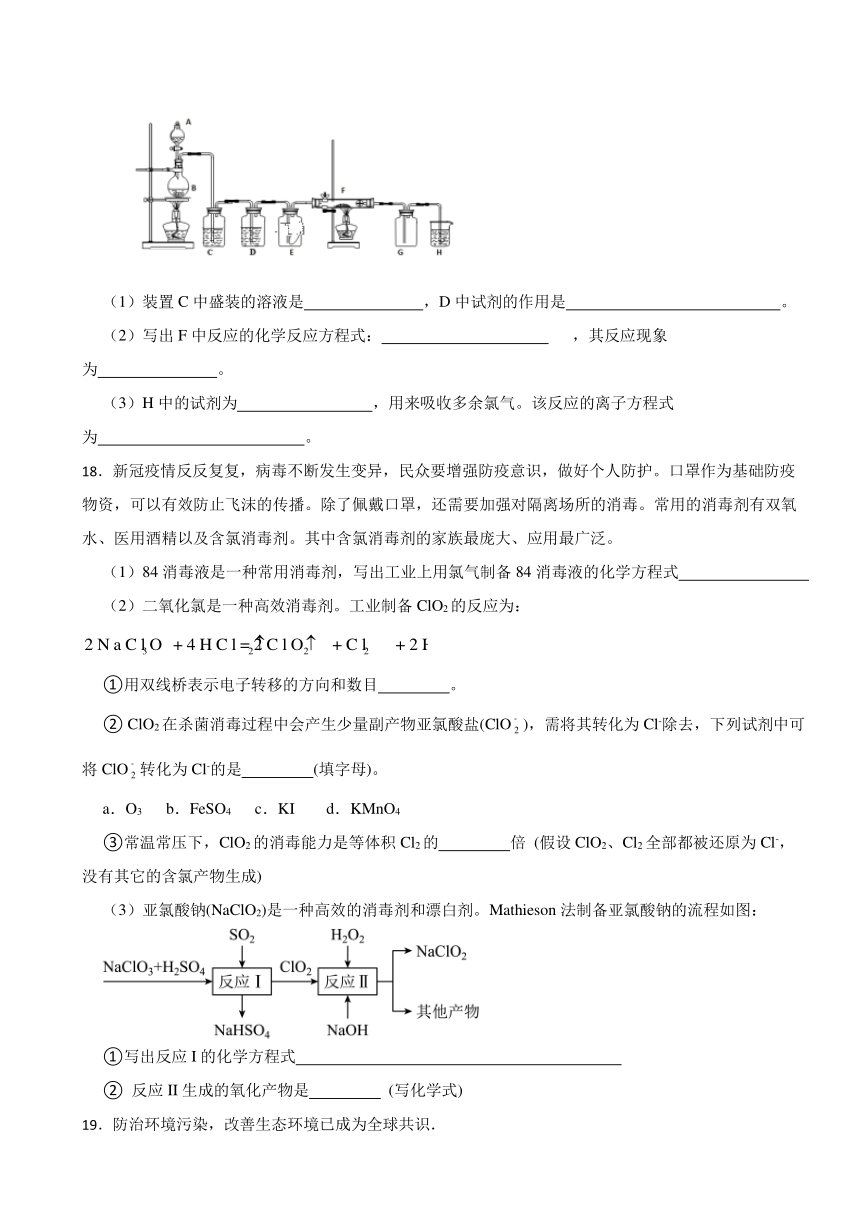
C.有刺激性气味、有毒 D.能与氢气反应
3.是重要的工业原料,可用于生产盐酸、漂白粉及制氯仿等有机溶剂。的制备可用下列反应:NaClO+2HCl(浓)=NaCl+Cl2↑+H2O,下列关于氯及其化合物的性质与用途具有对应关系的是( )
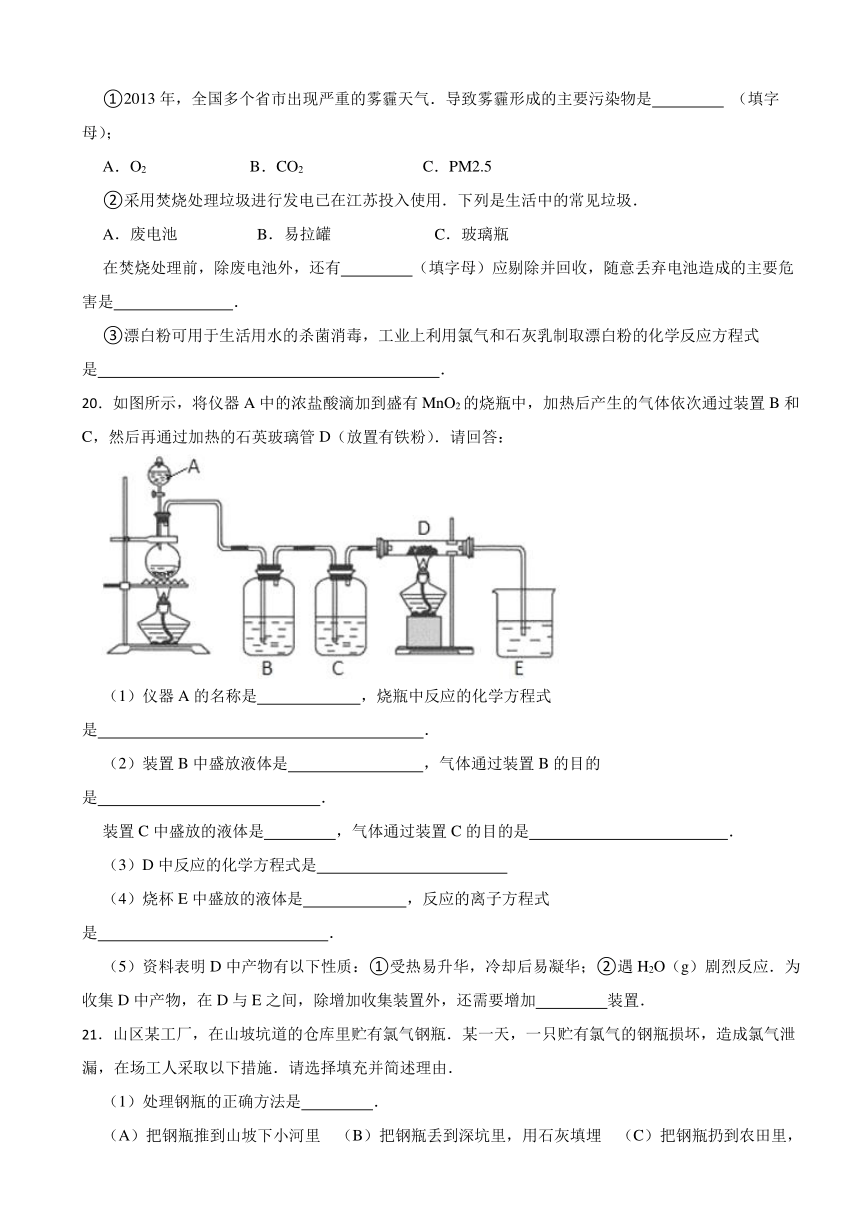
A.易液化,可用于生产盐酸
B.NaCl熔点较高,可用作防腐剂
C.盐酸具有挥发性,可用于除铁锈
D.NaClO具有强氧化性,可用作漂白剂
4.氯水既可以用来杀菌消毒,又可作漂白剂,其中起作用的物质是( )
A.Cl2 B.HCl C.HClO D.H2O
5.部分常见含氯物质的分类与相应化合价关系如图所示。下列推断不合理的是 ( )
A.既可被氧化,也可被还原
B.的浓溶液可与的固体反应生成与
C.实验室可通过加热与的浓溶液制得
D.可存在的循环转化关系
6.“84消毒液”可消杀新冠病毒,可用Cl2与NaOH溶液反应制备。下列关于“84消毒液”的说法错误的是( )
A.属于胶体 B.有效成分为NaClO
C.室温下溶液pH大于7 D.有强氧化性
7.下列有关各种物质的物理性质的叙述中错误的是( )
A.金属钠的氧化物都是淡黄色的固体
B.金属钠的密度比水小
C.纯碱和小苏打都能溶于水
D.Cl2是一种黄绿色的有毒气体
8.某化学教师为“氯气与金属钠反应”设计了如图装置的实验,实验操作,先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C.钠熔点高,所以先预热再反应
D.若在棉球外沿滴一滴石蕊溶液,可据其颜色变化判断氯气是否被碱液完全吸收
9.某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=Cl-+ ClO-+ H2O
B.该消毒液的pH约为12:ClO-+ H2O HClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO-
10.在给定条件下,下列选项所示物质间转化均能实现的是( )
A.Al H2 B.CuO Cu(OH)2
C.Cl2 FeCl2 D.NaCl溶液 单质Na
11.亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化利,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
下列说法错误的是( )
A.区应②反应过程中有大量使带火星木条复燃气体冒出
B.反应①得到的ClO2消毒漂白能力比氯气强,使用起来比较安全
C.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为1:2
D.反应②条件下,ClO2的氧化性大于H2O2
12.氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A.使新鲜的红玫瑰花褪色(HCl)
B.新制氯水呈浅黄绿色(Cl2)
C.加入小苏打固体,有气泡产生(H+)
D.滴加AgNO3溶液生成白色沉淀(Cl﹣)
13.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
A.氯气 B.液氯
C.新制氯水 D.氯气的酒精溶液
14.下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( )
A.新制氯水显淡黄绿色(Cl2)
B.将NaHCO3固体加入新制氯水中,有无色气泡产生(HClO)
C.向新制氯水中滴加石蕊溶液,溶液先变红后褪色(H+、HClO)
D.滴加AgNO3溶液有白色沉淀产生(Cl-)
15.下列关于氯水的叙述,正确的是( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸变红且不褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后酸性将变强
16.向盛有FeSO4溶液的试管中滴加足量新制氯水,向反应后的溶液中滴加下列溶液,无明显现象的是( )
A.HNO3 B.Ca(HCO3)2 C.KSCN D.Na2S
二、综合题
17.如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
(1)装置C中盛装的溶液是 ,D中试剂的作用是 。
(2)写出F中反应的化学反应方程式: ,其反应现象为 。
(3)H中的试剂为 ,用来吸收多余氯气。该反应的离子方程式为 。
18.新冠疫情反反复复,病毒不断发生变异,民众要增强防疫意识,做好个人防护。口罩作为基础防疫物资,可以有效防止飞沫的传播。除了佩戴口罩,还需要加强对隔离场所的消毒。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。
(1)84消毒液是一种常用消毒剂,写出工业上用氯气制备84消毒液的化学方程式
(2)二氧化氯是一种高效消毒剂。工业制备ClO2的反应为:
①用双线桥表示电子转移的方向和数目 。
② ClO2在杀菌消毒过程中会产生少量副产物亚氯酸盐(ClO),需将其转化为Cl-除去,下列试剂中可将ClO转化为Cl-的是 (填字母)。
a.O3 b.FeSO4 c.KI d.KMnO4
③常温常压下,ClO2的消毒能力是等体积Cl2的 倍 (假设ClO2、Cl2全部都被还原为Cl-,没有其它的含氯产物生成)
(3)亚氯酸钠(NaClO2)是一种高效的消毒剂和漂白剂。Mathieson法制备亚氯酸钠的流程如图:
①写出反应I的化学方程式
② 反应II生成的氧化产物是 (写化学式)
19.防治环境污染,改善生态环境已成为全球共识.
①2013年,全国多个省市出现严重的雾霾天气.导致雾霾形成的主要污染物是 (填字母);
A.O2 B.CO2 C.PM2.5
②采用焚烧处理垃圾进行发电已在江苏投入使用.下列是生活中的常见垃圾.
A.废电池 B.易拉罐 C.玻璃瓶
在焚烧处理前,除废电池外,还有 (填字母)应剔除并回收,随意丢弃电池造成的主要危害是 .
③漂白粉可用于生活用水的杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是 .
20.如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答:
(1)仪器A的名称是 ,烧瓶中反应的化学方程式是 .
(2)装置B中盛放液体是 ,气体通过装置B的目的是 .
装置C中盛放的液体是 ,气体通过装置C的目的是 .
(3)D中反应的化学方程式是
(4)烧杯E中盛放的液体是 ,反应的离子方程式是 .
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加 装置.
21.山区某工厂,在山坡坑道的仓库里贮有氯气钢瓶.某一天,一只贮有氯气的钢瓶损坏,造成氯气泄漏,在场工人采取以下措施.请选择填充并简述理由.
(1)处理钢瓶的正确方法是 .
(A)把钢瓶推到山坡下小河里 (B)把钢瓶丢到深坑里,用石灰填埋 (C)把钢瓶扔到农田里,简述理由 .
(2)钢瓶处理后,工人转移的方法正确的是 .简述理由 .
(A)转移到坡上 (B)转移到坡下
答案解析部分
1.【答案】D
【解析】【解答】A. HClO具有强氧化性,故具有漂白性,A不符题意;
B. NaClO具有强氧化性,故具有漂白性,B不符题意;
C. 新制氯水中含HClO,具有漂白性,C不符题意;
D.CaCl2不具漂白性,D符合题意;
故答案为:D。
【分析】A.HClO具有强氧化性, 有漂白作用 ;
B.次氯酸钠具有强氧化性, 有漂白作用 ;
C.新制氯水中含有次氯酸,具有强氧化性, 有漂白作用 。
2.【答案】A
【解析】【解答】A.Fe在氯气中燃烧生成,A符合题意;
B.氯气能溶于水,且与水反应生成氯化氢和次氯酸,B不符合题意;
C.氯气是有刺激性气味、有毒的气体,C不符合题意;
D.氯气能与氢气反应生成氯化氢,D不符合题意;
故答案为:A。
【分析】依据氯气的性质分析,A项中氯气与金属反应生成高价态氯化物。
3.【答案】D
【解析】【解答】A.生产盐酸,是用氯气与氢气反应,与氯气易液化无关,故A不符合题意;
B.高盐能使细胞脱水死亡,氯化钠抑制微生物的生长,作防腐剂,与氯化钠熔点高低无关,故B不符合题意;
C.盐酸除去铁锈,利用盐酸的酸性,与挥发性无关,故C不符合题意;
D.次氯酸钠具有强氧化性,可作漂白剂,故D符合题意;
故答案为:D。
【分析】A.氯气溶液液化与制备盐酸无关,制备盐酸是氯气与氢气反应,然后溶于水得到盐酸。
C.铁锈为主要成分铁的氧化物,利用盐酸的酸性,除去铁锈。
4.【答案】C
【解析】【解答】解:氯气与水可以反应生成具有强氧化性的HClO,具有漂白性,还可杀菌消毒作用,氯气、HCl不具有漂白性,故选C.
【分析】氯气(Cl2)可以和水反应得到HCl和HClO(次氯酸),HClO具有强氧化性和漂白性,以此解答该题.
5.【答案】B
【解析】【解答】A.由分析可知,为Cl2,其中Cl元素的化合价为0价,既可以升高也可以降低,故既可被氧化,也可被还原,A不符合题意;
B.由分析可知,由于反应ClO-+Cl-+2H+=Cl2↑+H2O,故的浓溶液即浓盐酸不可与的固体即NaClO反应生成NaCl与HClO,B符合题意;
C.实验室可通过加热与的浓溶液即浓盐酸制得即Cl2,反应方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,C不符合题意;
D.可存在的循环转化关系即Cl2ClO-HClOHClCl-Cl2,D不符合题意;
故答案为:B。
【分析】A.氯气进入水反应生成盐酸和次氯酸;
B.浓盐酸和次氯酸钠生成a不会生成b和e;
C.实验室制备氯气,用浓盐酸氧化二氧化锰;
D.Cl2ClO-HClOHClCl-
6.【答案】A
【解析】【解答】A.84消毒液分散质直径小于1nm,属于溶液,故A符合题意;
B.氯气和NaOH反应生成氯化钠和次氯酸钠,次氯酸根具有强氧化性,可以消毒杀菌,所以有效成分为NaClO,故B不符合题意;
C.次氯酸为弱酸,所以次氯酸钠为强碱弱酸盐,溶液显碱性,故C不符合题意;
D.次氯酸根具有强氧化性,所以84消毒液具有强氧化性,故D不符合题意;
故答案为A。
【分析】A、 84消毒液” 为次氯酸钠溶液不是胶体
7.【答案】A
【解析】【解答】A.金属钠的氧化物中过氧化钠是淡黄色的固体,氧化钠是白色固体,故A符合题意;
B.金属钠的密度比水小,比煤油的密度大,故B不符合题意;
C.纯碱和小苏打都能溶于水,但碳酸钠的溶解度大于碳酸氢钠的溶解度,故C不符合题意;
D.Cl2是一种黄绿色的有毒气体,密度比空气大,故D不符合题意。
胡答案为:A。
【分析】A.Na2O为白色固体;
B.钠的密度比水小;
C.Na2CO3和NaHCO3都能溶于水;
D.Cl2是一种黄绿色的有毒气体;
8.【答案】C
【解析】【解答】A. 钠在氯气中燃烧能生成氯化钠固体小颗粒,所以能看到白烟,A叙述不符合题意;
B. 氯气排放到空气中是有害的,因其能和氢氧化钠溶液反应,故可用浸有NaOH溶液的棉球用于吸收过量的氯气,B叙述不符合题意;
C. 钠熔点低,先预热是为了先升高温度使氯气反应较完全,C叙述符合题意;
D. 氯气与水反应生成氯化氢和次氯酸,紫色石蕊遇酸变红,如果氢氧化钠溶液不能完全吸收掉氯气,则过量的氯气会和水反应,而紫色石蕊变红,石蕊变红则说明氢氧化钠溶液没有完全吸收掉氯气,D叙述不符合题意。
故答案为:C。
【分析】A、根据钠的熔点较低,与氯气燃烧生成氯化钠白色晶体解答;
B、由于在玻璃管中的实验不可能完全进行,氯气有毒,需要用氢氧化钠进行为期处理;
C、根据钠的熔点较低解答;
D、根据氯气与水反应生成HCl能够使石蕊变红,生成的HClO具有强氧化性,能够使红色褪去解答;
9.【答案】B
【解析】【解答】A、用Cl2和NaOH溶液反应制取漂白液,A不符合题意;
B、根据提干信息知:饱和NaClO溶液的pH约为11,而该溶液pH=12>11,故主要是因为该消毒液中含有一定量的NaOH,B符合题意;
C、根据HCl和HClO中Cl的化合价分析,该氧化还原方程式的书写符合题意,C不符合题意;
D、根据漂白粉起漂白作用的原理,应用的是较强酸制取较弱酸,D不符合题意;
故答案为:B
【分析】A.Cl2与NaOH溶液反应生成NaCl、NaClO和H2O;
B.结合溶液的pH值分析;
C.酸性条件下,Cl-和ClO-可反应生成Cl2;
D.CH3COOH和HClO都是弱酸,在离子方程式中保留化学式;
10.【答案】A
【解析】【解答】A.Al能够与NaOH溶液反应生成H2,物质间转化能实现,故A选;
B.CuO难溶于水,与水不反应,所以CuO与水不能反应生成Cu(OH)2,故B不选;
C.铁在氯气中燃烧生成FeCl3,不生成FeCl2,故C不选;
D.电解氯化钠溶液生成氢氧化钠、氢气和氯气,得不到Na,电解熔融的氯化钠可以生成Na,故D不选;
故答案为:A。
【分析】A.Al是一种两性金属,能与NaOH溶液反应生成H2;
B.CuO与H2O不反应;
C.Cl2与Fe点燃条件下反应生成FeCl3;
D.电解NaCl溶液,得到NaOH、Cl2和H2;
11.【答案】C
【解析】【解答】A. 反应②方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,反应放出的O2有助燃性,能使带火星木条复燃,A不符合题意;
B. ClO2具有强氧化性,因而具有漂白性,其消毒漂白能力比氯气强,使用起来比较安全,现已广泛应用二氧化氯代替氯气进行自来水消毒,B不符合题意;
C. 根据流程图反应①中氧化剂是NaClO3,还原剂是SO2,还原产物是ClO2,氧化产物是NaHSO4,根据元素化合价升降总数相等可得NaClO3和SO2的物质的量之比为2:1,C符合题意;
D. 据流程图可知反应②为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,在该反应中ClO2作氧化剂,H2O2作还原剂,由于氧化性:氧化剂大于还原剂,可以推出ClO2的氧化性大于H2O2,D不符合题意;
故答案为:C。
【分析】NaClO3在酸性条件下与SO2发生氧化还原反应生成ClO2,然后ClO2与H2O2在碱性条件下反应生成NaClO2,反应方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,然后将溶液蒸发浓缩、冷却结晶、过滤可得到NaClO2,以此解答该题。
12.【答案】A
【解析】【解答】A.次氯酸具有强氧化性,可使红玫瑰花褪色,故A错误;
B.氯气是黄绿色气体,新制氯水中含有氯气,使得新制氯水呈浅黄绿色,故B正确;
C.新制氯水显酸性,能与碳酸氢钠反应生成CO2气体,故C正确;
D.新制氯水中的氯离子和硝酸银反应生成氯化银白色沉淀,故D正确;
故选A.
【分析】氯气与水反应,发生Cl2+H2O=H++Cl﹣+HClO,氯水中含有HClO、Cl2,具有氧化性,其中HClO具有漂白性,含有H+,具有酸性,以此解答.
13.【答案】C
【解析】【解答】解:A.氯气不具有酸性和漂白性,故A不选;
B.液氯不具有酸性和漂白性,故B不选;
C.新制氯水中含HCl、HClO,具有酸性,且HClO具有漂白性,则能使干燥的蓝色石蕊试纸先变红后褪色,故C选;
D.氯气的酒精溶液,溶剂为酒精,不能生成酸和具有漂白性的物质,故D不选;
故选C.
【分析】能使干燥的蓝色石蕊试纸先变红后褪色,则物质具有酸性和漂白性,以此来解答.
14.【答案】B
【解析】【解答】A.因新制氯水中含有大量的氯气分子,导致氯水显淡黄绿色,和Cl2有关,故不选A;
B.将NaHCO3固体加入新制氯水中,有无色气泡产生,这是因为NaHCO3和氯水中的H+发生了反应,与HClO无关,故选B;
C.向新制氯水中滴加石蕊溶液,由于溶液呈酸性,所以溶液会先变红,由于溶液中含有HClO,所以溶液变红后又会褪色,故不选C;
D.滴加AgNO3溶液有白色沉淀产生,这是因为Ag+和氯水中的Cl-结合生成AgCl沉淀,故不选D;
故答案为:B。
【分析】新制氯水中含有三种分子“Cl2、HClO、H2O”和四种离子“H+、Cl-、ClO-、OH-”。结合相关微粒的性质分析选项即可。
15.【答案】D
【解析】【解答】解:A、新制氯水中含有的分子有:Cl2、HClO、H2O,故A错误;
B、新制氯水中含有H+,可使蓝色石蕊试纸变红,含有HClO,具有强氧化性,可使试纸褪色,故B错误;
C、氯水中含有HClO,不稳定,见光易分解生成氧气,该气体是O2,故C错误;
D、氯水放置数天后,次氯酸分解生成盐酸,溶液的酸性增强,故D正确;
故选D.
【分析】氯水中,氯气与水发生反应:Cl2+H2O HClO+HCl,溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO﹣、Cl﹣等离子,氯水具有酸性和强氧化性,其中HClO见光易分解而变质,据此对各选项判断.
16.【答案】A
17.【答案】(1)饱和食盐水;吸收氯气中混有的水蒸气
(2)Cu+Cl2 CuCl2;棕黄色的烟
(3)氢氧化钠溶液;Cl2+2OH-=Cl-+ClO-+H2O
【解析】【解答】(1)由于浓盐酸具有挥发性,且反应在溶液中进行,因此反应生成Cl2中混合HCl和H2O(g)杂质,Cl2不溶于饱和食盐水中,因此C装置中溶液为饱和NaCl溶液,用于除去Cl2中混有的HCl;D装置中盛装的为浓硫酸,用于干燥Cl2;
(2)Cl2具有强氧化性,能与Cu反应生成CuCl2,该反应的化学方程式为:Cu+Cl2CuCl2,实验现象为:产生棕黄色的烟;
(3)Cl2是一种有毒气体,能被碱溶液吸收,因此H中的试剂为NaOH溶液,发生反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
【分析】(1)Cl2的制备过程中会产生杂质气体HCl和H2O(g),C、D装置为除杂装置,据此确定C中试剂和D的作用;
(2)Cl2具有强氧化性,能与Cu反应生成CuCl2,据此写出反应的化学方程式和确定反应现象;
(3)Cl2是一种有毒气体,实验过程中,应用NaOH溶液进行尾气吸收;
18.【答案】(1)Cl2+2NaOH=NaCl+NaClO+H2O
(2);bc;2.5
(3)2NaClO3 + H2SO4 +SO2 = 2NaHSO4+2ClO2;O2
【解析】【解答】(1)工业上用氯气与氢氧化钠反应制取84消毒液,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O
(2)根据化合价的变化分析电子转移,可得双线桥表示电子转移的方向和数目:;ClO转化为Cl-,氯元素由+3价变为-1价,ClO作氧化剂,被还原,需要外加还原剂,
故答案为:bc; ClO2生成氯离子,化合价由+4价变为-1价,故共转移5个电子,Cl2生成氯离子,化合价由0价变成-1价,共转移2个电子,常温常压下,等体积ClO2和Cl2,根据阿伏加德罗定律,二者的物质的量相等,故ClO2的消毒能力是等体积Cl2的=2.5倍;
(3)根据图示可知反应物为:NaClO3 、H2SO4、SO2,生成物为NaHSO4、ClO2,结合电子转移守恒、原子守恒可得反应的方程式为:2NaClO3 + H2SO4 +SO2 = 2NaHSO4+2ClO2;由图示可得反应II的反应关系式为:ClO2 +H2O2 +NaOH NaClO2+其它产物,可以分析氯元素的化合价由+4变为+3,是氧化剂,被还原,故NaClO2为还原产物,由关系式分析可知,H2O2为还原剂,其中氧元素的化合价由-1价变为0价,故氧化产物为:O2。
【分析】(1)84消毒液的有效成分是次氯酸钠,氯气通入氢氧化钠溶液中,生成氯化钠、次氯酸和水;
(2)①该反应中,氯酸钠中的Cl元素化合价从+5价降低到+4价,盐酸中的Cl元素从-1价升高到0价;
②ClO转化为Cl-,化合价降低,被还原;
③根据得失电子守恒计算;
(3)反应Ⅰ为NaClO3 、H2SO4、SO2反应生成NaHSO4、ClO2;还原剂被氧化得到氧化产物。
19.【答案】C;BC;重金属污染;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
【解析】【解答】解:①导致雾霾形成的主要污染物是pM2.5,能被肺吸收并进入血液,对人体危害很大,故选C;②易拉罐、玻璃瓶不能燃烧,所以不能采用焚烧处理,电池中的重金属能污染环境,所以不能随意丢弃电池;故答案为:BC;重金属污染;③氯气和石灰乳反应生成氯化钙、次氯酸钙、水,该反应为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
【分析】①PM2.5”是指大气层中直径≥2.5μm的颗粒物,能被肺吸收并进入血液,对人体危害很大,是形成雾霾的主要污染物;②不能燃烧的垃圾,不能采用焚烧处理;③氯气和石灰乳反应生成氯化钙、次氯酸钙、水;
20.【答案】(1)分液漏斗;4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
(2)饱和NaCl溶液;吸收氯气中混有的杂质HCl;浓硫酸;吸收水蒸气,干燥氯气
(3)2Fe+3Cl2 2FeCl3
(4)NaOH溶液;2OH﹣+Cl2=Cl﹣+ClO﹣+H2O
(5)干燥
【解析】【解答】解:(1)装置中A为分液漏斗,用来向烧瓶中加入浓盐酸和二氧化锰混加热反应生成氯化锰、氯气和水,反应的化学方程式为:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,
故答案为:分液漏斗,4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O;(2)反应生成的氯气中含有氯化氢和水蒸气杂质气体,氯化氢极易溶于水,氯气在饱和食盐水中溶解性减弱,通过饱和食盐水除去氯化氢气体,通过浓硫酸溶液吸收水蒸气,装置B中盛放液体是饱和食盐水,气体通过装置B的目的是吸收氯气中混有的杂质HCl,装置C中盛放的液体是浓硫酸,气体通过装置C的目的是吸收水蒸气,干燥氯气,
故答案为:饱和食盐水,吸收氯气中混有的杂质HCl,浓硫酸,吸收水蒸气,干燥氯气;(3)干燥的氯气通过装置D是氯气和铁加热条件下反应生成氯化铁的反应,反应的化学方程式为:2Fe+3Cl2 2FeCl3,
故答案为:2Fe+3Cl2 2FeCl3 ;(4)氯气有毒,不能排放到空气中,装置E是氢氧化钠溶液,用来吸收未反应的氯气,防止污染空气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:2OH﹣+Cl2=Cl﹣+ClO﹣+H2O,
故答案为:NaOH溶液,2OH﹣+Cl2=Cl﹣+ClO﹣+H2O;(5)生成的氯化铁①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应,需要防止水蒸气进入装置D,为收集D中产物,在D与E之间,除增加收集装置外,还需要增加干燥装置,防止装置E中水蒸气进入,
故答案为:干燥.
【分析】装置中烧瓶内为二氧化锰,仪器A为分液漏斗,是吧浓盐酸滴入二氧化锰在加热的条件下加热反应生成氯气,生成的氯气中含杂质氯化氢和水蒸气,通过装置B中的饱和食盐水除去氯化氢,通过装置C中的浓硫酸除去水蒸气,干燥的氯气进入装置D和铁加热反应生成氯化铁,剩余氯气通入氢氧化钠溶液吸收,(1)分析装置中A的形状和作用可知为分液漏斗,是用来向烧瓶中加入浓盐酸和二氧化锰混加热反应生成氯化锰、氯气和水;(2)发生装置生成的氯气中含有氯化氢和水蒸气,通过饱和食盐水除去氯化氢气体,通过浓硫酸溶液吸收水蒸气;(3)装置D中是干燥的氯气和铁反应生成氯化铁;(4)装置E是氢氧化钠溶液,用来吸收未反应的氯气,防止污染空气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;(5)生成的氯化铁①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应,需要防止水蒸气进入装置D;
21.【答案】(1)(B);石灰和水反应生成碱氢氧化钙,氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水,从而降低氯气毒性
(2)(A);氯气有毒且密度大于空气,导致低处氯气浓度大于高处,低处人易中毒
【解析】【解答】解:(1)氯气有毒,氯气和水反应生成HCl、HClO且氯气的溶解度较小,氯气能和碱反应生成盐和水,石灰和水反应生成氢氧化钙,氢氧化钙为碱,所以如果出现氯气泄漏,可以用石灰处理,故选(B),
故答案为:(B);石灰和水反应生成碱氢氧化钙,氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水,从而降低氯气毒性;(2)氯气有毒,且氯气密度大于空气,导致低处氯气浓度大于高处,所以出现氯气泄漏时人应该转移到山坡上,故答案为:(A);氯气有毒且密度大于空气,导致低处氯气浓度大于高处,低处人易中毒.
【分析】(1)氯气有毒,氯气和水反应生成HCl、HClO且氯气的溶解度较小,氯气能和碱反应生成盐和水;(2)氯气密度大于空气,根据氯气和空气密度相对大小判断.
一、单选题
1.日常生活和工业生产中常用到漂白剂。下列物质没有漂白作用的是( )
A.HClO B.NaClO溶液 C.新制氯水 D.CaCl2
2.下列关于氯气性质的描述错误的是( )
A.Fe在氯气中燃烧生成 B.能溶于水
C.有刺激性气味、有毒 D.能与氢气反应
3.是重要的工业原料,可用于生产盐酸、漂白粉及制氯仿等有机溶剂。的制备可用下列反应:NaClO+2HCl(浓)=NaCl+Cl2↑+H2O,下列关于氯及其化合物的性质与用途具有对应关系的是( )
A.易液化,可用于生产盐酸
B.NaCl熔点较高,可用作防腐剂
C.盐酸具有挥发性,可用于除铁锈
D.NaClO具有强氧化性,可用作漂白剂
4.氯水既可以用来杀菌消毒,又可作漂白剂,其中起作用的物质是( )
A.Cl2 B.HCl C.HClO D.H2O
5.部分常见含氯物质的分类与相应化合价关系如图所示。下列推断不合理的是 ( )
A.既可被氧化,也可被还原
B.的浓溶液可与的固体反应生成与
C.实验室可通过加热与的浓溶液制得
D.可存在的循环转化关系
6.“84消毒液”可消杀新冠病毒,可用Cl2与NaOH溶液反应制备。下列关于“84消毒液”的说法错误的是( )
A.属于胶体 B.有效成分为NaClO
C.室温下溶液pH大于7 D.有强氧化性
7.下列有关各种物质的物理性质的叙述中错误的是( )
A.金属钠的氧化物都是淡黄色的固体
B.金属钠的密度比水小
C.纯碱和小苏打都能溶于水
D.Cl2是一种黄绿色的有毒气体
8.某化学教师为“氯气与金属钠反应”设计了如图装置的实验,实验操作,先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C.钠熔点高,所以先预热再反应
D.若在棉球外沿滴一滴石蕊溶液,可据其颜色变化判断氯气是否被碱液完全吸收
9.某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=Cl-+ ClO-+ H2O
B.该消毒液的pH约为12:ClO-+ H2O HClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO-
10.在给定条件下,下列选项所示物质间转化均能实现的是( )
A.Al H2 B.CuO Cu(OH)2
C.Cl2 FeCl2 D.NaCl溶液 单质Na
11.亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化利,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
下列说法错误的是( )
A.区应②反应过程中有大量使带火星木条复燃气体冒出
B.反应①得到的ClO2消毒漂白能力比氯气强,使用起来比较安全
C.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为1:2
D.反应②条件下,ClO2的氧化性大于H2O2
12.氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A.使新鲜的红玫瑰花褪色(HCl)
B.新制氯水呈浅黄绿色(Cl2)
C.加入小苏打固体,有气泡产生(H+)
D.滴加AgNO3溶液生成白色沉淀(Cl﹣)
13.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
A.氯气 B.液氯
C.新制氯水 D.氯气的酒精溶液
14.下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( )
A.新制氯水显淡黄绿色(Cl2)
B.将NaHCO3固体加入新制氯水中,有无色气泡产生(HClO)
C.向新制氯水中滴加石蕊溶液,溶液先变红后褪色(H+、HClO)
D.滴加AgNO3溶液有白色沉淀产生(Cl-)
15.下列关于氯水的叙述,正确的是( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸变红且不褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后酸性将变强
16.向盛有FeSO4溶液的试管中滴加足量新制氯水,向反应后的溶液中滴加下列溶液,无明显现象的是( )
A.HNO3 B.Ca(HCO3)2 C.KSCN D.Na2S
二、综合题
17.如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
(1)装置C中盛装的溶液是 ,D中试剂的作用是 。
(2)写出F中反应的化学反应方程式: ,其反应现象为 。
(3)H中的试剂为 ,用来吸收多余氯气。该反应的离子方程式为 。
18.新冠疫情反反复复,病毒不断发生变异,民众要增强防疫意识,做好个人防护。口罩作为基础防疫物资,可以有效防止飞沫的传播。除了佩戴口罩,还需要加强对隔离场所的消毒。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。
(1)84消毒液是一种常用消毒剂,写出工业上用氯气制备84消毒液的化学方程式
(2)二氧化氯是一种高效消毒剂。工业制备ClO2的反应为:
①用双线桥表示电子转移的方向和数目 。
② ClO2在杀菌消毒过程中会产生少量副产物亚氯酸盐(ClO),需将其转化为Cl-除去,下列试剂中可将ClO转化为Cl-的是 (填字母)。
a.O3 b.FeSO4 c.KI d.KMnO4
③常温常压下,ClO2的消毒能力是等体积Cl2的 倍 (假设ClO2、Cl2全部都被还原为Cl-,没有其它的含氯产物生成)
(3)亚氯酸钠(NaClO2)是一种高效的消毒剂和漂白剂。Mathieson法制备亚氯酸钠的流程如图:
①写出反应I的化学方程式
② 反应II生成的氧化产物是 (写化学式)
19.防治环境污染,改善生态环境已成为全球共识.
①2013年,全国多个省市出现严重的雾霾天气.导致雾霾形成的主要污染物是 (填字母);
A.O2 B.CO2 C.PM2.5
②采用焚烧处理垃圾进行发电已在江苏投入使用.下列是生活中的常见垃圾.
A.废电池 B.易拉罐 C.玻璃瓶
在焚烧处理前,除废电池外,还有 (填字母)应剔除并回收,随意丢弃电池造成的主要危害是 .
③漂白粉可用于生活用水的杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是 .
20.如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答:
(1)仪器A的名称是 ,烧瓶中反应的化学方程式是 .
(2)装置B中盛放液体是 ,气体通过装置B的目的是 .
装置C中盛放的液体是 ,气体通过装置C的目的是 .
(3)D中反应的化学方程式是
(4)烧杯E中盛放的液体是 ,反应的离子方程式是 .
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加 装置.
21.山区某工厂,在山坡坑道的仓库里贮有氯气钢瓶.某一天,一只贮有氯气的钢瓶损坏,造成氯气泄漏,在场工人采取以下措施.请选择填充并简述理由.
(1)处理钢瓶的正确方法是 .
(A)把钢瓶推到山坡下小河里 (B)把钢瓶丢到深坑里,用石灰填埋 (C)把钢瓶扔到农田里,简述理由 .
(2)钢瓶处理后,工人转移的方法正确的是 .简述理由 .
(A)转移到坡上 (B)转移到坡下
答案解析部分
1.【答案】D
【解析】【解答】A. HClO具有强氧化性,故具有漂白性,A不符题意;
B. NaClO具有强氧化性,故具有漂白性,B不符题意;
C. 新制氯水中含HClO,具有漂白性,C不符题意;
D.CaCl2不具漂白性,D符合题意;
故答案为:D。
【分析】A.HClO具有强氧化性, 有漂白作用 ;
B.次氯酸钠具有强氧化性, 有漂白作用 ;
C.新制氯水中含有次氯酸,具有强氧化性, 有漂白作用 。
2.【答案】A
【解析】【解答】A.Fe在氯气中燃烧生成,A符合题意;
B.氯气能溶于水,且与水反应生成氯化氢和次氯酸,B不符合题意;
C.氯气是有刺激性气味、有毒的气体,C不符合题意;
D.氯气能与氢气反应生成氯化氢,D不符合题意;
故答案为:A。
【分析】依据氯气的性质分析,A项中氯气与金属反应生成高价态氯化物。
3.【答案】D
【解析】【解答】A.生产盐酸,是用氯气与氢气反应,与氯气易液化无关,故A不符合题意;
B.高盐能使细胞脱水死亡,氯化钠抑制微生物的生长,作防腐剂,与氯化钠熔点高低无关,故B不符合题意;
C.盐酸除去铁锈,利用盐酸的酸性,与挥发性无关,故C不符合题意;
D.次氯酸钠具有强氧化性,可作漂白剂,故D符合题意;
故答案为:D。
【分析】A.氯气溶液液化与制备盐酸无关,制备盐酸是氯气与氢气反应,然后溶于水得到盐酸。
C.铁锈为主要成分铁的氧化物,利用盐酸的酸性,除去铁锈。
4.【答案】C
【解析】【解答】解:氯气与水可以反应生成具有强氧化性的HClO,具有漂白性,还可杀菌消毒作用,氯气、HCl不具有漂白性,故选C.
【分析】氯气(Cl2)可以和水反应得到HCl和HClO(次氯酸),HClO具有强氧化性和漂白性,以此解答该题.
5.【答案】B
【解析】【解答】A.由分析可知,为Cl2,其中Cl元素的化合价为0价,既可以升高也可以降低,故既可被氧化,也可被还原,A不符合题意;
B.由分析可知,由于反应ClO-+Cl-+2H+=Cl2↑+H2O,故的浓溶液即浓盐酸不可与的固体即NaClO反应生成NaCl与HClO,B符合题意;
C.实验室可通过加热与的浓溶液即浓盐酸制得即Cl2,反应方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,C不符合题意;
D.可存在的循环转化关系即Cl2ClO-HClOHClCl-Cl2,D不符合题意;
故答案为:B。
【分析】A.氯气进入水反应生成盐酸和次氯酸;
B.浓盐酸和次氯酸钠生成a不会生成b和e;
C.实验室制备氯气,用浓盐酸氧化二氧化锰;
D.Cl2ClO-HClOHClCl-
6.【答案】A
【解析】【解答】A.84消毒液分散质直径小于1nm,属于溶液,故A符合题意;
B.氯气和NaOH反应生成氯化钠和次氯酸钠,次氯酸根具有强氧化性,可以消毒杀菌,所以有效成分为NaClO,故B不符合题意;
C.次氯酸为弱酸,所以次氯酸钠为强碱弱酸盐,溶液显碱性,故C不符合题意;
D.次氯酸根具有强氧化性,所以84消毒液具有强氧化性,故D不符合题意;
故答案为A。
【分析】A、 84消毒液” 为次氯酸钠溶液不是胶体
7.【答案】A
【解析】【解答】A.金属钠的氧化物中过氧化钠是淡黄色的固体,氧化钠是白色固体,故A符合题意;
B.金属钠的密度比水小,比煤油的密度大,故B不符合题意;
C.纯碱和小苏打都能溶于水,但碳酸钠的溶解度大于碳酸氢钠的溶解度,故C不符合题意;
D.Cl2是一种黄绿色的有毒气体,密度比空气大,故D不符合题意。
胡答案为:A。
【分析】A.Na2O为白色固体;
B.钠的密度比水小;
C.Na2CO3和NaHCO3都能溶于水;
D.Cl2是一种黄绿色的有毒气体;
8.【答案】C
【解析】【解答】A. 钠在氯气中燃烧能生成氯化钠固体小颗粒,所以能看到白烟,A叙述不符合题意;
B. 氯气排放到空气中是有害的,因其能和氢氧化钠溶液反应,故可用浸有NaOH溶液的棉球用于吸收过量的氯气,B叙述不符合题意;
C. 钠熔点低,先预热是为了先升高温度使氯气反应较完全,C叙述符合题意;
D. 氯气与水反应生成氯化氢和次氯酸,紫色石蕊遇酸变红,如果氢氧化钠溶液不能完全吸收掉氯气,则过量的氯气会和水反应,而紫色石蕊变红,石蕊变红则说明氢氧化钠溶液没有完全吸收掉氯气,D叙述不符合题意。
故答案为:C。
【分析】A、根据钠的熔点较低,与氯气燃烧生成氯化钠白色晶体解答;
B、由于在玻璃管中的实验不可能完全进行,氯气有毒,需要用氢氧化钠进行为期处理;
C、根据钠的熔点较低解答;
D、根据氯气与水反应生成HCl能够使石蕊变红,生成的HClO具有强氧化性,能够使红色褪去解答;
9.【答案】B
【解析】【解答】A、用Cl2和NaOH溶液反应制取漂白液,A不符合题意;
B、根据提干信息知:饱和NaClO溶液的pH约为11,而该溶液pH=12>11,故主要是因为该消毒液中含有一定量的NaOH,B符合题意;
C、根据HCl和HClO中Cl的化合价分析,该氧化还原方程式的书写符合题意,C不符合题意;
D、根据漂白粉起漂白作用的原理,应用的是较强酸制取较弱酸,D不符合题意;
故答案为:B
【分析】A.Cl2与NaOH溶液反应生成NaCl、NaClO和H2O;
B.结合溶液的pH值分析;
C.酸性条件下,Cl-和ClO-可反应生成Cl2;
D.CH3COOH和HClO都是弱酸,在离子方程式中保留化学式;
10.【答案】A
【解析】【解答】A.Al能够与NaOH溶液反应生成H2,物质间转化能实现,故A选;
B.CuO难溶于水,与水不反应,所以CuO与水不能反应生成Cu(OH)2,故B不选;
C.铁在氯气中燃烧生成FeCl3,不生成FeCl2,故C不选;
D.电解氯化钠溶液生成氢氧化钠、氢气和氯气,得不到Na,电解熔融的氯化钠可以生成Na,故D不选;
故答案为:A。
【分析】A.Al是一种两性金属,能与NaOH溶液反应生成H2;
B.CuO与H2O不反应;
C.Cl2与Fe点燃条件下反应生成FeCl3;
D.电解NaCl溶液,得到NaOH、Cl2和H2;
11.【答案】C
【解析】【解答】A. 反应②方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,反应放出的O2有助燃性,能使带火星木条复燃,A不符合题意;
B. ClO2具有强氧化性,因而具有漂白性,其消毒漂白能力比氯气强,使用起来比较安全,现已广泛应用二氧化氯代替氯气进行自来水消毒,B不符合题意;
C. 根据流程图反应①中氧化剂是NaClO3,还原剂是SO2,还原产物是ClO2,氧化产物是NaHSO4,根据元素化合价升降总数相等可得NaClO3和SO2的物质的量之比为2:1,C符合题意;
D. 据流程图可知反应②为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,在该反应中ClO2作氧化剂,H2O2作还原剂,由于氧化性:氧化剂大于还原剂,可以推出ClO2的氧化性大于H2O2,D不符合题意;
故答案为:C。
【分析】NaClO3在酸性条件下与SO2发生氧化还原反应生成ClO2,然后ClO2与H2O2在碱性条件下反应生成NaClO2,反应方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,然后将溶液蒸发浓缩、冷却结晶、过滤可得到NaClO2,以此解答该题。
12.【答案】A
【解析】【解答】A.次氯酸具有强氧化性,可使红玫瑰花褪色,故A错误;
B.氯气是黄绿色气体,新制氯水中含有氯气,使得新制氯水呈浅黄绿色,故B正确;
C.新制氯水显酸性,能与碳酸氢钠反应生成CO2气体,故C正确;
D.新制氯水中的氯离子和硝酸银反应生成氯化银白色沉淀,故D正确;
故选A.
【分析】氯气与水反应,发生Cl2+H2O=H++Cl﹣+HClO,氯水中含有HClO、Cl2,具有氧化性,其中HClO具有漂白性,含有H+,具有酸性,以此解答.
13.【答案】C
【解析】【解答】解:A.氯气不具有酸性和漂白性,故A不选;
B.液氯不具有酸性和漂白性,故B不选;
C.新制氯水中含HCl、HClO,具有酸性,且HClO具有漂白性,则能使干燥的蓝色石蕊试纸先变红后褪色,故C选;
D.氯气的酒精溶液,溶剂为酒精,不能生成酸和具有漂白性的物质,故D不选;
故选C.
【分析】能使干燥的蓝色石蕊试纸先变红后褪色,则物质具有酸性和漂白性,以此来解答.
14.【答案】B
【解析】【解答】A.因新制氯水中含有大量的氯气分子,导致氯水显淡黄绿色,和Cl2有关,故不选A;
B.将NaHCO3固体加入新制氯水中,有无色气泡产生,这是因为NaHCO3和氯水中的H+发生了反应,与HClO无关,故选B;
C.向新制氯水中滴加石蕊溶液,由于溶液呈酸性,所以溶液会先变红,由于溶液中含有HClO,所以溶液变红后又会褪色,故不选C;
D.滴加AgNO3溶液有白色沉淀产生,这是因为Ag+和氯水中的Cl-结合生成AgCl沉淀,故不选D;
故答案为:B。
【分析】新制氯水中含有三种分子“Cl2、HClO、H2O”和四种离子“H+、Cl-、ClO-、OH-”。结合相关微粒的性质分析选项即可。
15.【答案】D
【解析】【解答】解:A、新制氯水中含有的分子有:Cl2、HClO、H2O,故A错误;
B、新制氯水中含有H+,可使蓝色石蕊试纸变红,含有HClO,具有强氧化性,可使试纸褪色,故B错误;
C、氯水中含有HClO,不稳定,见光易分解生成氧气,该气体是O2,故C错误;
D、氯水放置数天后,次氯酸分解生成盐酸,溶液的酸性增强,故D正确;
故选D.
【分析】氯水中,氯气与水发生反应:Cl2+H2O HClO+HCl,溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO﹣、Cl﹣等离子,氯水具有酸性和强氧化性,其中HClO见光易分解而变质,据此对各选项判断.
16.【答案】A
17.【答案】(1)饱和食盐水;吸收氯气中混有的水蒸气
(2)Cu+Cl2 CuCl2;棕黄色的烟
(3)氢氧化钠溶液;Cl2+2OH-=Cl-+ClO-+H2O
【解析】【解答】(1)由于浓盐酸具有挥发性,且反应在溶液中进行,因此反应生成Cl2中混合HCl和H2O(g)杂质,Cl2不溶于饱和食盐水中,因此C装置中溶液为饱和NaCl溶液,用于除去Cl2中混有的HCl;D装置中盛装的为浓硫酸,用于干燥Cl2;
(2)Cl2具有强氧化性,能与Cu反应生成CuCl2,该反应的化学方程式为:Cu+Cl2CuCl2,实验现象为:产生棕黄色的烟;
(3)Cl2是一种有毒气体,能被碱溶液吸收,因此H中的试剂为NaOH溶液,发生反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
【分析】(1)Cl2的制备过程中会产生杂质气体HCl和H2O(g),C、D装置为除杂装置,据此确定C中试剂和D的作用;
(2)Cl2具有强氧化性,能与Cu反应生成CuCl2,据此写出反应的化学方程式和确定反应现象;
(3)Cl2是一种有毒气体,实验过程中,应用NaOH溶液进行尾气吸收;
18.【答案】(1)Cl2+2NaOH=NaCl+NaClO+H2O
(2);bc;2.5
(3)2NaClO3 + H2SO4 +SO2 = 2NaHSO4+2ClO2;O2
【解析】【解答】(1)工业上用氯气与氢氧化钠反应制取84消毒液,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O
(2)根据化合价的变化分析电子转移,可得双线桥表示电子转移的方向和数目:;ClO转化为Cl-,氯元素由+3价变为-1价,ClO作氧化剂,被还原,需要外加还原剂,
故答案为:bc; ClO2生成氯离子,化合价由+4价变为-1价,故共转移5个电子,Cl2生成氯离子,化合价由0价变成-1价,共转移2个电子,常温常压下,等体积ClO2和Cl2,根据阿伏加德罗定律,二者的物质的量相等,故ClO2的消毒能力是等体积Cl2的=2.5倍;
(3)根据图示可知反应物为:NaClO3 、H2SO4、SO2,生成物为NaHSO4、ClO2,结合电子转移守恒、原子守恒可得反应的方程式为:2NaClO3 + H2SO4 +SO2 = 2NaHSO4+2ClO2;由图示可得反应II的反应关系式为:ClO2 +H2O2 +NaOH NaClO2+其它产物,可以分析氯元素的化合价由+4变为+3,是氧化剂,被还原,故NaClO2为还原产物,由关系式分析可知,H2O2为还原剂,其中氧元素的化合价由-1价变为0价,故氧化产物为:O2。
【分析】(1)84消毒液的有效成分是次氯酸钠,氯气通入氢氧化钠溶液中,生成氯化钠、次氯酸和水;
(2)①该反应中,氯酸钠中的Cl元素化合价从+5价降低到+4价,盐酸中的Cl元素从-1价升高到0价;
②ClO转化为Cl-,化合价降低,被还原;
③根据得失电子守恒计算;
(3)反应Ⅰ为NaClO3 、H2SO4、SO2反应生成NaHSO4、ClO2;还原剂被氧化得到氧化产物。
19.【答案】C;BC;重金属污染;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
【解析】【解答】解:①导致雾霾形成的主要污染物是pM2.5,能被肺吸收并进入血液,对人体危害很大,故选C;②易拉罐、玻璃瓶不能燃烧,所以不能采用焚烧处理,电池中的重金属能污染环境,所以不能随意丢弃电池;故答案为:BC;重金属污染;③氯气和石灰乳反应生成氯化钙、次氯酸钙、水,该反应为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
【分析】①PM2.5”是指大气层中直径≥2.5μm的颗粒物,能被肺吸收并进入血液,对人体危害很大,是形成雾霾的主要污染物;②不能燃烧的垃圾,不能采用焚烧处理;③氯气和石灰乳反应生成氯化钙、次氯酸钙、水;
20.【答案】(1)分液漏斗;4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
(2)饱和NaCl溶液;吸收氯气中混有的杂质HCl;浓硫酸;吸收水蒸气,干燥氯气
(3)2Fe+3Cl2 2FeCl3
(4)NaOH溶液;2OH﹣+Cl2=Cl﹣+ClO﹣+H2O
(5)干燥
【解析】【解答】解:(1)装置中A为分液漏斗,用来向烧瓶中加入浓盐酸和二氧化锰混加热反应生成氯化锰、氯气和水,反应的化学方程式为:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,
故答案为:分液漏斗,4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O;(2)反应生成的氯气中含有氯化氢和水蒸气杂质气体,氯化氢极易溶于水,氯气在饱和食盐水中溶解性减弱,通过饱和食盐水除去氯化氢气体,通过浓硫酸溶液吸收水蒸气,装置B中盛放液体是饱和食盐水,气体通过装置B的目的是吸收氯气中混有的杂质HCl,装置C中盛放的液体是浓硫酸,气体通过装置C的目的是吸收水蒸气,干燥氯气,
故答案为:饱和食盐水,吸收氯气中混有的杂质HCl,浓硫酸,吸收水蒸气,干燥氯气;(3)干燥的氯气通过装置D是氯气和铁加热条件下反应生成氯化铁的反应,反应的化学方程式为:2Fe+3Cl2 2FeCl3,
故答案为:2Fe+3Cl2 2FeCl3 ;(4)氯气有毒,不能排放到空气中,装置E是氢氧化钠溶液,用来吸收未反应的氯气,防止污染空气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:2OH﹣+Cl2=Cl﹣+ClO﹣+H2O,
故答案为:NaOH溶液,2OH﹣+Cl2=Cl﹣+ClO﹣+H2O;(5)生成的氯化铁①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应,需要防止水蒸气进入装置D,为收集D中产物,在D与E之间,除增加收集装置外,还需要增加干燥装置,防止装置E中水蒸气进入,
故答案为:干燥.
【分析】装置中烧瓶内为二氧化锰,仪器A为分液漏斗,是吧浓盐酸滴入二氧化锰在加热的条件下加热反应生成氯气,生成的氯气中含杂质氯化氢和水蒸气,通过装置B中的饱和食盐水除去氯化氢,通过装置C中的浓硫酸除去水蒸气,干燥的氯气进入装置D和铁加热反应生成氯化铁,剩余氯气通入氢氧化钠溶液吸收,(1)分析装置中A的形状和作用可知为分液漏斗,是用来向烧瓶中加入浓盐酸和二氧化锰混加热反应生成氯化锰、氯气和水;(2)发生装置生成的氯气中含有氯化氢和水蒸气,通过饱和食盐水除去氯化氢气体,通过浓硫酸溶液吸收水蒸气;(3)装置D中是干燥的氯气和铁反应生成氯化铁;(4)装置E是氢氧化钠溶液,用来吸收未反应的氯气,防止污染空气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;(5)生成的氯化铁①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应,需要防止水蒸气进入装置D;
21.【答案】(1)(B);石灰和水反应生成碱氢氧化钙,氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水,从而降低氯气毒性
(2)(A);氯气有毒且密度大于空气,导致低处氯气浓度大于高处,低处人易中毒
【解析】【解答】解:(1)氯气有毒,氯气和水反应生成HCl、HClO且氯气的溶解度较小,氯气能和碱反应生成盐和水,石灰和水反应生成氢氧化钙,氢氧化钙为碱,所以如果出现氯气泄漏,可以用石灰处理,故选(B),
故答案为:(B);石灰和水反应生成碱氢氧化钙,氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水,从而降低氯气毒性;(2)氯气有毒,且氯气密度大于空气,导致低处氯气浓度大于高处,所以出现氯气泄漏时人应该转移到山坡上,故答案为:(A);氯气有毒且密度大于空气,导致低处氯气浓度大于高处,低处人易中毒.
【分析】(1)氯气有毒,氯气和水反应生成HCl、HClO且氯气的溶解度较小,氯气能和碱反应生成盐和水;(2)氯气密度大于空气,根据氯气和空气密度相对大小判断.
