4.3 化学键 同步测试 2023-2024学年高一上学期化学人教版(2019)必修第一册(含解析)
文档属性
| 名称 | 4.3 化学键 同步测试 2023-2024学年高一上学期化学人教版(2019)必修第一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 180.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 11:19:54 | ||
图片预览




文档简介
4.3 化学键 同步测试
一、单选题
1.下列含有共价键的离子化合物是( )
A.NaCl B.MgCl2 C.HCl D.NaOH
2.下列物质中只含共价键的是( )
A.HCl B.NaOH C.NH4Cl D.CH3COONa
3.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.2Na2O2+2H2O→4NaOH+O2↑
B.CaH2 +2H2O→Ca(OH) 2 +2H2↑
C.Mg3N2 +6H2O→3Mg(OH)2 ↓+2NH3↑
D.NH4Cl+NaOH NaCl+NH3↑ +H2O
4.下列物质中属于含有共价健的离子化合物的是( )
A. B. C. D.
5.下列物质中,含有共价键的是( )
A.K B.CaO
C.CO2 D.NaCl
6.下列物质中,属于只含有离子键的离子化合物的是( )
A.CO2 B.Ca(OH)2 C.HF D.Na2O
7.V、W、X、Y、Z为五种短周期主族元素。其中W、Y、Z分别位于三个不同周期,V、Y位于同一主族;Y原子的最外层电子数是W原子的最外层电子数的2倍;W、X、Y三种简单离子的核外电子排布相同。由W、X、Y、Z形成的某种化合物的结构如图所示。下列说法正确的是( )
A.简单离子半径:r(X)<r(W)<r(Y)<r(V)
B.简单氢化物的稳定性:Y<V
C.X与Y、Y与Z均可形成含非极性键的化合物
D.W与X两者的最高价氧化物的水化物不能发生反应
8.下列各组物质的晶体中,化学键类型和晶体类型均相同的是( )
A.NH3和NH4Cl B.HCl和H2O C.KCl和CCl4 D.CO2和SiO2
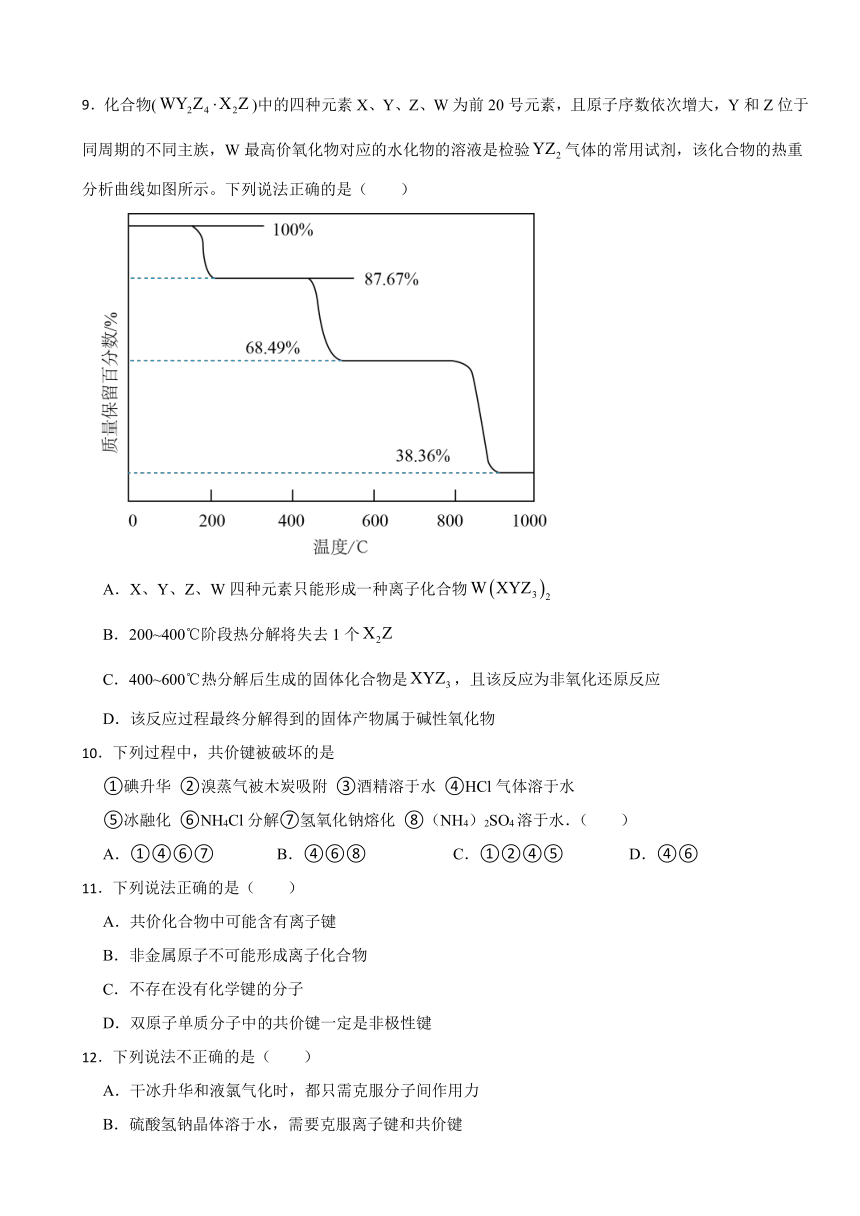
9.化合物()中的四种元素X、Y、Z、W为前20号元素,且原子序数依次增大,Y和Z位于同周期的不同主族,W最高价氧化物对应的水化物的溶液是检验气体的常用试剂,该化合物的热重分析曲线如图所示。下列说法正确的是( )
A.X、Y、Z、W四种元素只能形成一种离子化合物
B.200~400℃阶段热分解将失去1个
C.400~600℃热分解后生成的固体化合物是,且该反应为非氧化还原反应
D.该反应过程最终分解得到的固体产物属于碱性氧化物
10.下列过程中,共价键被破坏的是
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl分解⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.( )
A.①④⑥⑦ B.④⑥⑧ C.①②④⑤ D.④⑥
11.下列说法正确的是( )
A.共价化合物中可能含有离子键
B.非金属原子不可能形成离子化合物
C.不存在没有化学键的分子
D.双原子单质分子中的共价键一定是非极性键
12.下列说法不正确的是( )
A.干冰升华和液氯气化时,都只需克服分子间作用力
B.硫酸氢钠晶体溶于水,需要克服离子键和共价键
C.NH3和NCl3中,每个原子的最外层都具有8电子稳定结构
D.石墨转化为金刚石时,既有共价键的断裂,又有共价键的形成
13.下列化合物中,化学键的类型完全相同的是( )
A.CO2和MgO B.Na2O2和NaOH C.BF3和NH4NO3 D.HCl和H2O
14.下列说法正确的是( )
①离子化合物一定含离子键,也可能含共价键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥离子化合物在熔融状态下能导电.
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
15.下列物质中,只含有离子键的是( )
A.H2O B.CO2 C.MgCl2 D.KOH
二、综合题
16.153年前门捷列夫制得世界上第一张元素周期表,它反映了元素之间的内在联系,是对元素的一种很好的自然分类。如图为现代元素周期表的一部分,请回答下列问题:(以下问题均用相应的化学用语表达)
(1)在这10种元素中,非金属性最强的元素在周期表中的位置是 。
(2)由a、d、f三种元素形成的化合物含有的化学键有 (填写化学键类型),属于 化合物。
(3)元素b、c形成的简单气态氢化物中较稳定的是 ;d、h、i、j的简单离子半径由大到小的顺序排列为 。
(4)用电子式表示c2的形成过程 。
(5)在含有a、g、h简单阳离子的100mL溶液中,逐滴滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:
①沉淀减少时发生的离子方程式: 。
②a点的数值为: mL。
17.现有下列物质:①Cl2②Na2O2③NaOH④HCl⑤H2O2⑥MgF2⑦NH4Cl
(1)只由离子键构成的物质是 (填序号,下同).
(2)只由极性键构成的物质是 .
(3)只由非极性键构成的物质是 .
(4)只由非金属元素组成的离子化合物是 .
(5)由极性键和非极性键构成的物质是 .
(6)由离子键和极性键构成的物质是 .
(7)由离子键和非极性键构成的物质是 .
(8)属于共价化合物的物质是 .
18.根据问题填空:
(1)下列变化 (填序号)①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氧气溶于水⑥氯化铵受热分解.
未发生化学键破坏的是 ;仅发生离子键破坏的是 ;
(2)若上述物质都为纯净物时,属于共价化合物的是 ;属于离子化合物的是 ;
(3)写出下列物质的电子式
As NaH CsOH HSCN O22﹣ .
19.现有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知B元素是地壳中含量最高的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。
回答下列问题:
(1)用电子式表示C和E形成化合物的过程: 。
(2)写出基态F原子的核外电子排布式: 。
(3)A2D的电子式为 ,其分子中 (填“含”或“不含”,下同)键, π键。
(4)A、B、C共同形成的化合物中化学键的类型有 。
20.下列物质①氯化钠②氢氧化钠③氯化铵④过氧化钠⑤溴化氢⑥氯气
(1)只含有离子键的是
(2)只含极性共价键的是
(3)只含非极性共价键的是
(4)既含离子键又含非极性共价键的是
(5)既含离子键又含极性共价键的是
(6)由非金属元素组成的离子化合物的是 .
答案解析部分
1.【答案】D
【解析】【解答】A.NaCl是离子化合物,Na+与Cl-之间以离子键结合,不存在共价键,A不符合题意;
B.MgCl2是离子化合物,Mg2+与Cl-之间以离子键结合,不存在共价键,B不符合题意;
C.HCl是共价化合物,H原子与Cl原子之间以极性共价键H-Cl结合,无离子键,C不符合题意;
D.NaOH是离子化合物,Na+与OH-之间以离子键结合,在OH-中H、O原子之间以极性共价键H-O结合,是含有共价键的离子化合物,D符合题意;
故答案为:D。
【分析】 NaCl、MgCl2只含离子键,HCl只含共价键,NaOH中Na+与OH-之间以离子键结合,OH-中含有O-H共价键。
2.【答案】A
【解析】【解答】A、HCl分子中只有共价键,故A符合题意;
B、NaOH中除了共价键,还有离子键,故B不符合题意;
C、NH4Cl中除了共价键,还有离子键,故C不符合题意;
D. CH3COONa中除了共价键,还有离子键,故D不符合题意;
故答案为:A。
【分析】离子化合物主要有,碱,盐(除氯化铝和氯化铍)金属氧化物,金属氰化物。共价化合物主要有酸,非金属氧化物,非金属氢化物,氯化铝和氯化铍。离子化合物中一定含离子键,也可以含共价键,共价化合物中一定只含共价键。
3.【答案】A
【解析】【解答】A.2Na2O2+2H2O=4NaOH+O2↑中有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成,故A符合题意;
B. CaH2 +2H2O→Ca(OH) 2 +2H2↑中不存在非极性键的断裂,故B不符合题意;
C.Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑中有离子键、极性键的断裂,又有离子键、极性键的形成,故C不符合题意;
D.NH4Cl+NaOH═NaCl+NH3↑+H2O中有离子键、极性键的断裂,又有离子键、极性键的形成,故D不符合题意;
故答案为:A。
【分析】离子键指的是由阴阳离子通过静电作用形成的化学键;
极性键指的是不同的原子提供共用电子对形成的共价键;
非极性键指的是相同的原子通过共用电子对形成的共价键。
4.【答案】B
【解析】【解答】A. 只含有极性键,故A不选;
B. 中含有离子键和极性键,故B选;
C. 只含有离子键,故C不选;
D. 只含有极性键,故D不选;
故答案为:B。
【分析】铵根离子或金属离子与非金属离子或酸根离子的结合是离子键,非金属原子和非金属原子的结合是共价键,含有离子键的化合物为离子化合物,只含共价键的化合物为共价化合物。
5.【答案】C
【解析】【解答】A.K含有金属键,故A不符合题意;
B.CaO只含离子键,故B不符合题意;
C.CO2只含有共价键,故C符合题意;
D.NaCl只含离子键,故D不符合题意。
【分析】活泼金属与非活泼金属形成离子键,非金属之间形成共价键,即可得出本题答案
6.【答案】D
【解析】【解答】A.CO2为共价化合物,只含有共价键,A不符合题意;
B.Ca(OH)2,既含有离子键又含有共价键,B不符合题意;
C.HF为共价化合物,只含有共价键,C不符合题意;
D.Na2O只含有离子键,D符合题意;
故答案为:D。
【分析】离子化合物一定含有离子键,可能含有共价键,找出不含有共价键的离子化合物即可
7.【答案】C
【解析】【解答】
A.离子核外电子层数越大离子半径越大;当离子核外电子层相同时,离子的核电荷数越大离子半径越小,则简单离子半径:r(W)<r(X)<r(Y)<r(V),A不符合题意;
B.元素的非金属性越强,其相应的简单氢化物的稳定性就越强。由于元素的非金属性:O>S,所以简单氢化物的稳定性:Y>V,B不符合题意;
C.Na与O形成的Na2O2中含有非极性键;O与H形成的H2O2分子中也含有非极性键,C符合题意;
D.Al与Na的最高价氧化物的水化物分别为Al(OH)3、NaOH,Al(OH)3是两性氢氧化物,能够与强碱NaOH溶液发生反应生成偏铝酸钠和水,D不符合题意;
故答案为:C。
【分析】根据给出的信息结合分析可知,V为S,W为Al,X为Na,Y为O,Z为H元素,结合选项进行判断即可
8.【答案】B
【解析】【解答】A.NH3是含有共价键的分子晶体;NH4Cl含有共价键和离子键,是离子晶体,A不合题意;
B.HCl和H2O均为只含有共价键的分子晶体,B符合题意;
C.KCl为只含离子键的离子晶体,CCl4为只含共价键的分子晶体,C不合题意;
D.CO2为只含共价键的分子晶体,SiO2为只含共价键的原子晶体,D不合题意;
故答案为:B。
【分析】常见的化学键主要是离子键和共价键,晶体类型主要是分子晶体、离子晶体、原子晶体
离子化学物一定含有离子键,可能含有共价键,属于离子晶体
共价化学物中一定含有共价键,可能是分子晶体,或者是原子晶体
氨气、氯化氢、水、四氯化碳、二氧化碳具有共价键且是分子晶体,氯化钾具有离子键且为离自晶体,氯化铵含有共价键和离子键属于离子化合物,二氧化硅具有共价键是原子晶体
9.【答案】D
【解析】【解答】A.H、C、O、Ca四种元素可以形成离子化合物:Ca(HC2O4)2和Ca(HCO3)2,A不符合题意;
B.200~400℃阶段该化合物的质量保留百分数不变,不发生质量减少,B不符合题意;
C.当温度为400℃时,质量保留百分比为87.67%,相对分子质量为,失去了一个结晶水,此时剩余固体为CaC2O4;当温度为600℃时,质量保留百分比为68.49%,相对分子质量为,剩余固体为CaCO3,对比可知失去了CO,碳元素化合价发生了变化,是氧化还原反应,C不符合题意;
D.当温度接近1000℃时,质量保留百分比为38.36%,相对分子质量为,剩余固体为CaO,是碱性氧化物,D符合题意;
故答案为:D。
【分析】A.草酸氢盐和碳酸氢盐均为 离子化合物 ;
B. 依据热重分析曲线,质量保留百分数不变;
C.利用氧化还原反应中有元素化合价发生变化判断;
D.碱性氧化物指的是能与酸反应生成盐和水的氧化物。
10.【答案】D
【解析】【解答】解:①碘升华,为物理变化,只破坏分子间作用力,故不选;②溴蒸气被木炭吸附,为物理变化,只破坏分子间作用力,故不选;③酒精溶于水,不发生电离,为物理变化,只破坏分子间作用力,故不选;④HCl气体溶于水,H﹣Cl共价键断裂,发生电离,故选;⑤冰融化,为物理变化,只破坏分子间作用力,故不选;⑥NH4Cl分解生成氨气和HCl,离子键、共价键均破坏,故选;⑦氢氧化钠熔化,发生电离生成钠离子和氢氧根离子,只破坏离子键,故不选;⑧(NH4)2SO4溶于水,发生电离生成铵根离子和硫酸根离子,只破坏离子键,故不选;故选D.
【分析】一般来说,非金属之间形成共价键,化学变化中、电离均破坏化学键,以此来解答.
11.【答案】D
【解析】【解答】A.共价化合物中只含共价键,一定不含离子键,故A不符合题意;
B.非金属原子间也可以形成离子键,如NH4Cl等铵盐,故B不符合题意;
C.稀有气体是单原子分子,只存在分子间作用力,不存在化学键,故C不符合题意;
D.双原子单质分子中的两个原子间的共用电子不偏向任何一方,所以形成非极性键,故D符合题意。
故答案为:D。
【分析】A.在共价化合物中,不可能含有离子键,因为含有离子键的化合物就是离子化合物,而共价化合物中只有共价键;
B.离子化合物中既可能含有金属元素也可能含有非金属元素;
D.离子键通过两个或多个原子或化学集团失去或获得电子而成为离子后形成的;共价键是原子之间通过共用电子对形成的化学键。
12.【答案】C
【解析】【解答】A.干冰和液氯都是分子晶体,分子晶体气化时需克服分子间作用力,选项正确,A不符合题意;
B.NaHSO4晶体溶于水电离产生Na+、H+和SO42-,因此需克服离子键和共价键,选项正确,B不符合题意;
C.NH3中H不可能形成8电子结构,选项错误,C符合题意;
D.石墨转化为金刚石的过程中,有新物质生成,因此有化学键的断裂和形成,选项正确,D不符合题意;
故答案为:C
【分析】】A.分子晶体气化时克服分子间作用力;
B.结合NaHSO4在水中的电离分析;
C.H不可能满足8电子结构;
D.结合物质的转化分析;
13.【答案】D
【解析】【解答】解:A.二氧化碳中含共价键,MgO中含离子键,故A不选;
B.过氧化钠中含离子键和O﹣O非极性键,NaOH中含离子键和O﹣H极性键,故B不选;
C.BF3含共价键,NH4NO3含离子键和共价键,故C不选;
D.均只含极性共价键,故D选;
故选D.
【分析】一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答.
14.【答案】D
【解析】【解答】解:①含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,如KOH,故正确;
②只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,故错误;
③含金属元素的化合物不一定是离子化合物,可能是共价化合物,如氯化铝,故正确;
④由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物,如铵盐,故错误;
⑤由分子组成的物质中不一定存在共价键,如稀有气体,故错误;
⑥离子化合物在熔融状态下能电离出阴阳离子,含有自由移动离子的化合物能导电,所以离子化合物在熔融状态下能导电,故正确;
故选D.
【分析】①含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
②只含共价键的化合物是共价化合物;
③含金属元素的化合物不一定是离子化合物,可能是共价化合物;
④由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物;
⑤由分子组成的物质中不一定存在共价键;
⑥离子化合物在熔融状态下能电离出阴阳离子,含有自由移动离子的化合物能导电.
15.【答案】C
【解析】【解答】解:A.水分子中H原子和O原子之间只存在极性共价键,故A错误;
B.二氧化碳分子中C原子和O原子之间只存在极性共价键,故B错误;
C.氯化镁中镁离子和氯离子之间只存在离子键,故C正确;
D.KOH中钾离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,所以含有离子键和共价键,故D错误;
故选C.
【分析】一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间也形成离子键,据此分析解答.
16.【答案】(1)第二周期VIIA族
(2)离子键和极性共价键;离子
(3)NH3;r(S2-)>r(Cl-)>r(O2-)>r(Al3+)
(4)
(5)Al(OH)3+3OH-=AlO +2H2O;160
【解析】【解答】解:(1)在这10种元素中,非金属性最强的是F,位于周期表的第二周期ⅦA族。
(2)由a、d、f三种元素形成的化合物为NaOH,其中含有离子键和共价键;含有离子键的化合物为离子化合物。
(3)元素b、c分别为C、N,由于非金属性N>C,非金属性越强,则其简单氢化物的稳定性越强,所以简单气态氢化物中较稳定的是NH3。d、h、i、j的简单离子分别为O2-、Al3+、S2-、Cl-;S2-、Cl-的电子层数大于O2-、Al3+,因此其半径较大。电子层结构相同,核电荷数越大,离子半径越小。所以离子半径r(S2-)>r(Cl-)>r(O2-)>r(Al3+)。
(4)c2为N2,氮原子通过三对共用电子对形成共价键,用电子式表示其形成过程为。
(5)①滴加NaOH溶液的过程中形成的沉淀为Mg(OH)2、Al(OH)3;继续滴加NaOH溶液,沉淀逐渐溶解,能与NaOH反应的沉淀为Al(OH)3沉淀,该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
②反应生成的Mg(OH)2沉淀的质量为11.6g,其物质的量;反应生成Al(OH)3沉淀的质量为19.4g-11.6g=7.8g,其物质的量。因此生成Mg(OH)2、Al(OH)3沉淀所消耗n(NaOH)=0.2mol×2+0.1mol×3=0.7mol,则所需NaOH溶液的体积,所以b=140mL+20mL=160mL。
【分析】(1)非金属性最强的是F。
(2)a、d、f三种元素形成的化合物为NaOH。
(3)非金属性越强,其简单氢化物的稳定性越强。电子层数越大,离子半径越大;电子层结构相同,核电荷数越大,离子半径越小。
(4)c2的化学式为N2,其中所含的化学键为共价键。
(5)①能与NaOH反应的沉淀为Al(OH)3,Al(OH)3与NaOH反应生成可溶性NaAlO2和H2O。
②19.4g沉淀为Mg(OH)2、Al(OH)3,加入NaOH溶液后剩余的11.6g沉淀为Mg(OH)2,因此Al(OH)3沉淀的质量为19.4g-11.6g=7.8g。结合Mg(OH)2、Al(OH)3的物质的量计算消耗n(NaOH),进而计算所需NaOH溶液的体积。
17.【答案】(1)⑥
(2)④
(3)①
(4)⑦
(5)⑤
(6)③
(7)②
(8)④⑤
【解析】【解答】解:(1)氟化镁是由阴阳离子构成的,所以氟化镁中只含离子键,故答案为:⑥;(2)HCl只由极性键构成的物质,故答案为:④;(3)Cl2中只有氯氯非极性键构成的物质是①,故答案为:①;(4)离子化合物NH4Cl只有非金属元素组成的离子化合物,故答案为:⑦;(5)H2O2由氢氧极性键和氧氧非极性键构成的物质,故答案为:⑤;(6)NaOH由钠离子和氢氧根离子形成离子键和氧和氢形成的极性键构成的物质,故答案为:③;(7)Na2O2由钠离子和过氧根离子形成的离子键和氧氧形成的非极性键构成的物质,故答案为:②;(8)HCl和H2O2属于共价化合物的物质,故答案为:④⑤.
【分析】一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性键;含有离子键的化合物属于离子化合物,只含有共价键的化合物属于共价化合物,据此分析解答.
18.【答案】(1)①⑤;②③
(2)④;②③⑥
(3);Na+[:H]﹣;;;
【解析】【解答】解:(1)①碘的升华属于物理变化,只是状态发生变化,没有化学键的破坏;②烧碱熔化中存在离子键,融化烧碱时,阴阳离子间的化学键被破坏,所以破坏的是离子键;③氯化钠溶于水,在水分子的作用下,氯化钠中的离子键被破坏,所以破坏的是离子键;④氯化氢溶于水,在水分子的作用下,氯化氢中的共价键被破坏,所以破坏的是共价键;⑤氧气溶于水,属于物理变化,没有发生电离,没有化学键的破坏;⑥氯化铵受热分解,氯化铵是离子化合物,存在的化学键有离子键、共价键,受热分解时,阴阳离子间的化学键、及铵根离子中的共价键被破坏,所以所以破坏的是离子键、共价键;
未发生化学键破坏的是①⑤;仅发生离子键破坏的是②③;
故答案为:①⑤;②③;(2)只含有共价键的化合物属于共价化合物,所以属于共价化合物的是④,含有离子键的化合物属于离子化合物,属于离子化合物的是②③⑥;
故答案为:④;②③⑥;(3)As原子最外层有5个电子,电子式为 ;
NaH是离子化合物,由Na+和H﹣离子组成,电子式为Na+[:H]﹣;
CsOH是由铯离子和氢氧根离子构成的离子化合物,氢氧根离子中O与H以共价键相结合,其电子式为 ;
HSCN是共价化合物,其电子式为 ;
O22﹣中,氧原子之间形成的是非极性共价单键,并且有1对共用电子,电子式为 ;
故答案为: ;Na+[:H]﹣; ; ; .
【分析】(1)根据是否发生化学反应判断化学键是否被破坏,根据物质中存在的化学键判断破坏的化学键类型;(2)只含有共价键的化合物属于共价化合物,含有离子键的化合物属于离子化合物;(3)首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构;
19.【答案】(1)
(2)1s22s22p63s23p64s1
(3);含;不含
(4)离子键、极性共价键
【解析】【解答】B元素是地壳中含量最高的元素,B为O元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的 1/2 ;可推出A为H,C为Na,D为S;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个,可推出E为Cl元素;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族,可推出F为K元素;
(1)C和E形成化合物是NaCl,故答案为:第1空、
(2)基态F原子是K,故答案为:第1空、1s22s22p63s23p64s1
(3)A2D的电子式为 H2S,有共价单键,不含π键;故答案为:
第1空、
第2空、含
第3空、不含
(4)化合物是NaOH,为离子化合物,故答案为:第1空、离子键、极性共价键
【分析】地壳中含量最高的元素是O元素;氢和钠的价电子数相同,氧和硫的价电子数也相同,氢和钠两元素原子核外电子数之和是氧、硫两元素原子核内质子数之和的 1/2 ;钠、硫、氯三种元素的基态原子具有相同的电子层数,氯原子的p轨道上电子比硫原子的p轨道上电子多1个;钾原子的电子层数最多,和钠处于同一主族;
(1)形成氯化钠化合物的过程是,
(2)基态K原子的核外电子排布式为1s22s22p63s23p64s1,
(3) H2S电子式为,有共价单键,不含π键;
(4)NaOH是属于离子化合物,里面存在离子键和极性共价键。
20.【答案】(1)①
(2)⑤
(3)⑥
(4)④
(5)②
(6)③
【解析】【解答】解:①氯化钠只含离子键,为离子化合物;②氢氧化钠含离子键和O﹣H极性共价键,为离子化合物;③氯化铵含离子键和N﹣H极性键,为离子化合物;④过氧化钠含离子键和O﹣O非极性键,为离子化合物;⑤溴化氢只含H﹣Br极性共价键;⑥氯气只含Cl﹣Cl非极性键,则(1)只含有离子键的是①,故答案为:①;(2)只含极性共价键的是⑤,故答案为:⑤;(3)只含非极性共价键的是⑥,故答案为:⑥;(4)既含离子键又含非极性共价键的是④,故答案为:④;(5)既含离子键又含极性共价键的是②,故答案为:②;(6)由非金属元素组成的离子化合物的是③,故答案为:③.
【分析】一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,同种非金属形成非极性键,不同非金属形成极性键,以此来解答.
一、单选题
1.下列含有共价键的离子化合物是( )
A.NaCl B.MgCl2 C.HCl D.NaOH
2.下列物质中只含共价键的是( )
A.HCl B.NaOH C.NH4Cl D.CH3COONa
3.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.2Na2O2+2H2O→4NaOH+O2↑
B.CaH2 +2H2O→Ca(OH) 2 +2H2↑
C.Mg3N2 +6H2O→3Mg(OH)2 ↓+2NH3↑
D.NH4Cl+NaOH NaCl+NH3↑ +H2O
4.下列物质中属于含有共价健的离子化合物的是( )
A. B. C. D.
5.下列物质中,含有共价键的是( )
A.K B.CaO
C.CO2 D.NaCl
6.下列物质中,属于只含有离子键的离子化合物的是( )
A.CO2 B.Ca(OH)2 C.HF D.Na2O
7.V、W、X、Y、Z为五种短周期主族元素。其中W、Y、Z分别位于三个不同周期,V、Y位于同一主族;Y原子的最外层电子数是W原子的最外层电子数的2倍;W、X、Y三种简单离子的核外电子排布相同。由W、X、Y、Z形成的某种化合物的结构如图所示。下列说法正确的是( )
A.简单离子半径:r(X)<r(W)<r(Y)<r(V)
B.简单氢化物的稳定性:Y<V
C.X与Y、Y与Z均可形成含非极性键的化合物
D.W与X两者的最高价氧化物的水化物不能发生反应
8.下列各组物质的晶体中,化学键类型和晶体类型均相同的是( )
A.NH3和NH4Cl B.HCl和H2O C.KCl和CCl4 D.CO2和SiO2
9.化合物()中的四种元素X、Y、Z、W为前20号元素,且原子序数依次增大,Y和Z位于同周期的不同主族,W最高价氧化物对应的水化物的溶液是检验气体的常用试剂,该化合物的热重分析曲线如图所示。下列说法正确的是( )
A.X、Y、Z、W四种元素只能形成一种离子化合物
B.200~400℃阶段热分解将失去1个
C.400~600℃热分解后生成的固体化合物是,且该反应为非氧化还原反应
D.该反应过程最终分解得到的固体产物属于碱性氧化物
10.下列过程中,共价键被破坏的是
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl分解⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.( )
A.①④⑥⑦ B.④⑥⑧ C.①②④⑤ D.④⑥
11.下列说法正确的是( )
A.共价化合物中可能含有离子键
B.非金属原子不可能形成离子化合物
C.不存在没有化学键的分子
D.双原子单质分子中的共价键一定是非极性键
12.下列说法不正确的是( )
A.干冰升华和液氯气化时,都只需克服分子间作用力
B.硫酸氢钠晶体溶于水,需要克服离子键和共价键
C.NH3和NCl3中,每个原子的最外层都具有8电子稳定结构
D.石墨转化为金刚石时,既有共价键的断裂,又有共价键的形成
13.下列化合物中,化学键的类型完全相同的是( )
A.CO2和MgO B.Na2O2和NaOH C.BF3和NH4NO3 D.HCl和H2O
14.下列说法正确的是( )
①离子化合物一定含离子键,也可能含共价键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥离子化合物在熔融状态下能导电.
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
15.下列物质中,只含有离子键的是( )
A.H2O B.CO2 C.MgCl2 D.KOH
二、综合题
16.153年前门捷列夫制得世界上第一张元素周期表,它反映了元素之间的内在联系,是对元素的一种很好的自然分类。如图为现代元素周期表的一部分,请回答下列问题:(以下问题均用相应的化学用语表达)
(1)在这10种元素中,非金属性最强的元素在周期表中的位置是 。
(2)由a、d、f三种元素形成的化合物含有的化学键有 (填写化学键类型),属于 化合物。
(3)元素b、c形成的简单气态氢化物中较稳定的是 ;d、h、i、j的简单离子半径由大到小的顺序排列为 。
(4)用电子式表示c2的形成过程 。
(5)在含有a、g、h简单阳离子的100mL溶液中,逐滴滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:
①沉淀减少时发生的离子方程式: 。
②a点的数值为: mL。
17.现有下列物质:①Cl2②Na2O2③NaOH④HCl⑤H2O2⑥MgF2⑦NH4Cl
(1)只由离子键构成的物质是 (填序号,下同).
(2)只由极性键构成的物质是 .
(3)只由非极性键构成的物质是 .
(4)只由非金属元素组成的离子化合物是 .
(5)由极性键和非极性键构成的物质是 .
(6)由离子键和极性键构成的物质是 .
(7)由离子键和非极性键构成的物质是 .
(8)属于共价化合物的物质是 .
18.根据问题填空:
(1)下列变化 (填序号)①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氧气溶于水⑥氯化铵受热分解.
未发生化学键破坏的是 ;仅发生离子键破坏的是 ;
(2)若上述物质都为纯净物时,属于共价化合物的是 ;属于离子化合物的是 ;
(3)写出下列物质的电子式
As NaH CsOH HSCN O22﹣ .
19.现有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知B元素是地壳中含量最高的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。
回答下列问题:
(1)用电子式表示C和E形成化合物的过程: 。
(2)写出基态F原子的核外电子排布式: 。
(3)A2D的电子式为 ,其分子中 (填“含”或“不含”,下同)键, π键。
(4)A、B、C共同形成的化合物中化学键的类型有 。
20.下列物质①氯化钠②氢氧化钠③氯化铵④过氧化钠⑤溴化氢⑥氯气
(1)只含有离子键的是
(2)只含极性共价键的是
(3)只含非极性共价键的是
(4)既含离子键又含非极性共价键的是
(5)既含离子键又含极性共价键的是
(6)由非金属元素组成的离子化合物的是 .
答案解析部分
1.【答案】D
【解析】【解答】A.NaCl是离子化合物,Na+与Cl-之间以离子键结合,不存在共价键,A不符合题意;
B.MgCl2是离子化合物,Mg2+与Cl-之间以离子键结合,不存在共价键,B不符合题意;
C.HCl是共价化合物,H原子与Cl原子之间以极性共价键H-Cl结合,无离子键,C不符合题意;
D.NaOH是离子化合物,Na+与OH-之间以离子键结合,在OH-中H、O原子之间以极性共价键H-O结合,是含有共价键的离子化合物,D符合题意;
故答案为:D。
【分析】 NaCl、MgCl2只含离子键,HCl只含共价键,NaOH中Na+与OH-之间以离子键结合,OH-中含有O-H共价键。
2.【答案】A
【解析】【解答】A、HCl分子中只有共价键,故A符合题意;
B、NaOH中除了共价键,还有离子键,故B不符合题意;
C、NH4Cl中除了共价键,还有离子键,故C不符合题意;
D. CH3COONa中除了共价键,还有离子键,故D不符合题意;
故答案为:A。
【分析】离子化合物主要有,碱,盐(除氯化铝和氯化铍)金属氧化物,金属氰化物。共价化合物主要有酸,非金属氧化物,非金属氢化物,氯化铝和氯化铍。离子化合物中一定含离子键,也可以含共价键,共价化合物中一定只含共价键。
3.【答案】A
【解析】【解答】A.2Na2O2+2H2O=4NaOH+O2↑中有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成,故A符合题意;
B. CaH2 +2H2O→Ca(OH) 2 +2H2↑中不存在非极性键的断裂,故B不符合题意;
C.Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑中有离子键、极性键的断裂,又有离子键、极性键的形成,故C不符合题意;
D.NH4Cl+NaOH═NaCl+NH3↑+H2O中有离子键、极性键的断裂,又有离子键、极性键的形成,故D不符合题意;
故答案为:A。
【分析】离子键指的是由阴阳离子通过静电作用形成的化学键;
极性键指的是不同的原子提供共用电子对形成的共价键;
非极性键指的是相同的原子通过共用电子对形成的共价键。
4.【答案】B
【解析】【解答】A. 只含有极性键,故A不选;
B. 中含有离子键和极性键,故B选;
C. 只含有离子键,故C不选;
D. 只含有极性键,故D不选;
故答案为:B。
【分析】铵根离子或金属离子与非金属离子或酸根离子的结合是离子键,非金属原子和非金属原子的结合是共价键,含有离子键的化合物为离子化合物,只含共价键的化合物为共价化合物。
5.【答案】C
【解析】【解答】A.K含有金属键,故A不符合题意;
B.CaO只含离子键,故B不符合题意;
C.CO2只含有共价键,故C符合题意;
D.NaCl只含离子键,故D不符合题意。
【分析】活泼金属与非活泼金属形成离子键,非金属之间形成共价键,即可得出本题答案
6.【答案】D
【解析】【解答】A.CO2为共价化合物,只含有共价键,A不符合题意;
B.Ca(OH)2,既含有离子键又含有共价键,B不符合题意;
C.HF为共价化合物,只含有共价键,C不符合题意;
D.Na2O只含有离子键,D符合题意;
故答案为:D。
【分析】离子化合物一定含有离子键,可能含有共价键,找出不含有共价键的离子化合物即可
7.【答案】C
【解析】【解答】
A.离子核外电子层数越大离子半径越大;当离子核外电子层相同时,离子的核电荷数越大离子半径越小,则简单离子半径:r(W)<r(X)<r(Y)<r(V),A不符合题意;
B.元素的非金属性越强,其相应的简单氢化物的稳定性就越强。由于元素的非金属性:O>S,所以简单氢化物的稳定性:Y>V,B不符合题意;
C.Na与O形成的Na2O2中含有非极性键;O与H形成的H2O2分子中也含有非极性键,C符合题意;
D.Al与Na的最高价氧化物的水化物分别为Al(OH)3、NaOH,Al(OH)3是两性氢氧化物,能够与强碱NaOH溶液发生反应生成偏铝酸钠和水,D不符合题意;
故答案为:C。
【分析】根据给出的信息结合分析可知,V为S,W为Al,X为Na,Y为O,Z为H元素,结合选项进行判断即可
8.【答案】B
【解析】【解答】A.NH3是含有共价键的分子晶体;NH4Cl含有共价键和离子键,是离子晶体,A不合题意;
B.HCl和H2O均为只含有共价键的分子晶体,B符合题意;
C.KCl为只含离子键的离子晶体,CCl4为只含共价键的分子晶体,C不合题意;
D.CO2为只含共价键的分子晶体,SiO2为只含共价键的原子晶体,D不合题意;
故答案为:B。
【分析】常见的化学键主要是离子键和共价键,晶体类型主要是分子晶体、离子晶体、原子晶体
离子化学物一定含有离子键,可能含有共价键,属于离子晶体
共价化学物中一定含有共价键,可能是分子晶体,或者是原子晶体
氨气、氯化氢、水、四氯化碳、二氧化碳具有共价键且是分子晶体,氯化钾具有离子键且为离自晶体,氯化铵含有共价键和离子键属于离子化合物,二氧化硅具有共价键是原子晶体
9.【答案】D
【解析】【解答】A.H、C、O、Ca四种元素可以形成离子化合物:Ca(HC2O4)2和Ca(HCO3)2,A不符合题意;
B.200~400℃阶段该化合物的质量保留百分数不变,不发生质量减少,B不符合题意;
C.当温度为400℃时,质量保留百分比为87.67%,相对分子质量为,失去了一个结晶水,此时剩余固体为CaC2O4;当温度为600℃时,质量保留百分比为68.49%,相对分子质量为,剩余固体为CaCO3,对比可知失去了CO,碳元素化合价发生了变化,是氧化还原反应,C不符合题意;
D.当温度接近1000℃时,质量保留百分比为38.36%,相对分子质量为,剩余固体为CaO,是碱性氧化物,D符合题意;
故答案为:D。
【分析】A.草酸氢盐和碳酸氢盐均为 离子化合物 ;
B. 依据热重分析曲线,质量保留百分数不变;
C.利用氧化还原反应中有元素化合价发生变化判断;
D.碱性氧化物指的是能与酸反应生成盐和水的氧化物。
10.【答案】D
【解析】【解答】解:①碘升华,为物理变化,只破坏分子间作用力,故不选;②溴蒸气被木炭吸附,为物理变化,只破坏分子间作用力,故不选;③酒精溶于水,不发生电离,为物理变化,只破坏分子间作用力,故不选;④HCl气体溶于水,H﹣Cl共价键断裂,发生电离,故选;⑤冰融化,为物理变化,只破坏分子间作用力,故不选;⑥NH4Cl分解生成氨气和HCl,离子键、共价键均破坏,故选;⑦氢氧化钠熔化,发生电离生成钠离子和氢氧根离子,只破坏离子键,故不选;⑧(NH4)2SO4溶于水,发生电离生成铵根离子和硫酸根离子,只破坏离子键,故不选;故选D.
【分析】一般来说,非金属之间形成共价键,化学变化中、电离均破坏化学键,以此来解答.
11.【答案】D
【解析】【解答】A.共价化合物中只含共价键,一定不含离子键,故A不符合题意;
B.非金属原子间也可以形成离子键,如NH4Cl等铵盐,故B不符合题意;
C.稀有气体是单原子分子,只存在分子间作用力,不存在化学键,故C不符合题意;
D.双原子单质分子中的两个原子间的共用电子不偏向任何一方,所以形成非极性键,故D符合题意。
故答案为:D。
【分析】A.在共价化合物中,不可能含有离子键,因为含有离子键的化合物就是离子化合物,而共价化合物中只有共价键;
B.离子化合物中既可能含有金属元素也可能含有非金属元素;
D.离子键通过两个或多个原子或化学集团失去或获得电子而成为离子后形成的;共价键是原子之间通过共用电子对形成的化学键。
12.【答案】C
【解析】【解答】A.干冰和液氯都是分子晶体,分子晶体气化时需克服分子间作用力,选项正确,A不符合题意;
B.NaHSO4晶体溶于水电离产生Na+、H+和SO42-,因此需克服离子键和共价键,选项正确,B不符合题意;
C.NH3中H不可能形成8电子结构,选项错误,C符合题意;
D.石墨转化为金刚石的过程中,有新物质生成,因此有化学键的断裂和形成,选项正确,D不符合题意;
故答案为:C
【分析】】A.分子晶体气化时克服分子间作用力;
B.结合NaHSO4在水中的电离分析;
C.H不可能满足8电子结构;
D.结合物质的转化分析;
13.【答案】D
【解析】【解答】解:A.二氧化碳中含共价键,MgO中含离子键,故A不选;
B.过氧化钠中含离子键和O﹣O非极性键,NaOH中含离子键和O﹣H极性键,故B不选;
C.BF3含共价键,NH4NO3含离子键和共价键,故C不选;
D.均只含极性共价键,故D选;
故选D.
【分析】一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答.
14.【答案】D
【解析】【解答】解:①含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,如KOH,故正确;
②只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,故错误;
③含金属元素的化合物不一定是离子化合物,可能是共价化合物,如氯化铝,故正确;
④由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物,如铵盐,故错误;
⑤由分子组成的物质中不一定存在共价键,如稀有气体,故错误;
⑥离子化合物在熔融状态下能电离出阴阳离子,含有自由移动离子的化合物能导电,所以离子化合物在熔融状态下能导电,故正确;
故选D.
【分析】①含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
②只含共价键的化合物是共价化合物;
③含金属元素的化合物不一定是离子化合物,可能是共价化合物;
④由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物;
⑤由分子组成的物质中不一定存在共价键;
⑥离子化合物在熔融状态下能电离出阴阳离子,含有自由移动离子的化合物能导电.
15.【答案】C
【解析】【解答】解:A.水分子中H原子和O原子之间只存在极性共价键,故A错误;
B.二氧化碳分子中C原子和O原子之间只存在极性共价键,故B错误;
C.氯化镁中镁离子和氯离子之间只存在离子键,故C正确;
D.KOH中钾离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,所以含有离子键和共价键,故D错误;
故选C.
【分析】一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间也形成离子键,据此分析解答.
16.【答案】(1)第二周期VIIA族
(2)离子键和极性共价键;离子
(3)NH3;r(S2-)>r(Cl-)>r(O2-)>r(Al3+)
(4)
(5)Al(OH)3+3OH-=AlO +2H2O;160
【解析】【解答】解:(1)在这10种元素中,非金属性最强的是F,位于周期表的第二周期ⅦA族。
(2)由a、d、f三种元素形成的化合物为NaOH,其中含有离子键和共价键;含有离子键的化合物为离子化合物。
(3)元素b、c分别为C、N,由于非金属性N>C,非金属性越强,则其简单氢化物的稳定性越强,所以简单气态氢化物中较稳定的是NH3。d、h、i、j的简单离子分别为O2-、Al3+、S2-、Cl-;S2-、Cl-的电子层数大于O2-、Al3+,因此其半径较大。电子层结构相同,核电荷数越大,离子半径越小。所以离子半径r(S2-)>r(Cl-)>r(O2-)>r(Al3+)。
(4)c2为N2,氮原子通过三对共用电子对形成共价键,用电子式表示其形成过程为。
(5)①滴加NaOH溶液的过程中形成的沉淀为Mg(OH)2、Al(OH)3;继续滴加NaOH溶液,沉淀逐渐溶解,能与NaOH反应的沉淀为Al(OH)3沉淀,该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
②反应生成的Mg(OH)2沉淀的质量为11.6g,其物质的量;反应生成Al(OH)3沉淀的质量为19.4g-11.6g=7.8g,其物质的量。因此生成Mg(OH)2、Al(OH)3沉淀所消耗n(NaOH)=0.2mol×2+0.1mol×3=0.7mol,则所需NaOH溶液的体积,所以b=140mL+20mL=160mL。
【分析】(1)非金属性最强的是F。
(2)a、d、f三种元素形成的化合物为NaOH。
(3)非金属性越强,其简单氢化物的稳定性越强。电子层数越大,离子半径越大;电子层结构相同,核电荷数越大,离子半径越小。
(4)c2的化学式为N2,其中所含的化学键为共价键。
(5)①能与NaOH反应的沉淀为Al(OH)3,Al(OH)3与NaOH反应生成可溶性NaAlO2和H2O。
②19.4g沉淀为Mg(OH)2、Al(OH)3,加入NaOH溶液后剩余的11.6g沉淀为Mg(OH)2,因此Al(OH)3沉淀的质量为19.4g-11.6g=7.8g。结合Mg(OH)2、Al(OH)3的物质的量计算消耗n(NaOH),进而计算所需NaOH溶液的体积。
17.【答案】(1)⑥
(2)④
(3)①
(4)⑦
(5)⑤
(6)③
(7)②
(8)④⑤
【解析】【解答】解:(1)氟化镁是由阴阳离子构成的,所以氟化镁中只含离子键,故答案为:⑥;(2)HCl只由极性键构成的物质,故答案为:④;(3)Cl2中只有氯氯非极性键构成的物质是①,故答案为:①;(4)离子化合物NH4Cl只有非金属元素组成的离子化合物,故答案为:⑦;(5)H2O2由氢氧极性键和氧氧非极性键构成的物质,故答案为:⑤;(6)NaOH由钠离子和氢氧根离子形成离子键和氧和氢形成的极性键构成的物质,故答案为:③;(7)Na2O2由钠离子和过氧根离子形成的离子键和氧氧形成的非极性键构成的物质,故答案为:②;(8)HCl和H2O2属于共价化合物的物质,故答案为:④⑤.
【分析】一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性键;含有离子键的化合物属于离子化合物,只含有共价键的化合物属于共价化合物,据此分析解答.
18.【答案】(1)①⑤;②③
(2)④;②③⑥
(3);Na+[:H]﹣;;;
【解析】【解答】解:(1)①碘的升华属于物理变化,只是状态发生变化,没有化学键的破坏;②烧碱熔化中存在离子键,融化烧碱时,阴阳离子间的化学键被破坏,所以破坏的是离子键;③氯化钠溶于水,在水分子的作用下,氯化钠中的离子键被破坏,所以破坏的是离子键;④氯化氢溶于水,在水分子的作用下,氯化氢中的共价键被破坏,所以破坏的是共价键;⑤氧气溶于水,属于物理变化,没有发生电离,没有化学键的破坏;⑥氯化铵受热分解,氯化铵是离子化合物,存在的化学键有离子键、共价键,受热分解时,阴阳离子间的化学键、及铵根离子中的共价键被破坏,所以所以破坏的是离子键、共价键;
未发生化学键破坏的是①⑤;仅发生离子键破坏的是②③;
故答案为:①⑤;②③;(2)只含有共价键的化合物属于共价化合物,所以属于共价化合物的是④,含有离子键的化合物属于离子化合物,属于离子化合物的是②③⑥;
故答案为:④;②③⑥;(3)As原子最外层有5个电子,电子式为 ;
NaH是离子化合物,由Na+和H﹣离子组成,电子式为Na+[:H]﹣;
CsOH是由铯离子和氢氧根离子构成的离子化合物,氢氧根离子中O与H以共价键相结合,其电子式为 ;
HSCN是共价化合物,其电子式为 ;
O22﹣中,氧原子之间形成的是非极性共价单键,并且有1对共用电子,电子式为 ;
故答案为: ;Na+[:H]﹣; ; ; .
【分析】(1)根据是否发生化学反应判断化学键是否被破坏,根据物质中存在的化学键判断破坏的化学键类型;(2)只含有共价键的化合物属于共价化合物,含有离子键的化合物属于离子化合物;(3)首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构;
19.【答案】(1)
(2)1s22s22p63s23p64s1
(3);含;不含
(4)离子键、极性共价键
【解析】【解答】B元素是地壳中含量最高的元素,B为O元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的 1/2 ;可推出A为H,C为Na,D为S;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个,可推出E为Cl元素;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族,可推出F为K元素;
(1)C和E形成化合物是NaCl,故答案为:第1空、
(2)基态F原子是K,故答案为:第1空、1s22s22p63s23p64s1
(3)A2D的电子式为 H2S,有共价单键,不含π键;故答案为:
第1空、
第2空、含
第3空、不含
(4)化合物是NaOH,为离子化合物,故答案为:第1空、离子键、极性共价键
【分析】地壳中含量最高的元素是O元素;氢和钠的价电子数相同,氧和硫的价电子数也相同,氢和钠两元素原子核外电子数之和是氧、硫两元素原子核内质子数之和的 1/2 ;钠、硫、氯三种元素的基态原子具有相同的电子层数,氯原子的p轨道上电子比硫原子的p轨道上电子多1个;钾原子的电子层数最多,和钠处于同一主族;
(1)形成氯化钠化合物的过程是,
(2)基态K原子的核外电子排布式为1s22s22p63s23p64s1,
(3) H2S电子式为,有共价单键,不含π键;
(4)NaOH是属于离子化合物,里面存在离子键和极性共价键。
20.【答案】(1)①
(2)⑤
(3)⑥
(4)④
(5)②
(6)③
【解析】【解答】解:①氯化钠只含离子键,为离子化合物;②氢氧化钠含离子键和O﹣H极性共价键,为离子化合物;③氯化铵含离子键和N﹣H极性键,为离子化合物;④过氧化钠含离子键和O﹣O非极性键,为离子化合物;⑤溴化氢只含H﹣Br极性共价键;⑥氯气只含Cl﹣Cl非极性键,则(1)只含有离子键的是①,故答案为:①;(2)只含极性共价键的是⑤,故答案为:⑤;(3)只含非极性共价键的是⑥,故答案为:⑥;(4)既含离子键又含非极性共价键的是④,故答案为:④;(5)既含离子键又含极性共价键的是②,故答案为:②;(6)由非金属元素组成的离子化合物的是③,故答案为:③.
【分析】一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,同种非金属形成非极性键,不同非金属形成极性键,以此来解答.
