第四章化学反应与电能本单元复习与测试(含解析)2023--2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 第四章化学反应与电能本单元复习与测试(含解析)2023--2024学年上学期高二化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 773.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 11:23:18 | ||
图片预览


文档简介
第四章 化学反应与电能同步习题
一、单选题(共12题)
1.某新型锂离子可充电电池正极材料是含锂的二氧化钴(LiCoO2)。充电时LiCoO2被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中形成LiC6。下列说法正确的是
A.充电时,锂离子电池的负极发生氧化反应
B.放电时,锂离子电池的正极反应为CoO2+Li++e =LiCoO2
C.放电时,锂离子电池的正极的质量逐渐减小
D.充电时,C6极应与外接电源的正极相连
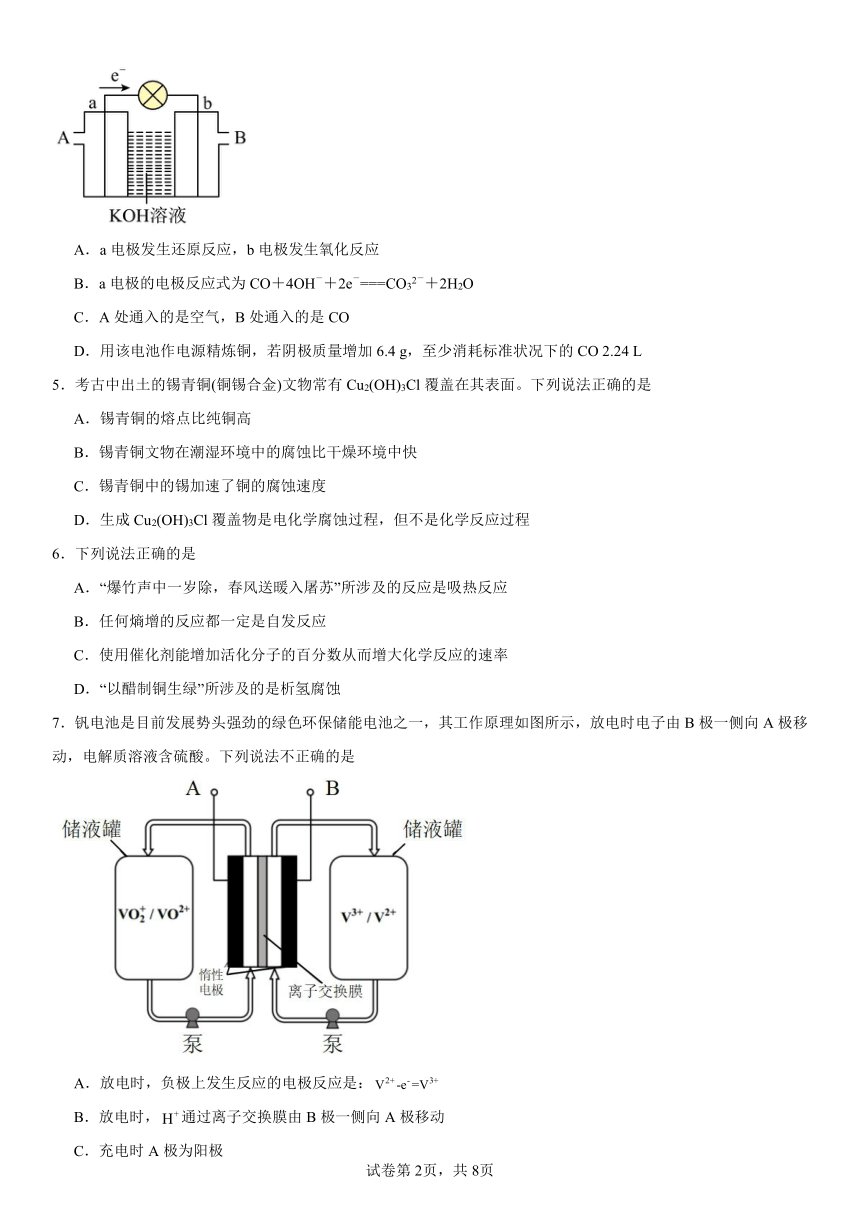
2.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法正确的是( )
A.该电池工作时电能转化为化学能
B.该电池中电极b是负极
C.外电路中电子由电极b通过导线流向电极a
D.该电池是绿色环保电池
3.海水淡化的方法有多种,如蒸馏法、电渗析法等。电渗析法是一种利用离子交换膜进行离子交换的方法,其原理如图所示。已知海水中含Na+、Cl—、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。下列叙述中正确的是
A.B膜是阴离子交换膜
B.通电后,海水中阳离子往a电极处运动
C.通电后,a电极的电极反应式为:4OH--4e-=O2↑+2H2O
D.通电后,b电极上产生无色气体,溶液中出现少量白色沉淀
4.如图是一氧化碳-空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中,正确的是( )
A.a电极发生还原反应,b电极发生氧化反应
B.a电极的电极反应式为CO+4OH-+2e-===CO32-+2H2O
C.A处通入的是空气,B处通入的是CO
D.用该电池作电源精炼铜,若阴极质量增加6.4 g,至少消耗标准状况下的CO 2.24 L
5.考古中出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
A.锡青铜的熔点比纯铜高
B.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
C.锡青铜中的锡加速了铜的腐蚀速度
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
6.下列说法正确的是
A.“爆竹声中一岁除,春风送暖入屠苏”所涉及的反应是吸热反应
B.任何熵增的反应都一定是自发反应
C.使用催化剂能增加活化分子的百分数从而增大化学反应的速率
D.“以醋制铜生绿”所涉及的是析氢腐蚀
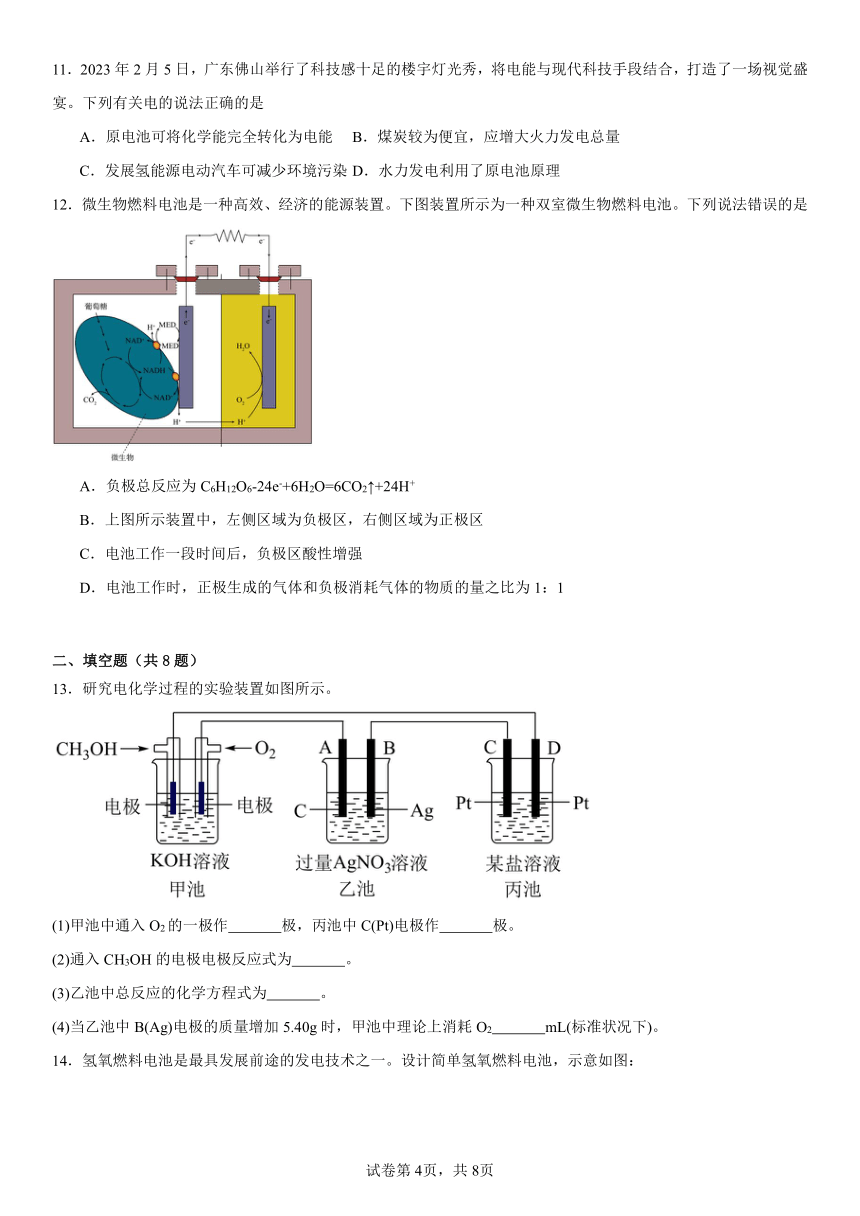
7.钒电池是目前发展势头强劲的绿色环保储能电池之一,其工作原理如图所示,放电时电子由B极一侧向A极移动,电解质溶液含硫酸。下列说法不正确的是
A.放电时,负极上发生反应的电极反应是:
B.放电时,通过离子交换膜由B极一侧向A极移动
C.充电时A极为阳极
D.充电时,电池总反应为:
8.甲、乙同学分别用如图所示装置验证铁的电化学防腐原理,相同时间后继续进行实验。
实验①:甲同学分别向Ⅰ、Ⅱ中Fe电极附近滴加K3[Fe(CN)6]溶液,Ⅰ中产生蓝色沉淀,Ⅱ中无沉淀。
实验②:乙同学分别取Ⅰ、Ⅱ中Fe电极附近溶液,滴加K3[Fe(CN)6]溶液,Ⅰ、Ⅱ中均无沉淀。
下列说法正确的是
A.Ⅰ是牺牲阳极保护法,正极反应式为
B.Ⅱ为外加电流阴极保护法,Fe电极与外接电源的正极相连
C.由实验①中Ⅰ、Ⅱ现象的差异,推测K3[Fe(CN)6]在Ⅰ中氧化性强于Ⅱ
D.由实验可知,两种保护法均能保护,且Ⅱ保护得更好
9.由于安全以及价格方面的优势,水系锌离子电池(ZiBs)被普遍认为是锂离子电池在大规模储能设备领域的替代品,其中一种电池工作原理如图所示。下列说法错误的是
A.工作时,移向CuI极
B.锌是负极,发生氧化反应
C.正极的电极反应式为CuI+e-=Cu+I-
D.工作时,电流流动方向:CuI→电灯泡→Zn→ZnSO4溶液→CuI
10.化学与人类生产、生活密切相关,下列说法错误的是
A.“暖宝宝”工作时将化学能转化为热能
B.在铁中添加一定量的镍制成的金属硬币不易被腐蚀
C.海轮船壳上镶入锌块,利用的防护方法是外接电流法
D.铜、铝电线连接起来使用易出现断电现象
11.2023年2月5日,广东佛山举行了科技感十足的楼宇灯光秀,将电能与现代科技手段结合,打造了一场视觉盛宴。下列有关电的说法正确的是
A.原电池可将化学能完全转化为电能 B.煤炭较为便宜,应增大火力发电总量
C.发展氢能源电动汽车可减少环境污染 D.水力发电利用了原电池原理
12.微生物燃料电池是一种高效、经济的能源装置。下图装置所示为一种双室微生物燃料电池。下列说法错误的是
A.负极总反应为C6H12O6-24e-+6H2O=6CO2↑+24H+
B.上图所示装置中,左侧区域为负极区,右侧区域为正极区
C.电池工作一段时间后,负极区酸性增强
D.电池工作时,正极生成的气体和负极消耗气体的物质的量之比为1:1
二、填空题(共8题)
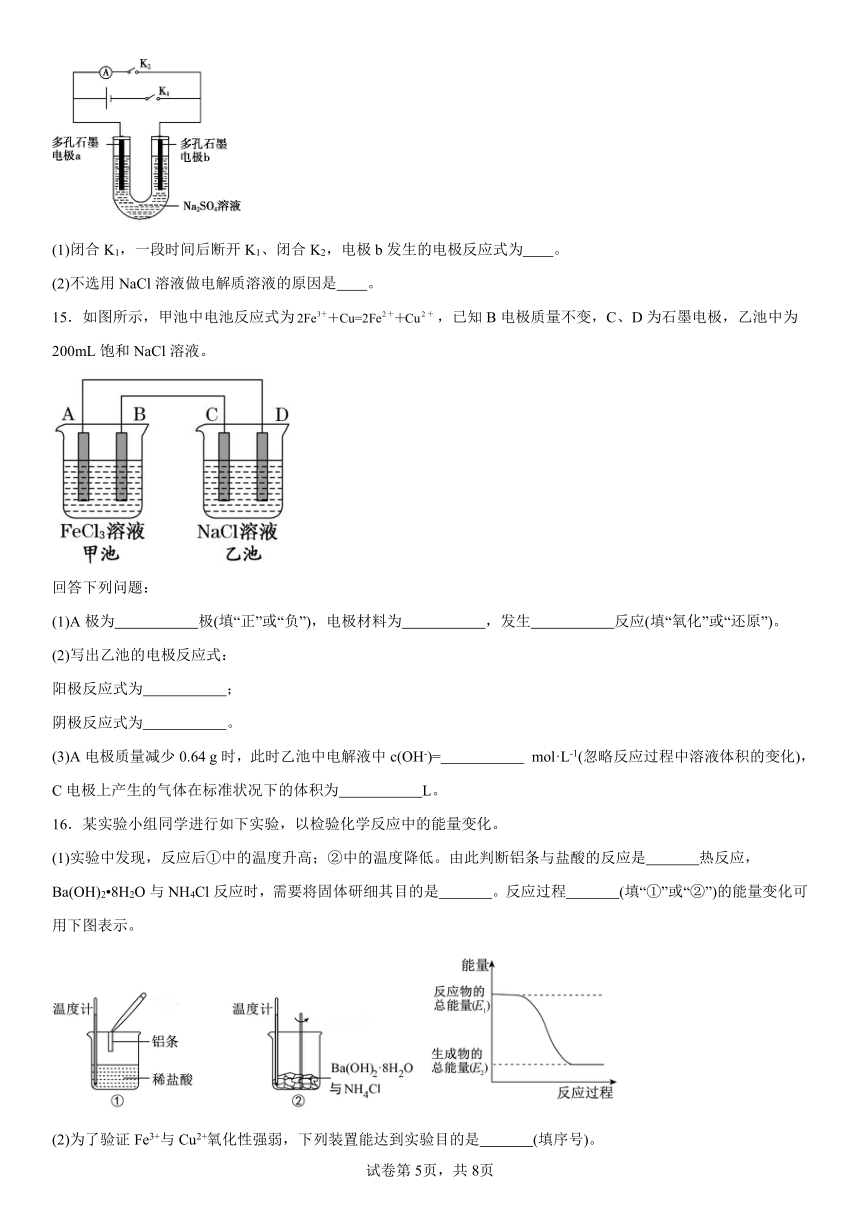
13.研究电化学过程的实验装置如图所示。
(1)甲池中通入O2的一极作 极,丙池中C(Pt)电极作 极。
(2)通入CH3OH的电极电极反应式为 。
(3)乙池中总反应的化学方程式为 。
(4)当乙池中B(Ag)电极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)。
14.氢氧燃料电池是最具发展前途的发电技术之一。设计简单氢氧燃料电池,示意如图:
(1)闭合K1,一段时间后断开K1、闭合K2,电极b发生的电极反应式为 。
(2)不选用NaCl溶液做电解质溶液的原因是 。
15.如图所示,甲池中电池反应式为,已知B电极质量不变,C、D为石墨电极,乙池中为200mL饱和NaCl溶液。
回答下列问题:
(1)A极为 极(填“正”或“负”),电极材料为 ,发生 反应(填“氧化”或“还原”)。
(2)写出乙池的电极反应式:
阳极反应式为 ;
阴极反应式为 。
(3)A电极质量减少0.64 g时,此时乙池中电解液中c(OH-)= mol·L-1(忽略反应过程中溶液体积的变化),C电极上产生的气体在标准状况下的体积为 L。
16.某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是 热反应,Ba(OH)2 8H2O与NH4Cl反应时,需要将固体研细其目的是 。反应过程 (填“①”或“②”)的能量变化可用下图表示。
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是 (填序号)。
(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中 (填A或B)处电极入口通甲烷,其电极反应式为 。
(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为 。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为 ;该原电池的负极反应式为 。
17.利用烧结的铁碳混合材料可除去废水中的污染物,在有、无溶解氧的情况下均可在溶液中生成絮凝剂,实现高效工作,其作用原理图示如下:
请回答:
(1)写出铁电极上电极方程式 。
(2)下列叙述正确的是。
A.铁电极为正极,碳电极为负极
B.经过加热烧结的铁碳混合物表面空隙发达,吸附能力大幅提高,有利除污
C.碳电极上的反应环境为无溶解氧环境
D.铁碳混合材料工作过程中电子从铁电极流出,被絮凝剂运输至碳电极表面
(3)有溶解氧时絮凝过程是利用了铁离子水解产物吸附污染物完成截流,写出相关的离子方程式 。
(4)无溶解氧时,可以利用生成的絮凝剂处理含铬废水,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为 (以铬元素的量计算)。
18.从H+、Cu2+、Na+、SO、Cl-五种离子中选择并恰当地组成电解质,按下列要求进行电解:
(1)以石墨为电极,使电解质质量减少,水质量不变,进行电解,则可采用的电解质是 。
(2)以石墨为电极,使电解质质量不变,水质量减少,进行电解,则可采用的电解质是 。
(3)以石墨为阳极,铁棒为阴极,使电解质和水的质量都减少,进行电解,则电解质是 。
(4)以石墨为电极进行电解,若阴极析出金属,阳极放出O2时,电解质的化学式可能是 。
(5)以石墨为电极进行电解,两极分别放出气体,且体积比为1∶1时,电解质的化学式可能是 。
19.电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(“HA”表示乳酸分子、“A”表示乳酸根离子)。
(1)阳极的电极反应式为 。
(2)简述浓缩室中得到浓乳酸的原理: 。
20.请根据所学化学反应原理,解决以下问题:
(1)依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s) 设计的原电池,可以提供稳定的电流.装置如图所示,其中盐桥中装有琼脂-饱和KCl溶液.
回答下列问题:
①电极X的材料和电解质溶液Y分别为 、 ;
②盐桥中K+移向 (填A或B);
③银电极发生的电极反应为 ;
④用此做电源电解硝酸银溶液(用碳棒做电极)的化学方程式为 ;
(2)已知25℃、101kPa时,16.0g气态肼(N2H4)在氧气中完全燃烧生成氮气和水,放出热量312kJ,则该热化学反应方程式 ;
(3)已知:C(s)+O2(g)═CO2(g)△H1=-396.5kJ mol-1;
H2(g)+O2═H2O(g)△H2=-241.8kJ mol-1;
CO(g)+O2(g)═CO2(g)△H3=-283.0kJ mol-1.
根据盖斯定律写出单质碳和水蒸气生成水煤气的热化学方程式: 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】锂离子可充电电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2被氧化,阳极电极反应式为LiCoO2-e- =Li++CoO2,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中形成LiC6,则C6为阴极,阴极电极反应式为Li++e-+C6=LiC6,据此分析作答。
【详解】A、充电时,锂离子电池的负极为阴极,阴极上发生得电子的还原反应,选项A错误;
B、放电时,电池的正极发生得电子的还原反应,电极反应式为CoO2+Li++e-=LiCoO2,选项B正确;
C. 放电时,锂离子电池的正极反应为CoO2+Li++e-=LiCoO2,正极的质量逐渐增大,选项C错误;
D. 充电时,C6电极为阴极,应与外接电源的负极相连,选项D错误。
答案选B。
【点睛】本题考查锂离子可充电电池的组成和工作原理,题目难度不大,本题注意从锂离子可充电电池充电时的反应分析反应原理。
2.D
【详解】A.该装置属于原电池,是将化学能转化为电能的装置,故A错误;
B.燃料电池中,通入燃料氢气的一极为负极,所以a是负极,故B错误;
C.电子从负极沿导线流向正极,a是负极、b是正极,则电子由电极a通过导线流向电极b,故C错误;
D.氢氧燃料电池的总反应式为2H2+O2═2H2O,产物是水,对环境无污染,是绿色环保电池,故D正确;
答案选D。
3.D
【详解】该装置为电解装置,阳离子向阴极移动,阴离子向阳极移动,故Na+向b移动,B为阳离子交换膜,AB错误;C、阳极发生氧化反应,Cl-先放电,错误;D、b极上H+放电,生成H2,Mg2+与OH-结合产生白色沉淀。答案选D。
4.D
【分析】一氧化碳-空气燃料电池,在碱性条件下的总反应是2CO+O2+4OH-=2CO32-+2H2O。
【详解】A. 电子由a极流出,a是负极,a电极CO失电子发生氧化反应,b电极氧气得电子发生还原反应,故A错误;
B. a是负极,a电极CO失电子发生氧化反应,a电极的电极反应式为CO+2OH--2e-===CO32-+H2O,故B错误;
C.a是负极,A处通入的是CO,b是正极,B处通入的是空气,故C错误;
D. 用该电池作电源精炼铜,若阴极质量增加6.4 g,则转移电子的物质的量是0.2mol,根据方程式CO+2OH--2e-===CO32-+H2O可知至少消耗标准状况下的CO 2.24 L,故D正确。
【点睛】本题考查原电池原理,明确电子流向与正负极的关系是解本题关键,再结合转移电子守恒、反应类型等知识点分析解答,电极反应式要结合电解质溶液酸碱性书写。
5.B
【详解】A.锡青铜是合金,合金的熔点比纯金属的熔点都低,故A不符合题意;
B.在潮湿环境中,锡青铜易形成原电池而发生电化学腐蚀,所以在潮湿环境中的腐蚀比干燥环境中快,故B符合题意;
C.锡青铜中的锡比铜活泼,所以形成原电池时,锡作负极,则铜被保护, 故C不符合题意;
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但属于化学反应,故D不符合题意;
答案选B。
6.C
【详解】A.“爆竹声中一岁除”中体现的是燃烧反应,为放热反应,A错误;
B.当反应的ΔG<0,反应能够自发进行,根据可得,对于熵增的反应,若该反应ΔH>0,则高温下才能自发进行,若ΔH<0,则任何条件下均能自发进行,B错误;
C.催化剂通过改变反应的途径进而降低反应的活化能,能够增加活化分子的百分数和单位体积内活化分子的浓度,加快反应速率,C正确;
D.“以醋制铜生绿”说明铜合金在电解质环境下与氧气、二氧化碳发生反应生成铜绿,总反应式为,负极反应式为,正极反应式为说明发生的电化学反应为吸氧腐蚀,而不是析氢腐蚀,D错误;
故选C。
7.D
【分析】原电池中电子由负极流出,向正极移动;已知,放电时电子由B极一侧向A极移动,则A为正极、B为负极;
【详解】A.负极发生氧化反应,由图可知,电极反应为,A正确;
B.放电时,阳离子向电源正极运动,通过离子交换膜由B极一侧向A极移动,B正确;
C.A极为电池的正极,则充电时为阳极,C正确;
D.充电时,阳极发生氧化反应转化为,阴极发生还原反应转化为,故电池总反应为:,D错误;
故选D。
8.D
【详解】A.由图可知,Fe电极是正极,Zn电极是负极,属于牺牲阳极的阴极保护法,由于电解质溶液呈酸性,故正极上氢离子得电子,则正极的反应为:2H++2e-═H2↑,A错误;
B.外加电流阴极保护法中要保护的电极应与外接电源的负极相连,即Fe电极与外接电源的负极相连,B错误;
C.由实验②现象可知,反应能否发生与K3[Fe(CN)6]在Ⅰ、Ⅱ中的氧化性无关,C错误;
D.对比Ⅰ、Ⅱ现象的差异可知,两种保护法均能保护Fe,且电解法保护的更好,即Ⅱ保护得更好,D正确;
故答案为:D。
9.A
【详解】A.根据图示可知Zn为负极,CuI为正极,Zn失去电子变为Zn2+进入溶液,溶液中向正电荷较多的负极Zn电极移动,A错误;
B.由于电极活动性:Zn>CuI,所以Zn为负极,失去电子,发生氧化反应,B正确;
C.由于电极活动性:Zn>CuI,所以CuI为正极,得到电子变为Cu单质和I-,电极反应式为:CuI+e-=Cu+I-,C正确;
D.电池工作时,电流从正极CuI开始经外电路流向负极Zn,溶液中阴离子在负极放电,阳离子向正极定向流动,从而形成闭合回路,故该电池工作时,电流流动方向:CuI→电灯泡→Zn→ZnSO4溶液→CuI,D正确;
故合理选项是A。
10.C
【详解】A.“暖宝宝”的工作原理是利用原电池加快氧化反应速度,将化学能转变为热能,A正确;
B.在铁中添加一定量的镍改变了内部结构,使得制成的金属硬币不易被腐蚀,B正确;
C.在海轮船壳上镶入锌块,此时锌作负极,铁作为原电池的正极而被保护,不易腐蚀,是利用了牺牲阳极的阴极保护法,C错误;
D.铜、铝电线连接起来使用,接头在潮湿空气中形成原电池,铝线表面被氧化而不导电,出现断电现象,D正确;
故选:C。
11.C
【详解】A.能量不能完全转化,原电池过程中化学能转化为电能、热能等,故A错误;
B.大力发展火力发电,会增大CO2的排放,故B错误;
C.氢能源的产物为水,属于无污染的物质,故发展氢能源电动汽车可减少环境污染,故C正确;
D.水力发电是将机械能转化为电能,而原电池是将化学能转化为电能,故D错误;
故选C。
12.D
【分析】由左侧电子流出可知左侧区域为负极区,负极上C6H12O6发生失电子的氧化反应生成CO2,电极反应式为C6H12O6-24e-+6H2O=6CO2↑+24H+,O2在正极上得电子,正极上的电极反应为O2+4e-+4H+=2H2O,据此分析解答。
【详解】A.负极上C6H12O6发生失电子的氧化反应生成CO2,电极反应式为C6H12O6-24e-+6H2O=6CO2↑+24H+,故A正确;
B.左侧葡萄糖失电子为负极,右侧氧气得电子为正极,所以左侧区域为负极区,右侧区域为正极区,故B正确;
C.负极电极反应式为C6H12O6-24e-+6H2O=6CO2↑+24H+,负极区域氢离子浓度增大,所以正极区酸性增强,故C正确;
D.正极O2得电子消耗气体,电极反应为6O2+26e-+24H+=12H2O,负极上生成CO2,电极反应式为C6H12O6-24e-+6H2O=6CO2↑+24H+,所以正极消耗气体,负极生成气体,气体的物质的量之比为6:6=1:1,故D错误;
故选:D。
13.(1) 正极 阳极
(2)CH3OH-6e-+8OH--═+6H2O
(3)
(4)280ml
【详解】(1)甲池中通入O2,氧气得到电子发生还原反应,是正极;通入甲醇的电极发生还原反应,为负极,则D为阴极,C为阳极;
(2)通入甲醇的电极发生还原反应,甲醇为负极,反应式为CH3OH-6e-+8OH--═+6H2O;
(3)乙池中A电极为阳极,则用C为阳极电解AgNO3溶液是,有Ag、HNO3和O2生成,总反应的化学方程式为;
(4)乙池中B(Ag)电极的质量增加5.40g时,析出Ag的物质的量为,转移电子的物质的量为0.05mol,根据电子守恒,甲池中理论上消耗标准状况下O2为;
14.(1)H2-2e-+2OH-=2H2O
(2)闭合K1,a极发生2Cl--2e-=Cl2;闭合K2,a极发生Cl2+2e-=2Cl-,形成的不是氢氧燃料电池
【详解】(1)闭合K1,a为电解池阳极生成氧气,b为阴极生成氢气;一段时间后断开K1、闭合K2,电极b处氢气发生氧化反应生成水,为原电池负极,发生的电极反应式为H2-2e-+2OH-=2H2O。
(2)选用NaCl溶液做电解质溶液,闭合K1,a极发生2Cl--2e-=Cl2;闭合K2,a极发生Cl2+2e-=2Cl-,形成的不是氢氧燃料电池。
15.(1) 负 铜 氧化
(2) 2Cl--2e-=Cl2↑ 2H++2e-=H2↑
(3) 0.1 0.224
【详解】(1)甲池中电池反应式为,B电极质量不变,可知B电极反应为:,B为正极,则A为负极,电极材料为Cu,电极反应为:,发生氧化反应,故答案为:负;铜;氧化;
(2)乙池为电解池,C为阳极,电极反应为2Cl--2e-=Cl2↑,D为阴极,电极反应为2H++2e-=H2↑。故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑;
(3)A极有0.64 g Cu溶解时,转移0.02 mol电子,乙池中C极上生成0.01 mol Cl2,体积为:0.224L,溶液中生成0.02 mol OH-。;故答案为:0.1;0.224;
16.(1) 放 扩大接触面积,提高反应速率 ①
(2)②
(3) A CH4-8e-+10OH-=CO+7H2O
(4) 2H++2e-═H2↑ Mg Al+4OH-﹣3e-=AlO+2H2O
【解析】(1)
温度升高,说明反应为放热;将固体研细其目的是扩大接触面积,提高反应速率;图示中反应物的总能量高于生成物的总能量,反应为放热反应,反应①为放热反应,故答案为:放;扩大接触面积,提高反应速率;①;
(2)
为了验证Fe3+与Cu2+氧化性强弱,可以利用原电池原理,装置②中发生的总反应为Cu与Fe3+反应生成Fe2+,根据氧化还原反应原理知氧化剂的氧化性强于氧化产物的氧化性,所以验证了Fe3+与Cu2+氧化性强弱,故答案为②;
(3)
由图所示,电子从A极流出,则A电极入口通甲烷,其电极反应式为:CH4-8e-+10OH-=CO+7H2O;
(4)
①正极氢离子得电子,电极反应式为2H++2e—=H2↑;
②因为Al和氢氧化钠溶液反应、而Mg不反应,所以负极是铝、Mg作正极;该原电池的负极反应式为:Al+4OH-﹣3e-=AlO+2H2O。
17.(1)Fe-2e-=Fe2+
(2)BC
(3)Fe3++3H2OFe(OH)3+3H+
(4)1.04mg·L-1
【分析】铁碳混合材料和废水构成原电池,Fe为负极,Fe失电子被氧化成Fe2+;C为正极。
【详解】(1)根据原理图示,Fe电极上Fe失电子被氧化成Fe2+,电极方程式为Fe-2e-=Fe2+;答案为:Fe-2e-=Fe2+。
(2)A.Fe电极上发生失电子的氧化反应,铁电极为负极,碳电极为正极,A项错误;
B.经过加热烧结的铁碳混合物表面空隙发达,具有较大的表面积,吸附能力大幅提高,有利除污,B项正确;
C.图示碳电极的电极反应为2H2O+2e-=H2↑+2OH-,反应环境应为无溶解氧环境,C项正确;
D.铁碳混合材料工作过程中电子从负极(铁电极)流出,经外电路运输至碳电极表面,D项错误;
答案选BC。
(3)有溶解氧时絮凝过程是利用了铁离子水解产物吸附污染物完成截流,Fe3+水解的离子方程式为Fe3++3H2O Fe(OH)3+3H+;答案为:Fe3++3H2O Fe(OH)3+3H+。
(4)根据电极反应Fe-2e-=Fe2+。电极上转移1,20mol电子生成0.60molFe2+;无溶解氧时,可以利用生成的絮凝剂处理含铬废水,最终溶液中金属离子均生成氢氧化物沉淀,此过程中最终形成Cr(OH)3沉淀、Fe2+形成Fe(OH)3沉淀,根据得失电子守恒,被还原的Cr元素物质的量为=0.20mol,处理的Cr元素的质量为0.20mol×52g/mol=10.4g,该污水在处理前的排放浓度为==1.04mg/L;答案为:1.04mg/L。
18.(1)HCl、CuCl2
(2)H2SO4、Na2SO4、NaHSO4
(3)CuSO4、NaCl
(4)CuSO4
(5)HCl、NaCl
【分析】(1)
石墨是惰性电极,惰性电极电解CuCl2溶液或者HCl溶液时,电解质质量减小,水量不变;
(2)
惰性电极电解Na2SO4溶液、H2SO4溶液或NaHSO4溶液时,氢离子、氢氧根离子放电,则电解质质量不变,水量减少;
(3)
石墨棒为阳极,铁棒为阴极,电解CuSO4、NaCI溶液时,则铜离子、氢氧根离子、氯离子、氢离子放电,所以电解质和水量都减少;
(4)
以石墨为电极进行电解,惰性电极电解CuSO4溶液,则阴极铜离子放电析出铜,阳极水中氢氧根离子放电生成O2;
(5)
以石墨为电极进行电解,惰性电极电解HCl溶液或者NaCl溶液,阴极是氢离子放电产生氢气,阳极是氯离子放电产生氯气,两极分别放出气体,且体积比为1:1。
19.(1)2H2O-4e- =4H+ + O2↑
(2)阳极室中穿过阳离子交换膜的H+与阴极室中穿过阴离子交换膜的A 在浓缩室结合生成HA
【详解】(1)在阳极,水电离的OH 放电,电极反应为2H2O-4e- =4H+ + O2↑;
(2)在阳极OH 放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室;阴极中的A 通过阴离子交换膜从阴极进入浓缩室,使得乳酸浓度增大。
20. Cu AgNO3溶液 B Ag++e-=Ag 4AgNO3+2H2O4HNO3+4Ag↓+O2↑ N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol C(s)+H2O(g)=CO(g)+H2(g)△H=+128.3kJ mol-1
【详解】(1)①氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)中,金属Cu失电子被氧化为负极,得电子的阳离子Ag+是电解质中的阳离子,所以电解质可以选择AgNO3溶液;
②原电池反应,阳离子向正极移动,Ag电极上银离子得电子被还原,为正极,所以K+移向B;
③银电极发生的电极反应为溶液中的银离子得到电子析出银单质,电极反应为:Ag++e-=Ag;
④电解硝酸银溶液时,阳极上水电离出的氢氧根放电生成氧气,阴极银离子放电生成银单质,总反应化学方程式为4AgNO3+2H2O4HNO3+4Ag↓+O2↑;
(2)16.0g气态肼(N2H4)物质的量为0.5mol,在氧气中完全燃烧生成氮气和水,放出热量312kJ,1mol气态肼(N2H4)燃烧放热614kJ,反应的热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(l) H=-624kJ/mol;
(3)①C(s)+O2(g)=CO2(g) H1=-396.5kJ mol-1
②H2(g)+ O2=H2O(g) H2=-241.8kJ mol-1
③CO(g)+O2(g)=CO2(g) H3=-283.0kJ mol-1
根据盖斯定律,①-②-③得到:单质碳和水蒸气生成水煤气的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g) H=128.3kJ mol-1。
答案第1页,共2页
答案第1页,共2页
一、单选题(共12题)
1.某新型锂离子可充电电池正极材料是含锂的二氧化钴(LiCoO2)。充电时LiCoO2被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中形成LiC6。下列说法正确的是
A.充电时,锂离子电池的负极发生氧化反应
B.放电时,锂离子电池的正极反应为CoO2+Li++e =LiCoO2
C.放电时,锂离子电池的正极的质量逐渐减小
D.充电时,C6极应与外接电源的正极相连
2.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法正确的是( )
A.该电池工作时电能转化为化学能
B.该电池中电极b是负极
C.外电路中电子由电极b通过导线流向电极a
D.该电池是绿色环保电池
3.海水淡化的方法有多种,如蒸馏法、电渗析法等。电渗析法是一种利用离子交换膜进行离子交换的方法,其原理如图所示。已知海水中含Na+、Cl—、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。下列叙述中正确的是
A.B膜是阴离子交换膜
B.通电后,海水中阳离子往a电极处运动
C.通电后,a电极的电极反应式为:4OH--4e-=O2↑+2H2O
D.通电后,b电极上产生无色气体,溶液中出现少量白色沉淀
4.如图是一氧化碳-空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中,正确的是( )
A.a电极发生还原反应,b电极发生氧化反应
B.a电极的电极反应式为CO+4OH-+2e-===CO32-+2H2O
C.A处通入的是空气,B处通入的是CO
D.用该电池作电源精炼铜,若阴极质量增加6.4 g,至少消耗标准状况下的CO 2.24 L
5.考古中出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
A.锡青铜的熔点比纯铜高
B.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
C.锡青铜中的锡加速了铜的腐蚀速度
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
6.下列说法正确的是
A.“爆竹声中一岁除,春风送暖入屠苏”所涉及的反应是吸热反应
B.任何熵增的反应都一定是自发反应
C.使用催化剂能增加活化分子的百分数从而增大化学反应的速率
D.“以醋制铜生绿”所涉及的是析氢腐蚀
7.钒电池是目前发展势头强劲的绿色环保储能电池之一,其工作原理如图所示,放电时电子由B极一侧向A极移动,电解质溶液含硫酸。下列说法不正确的是
A.放电时,负极上发生反应的电极反应是:
B.放电时,通过离子交换膜由B极一侧向A极移动
C.充电时A极为阳极
D.充电时,电池总反应为:
8.甲、乙同学分别用如图所示装置验证铁的电化学防腐原理,相同时间后继续进行实验。
实验①:甲同学分别向Ⅰ、Ⅱ中Fe电极附近滴加K3[Fe(CN)6]溶液,Ⅰ中产生蓝色沉淀,Ⅱ中无沉淀。
实验②:乙同学分别取Ⅰ、Ⅱ中Fe电极附近溶液,滴加K3[Fe(CN)6]溶液,Ⅰ、Ⅱ中均无沉淀。
下列说法正确的是
A.Ⅰ是牺牲阳极保护法,正极反应式为
B.Ⅱ为外加电流阴极保护法,Fe电极与外接电源的正极相连
C.由实验①中Ⅰ、Ⅱ现象的差异,推测K3[Fe(CN)6]在Ⅰ中氧化性强于Ⅱ
D.由实验可知,两种保护法均能保护,且Ⅱ保护得更好
9.由于安全以及价格方面的优势,水系锌离子电池(ZiBs)被普遍认为是锂离子电池在大规模储能设备领域的替代品,其中一种电池工作原理如图所示。下列说法错误的是
A.工作时,移向CuI极
B.锌是负极,发生氧化反应
C.正极的电极反应式为CuI+e-=Cu+I-
D.工作时,电流流动方向:CuI→电灯泡→Zn→ZnSO4溶液→CuI
10.化学与人类生产、生活密切相关,下列说法错误的是
A.“暖宝宝”工作时将化学能转化为热能
B.在铁中添加一定量的镍制成的金属硬币不易被腐蚀
C.海轮船壳上镶入锌块,利用的防护方法是外接电流法
D.铜、铝电线连接起来使用易出现断电现象
11.2023年2月5日,广东佛山举行了科技感十足的楼宇灯光秀,将电能与现代科技手段结合,打造了一场视觉盛宴。下列有关电的说法正确的是
A.原电池可将化学能完全转化为电能 B.煤炭较为便宜,应增大火力发电总量
C.发展氢能源电动汽车可减少环境污染 D.水力发电利用了原电池原理
12.微生物燃料电池是一种高效、经济的能源装置。下图装置所示为一种双室微生物燃料电池。下列说法错误的是
A.负极总反应为C6H12O6-24e-+6H2O=6CO2↑+24H+
B.上图所示装置中,左侧区域为负极区,右侧区域为正极区
C.电池工作一段时间后,负极区酸性增强
D.电池工作时,正极生成的气体和负极消耗气体的物质的量之比为1:1
二、填空题(共8题)
13.研究电化学过程的实验装置如图所示。
(1)甲池中通入O2的一极作 极,丙池中C(Pt)电极作 极。
(2)通入CH3OH的电极电极反应式为 。
(3)乙池中总反应的化学方程式为 。
(4)当乙池中B(Ag)电极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)。
14.氢氧燃料电池是最具发展前途的发电技术之一。设计简单氢氧燃料电池,示意如图:
(1)闭合K1,一段时间后断开K1、闭合K2,电极b发生的电极反应式为 。
(2)不选用NaCl溶液做电解质溶液的原因是 。
15.如图所示,甲池中电池反应式为,已知B电极质量不变,C、D为石墨电极,乙池中为200mL饱和NaCl溶液。
回答下列问题:
(1)A极为 极(填“正”或“负”),电极材料为 ,发生 反应(填“氧化”或“还原”)。
(2)写出乙池的电极反应式:
阳极反应式为 ;
阴极反应式为 。
(3)A电极质量减少0.64 g时,此时乙池中电解液中c(OH-)= mol·L-1(忽略反应过程中溶液体积的变化),C电极上产生的气体在标准状况下的体积为 L。
16.某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是 热反应,Ba(OH)2 8H2O与NH4Cl反应时,需要将固体研细其目的是 。反应过程 (填“①”或“②”)的能量变化可用下图表示。
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是 (填序号)。
(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中 (填A或B)处电极入口通甲烷,其电极反应式为 。
(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为 。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为 ;该原电池的负极反应式为 。
17.利用烧结的铁碳混合材料可除去废水中的污染物,在有、无溶解氧的情况下均可在溶液中生成絮凝剂,实现高效工作,其作用原理图示如下:
请回答:
(1)写出铁电极上电极方程式 。
(2)下列叙述正确的是。
A.铁电极为正极,碳电极为负极
B.经过加热烧结的铁碳混合物表面空隙发达,吸附能力大幅提高,有利除污
C.碳电极上的反应环境为无溶解氧环境
D.铁碳混合材料工作过程中电子从铁电极流出,被絮凝剂运输至碳电极表面
(3)有溶解氧时絮凝过程是利用了铁离子水解产物吸附污染物完成截流,写出相关的离子方程式 。
(4)无溶解氧时,可以利用生成的絮凝剂处理含铬废水,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为 (以铬元素的量计算)。
18.从H+、Cu2+、Na+、SO、Cl-五种离子中选择并恰当地组成电解质,按下列要求进行电解:
(1)以石墨为电极,使电解质质量减少,水质量不变,进行电解,则可采用的电解质是 。
(2)以石墨为电极,使电解质质量不变,水质量减少,进行电解,则可采用的电解质是 。
(3)以石墨为阳极,铁棒为阴极,使电解质和水的质量都减少,进行电解,则电解质是 。
(4)以石墨为电极进行电解,若阴极析出金属,阳极放出O2时,电解质的化学式可能是 。
(5)以石墨为电极进行电解,两极分别放出气体,且体积比为1∶1时,电解质的化学式可能是 。
19.电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(“HA”表示乳酸分子、“A”表示乳酸根离子)。
(1)阳极的电极反应式为 。
(2)简述浓缩室中得到浓乳酸的原理: 。
20.请根据所学化学反应原理,解决以下问题:
(1)依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s) 设计的原电池,可以提供稳定的电流.装置如图所示,其中盐桥中装有琼脂-饱和KCl溶液.
回答下列问题:
①电极X的材料和电解质溶液Y分别为 、 ;
②盐桥中K+移向 (填A或B);
③银电极发生的电极反应为 ;
④用此做电源电解硝酸银溶液(用碳棒做电极)的化学方程式为 ;
(2)已知25℃、101kPa时,16.0g气态肼(N2H4)在氧气中完全燃烧生成氮气和水,放出热量312kJ,则该热化学反应方程式 ;
(3)已知:C(s)+O2(g)═CO2(g)△H1=-396.5kJ mol-1;
H2(g)+O2═H2O(g)△H2=-241.8kJ mol-1;
CO(g)+O2(g)═CO2(g)△H3=-283.0kJ mol-1.
根据盖斯定律写出单质碳和水蒸气生成水煤气的热化学方程式: 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】锂离子可充电电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2被氧化,阳极电极反应式为LiCoO2-e- =Li++CoO2,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中形成LiC6,则C6为阴极,阴极电极反应式为Li++e-+C6=LiC6,据此分析作答。
【详解】A、充电时,锂离子电池的负极为阴极,阴极上发生得电子的还原反应,选项A错误;
B、放电时,电池的正极发生得电子的还原反应,电极反应式为CoO2+Li++e-=LiCoO2,选项B正确;
C. 放电时,锂离子电池的正极反应为CoO2+Li++e-=LiCoO2,正极的质量逐渐增大,选项C错误;
D. 充电时,C6电极为阴极,应与外接电源的负极相连,选项D错误。
答案选B。
【点睛】本题考查锂离子可充电电池的组成和工作原理,题目难度不大,本题注意从锂离子可充电电池充电时的反应分析反应原理。
2.D
【详解】A.该装置属于原电池,是将化学能转化为电能的装置,故A错误;
B.燃料电池中,通入燃料氢气的一极为负极,所以a是负极,故B错误;
C.电子从负极沿导线流向正极,a是负极、b是正极,则电子由电极a通过导线流向电极b,故C错误;
D.氢氧燃料电池的总反应式为2H2+O2═2H2O,产物是水,对环境无污染,是绿色环保电池,故D正确;
答案选D。
3.D
【详解】该装置为电解装置,阳离子向阴极移动,阴离子向阳极移动,故Na+向b移动,B为阳离子交换膜,AB错误;C、阳极发生氧化反应,Cl-先放电,错误;D、b极上H+放电,生成H2,Mg2+与OH-结合产生白色沉淀。答案选D。
4.D
【分析】一氧化碳-空气燃料电池,在碱性条件下的总反应是2CO+O2+4OH-=2CO32-+2H2O。
【详解】A. 电子由a极流出,a是负极,a电极CO失电子发生氧化反应,b电极氧气得电子发生还原反应,故A错误;
B. a是负极,a电极CO失电子发生氧化反应,a电极的电极反应式为CO+2OH--2e-===CO32-+H2O,故B错误;
C.a是负极,A处通入的是CO,b是正极,B处通入的是空气,故C错误;
D. 用该电池作电源精炼铜,若阴极质量增加6.4 g,则转移电子的物质的量是0.2mol,根据方程式CO+2OH--2e-===CO32-+H2O可知至少消耗标准状况下的CO 2.24 L,故D正确。
【点睛】本题考查原电池原理,明确电子流向与正负极的关系是解本题关键,再结合转移电子守恒、反应类型等知识点分析解答,电极反应式要结合电解质溶液酸碱性书写。
5.B
【详解】A.锡青铜是合金,合金的熔点比纯金属的熔点都低,故A不符合题意;
B.在潮湿环境中,锡青铜易形成原电池而发生电化学腐蚀,所以在潮湿环境中的腐蚀比干燥环境中快,故B符合题意;
C.锡青铜中的锡比铜活泼,所以形成原电池时,锡作负极,则铜被保护, 故C不符合题意;
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但属于化学反应,故D不符合题意;
答案选B。
6.C
【详解】A.“爆竹声中一岁除”中体现的是燃烧反应,为放热反应,A错误;
B.当反应的ΔG<0,反应能够自发进行,根据可得,对于熵增的反应,若该反应ΔH>0,则高温下才能自发进行,若ΔH<0,则任何条件下均能自发进行,B错误;
C.催化剂通过改变反应的途径进而降低反应的活化能,能够增加活化分子的百分数和单位体积内活化分子的浓度,加快反应速率,C正确;
D.“以醋制铜生绿”说明铜合金在电解质环境下与氧气、二氧化碳发生反应生成铜绿,总反应式为,负极反应式为,正极反应式为说明发生的电化学反应为吸氧腐蚀,而不是析氢腐蚀,D错误;
故选C。
7.D
【分析】原电池中电子由负极流出,向正极移动;已知,放电时电子由B极一侧向A极移动,则A为正极、B为负极;
【详解】A.负极发生氧化反应,由图可知,电极反应为,A正确;
B.放电时,阳离子向电源正极运动,通过离子交换膜由B极一侧向A极移动,B正确;
C.A极为电池的正极,则充电时为阳极,C正确;
D.充电时,阳极发生氧化反应转化为,阴极发生还原反应转化为,故电池总反应为:,D错误;
故选D。
8.D
【详解】A.由图可知,Fe电极是正极,Zn电极是负极,属于牺牲阳极的阴极保护法,由于电解质溶液呈酸性,故正极上氢离子得电子,则正极的反应为:2H++2e-═H2↑,A错误;
B.外加电流阴极保护法中要保护的电极应与外接电源的负极相连,即Fe电极与外接电源的负极相连,B错误;
C.由实验②现象可知,反应能否发生与K3[Fe(CN)6]在Ⅰ、Ⅱ中的氧化性无关,C错误;
D.对比Ⅰ、Ⅱ现象的差异可知,两种保护法均能保护Fe,且电解法保护的更好,即Ⅱ保护得更好,D正确;
故答案为:D。
9.A
【详解】A.根据图示可知Zn为负极,CuI为正极,Zn失去电子变为Zn2+进入溶液,溶液中向正电荷较多的负极Zn电极移动,A错误;
B.由于电极活动性:Zn>CuI,所以Zn为负极,失去电子,发生氧化反应,B正确;
C.由于电极活动性:Zn>CuI,所以CuI为正极,得到电子变为Cu单质和I-,电极反应式为:CuI+e-=Cu+I-,C正确;
D.电池工作时,电流从正极CuI开始经外电路流向负极Zn,溶液中阴离子在负极放电,阳离子向正极定向流动,从而形成闭合回路,故该电池工作时,电流流动方向:CuI→电灯泡→Zn→ZnSO4溶液→CuI,D正确;
故合理选项是A。
10.C
【详解】A.“暖宝宝”的工作原理是利用原电池加快氧化反应速度,将化学能转变为热能,A正确;
B.在铁中添加一定量的镍改变了内部结构,使得制成的金属硬币不易被腐蚀,B正确;
C.在海轮船壳上镶入锌块,此时锌作负极,铁作为原电池的正极而被保护,不易腐蚀,是利用了牺牲阳极的阴极保护法,C错误;
D.铜、铝电线连接起来使用,接头在潮湿空气中形成原电池,铝线表面被氧化而不导电,出现断电现象,D正确;
故选:C。
11.C
【详解】A.能量不能完全转化,原电池过程中化学能转化为电能、热能等,故A错误;
B.大力发展火力发电,会增大CO2的排放,故B错误;
C.氢能源的产物为水,属于无污染的物质,故发展氢能源电动汽车可减少环境污染,故C正确;
D.水力发电是将机械能转化为电能,而原电池是将化学能转化为电能,故D错误;
故选C。
12.D
【分析】由左侧电子流出可知左侧区域为负极区,负极上C6H12O6发生失电子的氧化反应生成CO2,电极反应式为C6H12O6-24e-+6H2O=6CO2↑+24H+,O2在正极上得电子,正极上的电极反应为O2+4e-+4H+=2H2O,据此分析解答。
【详解】A.负极上C6H12O6发生失电子的氧化反应生成CO2,电极反应式为C6H12O6-24e-+6H2O=6CO2↑+24H+,故A正确;
B.左侧葡萄糖失电子为负极,右侧氧气得电子为正极,所以左侧区域为负极区,右侧区域为正极区,故B正确;
C.负极电极反应式为C6H12O6-24e-+6H2O=6CO2↑+24H+,负极区域氢离子浓度增大,所以正极区酸性增强,故C正确;
D.正极O2得电子消耗气体,电极反应为6O2+26e-+24H+=12H2O,负极上生成CO2,电极反应式为C6H12O6-24e-+6H2O=6CO2↑+24H+,所以正极消耗气体,负极生成气体,气体的物质的量之比为6:6=1:1,故D错误;
故选:D。
13.(1) 正极 阳极
(2)CH3OH-6e-+8OH--═+6H2O
(3)
(4)280ml
【详解】(1)甲池中通入O2,氧气得到电子发生还原反应,是正极;通入甲醇的电极发生还原反应,为负极,则D为阴极,C为阳极;
(2)通入甲醇的电极发生还原反应,甲醇为负极,反应式为CH3OH-6e-+8OH--═+6H2O;
(3)乙池中A电极为阳极,则用C为阳极电解AgNO3溶液是,有Ag、HNO3和O2生成,总反应的化学方程式为;
(4)乙池中B(Ag)电极的质量增加5.40g时,析出Ag的物质的量为,转移电子的物质的量为0.05mol,根据电子守恒,甲池中理论上消耗标准状况下O2为;
14.(1)H2-2e-+2OH-=2H2O
(2)闭合K1,a极发生2Cl--2e-=Cl2;闭合K2,a极发生Cl2+2e-=2Cl-,形成的不是氢氧燃料电池
【详解】(1)闭合K1,a为电解池阳极生成氧气,b为阴极生成氢气;一段时间后断开K1、闭合K2,电极b处氢气发生氧化反应生成水,为原电池负极,发生的电极反应式为H2-2e-+2OH-=2H2O。
(2)选用NaCl溶液做电解质溶液,闭合K1,a极发生2Cl--2e-=Cl2;闭合K2,a极发生Cl2+2e-=2Cl-,形成的不是氢氧燃料电池。
15.(1) 负 铜 氧化
(2) 2Cl--2e-=Cl2↑ 2H++2e-=H2↑
(3) 0.1 0.224
【详解】(1)甲池中电池反应式为,B电极质量不变,可知B电极反应为:,B为正极,则A为负极,电极材料为Cu,电极反应为:,发生氧化反应,故答案为:负;铜;氧化;
(2)乙池为电解池,C为阳极,电极反应为2Cl--2e-=Cl2↑,D为阴极,电极反应为2H++2e-=H2↑。故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑;
(3)A极有0.64 g Cu溶解时,转移0.02 mol电子,乙池中C极上生成0.01 mol Cl2,体积为:0.224L,溶液中生成0.02 mol OH-。;故答案为:0.1;0.224;
16.(1) 放 扩大接触面积,提高反应速率 ①
(2)②
(3) A CH4-8e-+10OH-=CO+7H2O
(4) 2H++2e-═H2↑ Mg Al+4OH-﹣3e-=AlO+2H2O
【解析】(1)
温度升高,说明反应为放热;将固体研细其目的是扩大接触面积,提高反应速率;图示中反应物的总能量高于生成物的总能量,反应为放热反应,反应①为放热反应,故答案为:放;扩大接触面积,提高反应速率;①;
(2)
为了验证Fe3+与Cu2+氧化性强弱,可以利用原电池原理,装置②中发生的总反应为Cu与Fe3+反应生成Fe2+,根据氧化还原反应原理知氧化剂的氧化性强于氧化产物的氧化性,所以验证了Fe3+与Cu2+氧化性强弱,故答案为②;
(3)
由图所示,电子从A极流出,则A电极入口通甲烷,其电极反应式为:CH4-8e-+10OH-=CO+7H2O;
(4)
①正极氢离子得电子,电极反应式为2H++2e—=H2↑;
②因为Al和氢氧化钠溶液反应、而Mg不反应,所以负极是铝、Mg作正极;该原电池的负极反应式为:Al+4OH-﹣3e-=AlO+2H2O。
17.(1)Fe-2e-=Fe2+
(2)BC
(3)Fe3++3H2OFe(OH)3+3H+
(4)1.04mg·L-1
【分析】铁碳混合材料和废水构成原电池,Fe为负极,Fe失电子被氧化成Fe2+;C为正极。
【详解】(1)根据原理图示,Fe电极上Fe失电子被氧化成Fe2+,电极方程式为Fe-2e-=Fe2+;答案为:Fe-2e-=Fe2+。
(2)A.Fe电极上发生失电子的氧化反应,铁电极为负极,碳电极为正极,A项错误;
B.经过加热烧结的铁碳混合物表面空隙发达,具有较大的表面积,吸附能力大幅提高,有利除污,B项正确;
C.图示碳电极的电极反应为2H2O+2e-=H2↑+2OH-,反应环境应为无溶解氧环境,C项正确;
D.铁碳混合材料工作过程中电子从负极(铁电极)流出,经外电路运输至碳电极表面,D项错误;
答案选BC。
(3)有溶解氧时絮凝过程是利用了铁离子水解产物吸附污染物完成截流,Fe3+水解的离子方程式为Fe3++3H2O Fe(OH)3+3H+;答案为:Fe3++3H2O Fe(OH)3+3H+。
(4)根据电极反应Fe-2e-=Fe2+。电极上转移1,20mol电子生成0.60molFe2+;无溶解氧时,可以利用生成的絮凝剂处理含铬废水,最终溶液中金属离子均生成氢氧化物沉淀,此过程中最终形成Cr(OH)3沉淀、Fe2+形成Fe(OH)3沉淀,根据得失电子守恒,被还原的Cr元素物质的量为=0.20mol,处理的Cr元素的质量为0.20mol×52g/mol=10.4g,该污水在处理前的排放浓度为==1.04mg/L;答案为:1.04mg/L。
18.(1)HCl、CuCl2
(2)H2SO4、Na2SO4、NaHSO4
(3)CuSO4、NaCl
(4)CuSO4
(5)HCl、NaCl
【分析】(1)
石墨是惰性电极,惰性电极电解CuCl2溶液或者HCl溶液时,电解质质量减小,水量不变;
(2)
惰性电极电解Na2SO4溶液、H2SO4溶液或NaHSO4溶液时,氢离子、氢氧根离子放电,则电解质质量不变,水量减少;
(3)
石墨棒为阳极,铁棒为阴极,电解CuSO4、NaCI溶液时,则铜离子、氢氧根离子、氯离子、氢离子放电,所以电解质和水量都减少;
(4)
以石墨为电极进行电解,惰性电极电解CuSO4溶液,则阴极铜离子放电析出铜,阳极水中氢氧根离子放电生成O2;
(5)
以石墨为电极进行电解,惰性电极电解HCl溶液或者NaCl溶液,阴极是氢离子放电产生氢气,阳极是氯离子放电产生氯气,两极分别放出气体,且体积比为1:1。
19.(1)2H2O-4e- =4H+ + O2↑
(2)阳极室中穿过阳离子交换膜的H+与阴极室中穿过阴离子交换膜的A 在浓缩室结合生成HA
【详解】(1)在阳极,水电离的OH 放电,电极反应为2H2O-4e- =4H+ + O2↑;
(2)在阳极OH 放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室;阴极中的A 通过阴离子交换膜从阴极进入浓缩室,使得乳酸浓度增大。
20. Cu AgNO3溶液 B Ag++e-=Ag 4AgNO3+2H2O4HNO3+4Ag↓+O2↑ N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol C(s)+H2O(g)=CO(g)+H2(g)△H=+128.3kJ mol-1
【详解】(1)①氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)中,金属Cu失电子被氧化为负极,得电子的阳离子Ag+是电解质中的阳离子,所以电解质可以选择AgNO3溶液;
②原电池反应,阳离子向正极移动,Ag电极上银离子得电子被还原,为正极,所以K+移向B;
③银电极发生的电极反应为溶液中的银离子得到电子析出银单质,电极反应为:Ag++e-=Ag;
④电解硝酸银溶液时,阳极上水电离出的氢氧根放电生成氧气,阴极银离子放电生成银单质,总反应化学方程式为4AgNO3+2H2O4HNO3+4Ag↓+O2↑;
(2)16.0g气态肼(N2H4)物质的量为0.5mol,在氧气中完全燃烧生成氮气和水,放出热量312kJ,1mol气态肼(N2H4)燃烧放热614kJ,反应的热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(l) H=-624kJ/mol;
(3)①C(s)+O2(g)=CO2(g) H1=-396.5kJ mol-1
②H2(g)+ O2=H2O(g) H2=-241.8kJ mol-1
③CO(g)+O2(g)=CO2(g) H3=-283.0kJ mol-1
根据盖斯定律,①-②-③得到:单质碳和水蒸气生成水煤气的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g) H=128.3kJ mol-1。
答案第1页,共2页
答案第1页,共2页
