第3章物质的性质与转化(含解析)章节测试2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第3章物质的性质与转化(含解析)章节测试2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 425.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 12:10:32 | ||
图片预览




文档简介
第3章 物质的性质与转化 章节测试
一、单选题(共13题)
1.下列说法正确的是
A.FeCl3可以用置换反应制取,Fe(OH)3可以用化合反应制取
B.元素周期表第三周期元素中氧化性最弱的简单离子是Al3+
C.NH3·H2O的碱性弱于NaOH是因为N的金属性弱于Na
D.验证铜与浓硫酸反应后试管中的白色不溶物为CuSO4,可向该试管中加入适量水
2.下列“实验结论”与“实验操作及现象”不相符的一组是
选项 实验操作及现象 实验结论
A 向KI―淀粉溶液中滴加氯水,溶液变成蓝色 氧化性:Cl2>I2
B 向蔗糖中滴加浓硫酸,蔗糖变黑 浓硫酸有吸水性
C 向某盐溶液中滴加KSCN溶液,溶液变为红色 该溶液中含有Fe3+
D 向某盐溶液中加入浓NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 该溶液中含有
A.A B.B C.C D.D
3.类推思维是化学解题中常用的一种思维方法,下列类推正确的是
A.Na与水反应生成NaOH和H2,则Fe与水反应生成Fe(OH)3和H2
B.Al在O2中燃烧生成Al2O3,则Fe在O2中燃烧生成Fe2O3
C.CO2可以使滴有酚酞的NaOH溶液颜色变浅,则SO2也可以使滴有酚酞的NaOH溶液颜色变浅
D.Na2O能与酸反应生成盐和水,Na2O是碱性氧化物,则Al2O3与酸反应生成盐和水,Al2O3是碱性氧化物
4.邯郸被誉为“中国成语典故之都”,据统计,与邯郸有关的成语典故共有1584条,下列说法错误的是
A.“背水一战”中“水”指河水,属于混合物
B.“完璧归赵”中“璧”属于金属材料
C.“火树银花”形容焰火的灿烂,燃放烟花的过程中发生了氧化还原反应
D.“纸上谈兵”中“纸”的制作中若用SO2处理纸浆,是利用SO2的漂白性
5.传统文化富载化学知识。下列叙述正确的是
A.《天工开物》中“凡乌金纸 每纸一张打金箔五十 ”,表明金属有导电性
B.“磁石,色轻紫,石上皲涩,可吸连针铁”中的“磁石”指石灰石
C.“雷雨发庄稼”“豆茬种谷,必定有福”,两过程中均涉及生物固氮
D.《神农本草经》中描述石胆“能化铁为铜”,“石胆”中含有铜元素
6.下列实验过程可以达到实验目的的是( )
选项 实验目的 操作过程
A 比较Fe3+和I2的氧化性强弱 向淀粉碘化钾溶液中滴入氯化铁溶液,溶液变蓝色
B 检验CO2 将CO2通入氯化钙溶液,有白色沉淀生成
C 检验NaHCO3与Na2CO3溶液 用小试管分别取少量溶液,然后滴加澄清石灰水
D 检验溶液中含有SO42- 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成
A.A B.B C.C D.D
7.某无色澄清稀溶液中含有下列几种离子中的多种:Mg2+、、Cu2+、K+、Cl-、、I-、OH-。为确认溶液组成进行如下实验:
(1)取100 mL原溶液,加入足量Ba(OH)2溶液,有白色沉淀生成,将沉淀过滤、洗涤、干燥,得沉淀2.91 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
(2)加热(1)所得滤液,产生能使湿润红色石蕊试纸变蓝的气体4.48 L(已换算成标准状况,假定产生的气体全部逸出)
(3)另取100 mL原溶液加入足量氯水,反应后的混合液加入苯,上层溶液呈紫色
(4)取(3)下层溶液,加入HNO3酸化后,加入AgNO3溶液,有沉淀生成。
关于原溶液的说法正确的是
A.,
B.Cu2+、OH-一定不存在,可能存在K+、
C.一定存在、Mg2+、、I-
D.可能存在Cl-、K+,且
8.下列方程式书写不正确的是
A.过氧化钠与水反应的方程式:2Na2O2+2H2O=4NaOH+O2↑
B.FeCl3溶液腐蚀铜板的离子反应方程式:2Fe3++Cu=2Fe2++Cu2+
C.Cl2溶于水的离子方程式:Cl2+H2O=Cl-+ClO-+2H+
D.向明矾溶液中加入Ba(OH)2溶液至Al3+刚好沉淀完全:2Al3++3SO+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
9.为了证明硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]晶体的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+
C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-
D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+
10.下列推断正确的是( )
A.NO、NO2都是大气污染气体,在空气中都能稳定存在
B.向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C.可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
11.要检验某无色溶液是否含有SO42-,下列操作最合理的是
A.加入Ba(NO3)2溶液后再加稀HNO3酸化
B.加入BaCl2溶液后再加盐酸酸化
C.加入稀HNO3(酸化)后再加Ba(NO3)2溶液
D.加入盐酸酸化后再加BaCl2溶液
12.下列方案设计、现象和结论都正确的是
实验方案 现象 结论
A 铜片加入装有浓硝酸稀硝酸的试管中 浓硝酸产生红棕色气体:稀硝酸产生无色气体,在试管口略显红棕色 稀硝酸的氧化性强于浓硝酸的氧化性
B 往溶液中加入无水乙醇 析出深蓝色固体 溶剂极性越小的溶解度越小
C 加热试管底部的固体 试管底部固体减少,中部的内壁上出现白色固体 固体受热升华
D 向加有酚酞的溶液中加入溶液 溶液的红色变深 与溶液反应生成
A.A B.B C.C D.D
13.碳酸亚铁与砂糖混用为补血剂。实验室用如下装置和步骤可以制备(易被氧化)。下列说法错误的是
步骤一:实验中先关闭活塞2,打开活塞1和3;
步骤二:一段时间后,关闭活塞3,打开活塞2,在c瓶中得到产品。
A.步骤一的目的是排尽装置中的空气,防止Fe2+被氧化
B.步骤二可使溶液和溶液混合
C.装置c中发生的离子反应为
D.装置d的主要作用:吸收尾气,防止污染空气
二、填空题(共7题)
14.为了探究AgNO3的氧化性,某化学兴趣小组设计了如下实验。
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
请完成如表:
操作 现象 结论
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 存在Fe3+
取少量除尽Ag+后的溶液于试管中,加入 ,振荡 存在Fe2+
【实验结论】Fe的氧化产物为Fe2+和Fe3+。
15.碳酸锰(MnCO3) 是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1) 工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3 ↓+ (NH4)2 SO4+CO2 ↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4。加入稍过量的NH4HCO3的目的是 。
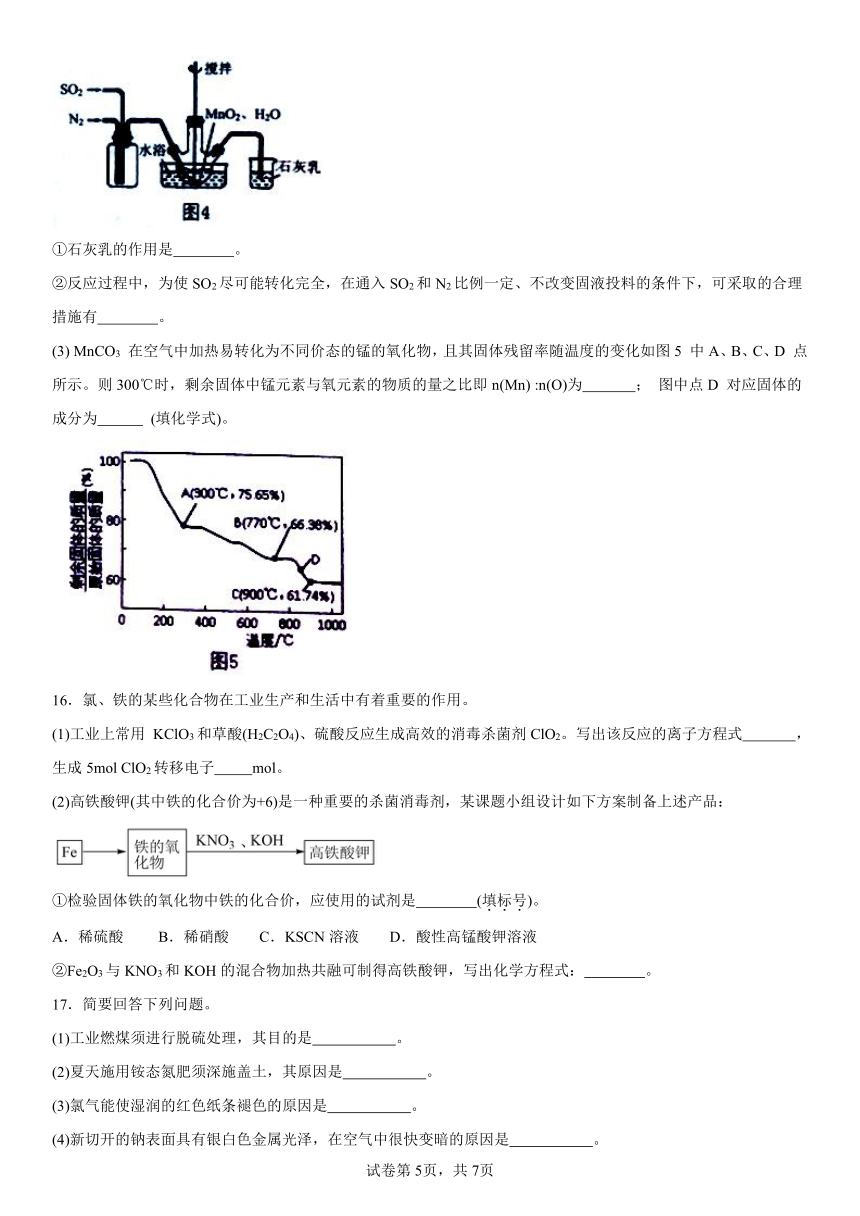
(2) 实验室模拟工业二氧化锰制备硫酸锰装置如图4所示。
①石灰乳的作用是 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
(3) MnCO3 在空气中加热易转化为不同价态的锰的氧化物,且其固体残留率随温度的变化如图5 中A、B、C、D 点所示。则300℃时,剩余固体中锰元素与氧元素的物质的量之比即n(Mn) :n(O)为 ; 图中点D 对应固体的成分为 (填化学式)。
16.氯、铁的某些化合物在工业生产和生活中有着重要的作用。
(1)工业上常用 KClO3和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2。写出该反应的离子方程式 ,生成5mol ClO2转移电子 mol。
(2)高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述产品:
①检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)。
A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.酸性高锰酸钾溶液
②Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸钾,写出化学方程式: 。
17.简要回答下列问题。
(1)工业燃煤须进行脱硫处理,其目的是 。
(2)夏天施用铵态氮肥须深施盖土,其原因是 。
(3)氯气能使湿润的红色纸条褪色的原因是 。
(4)新切开的钠表面具有银白色金属光泽,在空气中很快变暗的原因是 。
18.(1) Fe2(SO4)3在水溶液中的电离方程式: 。
(2)小苏打的化学式是: 。
(3)相同质量的CO2和CO所含的原子个数比是: 。
(4)实验室制氯气的化学方程式是MnO2+4HCl(浓)MnCl 2+Cl2↑+2H2O,若有87 gMnO2参加反应,则被氧化的氯化氢的物质的量为 mol。
(5)电子工业需用FeCl3溶液腐蚀绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式 。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液。现有下列试剂,需要用到的一组物质是 。
①烧碱 ②浓盐酸 ③铁粉 ④氯气 ⑤浓氨水
A.②③④ B.②④⑤ C.①②③ D.①②④
19.利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
(1)写出化学式:Y ,Z 。
(2)X与Y能否共存 (填“能”或“不能”),若不能请写出化学方程式若能请说明理由 。
(3)Na2SO3与足量Z反应的离子方程式 。
(4)Na2S2O3是重要的化工原料。Na2S2O3中硫元素的化合价为 ,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是 (填序号)。
a.Na2S+S b.Na2S2O3+S c.Na2SO4+SO2 d.Na2SO3+SO3
(5)Y与稀硝酸反应,硝酸的还原产物为NO,写出反应的化学方程式: 。
20.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。下图所示是硫及其部分化合物的“价类二维图”。根据图示回答下列问题:
(1)将与混合,可生成淡黄色固体,该反应的氧化产物与还原产物的质量之比为 。
(2)粉与浓溶液混合加热反应,反应的化学方程式为 。
(3)欲制备,从氧化还原角度分析,下列合理的是___________(选填字母)。
A. B.
C. D.
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】试题分析:A.溴化铁溶液中通入氯气反应生成FeCl3和溴,属于置换反应,氢氧化亚铁与氧气、水化合生成Fe(OH)3,故A正确;B.元素周期表第三周期元素中氧化性最弱的简单离子是钠离子,故B错误;C.NH3·H2O不是N的最高价氧化物的水化物,故C错误;D.验证铜与浓硫酸反应后试管中的白色不溶物为CuSO4,应该将反应后的物质倒入水中检验,故D错误;故选A。
考点:考查了元素及其化合物的性质的相关知识。
2.B
【详解】A.氯气与KI反应生成碘,由操作和现象可知氧化性:Cl2>I2,故A正确;
B.浓硫酸使蔗糖脱水后,C与浓硫酸发生氧化还原反应,现象与吸水性无关,故B错误;
C.滴加KSCN溶液,溶液变为红色,可知含铁离子,由操作和现象可知溶液中含有Fe3+,故C正确;
D.氨气可使湿润的红色石蕊试纸变蓝,由操作和现象可知溶液中含有,故D正确;
故选B。
【点睛】本题考查化学实验方案的评价,把握物质的性质、反应与现象、离子检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,难点B,浓硫酸使蔗糖脱水后,C与浓硫酸发生氧化还原反应,与吸水性无关。
3.C
【详解】A. Na与水反应生成NaOH和H2,但Fe的金属性比Na的金属性弱,所以铁和水不反应,但在高温下能和水蒸气反应,生成Fe3O4和H2,A错误;
B. Al在O2中燃烧生成Al2O3,Fe在O2中燃烧生成Fe3O4,B错误;
C. CO2和SO2均为酸性氧化物,CO2可以使滴有酚酞的NaOH溶液颜色变浅,则SO2也可以使滴有酚酞的NaOH溶液颜色变浅,C正确;
D. Na2O能与酸反应生成盐和水,Na2O是碱性氧化物,Al2O3与酸反应生成盐和水,但Al2O3也能和碱反应生成盐和水,所以Al2O3是两性氧化物,D错误;
故答案选C。
4.B
【详解】A.“水”指河水,属于混合物,A正确;
B.“完璧归赵”中“璧”指和氏璧,是古代的一种玉器,主要成分是硅酸盐,属于无机非金属材料,B错误;
C.“火树银花”形容焰火的灿烂,燃放烟花的过程中发生了氧化还原反应,C正确;
D.“纸”的制作中若用SO2处理纸浆,是利用了SO2的漂白性,D正确;
故选B。
5.D
【详解】A.将金转化成“箔”,表明金属有延展性,故A错误;
B.“磁石”的主要成分是四氧化三铁,故B错误;
C.“雷雨发庄稼”指空气中的氮气在雷电作用下转化成NO再进一步转化成硝酸盐,不属于生物固氮,故C错误;
D.描述的反应是硫酸铜和Fe发生置换反应生成Cu,“石胆”成分是硫酸铜,含有铜元素,故D正确;
答案选D。
6.A
【详解】A.向淀粉碘化钾溶液中滴入氯化铁溶液,溶液变蓝色,说明生成了I2,I元素被氧化,Fe元素被还原,Fe3+作氧化剂,I2作氧化产物,因此氧化性:Fe3+>I2,能够达到实验目的,故A符合题意;
B.CO2与CaCl2溶液不发生化学反应,不会生成白色沉淀,故B不符合题意;
C.NaHCO3与Na2CO3溶液与Ca(OH)2均会发生化学反应生成CaCO3沉淀,因此不能达到实验目的,故C不符合题意;
D.硝酸能够将亚硫酸根离子、亚硫酸氢根离子氧化为硫酸根离子,该实验不能排除亚硫酸根离子、亚硫酸氢根离子的干扰,故不能达到实验目的,故D不符合题意;
故答案为:A。
【点睛】向某溶液中加入盐酸酸化的,溶液中含有、Ag+时,溶液中会生成白色沉淀,同时还需要注意,若溶液中含有时,、会被硝酸氧化而生成,与Ba2+会发生反应而生成白色沉淀,但同时也有气体产生。
7.C
【详解】A.取少量该溶液加入Ba(OH)2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,说明白色沉淀为Mg(OH)2和BaSO4,二者质量和是2.91 g,则溶液中含有Mg2+、,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶,则硫酸钡的质量是2.33 g,所以离子的物质的量n()=;;Mg(OH)2的质量是m[Mg(OH)2]=2.91 g-2.33 g=0.58 g,Mg2+离子的物质的量为n(Mg2+)=n[Mg(OH)2]=;加热(1)所得滤液,产生能使湿润红色石蕊试纸变蓝的气体是NH3,其物质的量n(NH3)=,说明溶液中有的物质的量是0.05 mol,则,所以离子浓度,A错误;
B.无色澄清稀溶液,不存在蓝色Cu2+,由于溶液中含有Mg2+、,因此一定不存在OH-,而一定存在,B错误;
C.取原溶液加入足量氯水,反应后的混合液加入苯,上层溶液呈紫色,说明存在I-,根据选项A分析可知,溶液中存在一定存在、Mg2+、,C正确;
D.在(3)中加入足量氯水,再取(3)下层溶液,加入HNO3酸化后,加入AgNO3溶液,有沉淀生成,该沉淀是AgCl,但由于加入的氯水中引入了Cl-,因此不能判断原溶液中是否存在Cl-,因此就不能出判断和的相对大小,D错误;
故合理选项是C。
8.C
【详解】A.过氧化钠与水反应,生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,A正确;
B.Fe3+可与Cu反应,生成亚铁离子和铜离子,FeCl3溶液腐蚀铜板的离子反应方程式为2Fe3++Cu=2Fe2++Cu2+,B正确;
C.次氯酸为弱电解质,正确的离子方程式为,C错误;
D.向明矾溶液中加入Ba(OH)2溶液至Al3+刚好沉淀完全,离子方程式为2Al3++3SO+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓,D正确;
故答案选C。
9.B
【详解】A、晶体加热后生成液体可以判断是生成的水,证明晶体中含结晶水,故A正确;
B、应取少量样品于试管中,加入浓NaOH溶液,并适当加热,若产生的气体能使湿润的红色石蕊试纸变蓝,即产生NH3,则证明硫酸亚铁铵中含有NH4+,故B错误;
C、加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-,这是硫酸根离子的检验方法,故C正确;
D、溶液呈浅绿色证明试样溶液中含有Fe2+滴入KSCN溶液,溶液不显红色,再向试管中滴加几滴新配制的氯水,溶液的颜色变为红色,说明有Fe3+存在,这个结果间接地说明在原溶液中有Fe2+存在,故D正确;
故选B。
10.D
【详解】A.NO不稳定,极易被氧气氧化生成NO2,反应方程式为2NO+O2=2NO2,故A错误;
B.氯化铝与氨水反应生成氢氧化铝沉淀,反应方程式为AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl,Al(OH)3能溶于强碱溶液但不溶于弱碱溶液,氨水属于弱碱,所以氢氧化铝不溶于氨水,故B错误;
C.浓硫酸与铜需在加热条件下才能反应,加热条件下铝与浓硫酸也能反应,所以不能用浓硫酸除去镀在铝表面的铜镀层,故C错误;
D.Cu与稀硫酸不反应,加入硝酸钾后,溶液中存在硝酸根离子、氢离子,则Cu与硝酸可发生反应,所以铜粉溶解,故D正确;
故选D。
【点睛】本题的易错点为C,要注意常温下,铝与浓硫酸发生钝化,钝化属于化学变化,难点为D,要注意硝酸具有强氧化性,能够与铜反应。
11.D
【详解】检验SO42-时不能用硝酸酸化,因SO32-(HSO3-)能被氧化成SO42-;也不能先加氯化钡溶液再加盐酸,因若溶液中有Ag+,生成AgCl不溶于HCl。答案选D。
12.B
【详解】A.铜片和浓硝酸反应生成二氧化氮,和稀硝酸反应生成一氧化氮,一氧化氮和空气中的氧气反应生成红棕色的二氧化氮,该实验说明浓硝酸的氧化性强于稀硝酸的氧化性,故A错误;
B.在乙醇中的溶解度小于在水中的溶解度,所以加入乙醇的目的是降低溶剂的极性,促使晶体析出,说明溶剂极性越小的溶解度越小,故B正确;
C.加热试管底部的固体,发生分解生成氨气和HCl气体,氨气和HCl气体在试管中部遇冷又反应生成固体,不是因为固体受热升华,故C错误;
D.向加有酚酞的溶液中加入溶液,溶液碱性增强,溶液的红色变深,但不能说明反应生成了,故D错误;
故选B。
13.D
【详解】A.步骤一实验中先关闭活塞2,打开活塞1和3,使产生的氢气通入c装置,的目的是排尽装置中的空气,防止Fe2+被氧化,故A正确;
B.步骤二反应一段时间后,关闭活塞3,打开活塞2,产生的氢气使b装置内压强增大,将产生的溶液压入c,和溶液混合,故B正确;
C.装置c中发生的离子反应为,故C正确;
D.装置d的主要作用是液封,防止空气进入c装置,将产物氧化,故D错误;
故答案为D
14. 溶液呈红色 K3[Fe(CN)6]溶液 产生蓝色沉淀
【分析】根据三价铁和二价铁的性质的特殊性,利用反应现象的特别进行判断。
【详解】Fe3+遇KSCN溶液,溶液变红色。由于氯水与Fe2+反应,现象不明显,应直接用K3[Fe(CN)6]溶液检验,若有蓝色沉淀出现,则证明Fe2+存在,否则不存在。
15. 使MnSO4充分反应,提高MnSO4的利用率;NH4HCO3易分解 吸收多余的SO2,减少对环境的污染 减慢通入气体的流速 1: 2 Mn3O4、MnO
【详解】试题分析:本题考查反应条件的控制,与SO2有关的实验,热重图象题的计算。
(1)加入稍过量的NH4HCO3可以使MnSO4充分反应,提高MnSO4的利用率,NH4HCO3易分解,所以NH4HCO3要稍过量。
(2)①根据装置图,在三颈烧瓶中SO2与MnO2反应制得MnSO4,由于SO2污染大气,用石灰乳吸收多余的SO2,减少对环境的污染,反应为SO2+Ca(OH)2=CaSO3+H2O。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有:缓慢通入混合气体使混合气体与MnO2充分作用,适当控制温度。
(3)设MnCO3物质的量为1mol,m(MnCO3)=1mol115g/mol=115g,其中n(Mn)=1mol。300℃,剩余固体的质量为115g75.65%=87g,其中m(O)=87g-55g=32g,n(O)=32g16g/mol=2mol,n(Mn):n(O)=1:2。由图可见D点固体由B点和C点的固体混合而成,B点,剩余固体的质量为115g66.38%=76.34g,其中n(O)==1.334mol,n(Mn):n(O)=1mol:1.334mol=3:4,B点固体为Mn3O4;C点,剩余固体的质量为115g61.74%=71g,其中n(O)==1mol,n(Mn):n(O)=1mol:1mol=1:1,C点固体为MnO;D点对应固体成分为Mn3O4、MnO。
16.(1) 2ClO+H2C2O4+2H+ =2ClO2+2CO2+2H2O 5
(2) ACD 1Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O
【分析】本题主要考查物质的制备。
【详解】(1),和硫酸反应的化学方式,离子方程式,有方程式可知,生成2,反应转移2电子,则生成5转移5电子。
(2)①检验固体铁的氧化物应先加酸溶解固体,由于稀硝酸具有强氧化性,能将氧化,不能选择硝酸,向溶解后的溶液中加溶液,检验是否存在,再加入酸性高锰酸钾溶液,检验是否有,则检验固体中铁的氧化物中铁的化合价,应选用试剂是稀硫酸,硫氰化钾,酸性高锰酸钾溶液,故选ACD;
②由题意知,,,加热共融发生氧化还原反应,反应式为。
17.(1)减少二氧化硫的产生,减少对环境的污染
(2)夏天温度较高,铵态氮肥容易分解,挥发出氨气而失效
(3)氯气与水反应生成具有漂白作用的次氯酸
(4)钠单质氧化生成白色氧化钠固体覆盖在银白色金属光泽表面
【详解】(1)工业燃煤须进行脱硫处理,其目的是:减少燃烧时二氧化硫的产生,减少对环境的污染。
(2)夏天施用铵态氮肥须深施盖土,其原因是:夏天温度较高,铵态氮肥容易分解,挥发出氨气而失效。
(3)氯气能使湿润的红色纸条褪色的原因是:氯气与水反应生成具有漂白作用的次氯酸。
(4)新切开的钠表面具有银白色金属光泽,在空气中很快变暗的原因是:钠单质具有银白色金属光泽,且易被空气氧化生成白色氧化钠,白色固体覆盖在银白色金属光泽表面看起来变暗。
18. Fe2(SO4)3=2Fe3++3 NaHCO3 21:22 2 2FeCl3+Cu═CuCl2+2FeCl2 A
【详解】(1) Fe2(SO4)3在水溶液中的电离产生铁离子和硫酸根离子,其电离方程式为:Fe2(SO4)3=2Fe3++3;
(2) 碳酸氢钠又名小苏打,化学式为NaHCO3;
(3)令CO和CO2的质量都是1g,CO的物质的量==mol,CO2的物质的量==mol,根CO和CO2分子数目之比=mol:mol=11:7;每个CO分子含有2个原子,原子物质的量为CO的2倍,每个CO2分子含有3个原子,含有原子物质的量为二氧化碳的3倍,故CO2和CO含有原子数目之比=7×3:11×2=21:22;
(4)由方程式MnO2+4HCl(浓)MnCl 2+Cl2↑+2H2O可知,当有1molMnO2参加反应,有4molHCl参加反应,但生成1molCl2,说明有2molHCl被氧化,则若有87 gMnO2参加反应,n(MnO2)==1mol,则被氧化的氯化氢的物质的量为2mol;
(5)FeCl3中铁元素是+3价,最高价态,有氧化性,能被还原剂还原呈+2价,铜单质是0价最低价,具有还原性,能被氧化成+2价,所以方程式为:2FeCl3+Cu═CuCl2+2FeCl2;
若从腐蚀后的废液中回收铜并重新获得FeC13溶液,提供的试剂有:①烧碱 ②浓盐酸 ③铁粉 ④氯气 ⑤浓氨水,则应该首先向溶液中加入过量的Fe粉末,发生反应得到纯净的FeCl2溶液,把过量的Fe和置换出的Cu过滤出来,向滤渣中加入盐酸使Fe发生反应得到FeCl2溶液,再过滤除去Cu,把两次的滤液合并,再向其中通入过量的氯气就得到了FeC13溶液,所以需要用到的一组物质是②③④;
答案选A。
19.(1) SO2 H2SO4
(2) 不能 2H2S+SO2=2H2O+3S↓
(3)+2H+=SO2↑+H2O
(4) +2 b
(5)3SO2+2HNO3+2H2O=3H2SO4+2NO
【详解】(1)Y是+4价的氧化物,则Y为SO2,Z为+6价的酸,则Z为H2SO4;故答案为:SO2;H2SO4。
(2)X(H2S)与Y(SO2)发生氧化还原反应生成硫单质和水,因此不能共存,其反应方程式为2H2S+SO2=2H2O+3S↓;故答案为:不能;2H2S+SO2=2H2O+3S↓。
(3)Na2SO3与足量Z反应生成硫酸钠、二氧化硫和水,其反应的离子方程式+2H+=SO2↑+H2O;故答案为:+2H+=SO2↑+H2O。
(4)Na化合价为+1价,O为 2价,则Na2S2O3中硫元素的化合价为+2价,从氧化还原反应的角度分析,要发生反应必须是一个物质中S化合价比+2价高,S化合价比+2价低,a.Na2S+S,硫的化合价都比+2价低,因此a不符合题意;b.Na2SO3+S,前者为+4价,后者为0价,因此b符合题意;c.Na2SO4+SO2,前者为+6价,后者为+4价,都比+2价高,因此c不符合题意;d.Na2SO3+SO3,硫的价态都比+2价低,因此d不符合题意;故答案为:+2;b。
(5)Y与稀硝酸反应,硝酸的还原产物为NO,则氧化产物为硫酸,其反应的化学方程式:3SO2+2HNO3+2H2O=3H2SO4+2NO;故答案为:3SO2+2HNO3+2H2O=3H2SO4+2NO。
20.(1)
(2)
(3)B
【分析】从图中可以看出,X为硫的氢化物,且S显-2价,所以X为H2S;W为硫元素显+6价的酸,所以W为H2SO4。
【详解】(1)将H2S与SO2混合,生成的淡黄色固体为硫,化学方程式为2H2S+SO2=3S+2H2O,该反应的氧化产物(由H2S生成)与还原产物(由SO2生成)的质量之比为2:1。答案为:2:1;
(2)Cu与浓硫酸混合加热可以发生反应,生成硫酸铜、二氧化硫和水,该反应的化学方程式为:。
(3)在Na2S2O3中,S显+2价。
A.Na2S和S中,S元素的化合价分别为-2、0价,反应产物中S元素的价态不可能为+2价;
B.Na2SO3和S中,S元素的化合价分别为+4、0价,反应产物中S元素的价态可能为+2价;
C.Na2SO3和Na2SO4中,S元素的化合价分别为+4、+6价,反应产物中S元素的价态不可能为+2价;
D.SO2和Na2SO3中,S元素的化合价都为+4价,反应产物中S元素的价态一定为+4价;
综合以上分析,只有B符合题意,故选B。
答案为B。
【点睛】归中反应中,产物中变价元素的化合价一定位于反应物中该变价元素的价态之间。
答案第1页,共2页
答案第1页,共2页
一、单选题(共13题)
1.下列说法正确的是
A.FeCl3可以用置换反应制取,Fe(OH)3可以用化合反应制取
B.元素周期表第三周期元素中氧化性最弱的简单离子是Al3+
C.NH3·H2O的碱性弱于NaOH是因为N的金属性弱于Na
D.验证铜与浓硫酸反应后试管中的白色不溶物为CuSO4,可向该试管中加入适量水
2.下列“实验结论”与“实验操作及现象”不相符的一组是
选项 实验操作及现象 实验结论
A 向KI―淀粉溶液中滴加氯水,溶液变成蓝色 氧化性:Cl2>I2
B 向蔗糖中滴加浓硫酸,蔗糖变黑 浓硫酸有吸水性
C 向某盐溶液中滴加KSCN溶液,溶液变为红色 该溶液中含有Fe3+
D 向某盐溶液中加入浓NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 该溶液中含有
A.A B.B C.C D.D
3.类推思维是化学解题中常用的一种思维方法,下列类推正确的是
A.Na与水反应生成NaOH和H2,则Fe与水反应生成Fe(OH)3和H2
B.Al在O2中燃烧生成Al2O3,则Fe在O2中燃烧生成Fe2O3
C.CO2可以使滴有酚酞的NaOH溶液颜色变浅,则SO2也可以使滴有酚酞的NaOH溶液颜色变浅
D.Na2O能与酸反应生成盐和水,Na2O是碱性氧化物,则Al2O3与酸反应生成盐和水,Al2O3是碱性氧化物
4.邯郸被誉为“中国成语典故之都”,据统计,与邯郸有关的成语典故共有1584条,下列说法错误的是
A.“背水一战”中“水”指河水,属于混合物
B.“完璧归赵”中“璧”属于金属材料
C.“火树银花”形容焰火的灿烂,燃放烟花的过程中发生了氧化还原反应
D.“纸上谈兵”中“纸”的制作中若用SO2处理纸浆,是利用SO2的漂白性
5.传统文化富载化学知识。下列叙述正确的是
A.《天工开物》中“凡乌金纸 每纸一张打金箔五十 ”,表明金属有导电性
B.“磁石,色轻紫,石上皲涩,可吸连针铁”中的“磁石”指石灰石
C.“雷雨发庄稼”“豆茬种谷,必定有福”,两过程中均涉及生物固氮
D.《神农本草经》中描述石胆“能化铁为铜”,“石胆”中含有铜元素
6.下列实验过程可以达到实验目的的是( )
选项 实验目的 操作过程
A 比较Fe3+和I2的氧化性强弱 向淀粉碘化钾溶液中滴入氯化铁溶液,溶液变蓝色
B 检验CO2 将CO2通入氯化钙溶液,有白色沉淀生成
C 检验NaHCO3与Na2CO3溶液 用小试管分别取少量溶液,然后滴加澄清石灰水
D 检验溶液中含有SO42- 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成
A.A B.B C.C D.D
7.某无色澄清稀溶液中含有下列几种离子中的多种:Mg2+、、Cu2+、K+、Cl-、、I-、OH-。为确认溶液组成进行如下实验:
(1)取100 mL原溶液,加入足量Ba(OH)2溶液,有白色沉淀生成,将沉淀过滤、洗涤、干燥,得沉淀2.91 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
(2)加热(1)所得滤液,产生能使湿润红色石蕊试纸变蓝的气体4.48 L(已换算成标准状况,假定产生的气体全部逸出)
(3)另取100 mL原溶液加入足量氯水,反应后的混合液加入苯,上层溶液呈紫色
(4)取(3)下层溶液,加入HNO3酸化后,加入AgNO3溶液,有沉淀生成。
关于原溶液的说法正确的是
A.,
B.Cu2+、OH-一定不存在,可能存在K+、
C.一定存在、Mg2+、、I-
D.可能存在Cl-、K+,且
8.下列方程式书写不正确的是
A.过氧化钠与水反应的方程式:2Na2O2+2H2O=4NaOH+O2↑
B.FeCl3溶液腐蚀铜板的离子反应方程式:2Fe3++Cu=2Fe2++Cu2+
C.Cl2溶于水的离子方程式:Cl2+H2O=Cl-+ClO-+2H+
D.向明矾溶液中加入Ba(OH)2溶液至Al3+刚好沉淀完全:2Al3++3SO+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
9.为了证明硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]晶体的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+
C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-
D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+
10.下列推断正确的是( )
A.NO、NO2都是大气污染气体,在空气中都能稳定存在
B.向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C.可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
11.要检验某无色溶液是否含有SO42-,下列操作最合理的是
A.加入Ba(NO3)2溶液后再加稀HNO3酸化
B.加入BaCl2溶液后再加盐酸酸化
C.加入稀HNO3(酸化)后再加Ba(NO3)2溶液
D.加入盐酸酸化后再加BaCl2溶液
12.下列方案设计、现象和结论都正确的是
实验方案 现象 结论
A 铜片加入装有浓硝酸稀硝酸的试管中 浓硝酸产生红棕色气体:稀硝酸产生无色气体,在试管口略显红棕色 稀硝酸的氧化性强于浓硝酸的氧化性
B 往溶液中加入无水乙醇 析出深蓝色固体 溶剂极性越小的溶解度越小
C 加热试管底部的固体 试管底部固体减少,中部的内壁上出现白色固体 固体受热升华
D 向加有酚酞的溶液中加入溶液 溶液的红色变深 与溶液反应生成
A.A B.B C.C D.D
13.碳酸亚铁与砂糖混用为补血剂。实验室用如下装置和步骤可以制备(易被氧化)。下列说法错误的是
步骤一:实验中先关闭活塞2,打开活塞1和3;
步骤二:一段时间后,关闭活塞3,打开活塞2,在c瓶中得到产品。
A.步骤一的目的是排尽装置中的空气,防止Fe2+被氧化
B.步骤二可使溶液和溶液混合
C.装置c中发生的离子反应为
D.装置d的主要作用:吸收尾气,防止污染空气
二、填空题(共7题)
14.为了探究AgNO3的氧化性,某化学兴趣小组设计了如下实验。
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
请完成如表:
操作 现象 结论
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 存在Fe3+
取少量除尽Ag+后的溶液于试管中,加入 ,振荡 存在Fe2+
【实验结论】Fe的氧化产物为Fe2+和Fe3+。
15.碳酸锰(MnCO3) 是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1) 工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3 ↓+ (NH4)2 SO4+CO2 ↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4。加入稍过量的NH4HCO3的目的是 。
(2) 实验室模拟工业二氧化锰制备硫酸锰装置如图4所示。
①石灰乳的作用是 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
(3) MnCO3 在空气中加热易转化为不同价态的锰的氧化物,且其固体残留率随温度的变化如图5 中A、B、C、D 点所示。则300℃时,剩余固体中锰元素与氧元素的物质的量之比即n(Mn) :n(O)为 ; 图中点D 对应固体的成分为 (填化学式)。
16.氯、铁的某些化合物在工业生产和生活中有着重要的作用。
(1)工业上常用 KClO3和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2。写出该反应的离子方程式 ,生成5mol ClO2转移电子 mol。
(2)高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述产品:
①检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)。
A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.酸性高锰酸钾溶液
②Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸钾,写出化学方程式: 。
17.简要回答下列问题。
(1)工业燃煤须进行脱硫处理,其目的是 。
(2)夏天施用铵态氮肥须深施盖土,其原因是 。
(3)氯气能使湿润的红色纸条褪色的原因是 。
(4)新切开的钠表面具有银白色金属光泽,在空气中很快变暗的原因是 。
18.(1) Fe2(SO4)3在水溶液中的电离方程式: 。
(2)小苏打的化学式是: 。
(3)相同质量的CO2和CO所含的原子个数比是: 。
(4)实验室制氯气的化学方程式是MnO2+4HCl(浓)MnCl 2+Cl2↑+2H2O,若有87 gMnO2参加反应,则被氧化的氯化氢的物质的量为 mol。
(5)电子工业需用FeCl3溶液腐蚀绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式 。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液。现有下列试剂,需要用到的一组物质是 。
①烧碱 ②浓盐酸 ③铁粉 ④氯气 ⑤浓氨水
A.②③④ B.②④⑤ C.①②③ D.①②④
19.利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
(1)写出化学式:Y ,Z 。
(2)X与Y能否共存 (填“能”或“不能”),若不能请写出化学方程式若能请说明理由 。
(3)Na2SO3与足量Z反应的离子方程式 。
(4)Na2S2O3是重要的化工原料。Na2S2O3中硫元素的化合价为 ,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是 (填序号)。
a.Na2S+S b.Na2S2O3+S c.Na2SO4+SO2 d.Na2SO3+SO3
(5)Y与稀硝酸反应,硝酸的还原产物为NO,写出反应的化学方程式: 。
20.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。下图所示是硫及其部分化合物的“价类二维图”。根据图示回答下列问题:
(1)将与混合,可生成淡黄色固体,该反应的氧化产物与还原产物的质量之比为 。
(2)粉与浓溶液混合加热反应,反应的化学方程式为 。
(3)欲制备,从氧化还原角度分析,下列合理的是___________(选填字母)。
A. B.
C. D.
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】试题分析:A.溴化铁溶液中通入氯气反应生成FeCl3和溴,属于置换反应,氢氧化亚铁与氧气、水化合生成Fe(OH)3,故A正确;B.元素周期表第三周期元素中氧化性最弱的简单离子是钠离子,故B错误;C.NH3·H2O不是N的最高价氧化物的水化物,故C错误;D.验证铜与浓硫酸反应后试管中的白色不溶物为CuSO4,应该将反应后的物质倒入水中检验,故D错误;故选A。
考点:考查了元素及其化合物的性质的相关知识。
2.B
【详解】A.氯气与KI反应生成碘,由操作和现象可知氧化性:Cl2>I2,故A正确;
B.浓硫酸使蔗糖脱水后,C与浓硫酸发生氧化还原反应,现象与吸水性无关,故B错误;
C.滴加KSCN溶液,溶液变为红色,可知含铁离子,由操作和现象可知溶液中含有Fe3+,故C正确;
D.氨气可使湿润的红色石蕊试纸变蓝,由操作和现象可知溶液中含有,故D正确;
故选B。
【点睛】本题考查化学实验方案的评价,把握物质的性质、反应与现象、离子检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,难点B,浓硫酸使蔗糖脱水后,C与浓硫酸发生氧化还原反应,与吸水性无关。
3.C
【详解】A. Na与水反应生成NaOH和H2,但Fe的金属性比Na的金属性弱,所以铁和水不反应,但在高温下能和水蒸气反应,生成Fe3O4和H2,A错误;
B. Al在O2中燃烧生成Al2O3,Fe在O2中燃烧生成Fe3O4,B错误;
C. CO2和SO2均为酸性氧化物,CO2可以使滴有酚酞的NaOH溶液颜色变浅,则SO2也可以使滴有酚酞的NaOH溶液颜色变浅,C正确;
D. Na2O能与酸反应生成盐和水,Na2O是碱性氧化物,Al2O3与酸反应生成盐和水,但Al2O3也能和碱反应生成盐和水,所以Al2O3是两性氧化物,D错误;
故答案选C。
4.B
【详解】A.“水”指河水,属于混合物,A正确;
B.“完璧归赵”中“璧”指和氏璧,是古代的一种玉器,主要成分是硅酸盐,属于无机非金属材料,B错误;
C.“火树银花”形容焰火的灿烂,燃放烟花的过程中发生了氧化还原反应,C正确;
D.“纸”的制作中若用SO2处理纸浆,是利用了SO2的漂白性,D正确;
故选B。
5.D
【详解】A.将金转化成“箔”,表明金属有延展性,故A错误;
B.“磁石”的主要成分是四氧化三铁,故B错误;
C.“雷雨发庄稼”指空气中的氮气在雷电作用下转化成NO再进一步转化成硝酸盐,不属于生物固氮,故C错误;
D.描述的反应是硫酸铜和Fe发生置换反应生成Cu,“石胆”成分是硫酸铜,含有铜元素,故D正确;
答案选D。
6.A
【详解】A.向淀粉碘化钾溶液中滴入氯化铁溶液,溶液变蓝色,说明生成了I2,I元素被氧化,Fe元素被还原,Fe3+作氧化剂,I2作氧化产物,因此氧化性:Fe3+>I2,能够达到实验目的,故A符合题意;
B.CO2与CaCl2溶液不发生化学反应,不会生成白色沉淀,故B不符合题意;
C.NaHCO3与Na2CO3溶液与Ca(OH)2均会发生化学反应生成CaCO3沉淀,因此不能达到实验目的,故C不符合题意;
D.硝酸能够将亚硫酸根离子、亚硫酸氢根离子氧化为硫酸根离子,该实验不能排除亚硫酸根离子、亚硫酸氢根离子的干扰,故不能达到实验目的,故D不符合题意;
故答案为:A。
【点睛】向某溶液中加入盐酸酸化的,溶液中含有、Ag+时,溶液中会生成白色沉淀,同时还需要注意,若溶液中含有时,、会被硝酸氧化而生成,与Ba2+会发生反应而生成白色沉淀,但同时也有气体产生。
7.C
【详解】A.取少量该溶液加入Ba(OH)2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,说明白色沉淀为Mg(OH)2和BaSO4,二者质量和是2.91 g,则溶液中含有Mg2+、,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶,则硫酸钡的质量是2.33 g,所以离子的物质的量n()=;;Mg(OH)2的质量是m[Mg(OH)2]=2.91 g-2.33 g=0.58 g,Mg2+离子的物质的量为n(Mg2+)=n[Mg(OH)2]=;加热(1)所得滤液,产生能使湿润红色石蕊试纸变蓝的气体是NH3,其物质的量n(NH3)=,说明溶液中有的物质的量是0.05 mol,则,所以离子浓度,A错误;
B.无色澄清稀溶液,不存在蓝色Cu2+,由于溶液中含有Mg2+、,因此一定不存在OH-,而一定存在,B错误;
C.取原溶液加入足量氯水,反应后的混合液加入苯,上层溶液呈紫色,说明存在I-,根据选项A分析可知,溶液中存在一定存在、Mg2+、,C正确;
D.在(3)中加入足量氯水,再取(3)下层溶液,加入HNO3酸化后,加入AgNO3溶液,有沉淀生成,该沉淀是AgCl,但由于加入的氯水中引入了Cl-,因此不能判断原溶液中是否存在Cl-,因此就不能出判断和的相对大小,D错误;
故合理选项是C。
8.C
【详解】A.过氧化钠与水反应,生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,A正确;
B.Fe3+可与Cu反应,生成亚铁离子和铜离子,FeCl3溶液腐蚀铜板的离子反应方程式为2Fe3++Cu=2Fe2++Cu2+,B正确;
C.次氯酸为弱电解质,正确的离子方程式为,C错误;
D.向明矾溶液中加入Ba(OH)2溶液至Al3+刚好沉淀完全,离子方程式为2Al3++3SO+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓,D正确;
故答案选C。
9.B
【详解】A、晶体加热后生成液体可以判断是生成的水,证明晶体中含结晶水,故A正确;
B、应取少量样品于试管中,加入浓NaOH溶液,并适当加热,若产生的气体能使湿润的红色石蕊试纸变蓝,即产生NH3,则证明硫酸亚铁铵中含有NH4+,故B错误;
C、加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-,这是硫酸根离子的检验方法,故C正确;
D、溶液呈浅绿色证明试样溶液中含有Fe2+滴入KSCN溶液,溶液不显红色,再向试管中滴加几滴新配制的氯水,溶液的颜色变为红色,说明有Fe3+存在,这个结果间接地说明在原溶液中有Fe2+存在,故D正确;
故选B。
10.D
【详解】A.NO不稳定,极易被氧气氧化生成NO2,反应方程式为2NO+O2=2NO2,故A错误;
B.氯化铝与氨水反应生成氢氧化铝沉淀,反应方程式为AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl,Al(OH)3能溶于强碱溶液但不溶于弱碱溶液,氨水属于弱碱,所以氢氧化铝不溶于氨水,故B错误;
C.浓硫酸与铜需在加热条件下才能反应,加热条件下铝与浓硫酸也能反应,所以不能用浓硫酸除去镀在铝表面的铜镀层,故C错误;
D.Cu与稀硫酸不反应,加入硝酸钾后,溶液中存在硝酸根离子、氢离子,则Cu与硝酸可发生反应,所以铜粉溶解,故D正确;
故选D。
【点睛】本题的易错点为C,要注意常温下,铝与浓硫酸发生钝化,钝化属于化学变化,难点为D,要注意硝酸具有强氧化性,能够与铜反应。
11.D
【详解】检验SO42-时不能用硝酸酸化,因SO32-(HSO3-)能被氧化成SO42-;也不能先加氯化钡溶液再加盐酸,因若溶液中有Ag+,生成AgCl不溶于HCl。答案选D。
12.B
【详解】A.铜片和浓硝酸反应生成二氧化氮,和稀硝酸反应生成一氧化氮,一氧化氮和空气中的氧气反应生成红棕色的二氧化氮,该实验说明浓硝酸的氧化性强于稀硝酸的氧化性,故A错误;
B.在乙醇中的溶解度小于在水中的溶解度,所以加入乙醇的目的是降低溶剂的极性,促使晶体析出,说明溶剂极性越小的溶解度越小,故B正确;
C.加热试管底部的固体,发生分解生成氨气和HCl气体,氨气和HCl气体在试管中部遇冷又反应生成固体,不是因为固体受热升华,故C错误;
D.向加有酚酞的溶液中加入溶液,溶液碱性增强,溶液的红色变深,但不能说明反应生成了,故D错误;
故选B。
13.D
【详解】A.步骤一实验中先关闭活塞2,打开活塞1和3,使产生的氢气通入c装置,的目的是排尽装置中的空气,防止Fe2+被氧化,故A正确;
B.步骤二反应一段时间后,关闭活塞3,打开活塞2,产生的氢气使b装置内压强增大,将产生的溶液压入c,和溶液混合,故B正确;
C.装置c中发生的离子反应为,故C正确;
D.装置d的主要作用是液封,防止空气进入c装置,将产物氧化,故D错误;
故答案为D
14. 溶液呈红色 K3[Fe(CN)6]溶液 产生蓝色沉淀
【分析】根据三价铁和二价铁的性质的特殊性,利用反应现象的特别进行判断。
【详解】Fe3+遇KSCN溶液,溶液变红色。由于氯水与Fe2+反应,现象不明显,应直接用K3[Fe(CN)6]溶液检验,若有蓝色沉淀出现,则证明Fe2+存在,否则不存在。
15. 使MnSO4充分反应,提高MnSO4的利用率;NH4HCO3易分解 吸收多余的SO2,减少对环境的污染 减慢通入气体的流速 1: 2 Mn3O4、MnO
【详解】试题分析:本题考查反应条件的控制,与SO2有关的实验,热重图象题的计算。
(1)加入稍过量的NH4HCO3可以使MnSO4充分反应,提高MnSO4的利用率,NH4HCO3易分解,所以NH4HCO3要稍过量。
(2)①根据装置图,在三颈烧瓶中SO2与MnO2反应制得MnSO4,由于SO2污染大气,用石灰乳吸收多余的SO2,减少对环境的污染,反应为SO2+Ca(OH)2=CaSO3+H2O。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有:缓慢通入混合气体使混合气体与MnO2充分作用,适当控制温度。
(3)设MnCO3物质的量为1mol,m(MnCO3)=1mol115g/mol=115g,其中n(Mn)=1mol。300℃,剩余固体的质量为115g75.65%=87g,其中m(O)=87g-55g=32g,n(O)=32g16g/mol=2mol,n(Mn):n(O)=1:2。由图可见D点固体由B点和C点的固体混合而成,B点,剩余固体的质量为115g66.38%=76.34g,其中n(O)==1.334mol,n(Mn):n(O)=1mol:1.334mol=3:4,B点固体为Mn3O4;C点,剩余固体的质量为115g61.74%=71g,其中n(O)==1mol,n(Mn):n(O)=1mol:1mol=1:1,C点固体为MnO;D点对应固体成分为Mn3O4、MnO。
16.(1) 2ClO+H2C2O4+2H+ =2ClO2+2CO2+2H2O 5
(2) ACD 1Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O
【分析】本题主要考查物质的制备。
【详解】(1),和硫酸反应的化学方式,离子方程式,有方程式可知,生成2,反应转移2电子,则生成5转移5电子。
(2)①检验固体铁的氧化物应先加酸溶解固体,由于稀硝酸具有强氧化性,能将氧化,不能选择硝酸,向溶解后的溶液中加溶液,检验是否存在,再加入酸性高锰酸钾溶液,检验是否有,则检验固体中铁的氧化物中铁的化合价,应选用试剂是稀硫酸,硫氰化钾,酸性高锰酸钾溶液,故选ACD;
②由题意知,,,加热共融发生氧化还原反应,反应式为。
17.(1)减少二氧化硫的产生,减少对环境的污染
(2)夏天温度较高,铵态氮肥容易分解,挥发出氨气而失效
(3)氯气与水反应生成具有漂白作用的次氯酸
(4)钠单质氧化生成白色氧化钠固体覆盖在银白色金属光泽表面
【详解】(1)工业燃煤须进行脱硫处理,其目的是:减少燃烧时二氧化硫的产生,减少对环境的污染。
(2)夏天施用铵态氮肥须深施盖土,其原因是:夏天温度较高,铵态氮肥容易分解,挥发出氨气而失效。
(3)氯气能使湿润的红色纸条褪色的原因是:氯气与水反应生成具有漂白作用的次氯酸。
(4)新切开的钠表面具有银白色金属光泽,在空气中很快变暗的原因是:钠单质具有银白色金属光泽,且易被空气氧化生成白色氧化钠,白色固体覆盖在银白色金属光泽表面看起来变暗。
18. Fe2(SO4)3=2Fe3++3 NaHCO3 21:22 2 2FeCl3+Cu═CuCl2+2FeCl2 A
【详解】(1) Fe2(SO4)3在水溶液中的电离产生铁离子和硫酸根离子,其电离方程式为:Fe2(SO4)3=2Fe3++3;
(2) 碳酸氢钠又名小苏打,化学式为NaHCO3;
(3)令CO和CO2的质量都是1g,CO的物质的量==mol,CO2的物质的量==mol,根CO和CO2分子数目之比=mol:mol=11:7;每个CO分子含有2个原子,原子物质的量为CO的2倍,每个CO2分子含有3个原子,含有原子物质的量为二氧化碳的3倍,故CO2和CO含有原子数目之比=7×3:11×2=21:22;
(4)由方程式MnO2+4HCl(浓)MnCl 2+Cl2↑+2H2O可知,当有1molMnO2参加反应,有4molHCl参加反应,但生成1molCl2,说明有2molHCl被氧化,则若有87 gMnO2参加反应,n(MnO2)==1mol,则被氧化的氯化氢的物质的量为2mol;
(5)FeCl3中铁元素是+3价,最高价态,有氧化性,能被还原剂还原呈+2价,铜单质是0价最低价,具有还原性,能被氧化成+2价,所以方程式为:2FeCl3+Cu═CuCl2+2FeCl2;
若从腐蚀后的废液中回收铜并重新获得FeC13溶液,提供的试剂有:①烧碱 ②浓盐酸 ③铁粉 ④氯气 ⑤浓氨水,则应该首先向溶液中加入过量的Fe粉末,发生反应得到纯净的FeCl2溶液,把过量的Fe和置换出的Cu过滤出来,向滤渣中加入盐酸使Fe发生反应得到FeCl2溶液,再过滤除去Cu,把两次的滤液合并,再向其中通入过量的氯气就得到了FeC13溶液,所以需要用到的一组物质是②③④;
答案选A。
19.(1) SO2 H2SO4
(2) 不能 2H2S+SO2=2H2O+3S↓
(3)+2H+=SO2↑+H2O
(4) +2 b
(5)3SO2+2HNO3+2H2O=3H2SO4+2NO
【详解】(1)Y是+4价的氧化物,则Y为SO2,Z为+6价的酸,则Z为H2SO4;故答案为:SO2;H2SO4。
(2)X(H2S)与Y(SO2)发生氧化还原反应生成硫单质和水,因此不能共存,其反应方程式为2H2S+SO2=2H2O+3S↓;故答案为:不能;2H2S+SO2=2H2O+3S↓。
(3)Na2SO3与足量Z反应生成硫酸钠、二氧化硫和水,其反应的离子方程式+2H+=SO2↑+H2O;故答案为:+2H+=SO2↑+H2O。
(4)Na化合价为+1价,O为 2价,则Na2S2O3中硫元素的化合价为+2价,从氧化还原反应的角度分析,要发生反应必须是一个物质中S化合价比+2价高,S化合价比+2价低,a.Na2S+S,硫的化合价都比+2价低,因此a不符合题意;b.Na2SO3+S,前者为+4价,后者为0价,因此b符合题意;c.Na2SO4+SO2,前者为+6价,后者为+4价,都比+2价高,因此c不符合题意;d.Na2SO3+SO3,硫的价态都比+2价低,因此d不符合题意;故答案为:+2;b。
(5)Y与稀硝酸反应,硝酸的还原产物为NO,则氧化产物为硫酸,其反应的化学方程式:3SO2+2HNO3+2H2O=3H2SO4+2NO;故答案为:3SO2+2HNO3+2H2O=3H2SO4+2NO。
20.(1)
(2)
(3)B
【分析】从图中可以看出,X为硫的氢化物,且S显-2价,所以X为H2S;W为硫元素显+6价的酸,所以W为H2SO4。
【详解】(1)将H2S与SO2混合,生成的淡黄色固体为硫,化学方程式为2H2S+SO2=3S+2H2O,该反应的氧化产物(由H2S生成)与还原产物(由SO2生成)的质量之比为2:1。答案为:2:1;
(2)Cu与浓硫酸混合加热可以发生反应,生成硫酸铜、二氧化硫和水,该反应的化学方程式为:。
(3)在Na2S2O3中,S显+2价。
A.Na2S和S中,S元素的化合价分别为-2、0价,反应产物中S元素的价态不可能为+2价;
B.Na2SO3和S中,S元素的化合价分别为+4、0价,反应产物中S元素的价态可能为+2价;
C.Na2SO3和Na2SO4中,S元素的化合价分别为+4、+6价,反应产物中S元素的价态不可能为+2价;
D.SO2和Na2SO3中,S元素的化合价都为+4价,反应产物中S元素的价态一定为+4价;
综合以上分析,只有B符合题意,故选B。
答案为B。
【点睛】归中反应中,产物中变价元素的化合价一定位于反应物中该变价元素的价态之间。
答案第1页,共2页
答案第1页,共2页
