第八单元金属和金属材料单元练习(含答案)2023-2024学年化学人教版九年级下册
文档属性
| 名称 | 第八单元金属和金属材料单元练习(含答案)2023-2024学年化学人教版九年级下册 |  | |
| 格式 | docx | ||
| 文件大小 | 106.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 16:25:01 | ||
图片预览



文档简介
第八单元金属和金属材料单元练习
一、单选题
1.地壳中含量居第二位的金属元素是( )
A.氧 B.硅 C.铝 D.铁
2.“奋斗者号”载人潜水器采用新型钛合金作为舱壳材料。钛合金属于( )
A.金属材料 B.非金属材料 C.合成材料 D.复合材料
3.下列物品主要由合金制成的是( )
A.塑料水杯 B.青铜铸像 C.汽车轮胎 D.陶瓷花瓶
4.下列对事实的解释中,不合理的是( )
A.水变为水蒸气体积变大一一水分子间间隔变大
B.金刚石和石墨物理性质差异较大——碳原子的结构不同
C.生铁和钢的性能不同一一含碳量不同
D.硫在空气和氧气中燃烧的火焰颜色不同——氧气浓度不同
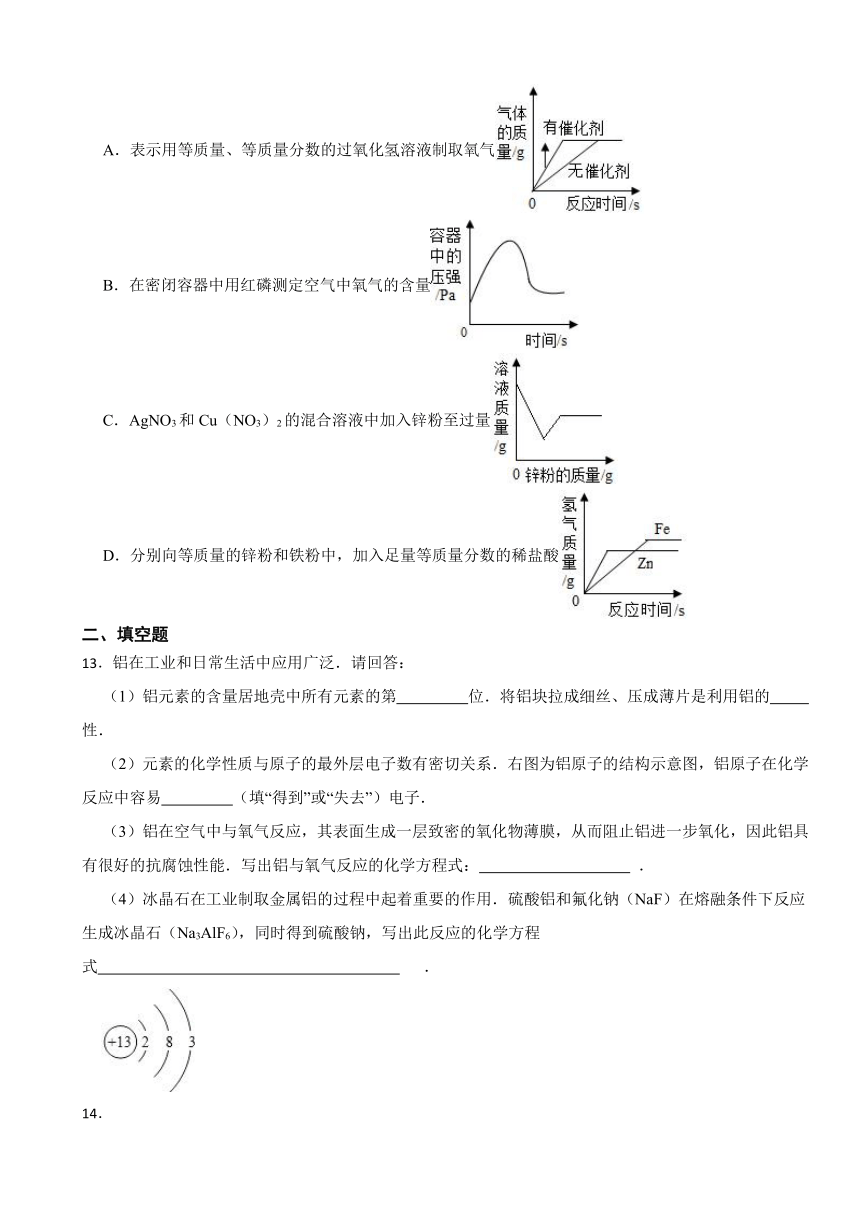
5.如图是探究铁制品锈蚀的条件时设计的实验。下列对比实验设计与探究的条件,对应关系正确的是( )
A.甲和丁:水 B.乙和丙:空气
C.甲和丙:空气 D.甲和乙:水
6.中国古代诗句中蕴含有很多化学原理,下列诗句的解释错误的是( )
诗句 解释
A 吴山开,越溪涸,三金合冶成宝锷 “宝锷”的成分为合金
B 遥知不是雪,为有暗香来 分子在不停地运动
C 千淘万漉虽辛苦,吹尽狂沙始到金 金的密度比沙大
D 千锤万凿出深山,烈火焚烧若等闲 煅烧生石灰得到熟石灰
A.A B.B C.C D.D
7.a、b、c分别代表镁、铝、铁三种金属中的一种,它们与酸反应生成氢气的关系图如下,x轴表示和酸反应的金属质量,y轴表示产生的氢气质量,则下列说法正确的是( )
A.金属活动性顺序是a>b>c
B.a、b、c分别是铝、镁、铁
C.生成物中金属元素的化合价是a>b>c
D.金属的相对原子质量是a<b<c
8.下列实验现象描述正确的是( )
A.镁带在空气中燃烧: 发出耀眼白光,冒白烟,产生有刺激性气味的气体,放热。
B.加热通入足量二氧化碳后的石蕊溶液: 溶液中有气泡产生,溶液由红色变为紫色。
C.生石灰中加入一定量的水: 白色固体变成白色溶液,吸收大量的热。
D.把铁钉放在硫酸铜溶液中: 银白色固体表面有铜析出,溶液由浅绿色变为蓝色。
9.人们常说的“五金”是指金、银、铜、铁、锡。下列说法错误的是( )
A.青铜(铜锡合金)的硬度大于铜
B.银的导电性比铜好,但电线一般用铜制而不用银制
C.黄铜(铜锌合金)与黄金颜色相近,可用稀硫酸鉴别
D.用铜、锡和溶液,可验证铜、铁、锡的金属活动性顺序
10.下列说法中,错误的是()
A.石油是不可再生能源 B.进入林区严禁携带火种
C.二氧化碳是空气污染物 D.回收废旧金属可保护金属资源
11.下列物质的性质和用途关系错误的是( )
A.金刚石的硬度大,可用于切割玻璃
B.活性炭具有吸附性,可用于脱色、除异味
C.稀有气体性质不活泼,可用于焊割金属用保护气
D.铝的化学性质稳定,可在铁栏杆的表面涂铝粉防止生锈
12.下列图象不能正确反映其对应关系的是( )
A.表示用等质量、等质量分数的过氧化氢溶液制取氧气
B.在密闭容器中用红磷测定空气中氧气的含量
C.AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
D.分别向等质量的锌粉和铁粉中,加入足量等质量分数的稀盐酸
二、填空题
13.铝在工业和日常生活中应用广泛.请回答:
(1)铝元素的含量居地壳中所有元素的第 位.将铝块拉成细丝、压成薄片是利用铝的 性.
(2)元素的化学性质与原子的最外层电子数有密切关系.右图为铝原子的结构示意图,铝原子在化学反应中容易 (填“得到”或“失去”)电子.
(3)铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化,因此铝具有很好的抗腐蚀性能.写出铝与氧气反应的化学方程式: .
(4)冰晶石在工业制取金属铝的过程中起着重要的作用.硫酸铝和氟化钠(NaF)在熔融条件下反应生成冰晶石(Na3AlF6),同时得到硫酸钠,写出此反应的化学方程式 .
14.
(1)天然气、 和煤被称为“化石燃料”。 天然气燃烧的化学方程式是 。
(2)已建成的南京长江三桥是世界上第一座弧线形斜拉桥。桥塔所用的钢材属于 (填“金属单质”或“合金”)。
(3)将花生油沿一根筷子倒入细口瓶中,该操作相当于化学实验中的 。
(4)世博园直饮水主要生产流程为:自来水→活性炭→超滤膜分离→紫外线消毒→直饮水,其中活性炭起 作用。
(5)洗涤剂对油污有 作用。
(6)从能量转化的角度来看,利用焚烧生活垃圾发电,是将 能转化为电能。
三、计算题
15.某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸19.6t(硫酸的质量分数为20%),与足量的废铁屑反应,可生成硫酸亚铁的质量?
四、实验探究题
16.根据如图所示实验回答问题。
(1)实验一图中玻璃管内发生化学反应的方程式为 ;酒精灯加上铁丝网罩的作用是 。
(2)实验二图中两块金属片互相刻画后,在纯铜片上留下明显划痕,该实验探究的目的是 。
(3)实验三探究铜、铝、银三种金属的活动性顺序,则X是 (填化学式)。
(4)实验四的实验现象是 ;探究的燃烧条件是 利用了铜片的 性。
17.铜片在潮湿的空气中久置,表面会产生绿色的铜锈.某小组同学设计并进行实验,探究铜生锈的条件.
【猜想与假设】常温下,铜生锈可能与O2、CO2、水蒸气有关.
【进行实验】通过控制与铜片接触的物质,利用如图装置(铜片长8cm,宽1cm,试管容积为20mL),分别进行下列7个实验,并持续观察30天.
编号 主要实验操作 实验现象
1 充满纯净的O2 铜片均无明显变化
2 充满纯净的CO2
3 充满经煮沸并迅速冷却的蒸馏水
4 加入蒸馏水5mL (液面未浸没铜片),再充满O2
5 加入经煮沸并迅速泠却的蒸馏水5mL,再充满CO2
6 充入10mLO2,再充入10mLCO2
7 加入蒸馏水5mL,再依次充入l0mLCO2和10mLO2 铜片生锈,且水面附近锈蚀最严重
【解释与结论】
(1)实验3中,要使用经煮沸并迅速泠却的蒸馏水,原因是 .
(2)实验5的目的是
(3)通过上述实验,得出铜生绣的条件是 .
(4)【反思与评价】
请写出一种防止铜制品锈蚀的方法 .
(5)查阅资料可知,铜锈的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3.由此,你认为上述实验中只需进行实验 (填实验编号),就可探究出铜生锈条件,理甶是 .
(6)与以上进行的实验对比,你认为铜片在通常状况的空气中,生锈非常缓慢的原因可能是 .
五、综合题
18.某化学实验小组向一定量锌粉和铜粉的混合物中滴加一定量硝酸银溶液,充分反应后过滤,得到滤液和滤渣。请回答下列问题。
(1)写出一定发生反应的化学方程式 。
(2)若向滤液中滴加稀盐酸有白色沉淀生成,则滤液中一定含有哪些溶质 ?
19.人类的生产生活离不开金属材料。
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属 的位置移到最后,正好符合由弱到强活动性顺序。
(2)铝、铁、铜是我们生产生活中使用比较广泛的金属。如图所示用品中,主要利用金属的延展性的是 (填字母序号)。
(3)合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于任何一种组成金属的熔点。下表是一些金属的熔点数据。
金属 铜 锌 锡 铅 铋 镉
熔点/℃ 1083 419.6 231.9 327.5 271.3 320.9
保险丝由铋、铅、锡、镉组成,其熔点约为_____。
A.15~30℃; B.60~80℃;
C.235~250℃; D.300~320℃。
答案解析部分
1.【答案】D
2.【答案】A
3.【答案】B
4.【答案】B
5.【答案】A
6.【答案】D
7.【答案】B
8.【答案】B
9.【答案】D
10.【答案】C
11.【答案】D
12.【答案】B
13.【答案】三;延展;失去;4Al+3O2=2Al2O3;Al2(SO4)3+12NaF2Na3AlF6+3Na2SO4
14.【答案】(1)石油;CH4+2O2 CO2+2H2O
(2)合金
(3)玻璃棒引流
(4)吸附
(5)乳化
(6)化学
15.【答案】解: 设可生成硫酸亚铁质量为x
Fe+H2SO4=FeSO4+H2↑
98 152
19.6t ×20% x
98:152= 19.6t ×20% :x
x=6.08t
答:生成硫酸亚铁的质量为6.08t
16.【答案】(1);可以使火焰集中,提高火焰的温度
(2)比较黄铜和纯铜的硬度大小
(3)Cu
(4)乒乓球碎片先燃烧;需要达到可燃物的着火点;导热
17.【答案】(1)除去水中的氧气
(2)探究铜生锈是否是铜与水和二氧化碳共同反应的结果
(3)与水、氧气和二氧化碳共同反应
(4)涂油
(5)5、7;碱式碳酸铜的化学式中含有碳、氢元素,由元素守恒可以知道,铜生锈的过程中一定有二氧化碳和水参加反应,故只需要进行实验5和7即可知道铜生锈条件是否需要氧气的参加
(6)空气中氧气、二氧化碳和水蒸气的含量较低
18.【答案】(1)Zn+2AgNO3=2Ag + Zn(NO3)2
(2)硝酸锌、硝酸铜、硝酸银或Zn(NO3)2、Cu(NO3)2、AgNO3
19.【答案】(1)铁
(2)C
(3)B
一、单选题
1.地壳中含量居第二位的金属元素是( )
A.氧 B.硅 C.铝 D.铁
2.“奋斗者号”载人潜水器采用新型钛合金作为舱壳材料。钛合金属于( )
A.金属材料 B.非金属材料 C.合成材料 D.复合材料
3.下列物品主要由合金制成的是( )
A.塑料水杯 B.青铜铸像 C.汽车轮胎 D.陶瓷花瓶
4.下列对事实的解释中,不合理的是( )
A.水变为水蒸气体积变大一一水分子间间隔变大
B.金刚石和石墨物理性质差异较大——碳原子的结构不同
C.生铁和钢的性能不同一一含碳量不同
D.硫在空气和氧气中燃烧的火焰颜色不同——氧气浓度不同
5.如图是探究铁制品锈蚀的条件时设计的实验。下列对比实验设计与探究的条件,对应关系正确的是( )
A.甲和丁:水 B.乙和丙:空气
C.甲和丙:空气 D.甲和乙:水
6.中国古代诗句中蕴含有很多化学原理,下列诗句的解释错误的是( )
诗句 解释
A 吴山开,越溪涸,三金合冶成宝锷 “宝锷”的成分为合金
B 遥知不是雪,为有暗香来 分子在不停地运动
C 千淘万漉虽辛苦,吹尽狂沙始到金 金的密度比沙大
D 千锤万凿出深山,烈火焚烧若等闲 煅烧生石灰得到熟石灰
A.A B.B C.C D.D
7.a、b、c分别代表镁、铝、铁三种金属中的一种,它们与酸反应生成氢气的关系图如下,x轴表示和酸反应的金属质量,y轴表示产生的氢气质量,则下列说法正确的是( )
A.金属活动性顺序是a>b>c
B.a、b、c分别是铝、镁、铁
C.生成物中金属元素的化合价是a>b>c
D.金属的相对原子质量是a<b<c
8.下列实验现象描述正确的是( )
A.镁带在空气中燃烧: 发出耀眼白光,冒白烟,产生有刺激性气味的气体,放热。
B.加热通入足量二氧化碳后的石蕊溶液: 溶液中有气泡产生,溶液由红色变为紫色。
C.生石灰中加入一定量的水: 白色固体变成白色溶液,吸收大量的热。
D.把铁钉放在硫酸铜溶液中: 银白色固体表面有铜析出,溶液由浅绿色变为蓝色。
9.人们常说的“五金”是指金、银、铜、铁、锡。下列说法错误的是( )
A.青铜(铜锡合金)的硬度大于铜
B.银的导电性比铜好,但电线一般用铜制而不用银制
C.黄铜(铜锌合金)与黄金颜色相近,可用稀硫酸鉴别
D.用铜、锡和溶液,可验证铜、铁、锡的金属活动性顺序
10.下列说法中,错误的是()
A.石油是不可再生能源 B.进入林区严禁携带火种
C.二氧化碳是空气污染物 D.回收废旧金属可保护金属资源
11.下列物质的性质和用途关系错误的是( )
A.金刚石的硬度大,可用于切割玻璃
B.活性炭具有吸附性,可用于脱色、除异味
C.稀有气体性质不活泼,可用于焊割金属用保护气
D.铝的化学性质稳定,可在铁栏杆的表面涂铝粉防止生锈
12.下列图象不能正确反映其对应关系的是( )
A.表示用等质量、等质量分数的过氧化氢溶液制取氧气
B.在密闭容器中用红磷测定空气中氧气的含量
C.AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
D.分别向等质量的锌粉和铁粉中,加入足量等质量分数的稀盐酸
二、填空题
13.铝在工业和日常生活中应用广泛.请回答:
(1)铝元素的含量居地壳中所有元素的第 位.将铝块拉成细丝、压成薄片是利用铝的 性.
(2)元素的化学性质与原子的最外层电子数有密切关系.右图为铝原子的结构示意图,铝原子在化学反应中容易 (填“得到”或“失去”)电子.
(3)铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化,因此铝具有很好的抗腐蚀性能.写出铝与氧气反应的化学方程式: .
(4)冰晶石在工业制取金属铝的过程中起着重要的作用.硫酸铝和氟化钠(NaF)在熔融条件下反应生成冰晶石(Na3AlF6),同时得到硫酸钠,写出此反应的化学方程式 .
14.
(1)天然气、 和煤被称为“化石燃料”。 天然气燃烧的化学方程式是 。
(2)已建成的南京长江三桥是世界上第一座弧线形斜拉桥。桥塔所用的钢材属于 (填“金属单质”或“合金”)。
(3)将花生油沿一根筷子倒入细口瓶中,该操作相当于化学实验中的 。
(4)世博园直饮水主要生产流程为:自来水→活性炭→超滤膜分离→紫外线消毒→直饮水,其中活性炭起 作用。
(5)洗涤剂对油污有 作用。
(6)从能量转化的角度来看,利用焚烧生活垃圾发电,是将 能转化为电能。
三、计算题
15.某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸19.6t(硫酸的质量分数为20%),与足量的废铁屑反应,可生成硫酸亚铁的质量?
四、实验探究题
16.根据如图所示实验回答问题。
(1)实验一图中玻璃管内发生化学反应的方程式为 ;酒精灯加上铁丝网罩的作用是 。
(2)实验二图中两块金属片互相刻画后,在纯铜片上留下明显划痕,该实验探究的目的是 。
(3)实验三探究铜、铝、银三种金属的活动性顺序,则X是 (填化学式)。
(4)实验四的实验现象是 ;探究的燃烧条件是 利用了铜片的 性。
17.铜片在潮湿的空气中久置,表面会产生绿色的铜锈.某小组同学设计并进行实验,探究铜生锈的条件.
【猜想与假设】常温下,铜生锈可能与O2、CO2、水蒸气有关.
【进行实验】通过控制与铜片接触的物质,利用如图装置(铜片长8cm,宽1cm,试管容积为20mL),分别进行下列7个实验,并持续观察30天.
编号 主要实验操作 实验现象
1 充满纯净的O2 铜片均无明显变化
2 充满纯净的CO2
3 充满经煮沸并迅速冷却的蒸馏水
4 加入蒸馏水5mL (液面未浸没铜片),再充满O2
5 加入经煮沸并迅速泠却的蒸馏水5mL,再充满CO2
6 充入10mLO2,再充入10mLCO2
7 加入蒸馏水5mL,再依次充入l0mLCO2和10mLO2 铜片生锈,且水面附近锈蚀最严重
【解释与结论】
(1)实验3中,要使用经煮沸并迅速泠却的蒸馏水,原因是 .
(2)实验5的目的是
(3)通过上述实验,得出铜生绣的条件是 .
(4)【反思与评价】
请写出一种防止铜制品锈蚀的方法 .
(5)查阅资料可知,铜锈的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3.由此,你认为上述实验中只需进行实验 (填实验编号),就可探究出铜生锈条件,理甶是 .
(6)与以上进行的实验对比,你认为铜片在通常状况的空气中,生锈非常缓慢的原因可能是 .
五、综合题
18.某化学实验小组向一定量锌粉和铜粉的混合物中滴加一定量硝酸银溶液,充分反应后过滤,得到滤液和滤渣。请回答下列问题。
(1)写出一定发生反应的化学方程式 。
(2)若向滤液中滴加稀盐酸有白色沉淀生成,则滤液中一定含有哪些溶质 ?
19.人类的生产生活离不开金属材料。
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属 的位置移到最后,正好符合由弱到强活动性顺序。
(2)铝、铁、铜是我们生产生活中使用比较广泛的金属。如图所示用品中,主要利用金属的延展性的是 (填字母序号)。
(3)合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于任何一种组成金属的熔点。下表是一些金属的熔点数据。
金属 铜 锌 锡 铅 铋 镉
熔点/℃ 1083 419.6 231.9 327.5 271.3 320.9
保险丝由铋、铅、锡、镉组成,其熔点约为_____。
A.15~30℃; B.60~80℃;
C.235~250℃; D.300~320℃。
答案解析部分
1.【答案】D
2.【答案】A
3.【答案】B
4.【答案】B
5.【答案】A
6.【答案】D
7.【答案】B
8.【答案】B
9.【答案】D
10.【答案】C
11.【答案】D
12.【答案】B
13.【答案】三;延展;失去;4Al+3O2=2Al2O3;Al2(SO4)3+12NaF2Na3AlF6+3Na2SO4
14.【答案】(1)石油;CH4+2O2 CO2+2H2O
(2)合金
(3)玻璃棒引流
(4)吸附
(5)乳化
(6)化学
15.【答案】解: 设可生成硫酸亚铁质量为x
Fe+H2SO4=FeSO4+H2↑
98 152
19.6t ×20% x
98:152= 19.6t ×20% :x
x=6.08t
答:生成硫酸亚铁的质量为6.08t
16.【答案】(1);可以使火焰集中,提高火焰的温度
(2)比较黄铜和纯铜的硬度大小
(3)Cu
(4)乒乓球碎片先燃烧;需要达到可燃物的着火点;导热
17.【答案】(1)除去水中的氧气
(2)探究铜生锈是否是铜与水和二氧化碳共同反应的结果
(3)与水、氧气和二氧化碳共同反应
(4)涂油
(5)5、7;碱式碳酸铜的化学式中含有碳、氢元素,由元素守恒可以知道,铜生锈的过程中一定有二氧化碳和水参加反应,故只需要进行实验5和7即可知道铜生锈条件是否需要氧气的参加
(6)空气中氧气、二氧化碳和水蒸气的含量较低
18.【答案】(1)Zn+2AgNO3=2Ag + Zn(NO3)2
(2)硝酸锌、硝酸铜、硝酸银或Zn(NO3)2、Cu(NO3)2、AgNO3
19.【答案】(1)铁
(2)C
(3)B
同课章节目录
