3.2水的电离和溶液的PH 同步练习题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2水的电离和溶液的PH 同步练习题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 321.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 16:52:30 | ||
图片预览


文档简介
3.2水的电离和溶液的PH同步练习题
一、选择题
1.下列关于溶液酸碱性的说法中,正确的是
A.的溶液一定显酸性
B.的溶液一定显中性
C.的溶液一定显中性
D.不能使酚酞试液变红的溶液一定显酸性
2.设NA为阿伏加德罗常数。下列说法错误的是
A.1 mol 白磷分子中含有P-P共价键数为6NA
B.1 mol NH4Cl溶于水形成的溶液中阳离子总数大于NA
C.1 mol Cu与足量的S蒸气反应,转移电子数为NA
D.常温下,pH=10的NaHCO3溶液中,由水电离产生的H+数为10-4NA
3.下列微粒表述正确,且能对水的电离产生影响的是
A.乙酸的结构式: B.氢氧化钠的电子式:
C.甲烷分子的球棍模型: D.钙离子的结构示意图:
4.下列溶液一定呈酸性的是( )
A.c(H+)=c(OH-)=10-6 B.PH<7的溶液
C.c(H+)>c(OH-)的溶液 D.使紫色石蕊试液呈蓝色的溶液
5.下列溶液一定呈中性的是
A.pH = 7的溶液 B.Kw = c(H+)·c(OH-) = 1.0×10-14的溶液
C.c(H+) = D.pH = 3的酸与pH = 11的碱等体积混合后的溶液
6.常温下,某地土壤的pH约为8,则土壤中的c(OH-)最接近于多少mol/L
A.1×10-5 B.1×10-6 C.1×10-8 D.1×10-9
7.某溶液改变一个条件,酸性一定增大的是
A.酸雨在空气中放置一段时间 B.使溶液中c(H+)增大
C.使溶液中c(OH-)减小 D.稀盐酸露置于空气中
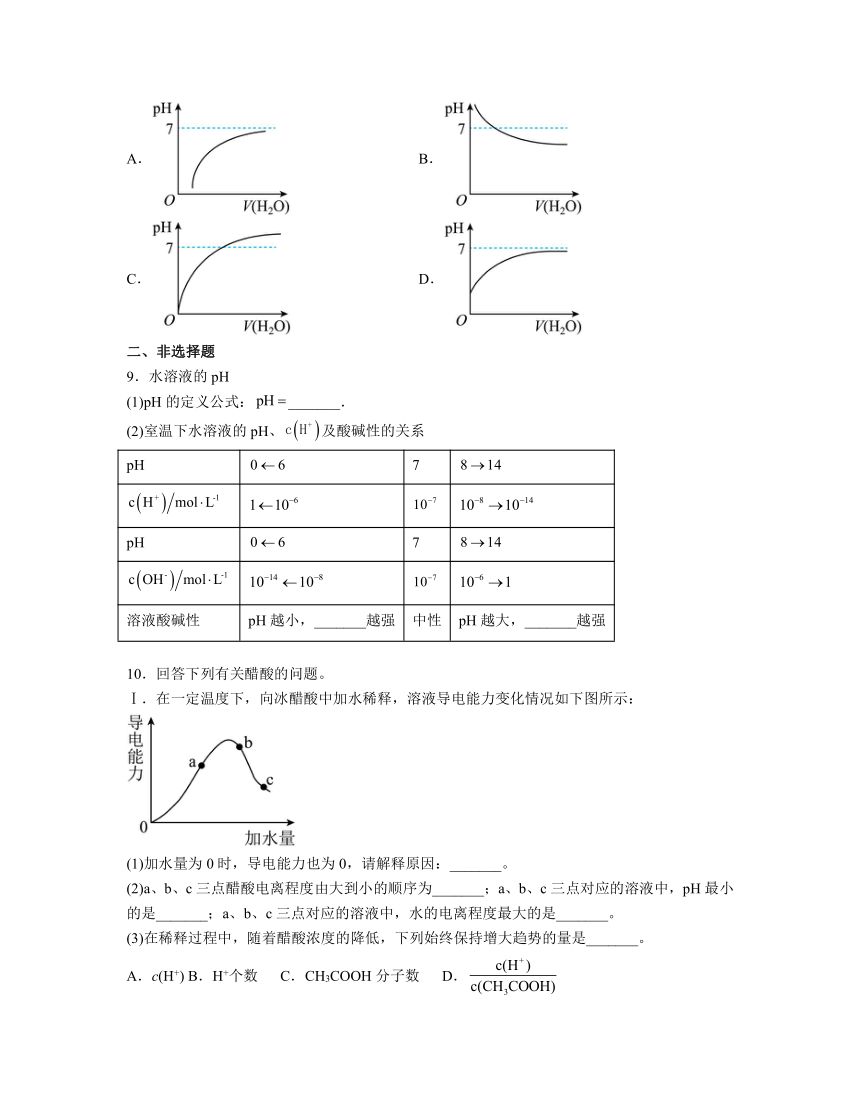
8.能表示人体大量喝水时,胃液的pH变化的是
A. B.
C. D.
二、非选择题
9.水溶液的pH
(1)pH的定义公式:_______.
(2)室温下水溶液的pH、及酸碱性的关系
pH 7
pH 7
溶液酸碱性 pH越小,_______越强 中性 pH越大,_______越强
10.回答下列有关醋酸的问题。
Ⅰ.在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如下图所示:
(1)加水量为0时,导电能力也为0,请解释原因:_______。
(2)a、b、c三点醋酸电离程度由大到小的顺序为_______;a、b、c三点对应的溶液中,pH最小的是_______;a、b、c三点对应的溶液中,水的电离程度最大的是_______。
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是_______。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.
Ⅱ.常温下,有HCl、H2SO4、CH3COOH三种溶液,请用化学符号填空:
(1)等体积、等物质的量浓度三种酸溶液,中和NaOH的能力由大到小的顺序是_______。
(2)当三种酸溶液c(H+)相同时,写出物质的量浓度最大的酸与氢氧化钾反应的离子方程式_______。
(3)pH=1的HCl溶液与0.04 mol/L的Ba(OH)2溶液等体积混合后溶液pH是_______。
【参考答案】
一、选择题
1.C
解析:A.常温下,溶液中c(H+)<0是酸性溶液,即常温下的溶液一定显酸性,非常温下就不一定是酸性溶液,A错误;
B.常温下,的溶液一定显中性,非常温下的溶液可能是酸性也可能是碱性,B错误;
C.任何温度下,的溶液一定显中性,C正确;
D.常温下,酚酞的变色范围是8.0~10.0,故不能使酚酞试液变红的溶液不一定显酸性,D错误;
故答案为:C。
2.D
解析:A.白磷为正四面体结构,每分子白磷含6个P-P键,1mol白磷分子中含P-P共价键为6,故A正确;
B.氯化铵溶液中除了铵根离子水解外,还存在水的电离,所以1mol氯化铵溶于水形成的溶液中阳离子总数大于,故B正确;
C.硫的非金属性较弱,与铜反应生成硫化亚铜,故1 mol Cu与足量的S蒸气反应,转移电子数为NA,故C正确 ;
D.未给出碳酸氢钠溶液的体积,所以不能计算出氢离子的数目,故D错误;
故选D。
3.A
解析:A.乙酸的结构式:,乙酸溶于水电离出的氢离子抑制水的电离, A正确;
B.氢氧化钠电离出氢氧根离子抑制水的电离,是离子化合物,电子式:,B错误;
C.甲烷分子的空间填充模型:,但甲烷不影响水的电离,C错误;
D.钙离子不影响水的电离,,钙原子失去2个电子形成钙离子,结构示意图:,D错误;
故选A。
4.C
解析:A. c(H+)=c(OH-)=10-6,溶液显中性,A不符合题意;
B. pH<7的溶液,无法确定氢离子和氢氧根离子浓度的相对大小,无法确定酸碱性,B不符合题意;
C. c(H+)>c(OH-)的溶,一定显酸性,C符合题意;
D. 使紫色石蕊试液呈蓝色的溶液,显碱性,D不符合题意;
故答案选C。
【点睛】溶液的酸碱性只与溶液中氢离子和氢氧根离子浓度的相对大小有关系。
5.C
解析:A.没有说明溶液的温度,pH = 7的溶液不一定有c(H+) = c(OH-),所以不一定显中性,A错误;
B.Kw = c(H+)·c(OH-) = 1.0×10-14的溶液,不一定有c(H+) = c(OH-),所以不一定显中性,B错误;
C.c(H+) =,Kw = c(H+)·c(OH-),则c(H+) = c(OH-),由中性溶液的定义可知,c(H+) = c(OH-)的溶液显中性,C正确;
D.只有在25℃,pH = 3的强酸与pH = 11的强碱等体积混合后的溶液才呈中性,没有说明酸或碱的强弱,所以不能判断溶液的酸碱性,D错误;
故选:C。
6.B
解析:常温下,Kw=c(H+)×c(OH-)=10-14,则c(OH-)=10-6mol/L,答案为B。
7.A
解析:A. 酸雨在空气中放置一段时间会发生反应:2H2SO3+O2=2H2SO4,溶液酸性增强,pH减小,故A符合;
B. 升高温度可以促进水的电离,使溶液中c(H+)增大,但溶液仍为中性,故B不符合;
C. 降低温度可以抑制水的电离,使溶液中c(OH-)减小,但溶液仍为中性,故C不符合;
D. 稀盐酸露置于空气中会挥发出溶质HCl气体,溶液的酸性会减弱,故D不符合;
故答案为A。
8.D
【分析】胃液的主要成分是盐酸,呈酸性,喝水导致胃液被稀释,则酸度下降,pH增大,但大量喝水可等效于无限稀释,则pH<7但接近于7,据此回答;
解析:A.据图分析加水前pH小于0,图示中起点错误, A错误;
B.胃液的主要成分是盐酸,呈酸性,开始不会pH >7, B错误;
C.稀释后pH >7,C错误;
D.据分析,大量喝水相当于HCl被无效稀释,pH逐渐增大接近于7但小于7,D正确;
答案选D。
二、非选择题
9. 酸性 碱性
解析:略
10. 冰醋酸的构成微粒为分子,没有带电荷微粒,所以不导电 c>b>a b c B、D H2SO4>HCl=CH3COOH CH3COOH+OH-=CH3COO-+H2O 2
解析:Ⅰ.(1)冰醋酸为共价化合物,必须溶于水才能电离出离子从而导电,即冰醋酸构成微粒为分子,没有带电荷微粒,故不导电;
(2)依据弱电解质“越稀越电离”规律,电离程度随着水的加入量增大而增大,即c>b>a;溶液导电能力强,说明离子浓度大,故b点c(H+)最大,此时pH最小;醋酸电离出的H+会抑制水的电离,溶液中c(H+)关系为:b > a > c,故c点对水的电离抑制程度最小,即水的电离程度最大;
(3)A.图示导电能力变化说明溶液中c(H+)是先增大后减小,A不符合题意;
B.加水稀释,促进醋酸电离,故H+个数增多,B符合题意;
C.加水稀释,促进醋酸电离,CH3COOH个数减少,C不符合题意;
D.由,结合B、C选项的判断知比值增大,D符合题意;
故答案选BD;
Ⅱ.(1)等体积等浓度的三种酸可提供的n(H+):H2SO4 > HCl = CH3COOH,故中和NaOH能力:H2SO4 > HCl = CH3COOH;
(2)醋酸为一元弱酸,微弱电离出H+,硫酸为二元强酸,1:2电离出H+,所以在溶液中c(H+)相等的情况下,三种酸物质的量浓度最大的是CH3COOH,在离子方程式中不能拆开,故离子方程式为:CH3COOH + OH- = CH3COO- + H2O;
(3)pH=1盐酸中c(H+)浓度为0.1 mol/L,0.04 mol/LBa(OH)2中c(OH-)浓度为0.08 mol/L,两者等体积混合酸过量,欲求pH需先求c(H+),,故pH= -Lgc(H+)=2
一、选择题
1.下列关于溶液酸碱性的说法中,正确的是
A.的溶液一定显酸性
B.的溶液一定显中性
C.的溶液一定显中性
D.不能使酚酞试液变红的溶液一定显酸性
2.设NA为阿伏加德罗常数。下列说法错误的是
A.1 mol 白磷分子中含有P-P共价键数为6NA
B.1 mol NH4Cl溶于水形成的溶液中阳离子总数大于NA
C.1 mol Cu与足量的S蒸气反应,转移电子数为NA
D.常温下,pH=10的NaHCO3溶液中,由水电离产生的H+数为10-4NA
3.下列微粒表述正确,且能对水的电离产生影响的是
A.乙酸的结构式: B.氢氧化钠的电子式:
C.甲烷分子的球棍模型: D.钙离子的结构示意图:
4.下列溶液一定呈酸性的是( )
A.c(H+)=c(OH-)=10-6 B.PH<7的溶液
C.c(H+)>c(OH-)的溶液 D.使紫色石蕊试液呈蓝色的溶液
5.下列溶液一定呈中性的是
A.pH = 7的溶液 B.Kw = c(H+)·c(OH-) = 1.0×10-14的溶液
C.c(H+) = D.pH = 3的酸与pH = 11的碱等体积混合后的溶液
6.常温下,某地土壤的pH约为8,则土壤中的c(OH-)最接近于多少mol/L
A.1×10-5 B.1×10-6 C.1×10-8 D.1×10-9
7.某溶液改变一个条件,酸性一定增大的是
A.酸雨在空气中放置一段时间 B.使溶液中c(H+)增大
C.使溶液中c(OH-)减小 D.稀盐酸露置于空气中
8.能表示人体大量喝水时,胃液的pH变化的是
A. B.
C. D.
二、非选择题
9.水溶液的pH
(1)pH的定义公式:_______.
(2)室温下水溶液的pH、及酸碱性的关系
pH 7
pH 7
溶液酸碱性 pH越小,_______越强 中性 pH越大,_______越强
10.回答下列有关醋酸的问题。
Ⅰ.在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如下图所示:
(1)加水量为0时,导电能力也为0,请解释原因:_______。
(2)a、b、c三点醋酸电离程度由大到小的顺序为_______;a、b、c三点对应的溶液中,pH最小的是_______;a、b、c三点对应的溶液中,水的电离程度最大的是_______。
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是_______。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.
Ⅱ.常温下,有HCl、H2SO4、CH3COOH三种溶液,请用化学符号填空:
(1)等体积、等物质的量浓度三种酸溶液,中和NaOH的能力由大到小的顺序是_______。
(2)当三种酸溶液c(H+)相同时,写出物质的量浓度最大的酸与氢氧化钾反应的离子方程式_______。
(3)pH=1的HCl溶液与0.04 mol/L的Ba(OH)2溶液等体积混合后溶液pH是_______。
【参考答案】
一、选择题
1.C
解析:A.常温下,溶液中c(H+)<0是酸性溶液,即常温下的溶液一定显酸性,非常温下就不一定是酸性溶液,A错误;
B.常温下,的溶液一定显中性,非常温下的溶液可能是酸性也可能是碱性,B错误;
C.任何温度下,的溶液一定显中性,C正确;
D.常温下,酚酞的变色范围是8.0~10.0,故不能使酚酞试液变红的溶液不一定显酸性,D错误;
故答案为:C。
2.D
解析:A.白磷为正四面体结构,每分子白磷含6个P-P键,1mol白磷分子中含P-P共价键为6,故A正确;
B.氯化铵溶液中除了铵根离子水解外,还存在水的电离,所以1mol氯化铵溶于水形成的溶液中阳离子总数大于,故B正确;
C.硫的非金属性较弱,与铜反应生成硫化亚铜,故1 mol Cu与足量的S蒸气反应,转移电子数为NA,故C正确 ;
D.未给出碳酸氢钠溶液的体积,所以不能计算出氢离子的数目,故D错误;
故选D。
3.A
解析:A.乙酸的结构式:,乙酸溶于水电离出的氢离子抑制水的电离, A正确;
B.氢氧化钠电离出氢氧根离子抑制水的电离,是离子化合物,电子式:,B错误;
C.甲烷分子的空间填充模型:,但甲烷不影响水的电离,C错误;
D.钙离子不影响水的电离,,钙原子失去2个电子形成钙离子,结构示意图:,D错误;
故选A。
4.C
解析:A. c(H+)=c(OH-)=10-6,溶液显中性,A不符合题意;
B. pH<7的溶液,无法确定氢离子和氢氧根离子浓度的相对大小,无法确定酸碱性,B不符合题意;
C. c(H+)>c(OH-)的溶,一定显酸性,C符合题意;
D. 使紫色石蕊试液呈蓝色的溶液,显碱性,D不符合题意;
故答案选C。
【点睛】溶液的酸碱性只与溶液中氢离子和氢氧根离子浓度的相对大小有关系。
5.C
解析:A.没有说明溶液的温度,pH = 7的溶液不一定有c(H+) = c(OH-),所以不一定显中性,A错误;
B.Kw = c(H+)·c(OH-) = 1.0×10-14的溶液,不一定有c(H+) = c(OH-),所以不一定显中性,B错误;
C.c(H+) =,Kw = c(H+)·c(OH-),则c(H+) = c(OH-),由中性溶液的定义可知,c(H+) = c(OH-)的溶液显中性,C正确;
D.只有在25℃,pH = 3的强酸与pH = 11的强碱等体积混合后的溶液才呈中性,没有说明酸或碱的强弱,所以不能判断溶液的酸碱性,D错误;
故选:C。
6.B
解析:常温下,Kw=c(H+)×c(OH-)=10-14,则c(OH-)=10-6mol/L,答案为B。
7.A
解析:A. 酸雨在空气中放置一段时间会发生反应:2H2SO3+O2=2H2SO4,溶液酸性增强,pH减小,故A符合;
B. 升高温度可以促进水的电离,使溶液中c(H+)增大,但溶液仍为中性,故B不符合;
C. 降低温度可以抑制水的电离,使溶液中c(OH-)减小,但溶液仍为中性,故C不符合;
D. 稀盐酸露置于空气中会挥发出溶质HCl气体,溶液的酸性会减弱,故D不符合;
故答案为A。
8.D
【分析】胃液的主要成分是盐酸,呈酸性,喝水导致胃液被稀释,则酸度下降,pH增大,但大量喝水可等效于无限稀释,则pH<7但接近于7,据此回答;
解析:A.据图分析加水前pH小于0,图示中起点错误, A错误;
B.胃液的主要成分是盐酸,呈酸性,开始不会pH >7, B错误;
C.稀释后pH >7,C错误;
D.据分析,大量喝水相当于HCl被无效稀释,pH逐渐增大接近于7但小于7,D正确;
答案选D。
二、非选择题
9. 酸性 碱性
解析:略
10. 冰醋酸的构成微粒为分子,没有带电荷微粒,所以不导电 c>b>a b c B、D H2SO4>HCl=CH3COOH CH3COOH+OH-=CH3COO-+H2O 2
解析:Ⅰ.(1)冰醋酸为共价化合物,必须溶于水才能电离出离子从而导电,即冰醋酸构成微粒为分子,没有带电荷微粒,故不导电;
(2)依据弱电解质“越稀越电离”规律,电离程度随着水的加入量增大而增大,即c>b>a;溶液导电能力强,说明离子浓度大,故b点c(H+)最大,此时pH最小;醋酸电离出的H+会抑制水的电离,溶液中c(H+)关系为:b > a > c,故c点对水的电离抑制程度最小,即水的电离程度最大;
(3)A.图示导电能力变化说明溶液中c(H+)是先增大后减小,A不符合题意;
B.加水稀释,促进醋酸电离,故H+个数增多,B符合题意;
C.加水稀释,促进醋酸电离,CH3COOH个数减少,C不符合题意;
D.由,结合B、C选项的判断知比值增大,D符合题意;
故答案选BD;
Ⅱ.(1)等体积等浓度的三种酸可提供的n(H+):H2SO4 > HCl = CH3COOH,故中和NaOH能力:H2SO4 > HCl = CH3COOH;
(2)醋酸为一元弱酸,微弱电离出H+,硫酸为二元强酸,1:2电离出H+,所以在溶液中c(H+)相等的情况下,三种酸物质的量浓度最大的是CH3COOH,在离子方程式中不能拆开,故离子方程式为:CH3COOH + OH- = CH3COO- + H2O;
(3)pH=1盐酸中c(H+)浓度为0.1 mol/L,0.04 mol/LBa(OH)2中c(OH-)浓度为0.08 mol/L,两者等体积混合酸过量,欲求pH需先求c(H+),,故pH= -Lgc(H+)=2
