第一章:化学反应与能量转化(含解析)同步习题2023---2024学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第一章:化学反应与能量转化(含解析)同步习题2023---2024学年上学期高二化学鲁科版(2019)选择性必修1 | 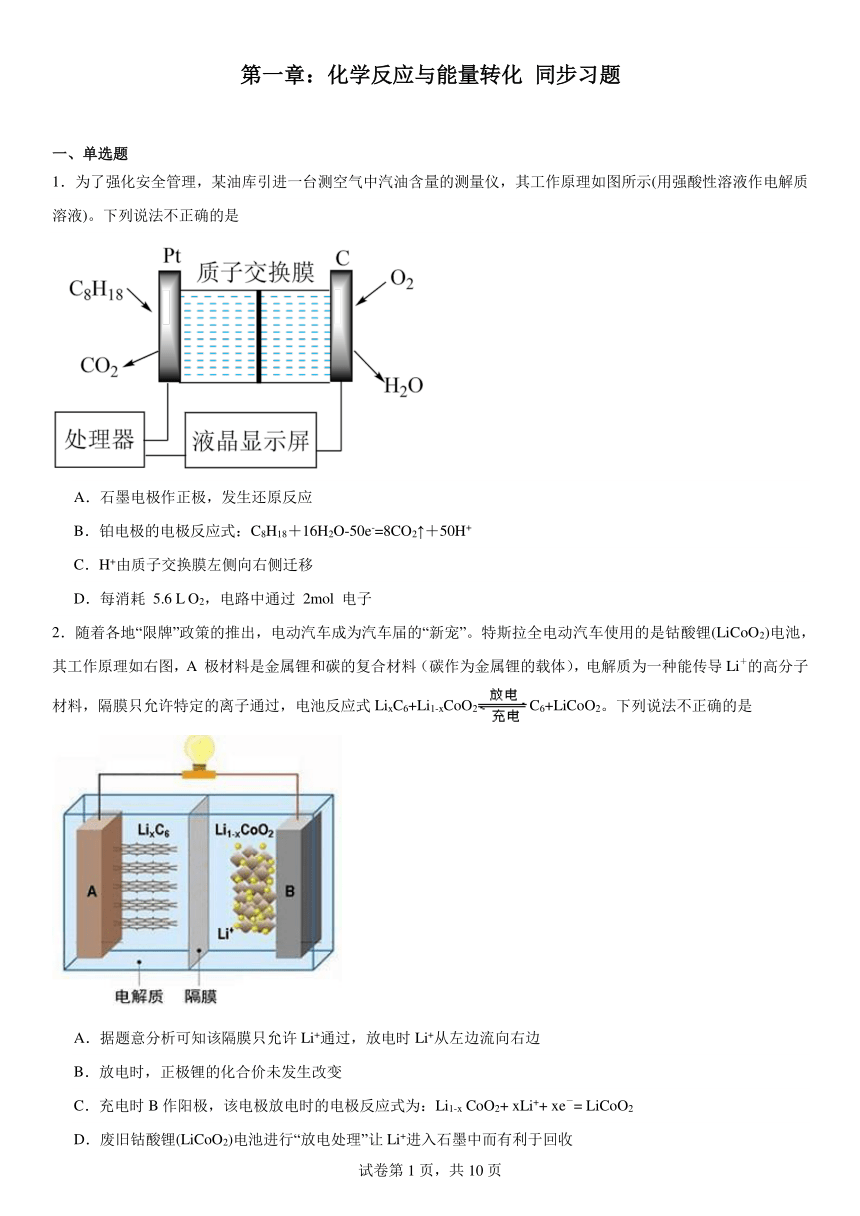 | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 20:27:18 | ||
图片预览




文档简介
第一章:化学反应与能量转化 同步习题
一、单选题
1.为了强化安全管理,某油库引进一台测空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液)。下列说法不正确的是
A.石墨电极作正极,发生还原反应
B.铂电极的电极反应式:C8H18+16H2O-50e-=8CO2↑+50H+
C.H+由质子交换膜左侧向右侧迁移
D.每消耗 5.6 L O2,电路中通过 2mol 电子
2.随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2C6+LiCoO2。下列说法不正确的是
A.据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边流向右边
B.放电时,正极锂的化合价未发生改变
C.充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+ xLi++ xe-= LiCoO2
D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收
3.有一种新型电池既可以实现海水淡化,又可以进行废水处理,还能获得电能。下列装置处理含CH3COO的废水。下列说法正确的是
A.b极发生氧化反应
B.Cl-通过隔膜II进入右室
C.负极反应为CH3COO8e2H2O2CO27H
D.若处理含有29.5gCH3COO的废水,模拟海水理论上可除NaCl234g
4.下列实验中,现象及推论都正确的是
实验 现象 推论
A 向酸性KMnO4溶液中通入SO2气体 紫红色褪去 SO2具有漂白性
B 常温下将Ba(OH)2·8H2O晶体与NH4Cl晶体在小烧杯中混合 烧杯壁变凉 该反应的 H<0
C 向FeCl2和KSCN的混合溶液中滴入硝酸酸化的AgNO3溶液 生成沉淀且溶液变红 氧化性:Fe3+D 分别向盛有0.1mol/L醋酸和饱和硼酸溶液的试管中滴加等浓度Na2CO3溶液 前者产生无色气泡,后者无明显现象 酸性:醋酸>碳酸>硼酸
A.A B.B C.C D.D
5.一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:,该电池工作时,下列说法错误的是
A.负载通过0.04mol电子时,有0.224L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为
D.电子由VB2电极经负载流向复合碳电极
6.锂空气电池是一种高理论比能量的可充电电池。放电时,总反应为2Li+O2=Li2O2,工作原理如下图所示。下列说法错误的是
A.电解液a为非水电解液
B.放电时,A处的电极反应为Li-e- =Li+
C.充电时,Li+向Li电极区域迁移
D.充电时,B处的电极反应为O2+2Li++2e- =Li2O2
7.用下列装置能达到预期目的的是( )
A.甲图装置可用于电解精炼铝
B.乙图装置可得到持续、稳定的电流
C.丙图装置可达到保护钢闸门的目的
D.丁图装置可达到保护钢闸门的目的
8.可逆反应NO2(g)+CO(g) CO2(g)+NO(g),反应过程中的能量变化如图所示,下列说法正确的是
A.1molNO2与1molCO混合经充分反应放热234kJ
B.E1为逆反应活化能
C.该反应反应物的总能最高于生成物的总能量
D.该反应的反应热ΔH=E2-E1
9.以、为原料合成涉及的主要反应如下:
Ⅰ:
Ⅱ:
Ⅲ:
则反应的焓变为
A. B.-40.9
C.+40.9 D.+139.9
10.用电解法处理酸性含铬废水(主要含有时,以铁板作阴、阳极,处理过程中发生反应:,最后以形式除去。下列说法正确的是
A.电解过程中废水的pH会减小
B.电解时H+在阴极得电子生成H2
C.电解后除沉淀外,还有沉淀生成
D.电路中每转移0.6 mol e-,最多有0.1 mol被还原
11.下列反应中Q2>Q1的是( )
A.H2(g)+Cl2(g)=2HCl(g) ΔH=Q1 kJ/mol;H2(g)+Cl2(g)=2HCl(l) ΔH=Q2 kJ/mol
B.H2O(l)=H2(g)+1/2O2(g) ΔH=Q1 kJ/mol;2H2(g)+O2(g)=2H2O(l) ΔH=Q2 kJ/mol
C.S(s)+O2(g)=SO2(g) ΔH=Q1 kJ/mol;S(g)+O2(g)=SO2(g) ΔH=Q2 kJ/mol
D.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=Q1 kJ/mol;CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=Q2 kJ/mol
12.氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A.氢氧燃料电池工作时化学能全部转化电能
B.氢氧燃料电池的负极反应为O2+4H++4e-=2H2O
C.氢氧燃料电池放电过程中消耗11.2LH2(标准状况下),转移的电子数目为6.02×1023
D.反应2H2(g)+O2(g)=2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和—反应中断裂旧共价键的键能之和
13.劳动成就梦想。下列家务劳动与所述的化学知识不相符的是
选项 家务劳动 化学知识
A 清理鱼缸并往水中通入空气 空气中的氧气易溶于水
B 用洗洁精洗涤餐具 利用了乳化作用
C 用食醋清洗水垢 醋酸可以和碳酸盐反应
D 用餐后将洗净的铁锅擦干 铁在潮湿环境中易生锈
A.A B.B C.C D.D
二、填空题
正误判断
14.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热
15.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
16.在测定中和热时,稀酸溶液中H+与稀碱溶液中OH-的物质的量相等,则所测中和热数值更准确
17.中和热的测定实验中,分多次将NaOH溶液倒入装盐酸的小烧杯中,测出来的中和热的数值偏小
18.测定中和热时,使用稀醋酸代替稀盐酸,所测中和热数值偏小
19.煤、石油、天然气等燃料的最初来源都可追溯到太阳能
20.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
21.农村用沼气池产生的沼气作燃料属于生物质能的利用
22.随着科技的发展,氢气将成为主要能源之一
23.食用植物体内的淀粉、蛋白质等属于直接利用能源
24.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O1. △H =+57.3 kJ·mol-1 (中和热)
25.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H =-1367.0 kJ·mol-1 (燃烧热)
26.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
27.已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量
28.电解在化工生产、金属冶炼及科学研究等方面有重要应用。
(1)工业上用电解熔融氧化铝的方法来制取金属铝。纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石Na3AlF6) 在1000℃左右就可以得到熔融体。
①写出电解时阳极的电极反应式: 。
②电解过程中作阳极的石墨易消耗,原因是 。
(2) 电解食盐水是氯破工业的基础。
①电解所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为 、 。电解时,阴极反应的主要产物是 。
②电解时用盐酸控制阳极区的pH在2~3,用必要的文字和反应方程式说明原因: 。
(3)Cu2O是半导体材料,工业上常用电解法制取。电解装置如下图所示。
电解装置中采用离了交换膜控制阳极区OH-的浓度而制备纳米Cu2O。该离子交换膜是 (填“阴”或“阳”)离子交换膜,阳极生成Cu2O的电极反应式为 。
29.写出不同介质中甲烷燃料电池的电极反应式。
(1)酸性介质(如)
总反应式: 。负极: 。正极: 。
(2)碱性介质(如)
总反应式: 。负极: 。正极: 。
(3)固体电解质(高温下能传导)
总反应式: 。负极: 。正极: 。
(4)熔融碳酸盐(如熔融)
总反应式: 。负极: 。正极: 。
30.电化学原理在工业生产中发挥着巨大的作用。是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产。
(1)阳极的电极反应为 。
(2)阴极产生的气体为 (填物质名称)。
(3)左侧的离子交换膜为 (填“阴”或“阳”)离子交换膜, (填“>”“<”或“=”)。
31.根据装置图,写反应式。
(1)若A、B均为惰性电极,电解质溶液为MgCl2溶液
阳极:
阴极:
总反应化学方程式:
(2)若A为Cu, B为碳棒,电解质溶液为CuSO4溶液。
阳极:
阴极:
32.氨的转化与去除:微生物燃料电池(MFC)是一种现代化氨氮去除技术,如图为MFC碳氮联合同时去除的氮转化系统原理示意图。
(1)A极的电极反应式为 ,A、B两极生成CO2和N2的物质的量之比为 。
(2)用化学用语简述去除的原理: 。
33.如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O
请回答:
(1)甲池是 池,通入O2的电极作为 极,电极反应式为 。
(2)乙池是 池,A电极名称为 极,电极反应式为 。
乙池中的总反应离子方程式为 ,
溶液的pH (填“增大”、“减小”或“不变”)。
(3)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2 mL(标准状况下)。
34.原电池反应一般是氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子,电子通过外电路输送到正极上,氧化剂在正极上得电子,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转化。
(1)化学反应, (填“能”或“不能”)通过原电池原理设计成化学电源,理由是 。
(2)甲醇燃料电池结构简单、能量转化率高,工作原理如图所示。加入的a是 (填名称),该电极的名称是 (填“正”或“负”)极,其电极反应式为 。
(3)我国科学工作者从环境污染物中分离出一株假单胞菌,该菌株能够在分解有机物的同时产生电能,其原理如图所示。
①该电池的电流方向:由 (填“左”或“右”,下同)侧电极经过负载流向 侧电极。
②当1mol参与电极反应时,从 (填“左”或“右”,下同)侧穿过质子交换膜进入 侧的数目为 。
35.回答下列问题
(1)在微生物作用的条件下,NH经过两步反应被氧化成NO。两步反应的能量变化示意图如下:
1mol NH(aq)全部氧化成NO(aq)的热化学方程式是 。
(2)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和 ΔH2的关系是ΔH1 ΔH2 (填“>”“<”或“=”)。
(3)在298K、101kPa时,已知:2H2O(g)=O2(g)+2H2(g) ΔH1;
Cl2(g)+H2(g)=2HCl(g) ΔH2;
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3。
则ΔH3与ΔH1和ΔH2 之间的关系正确的是___________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30kJ,其他相关数据如下表:
物质 H2(g) Br2(g) HBr(g)
1mol分子中的化学键断裂时需要吸收的能量(kJ) 436 200 a
则表中a= 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.由图示分析可知石墨电极(C电极)为正极,在原电池工作时得到电子发生还原反应,故A不选;
B.由图示分析可知Pt电极为电源的负极,C8H18在Pt电极失去电子发生氧化反应,则C8H18+16H2O-50e-=8CO2↑+50H+,故B不选;
C.在原电池工作中阳离子由负极向正极移动,所以H+由质子交换膜左侧向右侧迁移,故C不选;
D.如果在标准状况下,5.6 L O2的物质的量为,又由于每消耗1mol O2转移4mol ,所以每消耗 5.6 L O2,电路中通过 1mol 电子,故选D。
答案选D
2.D
【详解】试题分析:根据电池反应式知,放电时,负极反应式为LixC6-xe-=C6+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,所以A是负极、B是正极。A.据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边流向右边,A正确; B.无论放电还是充电,Li元素化合价都是+1价,所以化合价不变,B正确;C.充电时,B电极是阳极,放电时是正极,正极上得电子发生还原反应,电极反应式为Li1-x CoO2+xLi++xe-=LiCoO2,C正确;D.根据电池反应式知,充电时锂离子加入石墨中,D错误。
考点:考查了原电池和电解池原理的相关知识。
3.D
【分析】由图可知,CH3COO在a极附近转化成CO2,其中碳元素化合价升高,发生氧化反应,所以a极为负极,则b极为正极。
【详解】A.根据分析,b极为正极,发生还原反应,A项错误;
B.原电池中,阴离子移向负极,所以Cl-通过隔膜I进入左室,B项错误;
C.负极附近CH3COO失电子被氧化生成CO2和H,正确的电极反应式为:CH3COO8e2H2O2CO27H,C项错误;
D.当电路中转移1mol电子时,根据电荷守恒可知,海水中有1mol Cl-移向负极,同时有1mol Na+移向正极,即除去1mol NaCl,根据负极反应式可知,每消耗1mol CH3COO时转移8mol电子,所以若处理含有29.5g(即0.5mol)CH3COO的废水时,转移4mol电子,则消除4mol NaCl ,即模拟海水理论上可除NaCl234g ,D项正确;
答案选D。
4.D
【详解】A.酸性高锰酸钾可与二氧化硫发生氧化还原反应,溶液褪色,可知二氧化硫具有还原性,与漂白性无关,故A错误;
B.Ba(OH)2·8H2O晶体与NH4Cl晶体混合后,烧杯壁变凉说明反应吸热,△H>0,故B错误;
C.硝酸也可氧化亚铁离子生成三价铁,由实验及现象可知,无法比较Fe3+、Ag+的氧化性强弱,故C错误;
D.醋酸与碳酸钠反应生成二氧化碳,硼酸不能与碳酸钠反应生成二氧化碳,由强酸制取弱酸的原理可知,酸性:醋酸>碳酸>硼酸,故D正确;
故答案选D。
5.B
【分析】从图中可以看出,通入空气的复合碳电极为正极,VB2电极为负极。从VB2电极发生反应:可以看出,负极消耗OH-,则正极发生的反应为O2+4e-+2H2O==4OH-,由此解题。
【详解】A.由正极反应式O2+4e-+2H2O==4OH-可以看出,有0.224L(标准状况)O2参与反应时,参加反应O2的物质的量为0.01mol,负载通过0.04mol电子,A正确;
B.从正极反应式看,正极生成OH-,正极区溶液的pH升高,负极消耗OH-,负极区溶液的pH降低,B错误;
C.依据得失电子守恒调整正、负极的电极反应式,然后相加,即可得出电池总反应为,C正确;
D.由分析可知,VB2电极为负极,复合碳电极为正极,电子由VB2电极经负载流向复合碳电极,D正确;
故选B。
6.D
【详解】A.锂单质化学性质活泼,不能使用具有活泼氢的水、醇、羧酸等做电解质溶液,描述正确,不符题意;
B.根据题意,锂—空气电池,还原性更强的锂单质是失电子一极,做负极,所以A极锂单质失电子生成锂离子,描述正确,不符题意;
C.二次电池充电,放电时负极电子流出,充电时,电池的负极电子流入,充当电解池阴极,根据直流电路电荷移动特点,阳离子向阴极移动,故选项描述正确,不符题意;
D.二次电池充电,放电时正极B处电子流入,充电时,B极电子流出,发生氧化反应,失电子,选项中电极反应式显示是得电子,所以描述错误,符合题意;
综上,本题选D。
7.D
【详解】A.电解精炼铝可以让粗铝做阳极,纯铝做阴极,电解质不能使;氯化铝溶液,这样在阴极上会析出氢气,可以使熔融的氧化铝,错误,不选A;
B.原电池可以产生电流,但不能提供稳定的电流,错误,不选B;
C.丙图装置中,形成原电池,钢闸门是负极,易被腐蚀,不能达到保护闸门的目的,错误,不选C;
D.丁图装置,形成电解池,钢闸门时阴极,不容易被腐蚀,可达到保护钢闸门的目的,正确,选D。
8.C
【详解】A.由图像可知,NO2(g)+CO(g) CO2(g)+NO(g),ΔH=+134 kJ/mol -368 kJ/mol =-234 kJ/mol,1molNO2与1molCO完全反应时放热234kJ,但该反应是可逆反应,反应物不能完全转化为生成物,因此放热小于234kJ,故A错误;
B.活化能是指化学反应中,由反应物分子到达活化分子所需的最小能量。由图可知E1是反应物分子变为活化分子时需要的能量,应为正反应的活化能,故B错误;
C.由图像显示可知,该反应反应物的总能最高于生成物的总能量,故C正确;
D.根据A项计算可知,该反应放热,ΔH<0,则结合图示数据,该反应的反应热ΔH= E1-E2,故D错误;
答案选C。
9.C
【详解】根据盖斯定律,反应Ⅲ=Ⅰ-Ⅱ,=,故C正确;
故选:C。
10.B
【详解】A.由反应式可知,处理过程中消耗H+,溶液的酸性减弱,pH会增大,故A错误;
B.电解时阴极发生还原反应,溶液中H+在阴极得电子生成H2,故B正确;
C.溶液中H+在阴极得电子减少,同时生成氢氧根离子,有沉淀生成,故C错误;
D.由电极反应式Fe-2e-=Fe2+,转移0.6 mol电子,需要0.3 mol Fe,再根据处理过程关系式得:6Fe~12e-~6Fe2+~, 0.05 mol 被还原,故D错误;
故答案为B。
11.D
【详解】A.HCl(g) 转化为HCl(l)时能继续释放能量,故H2(g)+Cl2(g)=2HCl(g)放出的热量比 H2(g)+Cl2(g)=2HCl(l)更少,故Q1> Q2,A不合题意;
B.H2O(l)=H2(g)+1/2O2(g) ΔH=Q1>0 kJ/mol;2H2(g)+O2(g)=2H2O(l) ΔH=Q2 <0kJ/mol,故Q1> Q2,B不合题意;
C.S(s)比 S(g)所具有的能量更大,故S(s)+O2(g)=SO2(g)放出的热量比S(g)+O2(g)=SO2(g)更少,故 Q1> Q2,C不合题意;
D.CH3COOH为弱酸,电离时需吸收能量,故HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)放出的热量比CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)更多,故Q2 >Q1 ,D符合题意;
故答案为:D。
12.C
【详解】A.氢氧燃料电池工作时部分化学能转化电能,部分转化为热能,A说法错误;
B.氢氧燃料电池,氢气作负极,失电子发生氧化反应,中性条件的电极反应式为:2H2- 4e- =4H+,B说法错误;
C.标准状况下,Vm=22.4L/mol,11.2LH2的物质的量为0.5mol,转移电子的物质的量为1mol,电子数目为6.02×1023,C说法正确;
D.反应中,应该如下估算: H=反应中断裂旧化学键的键能之和-反应中形成新共价键的键能之和,D说法错误;
答案为C。
13.A
【详解】A.氧气难溶于水,A错误;
B.洗洁精对油污有乳化作用,所以洗洁精洗涤餐具上的油污时,发生乳化作用,B正确;
C.醋酸可以和碳酸盐反应,因此可用食醋清洗水垢,C正确;
D.由于铁在潮湿环境中易生锈,所以需将用餐后将洗净的铁锅擦干,D正确。
故选A。
14.错误 15.错误 16.错误 17.正确 18.正确 19.正确 20.正确 21.正确 22.正确 23.错误 24.错误 25.错误 26.错误 27.错误
【解析】14.中和热是以生成1mol水为标准的,错误;
15.101 kPa时,1 mol碳完全燃烧所放出的热量为碳的燃烧热,错误;
16.碱应该过量确保生成固定量的水,错误;
17.会导致测定的中和热比准确值小,因为多次加入会导致热量的损失,正确;
18.测定中和热时,使用稀醋酸代替稀盐酸,所测中和热数值偏小,因为醋酸电离吸热,正确;
19.煤、石油、天然气等燃料的最初来源都可追溯到太阳能,因为植物生长需要光合作用,正确;
20.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能,因为植物生长需要光合作用,正确;
21.农村用沼气池是动物粪便,产生的沼气作燃料属于生物质能的利用,正确;
22.氢气燃烧值大,无污染,是一种理想的能源,正确;
23.人体消化它的时候不是直接利用淀粉,而是把淀粉先分解成葡萄糖,错误;
24.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H =-57.3 kJ·mol-1 (中和热),错误;
25.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H =-1367.0 kJ·mol-1 (燃烧热),应为液态水,错误;
26.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH会有所变化,则CH3OH(g)的燃烧热不能确定,错误;
27.已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出小于57.3 kJ的热量,因为醋酸电离吸热,错误。
28. 2O2--4e-=O2↑ 石墨电极被阳极上产生的氧气氧化 NaOH Na2CO3 NaOH和H2 Cl2+H2OHCl+HClO,增大H+和 Cl-浓度,抑制氯气与水的反应,减少氯气的损失 阴 2Cu-2e-+2OH-=Cu2O+H2O
【详解】(1)①由电解装置可知,阳极上氧离子失去电子,电极反应 2O2--4e-=O2↑ ;②阳极上产生氧气,石墨电极被阳极上产生的氧气氧化,故电解过程中作阳极的石墨易消耗。(2)①食盐溶液中混有Mg2+和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+;电解时,阴极反应2H20+2e-=2OH-+H2↑,阴极反应的主要产物是NaOH和H2;②电解时用盐酸控制阳极区的pH在2~3,用必要的文字和反应方程式说明原因: Cl2+H2OHCl+HClO,增大H+和 Cl-浓度,抑制氯气与水的反应,减少氯气的损失。(3)用阴离子交换膜控制电解液中控制阳极区OH-的浓度而制备纳米Cu2O。在电解池中,当阳极是活泼电极时,该电极本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O。
29.(1)
(2)
(3)
(4)
【分析】燃料电池中,通入甲烷的一极作负极,通入氧气的一极作正极,据此分析解答。
【详解】(1)酸性介质(如)中,总反应式为;负极反应式为;正极反应式为;
(2)碱性介质(如)中,总反应式为;负极反应式为;正极反应式为;
(3)固体电解质(高温下能传导)中,总反应式为;负极反应式为;正极反应式为;
(4)熔融碳酸盐(如熔融)中,总反应式为;负极反应式为;正极反应式为;
30. 氢气 阳 <
【详解】(1)根据图知,Cu电极为阴极,Fe电极为阳极,电解时,在碱性环境中阳极铁失去电子生成,电极反应为。
(2)左侧为阴极室,的放电能力大于的放电能力,阴极Cu上的电极反应为,故阴极产生的气体为。
(3)由上述分析知,阴极室会产生,会通过离子交换膜进入阴极室平衡电荷,则左侧为阳离子交换膜。阴极的电极反应为,阴极区浓度增大,则。
31.(1) 2Cl--2e-=Cl2↑ 2H2O+2e-+Mg2+=Mg(OH)2↓+H2↑ Mg2++2Cl-+
(2) Cu-2e-=Cu2+ Cu2++2e-=Cu
【详解】(1)电解氯化镁溶液,阳极生成氯气,阴极生成氢气和氢氧化镁沉淀,阳极反应为2Cl--2e-=Cl2↑,阴极反应为2H2O+2e-+Mg2+=Mg(OH)2↓+H2↑,总反应电解式为:Mg2++2Cl-+;
(2)若A为Cu,B为碳棒,电解质溶液为CuSO4溶液,为电镀铜装置,阳极反应为Cu-2e-=Cu2+,阴极反应为Cu2++2e-=Cu。
32.(1) CH3COO--8e-+2H2O=2CO2↑+7H+ 5∶2
(2)在好氧微生物反应器中转化为:+2O2=+2H++H2O,在MFC电池正极转化为N2:2+12H++10e-=N2↑+6H2O
【详解】(1)B极电极反应式为2N+12H++10e-=N2↑+6H2O,A极电极反应式为CH3COO--8e-+2H2O=2CO2↑+7H+,A、B两极生成CO2和N2的物质的量之比为5∶2。故答案为:CH3COO--8e-+2H2O=2CO2↑+7H+;5∶2;
(2)在好氧微生物反应器中转化为:+2O2=+2H++H2O,在MFC电池正极转化为N2:2+12H++10e-=N2↑+6H2O,最终实现转化为无污染的氮气,故答案为:在好氧微生物反应器中转化为:+2O2=+2H++H2O,在MFC电池正极转化为N2:2+12H++10e-=N2↑+6H2O;
33. 原电 正 O2+2H2O+4e-===4OH- 电解 阳 4OH--4e-===O2↑+2H2O 4Ag++2H2O4Ag+O2↑+4H+ 减小 280
【详解】(1)根据甲中发生的化学反应,可知该反应是自发的放热反应,所以甲是原电池,其余为电解池。通入氧气的一极是正极,发生还原反应,结合电解质溶液,电极反应式为O2+2H2O+4e-===4OH-;
(2)乙池是电解池,因为通入氧气的一极是正极,A与正极相连,则A极是阳极,所以发生氧化反应,氢氧根离子放电生成氧气,电极反应式为2H2O -4e-=O2↑+4H+,则B是电解池的阴极,发生还原反应,银离子得到电子生成Ag,根据得失电子守恒,可得总反应式为4Ag++2H2O4Ag+O2↑+4H+;
(3)当乙池中B(Ag)极的质量增加5.40 g时,5.40gAg的物质的量是5.40g/108g/mol=0.05mol,则该过程转移电子的物质的量是0.05mol,根据得失电子守恒规律,所以甲池中理论上消耗O2的物质的量是0.05/4mol,标准状况下的体积是0.05/4mol×22.4L/mol=0.28L=280mL。
34.(1) 不能 该反应是非氧化还原反应
(2) 甲醇 负
(3) 右 左 左 右 4
【分析】(1)从是否为氧化还原反应的角度判断能否设计为原电池;
(2)根据电子和离子的移动方向可以判断左右两侧电极,左侧为负极,右侧为正极;
(3)根据右侧电极上物质的变化及元素价态的升降,可以判断左右两侧电极,左侧为负极,右侧为正极,根据转移的电子所带电荷与转移H+所带电荷相等来分析转移的氢离子数目。
【详解】(1)化学反应CuO+H2SO4=CuSO4+H2O,反应前后元素化合价没有发生变化,是一个非氧化还原反应,所以不能通过原电池原理设计成化学电源;
故答案为:不能;该反应是非氧化还原反应;
(2)根据甲醇燃料电池工作原理图可知,左边加入a,在电极上失去电子,发生氧化反应,作电源的负极,所以加入的a是甲醇,电极反应式为: ;
故答案为:甲醇;负;;
(3)从图中可以看出,右侧氧气得电子,转化为H2O,所以左侧为负极,右侧为正极,①所以该电池的电流方向:由右侧电极经过负载流向左侧电极,②当1mol参与电极反应时,正极电极反应式为:,当1mol参与电极反应时消耗4molH+,所以从左侧穿过质子交换膜进入右侧的数目为4;
故答案为:右;左;左;右;4
35.(1)NH(aq)+2O2(g)=2H+(aq)+H2O(l)+ NO(aq) ΔH=-346kJ·mol-1;
(2)<
(3)A
(4)369
【详解】(1)据图可知第一步的热化学方程式为:①NH(aq)+O2(g)=NO(aq)+2H+(aq)+H2O(l) ΔH=-273kJ/mol,第二步的热化学方程式为:②NOaq) +O2(g)= NO (aq) ΔH=-73kJ/mol,根据盖斯定律,由①+②可得:NH(aq)+2O2(g)=2H+(aq)+H2O(l)+ NO(aq) ΔH=(-273kJ/mol)+(-73kJ/mol)=-346kJ·mol-1;
(2)P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2,由盖斯定律②-①可得到反应:4P(红磷,s)=P4(白磷,s) ΔH=ΔH2-ΔH1,红磷比白磷稳定,说明红磷的能量低于白磷,该反应是吸热反应,即ΔH=ΔH2-ΔH1>0,即ΔH1<ΔH2;
(3)依次将三个热化学方程式标号为①、②、③,反应③=②×2+①,由盖斯定律可知:ΔH3=ΔH1+2ΔH2,故答案为A;
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,则H2(g)+Br2(g)=2HBr(g) ΔH=-102kJ·mol-1,ΔH=反应物键能-生成物键能,则有-102=436+200-2a,解得a=369。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.为了强化安全管理,某油库引进一台测空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液)。下列说法不正确的是
A.石墨电极作正极,发生还原反应
B.铂电极的电极反应式:C8H18+16H2O-50e-=8CO2↑+50H+
C.H+由质子交换膜左侧向右侧迁移
D.每消耗 5.6 L O2,电路中通过 2mol 电子
2.随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2C6+LiCoO2。下列说法不正确的是
A.据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边流向右边
B.放电时,正极锂的化合价未发生改变
C.充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+ xLi++ xe-= LiCoO2
D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收
3.有一种新型电池既可以实现海水淡化,又可以进行废水处理,还能获得电能。下列装置处理含CH3COO的废水。下列说法正确的是
A.b极发生氧化反应
B.Cl-通过隔膜II进入右室
C.负极反应为CH3COO8e2H2O2CO27H
D.若处理含有29.5gCH3COO的废水,模拟海水理论上可除NaCl234g
4.下列实验中,现象及推论都正确的是
实验 现象 推论
A 向酸性KMnO4溶液中通入SO2气体 紫红色褪去 SO2具有漂白性
B 常温下将Ba(OH)2·8H2O晶体与NH4Cl晶体在小烧杯中混合 烧杯壁变凉 该反应的 H<0
C 向FeCl2和KSCN的混合溶液中滴入硝酸酸化的AgNO3溶液 生成沉淀且溶液变红 氧化性:Fe3+
A.A B.B C.C D.D
5.一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:,该电池工作时,下列说法错误的是
A.负载通过0.04mol电子时,有0.224L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为
D.电子由VB2电极经负载流向复合碳电极
6.锂空气电池是一种高理论比能量的可充电电池。放电时,总反应为2Li+O2=Li2O2,工作原理如下图所示。下列说法错误的是
A.电解液a为非水电解液
B.放电时,A处的电极反应为Li-e- =Li+
C.充电时,Li+向Li电极区域迁移
D.充电时,B处的电极反应为O2+2Li++2e- =Li2O2
7.用下列装置能达到预期目的的是( )
A.甲图装置可用于电解精炼铝
B.乙图装置可得到持续、稳定的电流
C.丙图装置可达到保护钢闸门的目的
D.丁图装置可达到保护钢闸门的目的
8.可逆反应NO2(g)+CO(g) CO2(g)+NO(g),反应过程中的能量变化如图所示,下列说法正确的是
A.1molNO2与1molCO混合经充分反应放热234kJ
B.E1为逆反应活化能
C.该反应反应物的总能最高于生成物的总能量
D.该反应的反应热ΔH=E2-E1
9.以、为原料合成涉及的主要反应如下:
Ⅰ:
Ⅱ:
Ⅲ:
则反应的焓变为
A. B.-40.9
C.+40.9 D.+139.9
10.用电解法处理酸性含铬废水(主要含有时,以铁板作阴、阳极,处理过程中发生反应:,最后以形式除去。下列说法正确的是
A.电解过程中废水的pH会减小
B.电解时H+在阴极得电子生成H2
C.电解后除沉淀外,还有沉淀生成
D.电路中每转移0.6 mol e-,最多有0.1 mol被还原
11.下列反应中Q2>Q1的是( )
A.H2(g)+Cl2(g)=2HCl(g) ΔH=Q1 kJ/mol;H2(g)+Cl2(g)=2HCl(l) ΔH=Q2 kJ/mol
B.H2O(l)=H2(g)+1/2O2(g) ΔH=Q1 kJ/mol;2H2(g)+O2(g)=2H2O(l) ΔH=Q2 kJ/mol
C.S(s)+O2(g)=SO2(g) ΔH=Q1 kJ/mol;S(g)+O2(g)=SO2(g) ΔH=Q2 kJ/mol
D.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=Q1 kJ/mol;CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=Q2 kJ/mol
12.氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A.氢氧燃料电池工作时化学能全部转化电能
B.氢氧燃料电池的负极反应为O2+4H++4e-=2H2O
C.氢氧燃料电池放电过程中消耗11.2LH2(标准状况下),转移的电子数目为6.02×1023
D.反应2H2(g)+O2(g)=2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和—反应中断裂旧共价键的键能之和
13.劳动成就梦想。下列家务劳动与所述的化学知识不相符的是
选项 家务劳动 化学知识
A 清理鱼缸并往水中通入空气 空气中的氧气易溶于水
B 用洗洁精洗涤餐具 利用了乳化作用
C 用食醋清洗水垢 醋酸可以和碳酸盐反应
D 用餐后将洗净的铁锅擦干 铁在潮湿环境中易生锈
A.A B.B C.C D.D
二、填空题
正误判断
14.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热
15.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
16.在测定中和热时,稀酸溶液中H+与稀碱溶液中OH-的物质的量相等,则所测中和热数值更准确
17.中和热的测定实验中,分多次将NaOH溶液倒入装盐酸的小烧杯中,测出来的中和热的数值偏小
18.测定中和热时,使用稀醋酸代替稀盐酸,所测中和热数值偏小
19.煤、石油、天然气等燃料的最初来源都可追溯到太阳能
20.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
21.农村用沼气池产生的沼气作燃料属于生物质能的利用
22.随着科技的发展,氢气将成为主要能源之一
23.食用植物体内的淀粉、蛋白质等属于直接利用能源
24.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O1. △H =+57.3 kJ·mol-1 (中和热)
25.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H =-1367.0 kJ·mol-1 (燃烧热)
26.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
27.已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量
28.电解在化工生产、金属冶炼及科学研究等方面有重要应用。
(1)工业上用电解熔融氧化铝的方法来制取金属铝。纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石Na3AlF6) 在1000℃左右就可以得到熔融体。
①写出电解时阳极的电极反应式: 。
②电解过程中作阳极的石墨易消耗,原因是 。
(2) 电解食盐水是氯破工业的基础。
①电解所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为 、 。电解时,阴极反应的主要产物是 。
②电解时用盐酸控制阳极区的pH在2~3,用必要的文字和反应方程式说明原因: 。
(3)Cu2O是半导体材料,工业上常用电解法制取。电解装置如下图所示。
电解装置中采用离了交换膜控制阳极区OH-的浓度而制备纳米Cu2O。该离子交换膜是 (填“阴”或“阳”)离子交换膜,阳极生成Cu2O的电极反应式为 。
29.写出不同介质中甲烷燃料电池的电极反应式。
(1)酸性介质(如)
总反应式: 。负极: 。正极: 。
(2)碱性介质(如)
总反应式: 。负极: 。正极: 。
(3)固体电解质(高温下能传导)
总反应式: 。负极: 。正极: 。
(4)熔融碳酸盐(如熔融)
总反应式: 。负极: 。正极: 。
30.电化学原理在工业生产中发挥着巨大的作用。是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产。
(1)阳极的电极反应为 。
(2)阴极产生的气体为 (填物质名称)。
(3)左侧的离子交换膜为 (填“阴”或“阳”)离子交换膜, (填“>”“<”或“=”)。
31.根据装置图,写反应式。
(1)若A、B均为惰性电极,电解质溶液为MgCl2溶液
阳极:
阴极:
总反应化学方程式:
(2)若A为Cu, B为碳棒,电解质溶液为CuSO4溶液。
阳极:
阴极:
32.氨的转化与去除:微生物燃料电池(MFC)是一种现代化氨氮去除技术,如图为MFC碳氮联合同时去除的氮转化系统原理示意图。
(1)A极的电极反应式为 ,A、B两极生成CO2和N2的物质的量之比为 。
(2)用化学用语简述去除的原理: 。
33.如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O
请回答:
(1)甲池是 池,通入O2的电极作为 极,电极反应式为 。
(2)乙池是 池,A电极名称为 极,电极反应式为 。
乙池中的总反应离子方程式为 ,
溶液的pH (填“增大”、“减小”或“不变”)。
(3)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2 mL(标准状况下)。
34.原电池反应一般是氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子,电子通过外电路输送到正极上,氧化剂在正极上得电子,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转化。
(1)化学反应, (填“能”或“不能”)通过原电池原理设计成化学电源,理由是 。
(2)甲醇燃料电池结构简单、能量转化率高,工作原理如图所示。加入的a是 (填名称),该电极的名称是 (填“正”或“负”)极,其电极反应式为 。
(3)我国科学工作者从环境污染物中分离出一株假单胞菌,该菌株能够在分解有机物的同时产生电能,其原理如图所示。
①该电池的电流方向:由 (填“左”或“右”,下同)侧电极经过负载流向 侧电极。
②当1mol参与电极反应时,从 (填“左”或“右”,下同)侧穿过质子交换膜进入 侧的数目为 。
35.回答下列问题
(1)在微生物作用的条件下,NH经过两步反应被氧化成NO。两步反应的能量变化示意图如下:
1mol NH(aq)全部氧化成NO(aq)的热化学方程式是 。
(2)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和 ΔH2的关系是ΔH1 ΔH2 (填“>”“<”或“=”)。
(3)在298K、101kPa时,已知:2H2O(g)=O2(g)+2H2(g) ΔH1;
Cl2(g)+H2(g)=2HCl(g) ΔH2;
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3。
则ΔH3与ΔH1和ΔH2 之间的关系正确的是___________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30kJ,其他相关数据如下表:
物质 H2(g) Br2(g) HBr(g)
1mol分子中的化学键断裂时需要吸收的能量(kJ) 436 200 a
则表中a= 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.由图示分析可知石墨电极(C电极)为正极,在原电池工作时得到电子发生还原反应,故A不选;
B.由图示分析可知Pt电极为电源的负极,C8H18在Pt电极失去电子发生氧化反应,则C8H18+16H2O-50e-=8CO2↑+50H+,故B不选;
C.在原电池工作中阳离子由负极向正极移动,所以H+由质子交换膜左侧向右侧迁移,故C不选;
D.如果在标准状况下,5.6 L O2的物质的量为,又由于每消耗1mol O2转移4mol ,所以每消耗 5.6 L O2,电路中通过 1mol 电子,故选D。
答案选D
2.D
【详解】试题分析:根据电池反应式知,放电时,负极反应式为LixC6-xe-=C6+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,所以A是负极、B是正极。A.据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边流向右边,A正确; B.无论放电还是充电,Li元素化合价都是+1价,所以化合价不变,B正确;C.充电时,B电极是阳极,放电时是正极,正极上得电子发生还原反应,电极反应式为Li1-x CoO2+xLi++xe-=LiCoO2,C正确;D.根据电池反应式知,充电时锂离子加入石墨中,D错误。
考点:考查了原电池和电解池原理的相关知识。
3.D
【分析】由图可知,CH3COO在a极附近转化成CO2,其中碳元素化合价升高,发生氧化反应,所以a极为负极,则b极为正极。
【详解】A.根据分析,b极为正极,发生还原反应,A项错误;
B.原电池中,阴离子移向负极,所以Cl-通过隔膜I进入左室,B项错误;
C.负极附近CH3COO失电子被氧化生成CO2和H,正确的电极反应式为:CH3COO8e2H2O2CO27H,C项错误;
D.当电路中转移1mol电子时,根据电荷守恒可知,海水中有1mol Cl-移向负极,同时有1mol Na+移向正极,即除去1mol NaCl,根据负极反应式可知,每消耗1mol CH3COO时转移8mol电子,所以若处理含有29.5g(即0.5mol)CH3COO的废水时,转移4mol电子,则消除4mol NaCl ,即模拟海水理论上可除NaCl234g ,D项正确;
答案选D。
4.D
【详解】A.酸性高锰酸钾可与二氧化硫发生氧化还原反应,溶液褪色,可知二氧化硫具有还原性,与漂白性无关,故A错误;
B.Ba(OH)2·8H2O晶体与NH4Cl晶体混合后,烧杯壁变凉说明反应吸热,△H>0,故B错误;
C.硝酸也可氧化亚铁离子生成三价铁,由实验及现象可知,无法比较Fe3+、Ag+的氧化性强弱,故C错误;
D.醋酸与碳酸钠反应生成二氧化碳,硼酸不能与碳酸钠反应生成二氧化碳,由强酸制取弱酸的原理可知,酸性:醋酸>碳酸>硼酸,故D正确;
故答案选D。
5.B
【分析】从图中可以看出,通入空气的复合碳电极为正极,VB2电极为负极。从VB2电极发生反应:可以看出,负极消耗OH-,则正极发生的反应为O2+4e-+2H2O==4OH-,由此解题。
【详解】A.由正极反应式O2+4e-+2H2O==4OH-可以看出,有0.224L(标准状况)O2参与反应时,参加反应O2的物质的量为0.01mol,负载通过0.04mol电子,A正确;
B.从正极反应式看,正极生成OH-,正极区溶液的pH升高,负极消耗OH-,负极区溶液的pH降低,B错误;
C.依据得失电子守恒调整正、负极的电极反应式,然后相加,即可得出电池总反应为,C正确;
D.由分析可知,VB2电极为负极,复合碳电极为正极,电子由VB2电极经负载流向复合碳电极,D正确;
故选B。
6.D
【详解】A.锂单质化学性质活泼,不能使用具有活泼氢的水、醇、羧酸等做电解质溶液,描述正确,不符题意;
B.根据题意,锂—空气电池,还原性更强的锂单质是失电子一极,做负极,所以A极锂单质失电子生成锂离子,描述正确,不符题意;
C.二次电池充电,放电时负极电子流出,充电时,电池的负极电子流入,充当电解池阴极,根据直流电路电荷移动特点,阳离子向阴极移动,故选项描述正确,不符题意;
D.二次电池充电,放电时正极B处电子流入,充电时,B极电子流出,发生氧化反应,失电子,选项中电极反应式显示是得电子,所以描述错误,符合题意;
综上,本题选D。
7.D
【详解】A.电解精炼铝可以让粗铝做阳极,纯铝做阴极,电解质不能使;氯化铝溶液,这样在阴极上会析出氢气,可以使熔融的氧化铝,错误,不选A;
B.原电池可以产生电流,但不能提供稳定的电流,错误,不选B;
C.丙图装置中,形成原电池,钢闸门是负极,易被腐蚀,不能达到保护闸门的目的,错误,不选C;
D.丁图装置,形成电解池,钢闸门时阴极,不容易被腐蚀,可达到保护钢闸门的目的,正确,选D。
8.C
【详解】A.由图像可知,NO2(g)+CO(g) CO2(g)+NO(g),ΔH=+134 kJ/mol -368 kJ/mol =-234 kJ/mol,1molNO2与1molCO完全反应时放热234kJ,但该反应是可逆反应,反应物不能完全转化为生成物,因此放热小于234kJ,故A错误;
B.活化能是指化学反应中,由反应物分子到达活化分子所需的最小能量。由图可知E1是反应物分子变为活化分子时需要的能量,应为正反应的活化能,故B错误;
C.由图像显示可知,该反应反应物的总能最高于生成物的总能量,故C正确;
D.根据A项计算可知,该反应放热,ΔH<0,则结合图示数据,该反应的反应热ΔH= E1-E2,故D错误;
答案选C。
9.C
【详解】根据盖斯定律,反应Ⅲ=Ⅰ-Ⅱ,=,故C正确;
故选:C。
10.B
【详解】A.由反应式可知,处理过程中消耗H+,溶液的酸性减弱,pH会增大,故A错误;
B.电解时阴极发生还原反应,溶液中H+在阴极得电子生成H2,故B正确;
C.溶液中H+在阴极得电子减少,同时生成氢氧根离子,有沉淀生成,故C错误;
D.由电极反应式Fe-2e-=Fe2+,转移0.6 mol电子,需要0.3 mol Fe,再根据处理过程关系式得:6Fe~12e-~6Fe2+~, 0.05 mol 被还原,故D错误;
故答案为B。
11.D
【详解】A.HCl(g) 转化为HCl(l)时能继续释放能量,故H2(g)+Cl2(g)=2HCl(g)放出的热量比 H2(g)+Cl2(g)=2HCl(l)更少,故Q1> Q2,A不合题意;
B.H2O(l)=H2(g)+1/2O2(g) ΔH=Q1>0 kJ/mol;2H2(g)+O2(g)=2H2O(l) ΔH=Q2 <0kJ/mol,故Q1> Q2,B不合题意;
C.S(s)比 S(g)所具有的能量更大,故S(s)+O2(g)=SO2(g)放出的热量比S(g)+O2(g)=SO2(g)更少,故 Q1> Q2,C不合题意;
D.CH3COOH为弱酸,电离时需吸收能量,故HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)放出的热量比CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)更多,故Q2 >Q1 ,D符合题意;
故答案为:D。
12.C
【详解】A.氢氧燃料电池工作时部分化学能转化电能,部分转化为热能,A说法错误;
B.氢氧燃料电池,氢气作负极,失电子发生氧化反应,中性条件的电极反应式为:2H2- 4e- =4H+,B说法错误;
C.标准状况下,Vm=22.4L/mol,11.2LH2的物质的量为0.5mol,转移电子的物质的量为1mol,电子数目为6.02×1023,C说法正确;
D.反应中,应该如下估算: H=反应中断裂旧化学键的键能之和-反应中形成新共价键的键能之和,D说法错误;
答案为C。
13.A
【详解】A.氧气难溶于水,A错误;
B.洗洁精对油污有乳化作用,所以洗洁精洗涤餐具上的油污时,发生乳化作用,B正确;
C.醋酸可以和碳酸盐反应,因此可用食醋清洗水垢,C正确;
D.由于铁在潮湿环境中易生锈,所以需将用餐后将洗净的铁锅擦干,D正确。
故选A。
14.错误 15.错误 16.错误 17.正确 18.正确 19.正确 20.正确 21.正确 22.正确 23.错误 24.错误 25.错误 26.错误 27.错误
【解析】14.中和热是以生成1mol水为标准的,错误;
15.101 kPa时,1 mol碳完全燃烧所放出的热量为碳的燃烧热,错误;
16.碱应该过量确保生成固定量的水,错误;
17.会导致测定的中和热比准确值小,因为多次加入会导致热量的损失,正确;
18.测定中和热时,使用稀醋酸代替稀盐酸,所测中和热数值偏小,因为醋酸电离吸热,正确;
19.煤、石油、天然气等燃料的最初来源都可追溯到太阳能,因为植物生长需要光合作用,正确;
20.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能,因为植物生长需要光合作用,正确;
21.农村用沼气池是动物粪便,产生的沼气作燃料属于生物质能的利用,正确;
22.氢气燃烧值大,无污染,是一种理想的能源,正确;
23.人体消化它的时候不是直接利用淀粉,而是把淀粉先分解成葡萄糖,错误;
24.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H =-57.3 kJ·mol-1 (中和热),错误;
25.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H =-1367.0 kJ·mol-1 (燃烧热),应为液态水,错误;
26.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH会有所变化,则CH3OH(g)的燃烧热不能确定,错误;
27.已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出小于57.3 kJ的热量,因为醋酸电离吸热,错误。
28. 2O2--4e-=O2↑ 石墨电极被阳极上产生的氧气氧化 NaOH Na2CO3 NaOH和H2 Cl2+H2OHCl+HClO,增大H+和 Cl-浓度,抑制氯气与水的反应,减少氯气的损失 阴 2Cu-2e-+2OH-=Cu2O+H2O
【详解】(1)①由电解装置可知,阳极上氧离子失去电子,电极反应 2O2--4e-=O2↑ ;②阳极上产生氧气,石墨电极被阳极上产生的氧气氧化,故电解过程中作阳极的石墨易消耗。(2)①食盐溶液中混有Mg2+和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+;电解时,阴极反应2H20+2e-=2OH-+H2↑,阴极反应的主要产物是NaOH和H2;②电解时用盐酸控制阳极区的pH在2~3,用必要的文字和反应方程式说明原因: Cl2+H2OHCl+HClO,增大H+和 Cl-浓度,抑制氯气与水的反应,减少氯气的损失。(3)用阴离子交换膜控制电解液中控制阳极区OH-的浓度而制备纳米Cu2O。在电解池中,当阳极是活泼电极时,该电极本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O。
29.(1)
(2)
(3)
(4)
【分析】燃料电池中,通入甲烷的一极作负极,通入氧气的一极作正极,据此分析解答。
【详解】(1)酸性介质(如)中,总反应式为;负极反应式为;正极反应式为;
(2)碱性介质(如)中,总反应式为;负极反应式为;正极反应式为;
(3)固体电解质(高温下能传导)中,总反应式为;负极反应式为;正极反应式为;
(4)熔融碳酸盐(如熔融)中,总反应式为;负极反应式为;正极反应式为;
30. 氢气 阳 <
【详解】(1)根据图知,Cu电极为阴极,Fe电极为阳极,电解时,在碱性环境中阳极铁失去电子生成,电极反应为。
(2)左侧为阴极室,的放电能力大于的放电能力,阴极Cu上的电极反应为,故阴极产生的气体为。
(3)由上述分析知,阴极室会产生,会通过离子交换膜进入阴极室平衡电荷,则左侧为阳离子交换膜。阴极的电极反应为,阴极区浓度增大,则。
31.(1) 2Cl--2e-=Cl2↑ 2H2O+2e-+Mg2+=Mg(OH)2↓+H2↑ Mg2++2Cl-+
(2) Cu-2e-=Cu2+ Cu2++2e-=Cu
【详解】(1)电解氯化镁溶液,阳极生成氯气,阴极生成氢气和氢氧化镁沉淀,阳极反应为2Cl--2e-=Cl2↑,阴极反应为2H2O+2e-+Mg2+=Mg(OH)2↓+H2↑,总反应电解式为:Mg2++2Cl-+;
(2)若A为Cu,B为碳棒,电解质溶液为CuSO4溶液,为电镀铜装置,阳极反应为Cu-2e-=Cu2+,阴极反应为Cu2++2e-=Cu。
32.(1) CH3COO--8e-+2H2O=2CO2↑+7H+ 5∶2
(2)在好氧微生物反应器中转化为:+2O2=+2H++H2O,在MFC电池正极转化为N2:2+12H++10e-=N2↑+6H2O
【详解】(1)B极电极反应式为2N+12H++10e-=N2↑+6H2O,A极电极反应式为CH3COO--8e-+2H2O=2CO2↑+7H+,A、B两极生成CO2和N2的物质的量之比为5∶2。故答案为:CH3COO--8e-+2H2O=2CO2↑+7H+;5∶2;
(2)在好氧微生物反应器中转化为:+2O2=+2H++H2O,在MFC电池正极转化为N2:2+12H++10e-=N2↑+6H2O,最终实现转化为无污染的氮气,故答案为:在好氧微生物反应器中转化为:+2O2=+2H++H2O,在MFC电池正极转化为N2:2+12H++10e-=N2↑+6H2O;
33. 原电 正 O2+2H2O+4e-===4OH- 电解 阳 4OH--4e-===O2↑+2H2O 4Ag++2H2O4Ag+O2↑+4H+ 减小 280
【详解】(1)根据甲中发生的化学反应,可知该反应是自发的放热反应,所以甲是原电池,其余为电解池。通入氧气的一极是正极,发生还原反应,结合电解质溶液,电极反应式为O2+2H2O+4e-===4OH-;
(2)乙池是电解池,因为通入氧气的一极是正极,A与正极相连,则A极是阳极,所以发生氧化反应,氢氧根离子放电生成氧气,电极反应式为2H2O -4e-=O2↑+4H+,则B是电解池的阴极,发生还原反应,银离子得到电子生成Ag,根据得失电子守恒,可得总反应式为4Ag++2H2O4Ag+O2↑+4H+;
(3)当乙池中B(Ag)极的质量增加5.40 g时,5.40gAg的物质的量是5.40g/108g/mol=0.05mol,则该过程转移电子的物质的量是0.05mol,根据得失电子守恒规律,所以甲池中理论上消耗O2的物质的量是0.05/4mol,标准状况下的体积是0.05/4mol×22.4L/mol=0.28L=280mL。
34.(1) 不能 该反应是非氧化还原反应
(2) 甲醇 负
(3) 右 左 左 右 4
【分析】(1)从是否为氧化还原反应的角度判断能否设计为原电池;
(2)根据电子和离子的移动方向可以判断左右两侧电极,左侧为负极,右侧为正极;
(3)根据右侧电极上物质的变化及元素价态的升降,可以判断左右两侧电极,左侧为负极,右侧为正极,根据转移的电子所带电荷与转移H+所带电荷相等来分析转移的氢离子数目。
【详解】(1)化学反应CuO+H2SO4=CuSO4+H2O,反应前后元素化合价没有发生变化,是一个非氧化还原反应,所以不能通过原电池原理设计成化学电源;
故答案为:不能;该反应是非氧化还原反应;
(2)根据甲醇燃料电池工作原理图可知,左边加入a,在电极上失去电子,发生氧化反应,作电源的负极,所以加入的a是甲醇,电极反应式为: ;
故答案为:甲醇;负;;
(3)从图中可以看出,右侧氧气得电子,转化为H2O,所以左侧为负极,右侧为正极,①所以该电池的电流方向:由右侧电极经过负载流向左侧电极,②当1mol参与电极反应时,正极电极反应式为:,当1mol参与电极反应时消耗4molH+,所以从左侧穿过质子交换膜进入右侧的数目为4;
故答案为:右;左;左;右;4
35.(1)NH(aq)+2O2(g)=2H+(aq)+H2O(l)+ NO(aq) ΔH=-346kJ·mol-1;
(2)<
(3)A
(4)369
【详解】(1)据图可知第一步的热化学方程式为:①NH(aq)+O2(g)=NO(aq)+2H+(aq)+H2O(l) ΔH=-273kJ/mol,第二步的热化学方程式为:②NOaq) +O2(g)= NO (aq) ΔH=-73kJ/mol,根据盖斯定律,由①+②可得:NH(aq)+2O2(g)=2H+(aq)+H2O(l)+ NO(aq) ΔH=(-273kJ/mol)+(-73kJ/mol)=-346kJ·mol-1;
(2)P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2,由盖斯定律②-①可得到反应:4P(红磷,s)=P4(白磷,s) ΔH=ΔH2-ΔH1,红磷比白磷稳定,说明红磷的能量低于白磷,该反应是吸热反应,即ΔH=ΔH2-ΔH1>0,即ΔH1<ΔH2;
(3)依次将三个热化学方程式标号为①、②、③,反应③=②×2+①,由盖斯定律可知:ΔH3=ΔH1+2ΔH2,故答案为A;
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,则H2(g)+Br2(g)=2HBr(g) ΔH=-102kJ·mol-1,ΔH=反应物键能-生成物键能,则有-102=436+200-2a,解得a=369。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
