2.2.1氯气的性质课件(共29张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.1氯气的性质课件(共29张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 13.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 00:00:00 | ||
图片预览







文档简介
(共29张PPT)
新人教版 化学 必修第一册
§2.2.1 氯气的性质
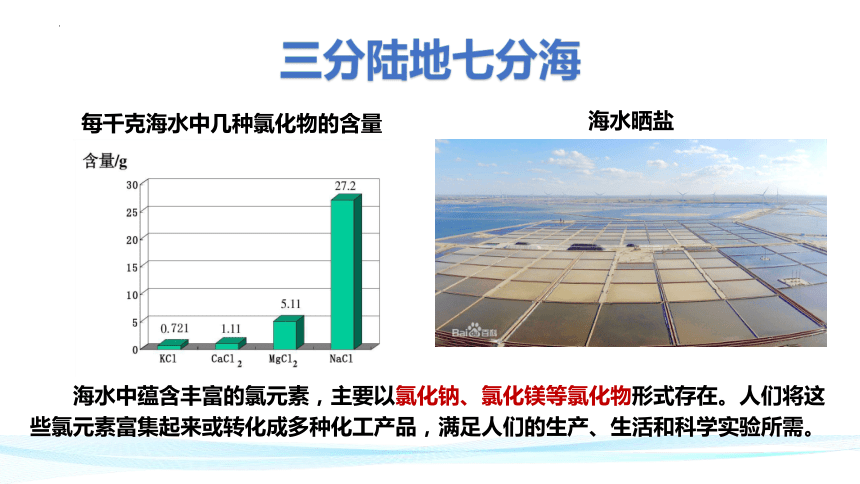
每千克海水中几种氯化物的含量
海水中蕴含丰富的氯元素,主要以氯化钠、氯化镁等氯化物形式存在。人们将这些氯元素富集起来或转化成多种化工产品,满足人们的生产、生活和科学实验所需。
三分陆地七分海
海水晒盐
Part One
氯气的发现史
在1774年,当舍勒将软锰矿(二氧化锰)与浓盐酸混合并加热时,产生了一种黄绿色的气体,这种气体的强烈的刺激性气味使他极为难受,但是他确信自己制得了一种新气体,他又感到一种由衷的快乐。
舍勒把氯气溶解在水里(氯气可溶于水,体积比为1:2),发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属或金属氧化物发生化学反应。从1774年舍勒发现氯气以后,许多科学家对这种气体的性质进行研究,到1810年,氯气一直被当作一种化合物。直到1810年戴维经过大量实验研究,确认这种气体是由一种化学元素组成的物质。他将这种元素命名为chlorine,这个名称来自希腊文,有“绿色的”意思。我国早年的译文将其译作“绿气”,后改为氯气。
Part Three
氯气的性质
氯气泄漏事件
近日,京沪高速公路一辆满载液氯的液罐车发生车祸,大量液氯外泄。据目击者描述 : “一股黄绿色的气体溢出,并有刺鼻的味道 。”
事发后消防队员不断地用水枪喷射,但因气体扩散 ,造成多人中毒死亡的特大事故,附近居民采取应急措施,疏散到一高坡上。
纯净物——液态氯单质
颜色:
密度:
沸点:
溶解性:
味道:
物理性质
毒性:
状态:
黄绿色
气体
能溶于水(1:2)
比空气大
-34.6°C,易液化
刺激性气味
有毒
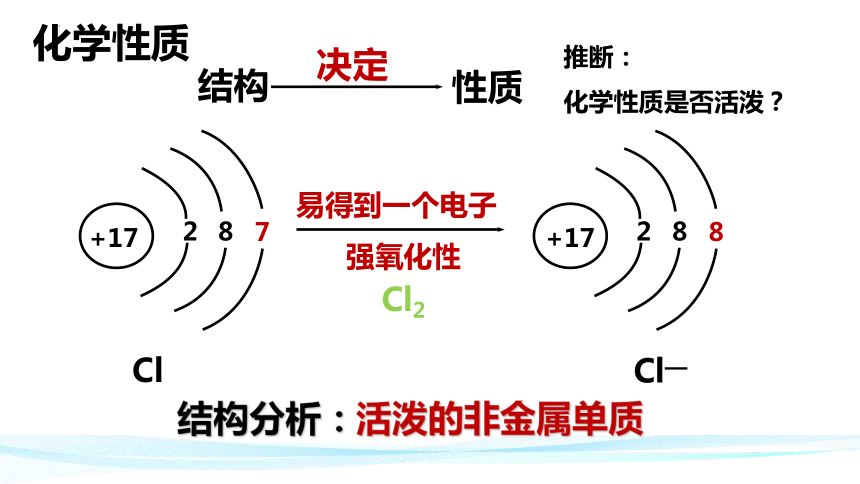
结构
性质
+17
8
2
7
易得到一个电子
Cl
决定
推断:
化学性质是否活泼?
强氧化性
Cl2
化学性质
结构分析:活泼的非金属单质
+17
8
2
8
Cl—
①钠与氯气的反应
1、与金属反应
现象:剧烈燃烧,黄色火焰,生成大量白烟。
2Na+Cl2 === 2NaCl
+1
固体小颗粒
钠的焰色试验
1、与金属反应
②铁与氯气的反应
现象:剧烈燃烧,生成棕褐色的烟,水溶液显黄色。
2Fe + 3Cl2 === 2FeCl3
点燃
+3
少量氯气与铁单质反应生成什么?
1、与金属反应
③ 铜与氯气的反应
现象:剧烈燃烧,生成棕黄色的烟。加入足量水显蓝色。
Cu+Cl2 ===CuCl2
点燃
+2
①钠与氯气的反应
1、与金属反应
②铁与氯气的反应
③ 铜与氯气的反应
+1
事实证明:氯气可与大多数金属在点燃或加热的条件下直接化合,而且生成高价态金属氯化物。
2Na+Cl2 === 2NaCl
2Fe + 3Cl2 === 2FeCl3
点燃
+3
Cu+Cl2 ===CuCl2
点燃
+2
1、与金属反应
②铁与氯气的反应
通常情况下,干燥的氯气与铁不反应,
所以可以用钢瓶储存干燥液氯。
2Fe + 3Cl2 === 2FeCl3
点燃
H2 + Cl2 === 2HCl
点燃
安静燃烧,苍白色火焰,
瓶口有白雾,生成刺激性气味气体
与H2反应
2、与非金属反应
液体小液滴
H2 + Cl2 === 2HCl
光照
若混合后光照......
与H2反应
2、与非金属反应
剧烈爆炸,瓶口有白雾
H2 + Cl2 === 2HCl
点燃
安静燃烧,苍白色火焰,
瓶口有白雾,生成刺激性气味气体
H2 + Cl2 === 2HCl
光照
若混合后光照......
与H2反应
反应条件不同
现象不同
但产物相同
2、与非金属反应
剧烈爆炸,瓶口有白雾
我们以前学过的燃烧反应,都是物质在氧气中的燃烧。
通过氯气与金属单质、非金属单质的反应,你对燃烧的条件及其本质有什么新的认识?
①发光放热的剧烈的化学反应
②本质:氧化还原反应
③不一定有氧气参加,氯气有时也可作助燃剂
2、与非金属反应
自来水用氯气消毒
游泳池
氯气能溶解于水
在常温下,1体积的水能够溶解约2体积的氯气
氯气的水溶液叫做氯水。
氯气溶于水为什么能杀菌、消毒呢?
【探究实验1】
(1)将干燥的氯气分别通入放有干燥有色布条和湿润的有色布条的广口瓶中,观察实验现象。
(2)将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
现象:干燥布条不褪色,湿润的布条褪色;有色鲜花褪色
结论:干燥的Cl2无漂白性,
Cl2遇水生成一种有漂白性的物质
氯水成分探究:
【探究实验2】分别用玻璃棒蘸取新制氯水和稀盐酸滴在pH试纸上。观察现象。
思考:使pH试纸褪色的“?”是什么?
现象:测新制氯水的pH试纸先变红后褪色,
测盐酸的pH试纸变红(说明pH<7)。
结论:氯水中有 H+ 和有漂白性的“?”
能用pH试纸测定新制氯水的pH吗?
氯水成分探究:
【探究实验3】在试管中滴入几滴新制氯水,再滴入几滴硝酸银溶液和两滴稀硝酸,观察现象。
AgCl
现象:产生不溶于稀硝酸的白色沉淀
结论:氯水中有Cl—
氯水成分探究:
很弱的酸
(比碳酸弱)
Cl2 + H2O H++Cl — + HClO
化学方程式:
(次氯酸)
化学性质
3.与H2O(水)反应
离子方程式:
Cl2 + H2O HCl + HClO
不稳定
(必修一P48)
2HClO === 2HCl+O2↑
光照
强氧化性
漂
白
性
-1
+1
0
歧化反应
每消耗一个Cl2,转移____个电子
HClO H+ + ClO-
HCl = H+ + Cl-
三分子:Cl2、H2O、HClO
四离子:H+、Cl—、ClO—、OH —(少量)
Cl2 + H2O HCl + HClO
H2O H+ + OH-
可逆:反应物与生成物共存
【讨论】新制氯水中存在哪些微粒?
液氯 新制氯水 久置氯水
分类
颜色
酸性
漂白性
氧化性
纯净物
混合物
混合物
黄绿色
浅黄绿色
无色
×
√
×
×
√
√
(稀盐酸)
√
√
×
液氯、新制氯水、久置氯水的比较
【讨论】推测氯气能否与NaOH溶液反应?
+ +
NaOH NaOH
Cl2+2NaOH=NaCl+NaClO+H2O
用途:氯气的尾气处理,
Cl2 + H2O HCl + HClO
主要成分
有效成分
用澄清石灰水可以吗?
制84消毒液等。
Cl2+2NaOH = NaCl+NaClO+H2O
(1)氯气与NaOH溶液反应
(2)氯气与石灰乳 Ca(OH)2 反应
化学性质
3.与碱反应
-1
+1
0
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2+2H2O
-1
+1
0
歧化反应
每生成一个NaCl,
转移____个电子
制备84消毒液
制备漂白粉
失效的原理:
2HClO 2HCl+O2↑
使用原理:
有效成份: Ca(ClO)2
主要成份: CaCl2 和Ca(ClO)2
制取:
同时也是失效原理
如何保存?
密封保存,放在阴凉干燥处
光照
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2+2H2O
Ca(ClO) 2 +CO2+H2O = CaCO3+2HClO
漂粉精?
漂白粉
强酸制弱酸
合成塑料、橡胶、人造纤维、
农药和药品的重要原料
制取漂白剂
制取盐酸
作消毒剂
氯气
氯气的用途
1.氯气是黄绿色、有刺激性气味的有毒气体,能溶于水,氯水是一种混合物。
2.氯气能与金属单质、非金属单质(氢气)发生反应;
氯气还能与水、碱溶液反应(歧化反应)。
3.次氯酸很不稳定,酸性小于碳酸,但具有强氧化性,可用于杀菌、消毒、漂白织物。
小结
新人教版 化学 必修第一册
§2.2.1 氯气的性质
每千克海水中几种氯化物的含量
海水中蕴含丰富的氯元素,主要以氯化钠、氯化镁等氯化物形式存在。人们将这些氯元素富集起来或转化成多种化工产品,满足人们的生产、生活和科学实验所需。
三分陆地七分海
海水晒盐
Part One
氯气的发现史
在1774年,当舍勒将软锰矿(二氧化锰)与浓盐酸混合并加热时,产生了一种黄绿色的气体,这种气体的强烈的刺激性气味使他极为难受,但是他确信自己制得了一种新气体,他又感到一种由衷的快乐。
舍勒把氯气溶解在水里(氯气可溶于水,体积比为1:2),发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属或金属氧化物发生化学反应。从1774年舍勒发现氯气以后,许多科学家对这种气体的性质进行研究,到1810年,氯气一直被当作一种化合物。直到1810年戴维经过大量实验研究,确认这种气体是由一种化学元素组成的物质。他将这种元素命名为chlorine,这个名称来自希腊文,有“绿色的”意思。我国早年的译文将其译作“绿气”,后改为氯气。
Part Three
氯气的性质
氯气泄漏事件
近日,京沪高速公路一辆满载液氯的液罐车发生车祸,大量液氯外泄。据目击者描述 : “一股黄绿色的气体溢出,并有刺鼻的味道 。”
事发后消防队员不断地用水枪喷射,但因气体扩散 ,造成多人中毒死亡的特大事故,附近居民采取应急措施,疏散到一高坡上。
纯净物——液态氯单质
颜色:
密度:
沸点:
溶解性:
味道:
物理性质
毒性:
状态:
黄绿色
气体
能溶于水(1:2)
比空气大
-34.6°C,易液化
刺激性气味
有毒
结构
性质
+17
8
2
7
易得到一个电子
Cl
决定
推断:
化学性质是否活泼?
强氧化性
Cl2
化学性质
结构分析:活泼的非金属单质
+17
8
2
8
Cl—
①钠与氯气的反应
1、与金属反应
现象:剧烈燃烧,黄色火焰,生成大量白烟。
2Na+Cl2 === 2NaCl
+1
固体小颗粒
钠的焰色试验
1、与金属反应
②铁与氯气的反应
现象:剧烈燃烧,生成棕褐色的烟,水溶液显黄色。
2Fe + 3Cl2 === 2FeCl3
点燃
+3
少量氯气与铁单质反应生成什么?
1、与金属反应
③ 铜与氯气的反应
现象:剧烈燃烧,生成棕黄色的烟。加入足量水显蓝色。
Cu+Cl2 ===CuCl2
点燃
+2
①钠与氯气的反应
1、与金属反应
②铁与氯气的反应
③ 铜与氯气的反应
+1
事实证明:氯气可与大多数金属在点燃或加热的条件下直接化合,而且生成高价态金属氯化物。
2Na+Cl2 === 2NaCl
2Fe + 3Cl2 === 2FeCl3
点燃
+3
Cu+Cl2 ===CuCl2
点燃
+2
1、与金属反应
②铁与氯气的反应
通常情况下,干燥的氯气与铁不反应,
所以可以用钢瓶储存干燥液氯。
2Fe + 3Cl2 === 2FeCl3
点燃
H2 + Cl2 === 2HCl
点燃
安静燃烧,苍白色火焰,
瓶口有白雾,生成刺激性气味气体
与H2反应
2、与非金属反应
液体小液滴
H2 + Cl2 === 2HCl
光照
若混合后光照......
与H2反应
2、与非金属反应
剧烈爆炸,瓶口有白雾
H2 + Cl2 === 2HCl
点燃
安静燃烧,苍白色火焰,
瓶口有白雾,生成刺激性气味气体
H2 + Cl2 === 2HCl
光照
若混合后光照......
与H2反应
反应条件不同
现象不同
但产物相同
2、与非金属反应
剧烈爆炸,瓶口有白雾
我们以前学过的燃烧反应,都是物质在氧气中的燃烧。
通过氯气与金属单质、非金属单质的反应,你对燃烧的条件及其本质有什么新的认识?
①发光放热的剧烈的化学反应
②本质:氧化还原反应
③不一定有氧气参加,氯气有时也可作助燃剂
2、与非金属反应
自来水用氯气消毒
游泳池
氯气能溶解于水
在常温下,1体积的水能够溶解约2体积的氯气
氯气的水溶液叫做氯水。
氯气溶于水为什么能杀菌、消毒呢?
【探究实验1】
(1)将干燥的氯气分别通入放有干燥有色布条和湿润的有色布条的广口瓶中,观察实验现象。
(2)将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
现象:干燥布条不褪色,湿润的布条褪色;有色鲜花褪色
结论:干燥的Cl2无漂白性,
Cl2遇水生成一种有漂白性的物质
氯水成分探究:
【探究实验2】分别用玻璃棒蘸取新制氯水和稀盐酸滴在pH试纸上。观察现象。
思考:使pH试纸褪色的“?”是什么?
现象:测新制氯水的pH试纸先变红后褪色,
测盐酸的pH试纸变红(说明pH<7)。
结论:氯水中有 H+ 和有漂白性的“?”
能用pH试纸测定新制氯水的pH吗?
氯水成分探究:
【探究实验3】在试管中滴入几滴新制氯水,再滴入几滴硝酸银溶液和两滴稀硝酸,观察现象。
AgCl
现象:产生不溶于稀硝酸的白色沉淀
结论:氯水中有Cl—
氯水成分探究:
很弱的酸
(比碳酸弱)
Cl2 + H2O H++Cl — + HClO
化学方程式:
(次氯酸)
化学性质
3.与H2O(水)反应
离子方程式:
Cl2 + H2O HCl + HClO
不稳定
(必修一P48)
2HClO === 2HCl+O2↑
光照
强氧化性
漂
白
性
-1
+1
0
歧化反应
每消耗一个Cl2,转移____个电子
HClO H+ + ClO-
HCl = H+ + Cl-
三分子:Cl2、H2O、HClO
四离子:H+、Cl—、ClO—、OH —(少量)
Cl2 + H2O HCl + HClO
H2O H+ + OH-
可逆:反应物与生成物共存
【讨论】新制氯水中存在哪些微粒?
液氯 新制氯水 久置氯水
分类
颜色
酸性
漂白性
氧化性
纯净物
混合物
混合物
黄绿色
浅黄绿色
无色
×
√
×
×
√
√
(稀盐酸)
√
√
×
液氯、新制氯水、久置氯水的比较
【讨论】推测氯气能否与NaOH溶液反应?
+ +
NaOH NaOH
Cl2+2NaOH=NaCl+NaClO+H2O
用途:氯气的尾气处理,
Cl2 + H2O HCl + HClO
主要成分
有效成分
用澄清石灰水可以吗?
制84消毒液等。
Cl2+2NaOH = NaCl+NaClO+H2O
(1)氯气与NaOH溶液反应
(2)氯气与石灰乳 Ca(OH)2 反应
化学性质
3.与碱反应
-1
+1
0
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2+2H2O
-1
+1
0
歧化反应
每生成一个NaCl,
转移____个电子
制备84消毒液
制备漂白粉
失效的原理:
2HClO 2HCl+O2↑
使用原理:
有效成份: Ca(ClO)2
主要成份: CaCl2 和Ca(ClO)2
制取:
同时也是失效原理
如何保存?
密封保存,放在阴凉干燥处
光照
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2+2H2O
Ca(ClO) 2 +CO2+H2O = CaCO3+2HClO
漂粉精?
漂白粉
强酸制弱酸
合成塑料、橡胶、人造纤维、
农药和药品的重要原料
制取漂白剂
制取盐酸
作消毒剂
氯气
氯气的用途
1.氯气是黄绿色、有刺激性气味的有毒气体,能溶于水,氯水是一种混合物。
2.氯气能与金属单质、非金属单质(氢气)发生反应;
氯气还能与水、碱溶液反应(歧化反应)。
3.次氯酸很不稳定,酸性小于碳酸,但具有强氧化性,可用于杀菌、消毒、漂白织物。
小结
