专题2 研究物质的基本方法 同步练习(含答案) 2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题2 研究物质的基本方法 同步练习(含答案) 2023-2024学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 295.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 22:56:00 | ||
图片预览


文档简介
专题2 研究物质的基本方法
1.用有机溶剂提取菠菜中的色素所形成的色素石油醚溶液,要用干燥剂进行干燥以后再用纸色谱法进行色素分离。下列物质中可用作干燥剂的是( )
A.芒硝 B.无水硫酸钠
C.蓝矾 D.明矾
2.X22﹣离子共有2n个电子,元素X的原子核内的质子数为
A.n﹣1 B.n+1 C.n D.2n
3.已知碘元素的核电荷数为53,下列关于131I的说法正确的是( )
A.131I的核外有53个电子 B.131I的质量数为78
C.131I的核内有53个中子 D.131I的核内有131个质子
4.下列实验能达到预期目的的是
序号 实验操作 实验目的
A 将乙烯和乙烷的混合气体通过酸性高锰酸钾溶液 除去乙烷中混有的少量的乙烯
B 往苯与苯酚混合物中加入氢氧化钠溶液,分液 除去苯中混有的少量的苯酚
C 往碘水中加入酒精,分液 提取碘水中的碘
D 取少量淀粉水解(水解时用硫酸作催化剂)后的溶液,加入新制的Cu(OH)2悬浊液,加热 检验淀粉的水解产物
A.A B.B C.C D.D
5.设NA为阿伏加 德罗常数的值。下列叙述正确的是( )
A.1.8 g NH中含有的电子数为NA
B.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
C.标准状况下,2.24 L CCl4含有的氯原子数为0.4NA
D.1 L 0.1 mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
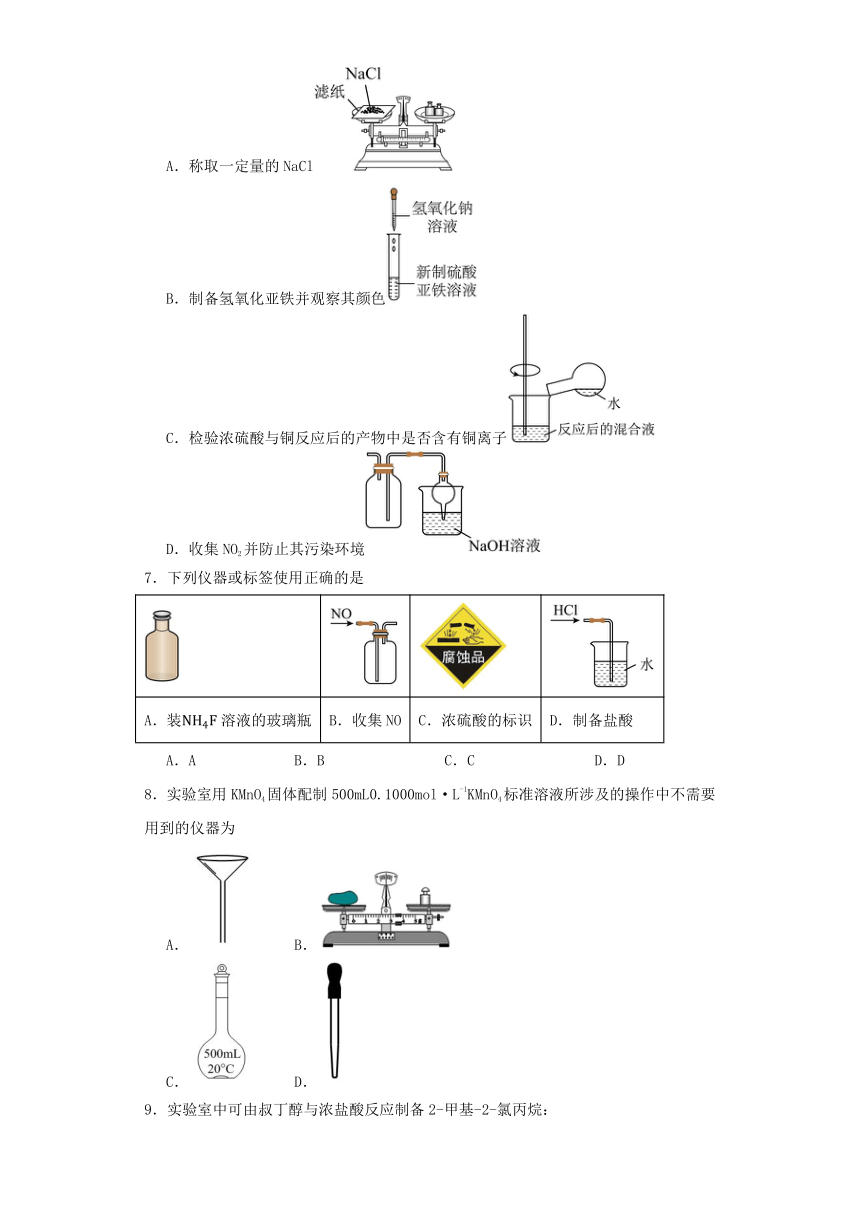
6.正确的实验操作是实验成功的重要因素,下列实验操作正确的是
A.称取一定量的NaCl
B.制备氢氧化亚铁并观察其颜色
C.检验浓硫酸与铜反应后的产物中是否含有铜离子
D.收集NO2并防止其污染环境
7.下列仪器或标签使用正确的是
A.装溶液的玻璃瓶 B.收集NO C.浓硫酸的标识 D.制备盐酸
A.A B.B C.C D.D
8.实验室用KMnO4固体配制500mL0.1000mol·L-1KMnO4标准溶液所涉及的操作中不需要用到的仪器为
A. B.
C. D.
9.实验室中可由叔丁醇与浓盐酸反应制备2-甲基-2-氯丙烷:
下列说法错误的是
A.该反应为取代反应
B.两次水洗的目的是相同的
C.无水CaCl2的作用是除去少量水
D.①操作的名称为过滤
10.用质量分数为0.35、密度为0.88 g/cm3的氨水配制9.0 mol/L的氨水100 mL,需要的定量仪器有①100 mL容量瓶 ②10 mL量筒 ③50 mL量筒 ④电子天平 ⑤烧杯 ⑥胶头滴管
A.①③④⑤⑥ B.①②④⑤⑥ C.①④⑤⑥ D.①③
11.下列说法正确的是( )
A.氧化钙、氧化镁、氧化铝都属于碱性氧化物
B.生铁、水银和黄铜都属于合金
C.萃取操作时,选择的萃取剂与水不互溶,且萃取剂的密度必须比水大
D.用长滴管往硫酸亚铁溶液中滴入氢氧化钠溶液,会观察到先产生白色沉淀,逐渐变为灰绿色,最后呈现红褐色
12.进行化学实验时应强化安全意识。下列做法正确的是
A.金属钠着火时使用泡沫灭火器灭火
B.用试管加热碳酸氢钠固体时使试管口竖直向上
C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
13.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
混合物 试剂 分离方法
A 苯(苯酚) 溴水 过滤
B 甲烷(乙烯) 酸性高锰酸钾溶液 洗气
C 乙酸乙酯(乙酸) 氢氧化钠溶液 蒸馏
D 乙醇(水) 氧化钙 蒸馏
A.A B.B C.C D.D
14.粗食盐的杂质主要是MgCl2,为了除去杂质,工业上常把粗盐粉碎后用饱和食盐水浸洗,再过滤出食盐。对此,下面的评论正确的是
A.浸洗前后,被浸洗的食盐中MgCl2的含量基本不变
B.用来浸洗的饱和食盐水在浸洗前后没有变化
C.浸洗用过的饱和食盐水可以无限次地使用下去
D.粉碎颗粒的大小影响浸洗后盐中MgCl2的含量
15.除去下列物质中的少量杂质,所选用试剂及操作方法均正确的是
选项 物质(括号内为杂质) 选用试剂 操作方法
A CO2(CO) 足量的O2 点燃
B NaCl溶液(碘) CCl4 萃取、分液
C Fe(Cu) 加盐酸 过滤
D CO2(HCl) 氢氧化钠溶液 洗气
A.A B.B C.C D.D
16.“皮鞋很忙”的恶搞段子曾经风靡网络,揭露了某些行业用烂皮鞋制造酸奶或毒胶囊的不法行为。央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是 价。CrO2-是一种酸根离子,则Fe(CrO2)2属于 (填“酸”“碱”“盐”或“氧化物”)。
(2)区分明胶的水溶液和K2SO4溶液的方法是 。分离提纯明胶的水溶液和K2SO4溶液的混合物方法是 。
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。现有10 mL明胶的水溶液与5 mL Na2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计一个实验证明SO42-能够透过半透膜: 。
17.分离提纯有机化合物常用的方法
(1)蒸馏和重结晶
适用对象 要求
蒸馏 常用于分离、提纯液态有机化合物 ①该有机化合物热稳定性较高 ②该有机化合物与杂质的 相差较大
重结晶 常用于分离、提纯固体有机化合物 ①杂质在所选溶剂中的 很小或很大 ②被提纯的有机化合物在此溶剂中的 受温度的影响
(2)萃取和分液
①常用的萃取剂: 、 、 、石油醚、二氯甲烷等。
②液-液萃取:利用待分离组分在两种 的溶剂中的 不同,将其从一种溶剂转移到另一种溶剂的过程。
18.在下面的横线上填上适当的内容。
(1)6.02×1023个Na+的物质的量为 ,其质量为 。
(2)NO2的摩尔质量为 ,标准状况下,1molSO2气体的体积为 。
(3)标准状况下,1molCO2的体积 ,含有CO2分子个数 。
(4)配制500mL1mol/LNa2CO3溶液,Na2CO3的物质的量为 ,需要Na2CO3的质量为 。
19.KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如图所示。
请回答下列问题:
(1)为尽量少引入杂质,试剂①应选用 (填序号)。
A.HCl溶液 B.H2SO4溶液 C.氨水 D.NaOH溶液
(2)易拉罐溶解过程中主要反应的离子方程式为 。
(3)沉淀B的化学式为 。
(4)由沉淀B生成KAl(SO4)2的化学方程式为 。
(5)向30mL1 mol·L 1的KAl(SO4)2溶液中逐渐加入浓度为4mol·L 1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为 。
20.实验室需要配制0.5mol/LNaCl溶液,现使用固体配制,按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸。
(2)计算。配制该溶液需取晶体 。
(3)称量。天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置(5g以下用游码): 。
(4)将药品倒入烧杯中溶解、冷却后,转移、洗涤。在转移时应使用 引流,需要洗涤烧杯和玻璃棒次。然后定容、摇匀,最后将将配好的溶液倒入指定的试剂瓶,并贴好标签,注明溶液名称及浓度。
(5)配制时下列操作会导致所配溶液浓度偏高的是 。
A.转移时有少量溶液溅出
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线
E.称量时用了生锈的砝码
(6)下图是某同学在实验室配制该溶液的过程示意图,其中有错误的是 (填操作序号)。
参考答案:
1.B2.A3.A4.B5.A6.A7.C8.A9.D10.D11.D12.D13.D14.D15.B
16. +2 盐 丁达尔效应 渗析 取烧杯中的液体,加入少量的氯化钡溶液,出现白色沉淀,再加入稀硝酸,白色的沉淀不溶解,证明硫酸根离子透过了半透膜
17.(1) 沸点 溶解度 溶解度 较大
(2) 苯 乙醚 互不相溶 溶解度
18.(1) 1mol 23g
(2) 46g/mol 22.4L
(3) 22.4L 6.02×1023
(4) 0.5mol 53g
19. D 2Al + 2OH-+2H2O=2AlO+3H2↑ Al(OH)3 Al(OH)3 + 3H2SO4 + K2SO4 = 2KAl(SO4)2+ 6 H2O 7.5mL 和 27.5mL
20.(1) 250mL容量瓶 胶头滴管
(2)7.3
(3)
(4)玻璃棒
(5)CE
(6)①③⑤
1.用有机溶剂提取菠菜中的色素所形成的色素石油醚溶液,要用干燥剂进行干燥以后再用纸色谱法进行色素分离。下列物质中可用作干燥剂的是( )
A.芒硝 B.无水硫酸钠
C.蓝矾 D.明矾
2.X22﹣离子共有2n个电子,元素X的原子核内的质子数为
A.n﹣1 B.n+1 C.n D.2n
3.已知碘元素的核电荷数为53,下列关于131I的说法正确的是( )
A.131I的核外有53个电子 B.131I的质量数为78
C.131I的核内有53个中子 D.131I的核内有131个质子
4.下列实验能达到预期目的的是
序号 实验操作 实验目的
A 将乙烯和乙烷的混合气体通过酸性高锰酸钾溶液 除去乙烷中混有的少量的乙烯
B 往苯与苯酚混合物中加入氢氧化钠溶液,分液 除去苯中混有的少量的苯酚
C 往碘水中加入酒精,分液 提取碘水中的碘
D 取少量淀粉水解(水解时用硫酸作催化剂)后的溶液,加入新制的Cu(OH)2悬浊液,加热 检验淀粉的水解产物
A.A B.B C.C D.D
5.设NA为阿伏加 德罗常数的值。下列叙述正确的是( )
A.1.8 g NH中含有的电子数为NA
B.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
C.标准状况下,2.24 L CCl4含有的氯原子数为0.4NA
D.1 L 0.1 mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
6.正确的实验操作是实验成功的重要因素,下列实验操作正确的是
A.称取一定量的NaCl
B.制备氢氧化亚铁并观察其颜色
C.检验浓硫酸与铜反应后的产物中是否含有铜离子
D.收集NO2并防止其污染环境
7.下列仪器或标签使用正确的是
A.装溶液的玻璃瓶 B.收集NO C.浓硫酸的标识 D.制备盐酸
A.A B.B C.C D.D
8.实验室用KMnO4固体配制500mL0.1000mol·L-1KMnO4标准溶液所涉及的操作中不需要用到的仪器为
A. B.
C. D.
9.实验室中可由叔丁醇与浓盐酸反应制备2-甲基-2-氯丙烷:
下列说法错误的是
A.该反应为取代反应
B.两次水洗的目的是相同的
C.无水CaCl2的作用是除去少量水
D.①操作的名称为过滤
10.用质量分数为0.35、密度为0.88 g/cm3的氨水配制9.0 mol/L的氨水100 mL,需要的定量仪器有①100 mL容量瓶 ②10 mL量筒 ③50 mL量筒 ④电子天平 ⑤烧杯 ⑥胶头滴管
A.①③④⑤⑥ B.①②④⑤⑥ C.①④⑤⑥ D.①③
11.下列说法正确的是( )
A.氧化钙、氧化镁、氧化铝都属于碱性氧化物
B.生铁、水银和黄铜都属于合金
C.萃取操作时,选择的萃取剂与水不互溶,且萃取剂的密度必须比水大
D.用长滴管往硫酸亚铁溶液中滴入氢氧化钠溶液,会观察到先产生白色沉淀,逐渐变为灰绿色,最后呈现红褐色
12.进行化学实验时应强化安全意识。下列做法正确的是
A.金属钠着火时使用泡沫灭火器灭火
B.用试管加热碳酸氢钠固体时使试管口竖直向上
C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
13.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
混合物 试剂 分离方法
A 苯(苯酚) 溴水 过滤
B 甲烷(乙烯) 酸性高锰酸钾溶液 洗气
C 乙酸乙酯(乙酸) 氢氧化钠溶液 蒸馏
D 乙醇(水) 氧化钙 蒸馏
A.A B.B C.C D.D
14.粗食盐的杂质主要是MgCl2,为了除去杂质,工业上常把粗盐粉碎后用饱和食盐水浸洗,再过滤出食盐。对此,下面的评论正确的是
A.浸洗前后,被浸洗的食盐中MgCl2的含量基本不变
B.用来浸洗的饱和食盐水在浸洗前后没有变化
C.浸洗用过的饱和食盐水可以无限次地使用下去
D.粉碎颗粒的大小影响浸洗后盐中MgCl2的含量
15.除去下列物质中的少量杂质,所选用试剂及操作方法均正确的是
选项 物质(括号内为杂质) 选用试剂 操作方法
A CO2(CO) 足量的O2 点燃
B NaCl溶液(碘) CCl4 萃取、分液
C Fe(Cu) 加盐酸 过滤
D CO2(HCl) 氢氧化钠溶液 洗气
A.A B.B C.C D.D
16.“皮鞋很忙”的恶搞段子曾经风靡网络,揭露了某些行业用烂皮鞋制造酸奶或毒胶囊的不法行为。央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是 价。CrO2-是一种酸根离子,则Fe(CrO2)2属于 (填“酸”“碱”“盐”或“氧化物”)。
(2)区分明胶的水溶液和K2SO4溶液的方法是 。分离提纯明胶的水溶液和K2SO4溶液的混合物方法是 。
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。现有10 mL明胶的水溶液与5 mL Na2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计一个实验证明SO42-能够透过半透膜: 。
17.分离提纯有机化合物常用的方法
(1)蒸馏和重结晶
适用对象 要求
蒸馏 常用于分离、提纯液态有机化合物 ①该有机化合物热稳定性较高 ②该有机化合物与杂质的 相差较大
重结晶 常用于分离、提纯固体有机化合物 ①杂质在所选溶剂中的 很小或很大 ②被提纯的有机化合物在此溶剂中的 受温度的影响
(2)萃取和分液
①常用的萃取剂: 、 、 、石油醚、二氯甲烷等。
②液-液萃取:利用待分离组分在两种 的溶剂中的 不同,将其从一种溶剂转移到另一种溶剂的过程。
18.在下面的横线上填上适当的内容。
(1)6.02×1023个Na+的物质的量为 ,其质量为 。
(2)NO2的摩尔质量为 ,标准状况下,1molSO2气体的体积为 。
(3)标准状况下,1molCO2的体积 ,含有CO2分子个数 。
(4)配制500mL1mol/LNa2CO3溶液,Na2CO3的物质的量为 ,需要Na2CO3的质量为 。
19.KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如图所示。
请回答下列问题:
(1)为尽量少引入杂质,试剂①应选用 (填序号)。
A.HCl溶液 B.H2SO4溶液 C.氨水 D.NaOH溶液
(2)易拉罐溶解过程中主要反应的离子方程式为 。
(3)沉淀B的化学式为 。
(4)由沉淀B生成KAl(SO4)2的化学方程式为 。
(5)向30mL1 mol·L 1的KAl(SO4)2溶液中逐渐加入浓度为4mol·L 1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为 。
20.实验室需要配制0.5mol/LNaCl溶液,现使用固体配制,按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸。
(2)计算。配制该溶液需取晶体 。
(3)称量。天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置(5g以下用游码): 。
(4)将药品倒入烧杯中溶解、冷却后,转移、洗涤。在转移时应使用 引流,需要洗涤烧杯和玻璃棒次。然后定容、摇匀,最后将将配好的溶液倒入指定的试剂瓶,并贴好标签,注明溶液名称及浓度。
(5)配制时下列操作会导致所配溶液浓度偏高的是 。
A.转移时有少量溶液溅出
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线
E.称量时用了生锈的砝码
(6)下图是某同学在实验室配制该溶液的过程示意图,其中有错误的是 (填操作序号)。
参考答案:
1.B2.A3.A4.B5.A6.A7.C8.A9.D10.D11.D12.D13.D14.D15.B
16. +2 盐 丁达尔效应 渗析 取烧杯中的液体,加入少量的氯化钡溶液,出现白色沉淀,再加入稀硝酸,白色的沉淀不溶解,证明硫酸根离子透过了半透膜
17.(1) 沸点 溶解度 溶解度 较大
(2) 苯 乙醚 互不相溶 溶解度
18.(1) 1mol 23g
(2) 46g/mol 22.4L
(3) 22.4L 6.02×1023
(4) 0.5mol 53g
19. D 2Al + 2OH-+2H2O=2AlO+3H2↑ Al(OH)3 Al(OH)3 + 3H2SO4 + K2SO4 = 2KAl(SO4)2+ 6 H2O 7.5mL 和 27.5mL
20.(1) 250mL容量瓶 胶头滴管
(2)7.3
(3)
(4)玻璃棒
(5)CE
(6)①③⑤
