3.1.物质的聚集状态与晶体的常识 随堂检测题(含解析) 2023-2024学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.1.物质的聚集状态与晶体的常识 随堂检测题(含解析) 2023-2024学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-30 22:56:09 | ||
图片预览




文档简介
3.1.物质的聚集状态与晶体的常识随堂检测题2023-2024学年下学期高二化学人教版(2019)选择性必修2
一、单选题
1.下列各组基态原子的电子排布式对应的元素中,能构成共价晶体的是
A.1s1和1s22s22p3 B.1s22s22p4和1s22s22p63s23p3
C.1s22s22p4和1s22s22p3 D.1s22s22p2和1s22s22p63s23p2
2.科学研究表明,物质含有许多种聚集状态,下列关于物质聚集状态的描述错误的是
A.等离子体的外观为气态
B.液晶和液态是物质的两种聚集状态
C.等离子体的基本构成粒子只有阴、阳离子
D.离子液体是熔点不高的仅由离子组成的液体物质
3.下列途径不能得到晶体的是
A.FeCl3蒸气冷凝 B.熔融态SiO2热液缓慢冷却
C.熔融态SiO2快速冷却 D.CuSO4饱和溶液蒸发浓缩后冷却
4.下列叙述不属于晶体特点的是
A.有规则的几何外形 B.具有各向异性
C.有自范性 D.没有固定熔点
5.已知晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。于晶体的说法中,正确的是
A.晶体是分子晶体
B.晶体中,C-N键的键长比金刚石中的C-C键的键长要长
C.晶体中,C-N键的键长比金刚石中的C-C键的键长要短
D.晶体中微粒间通过离子键结合
6.化学在生活中有着重要的应用。下列叙述不正确的是
A.肥皂中含有的表面活性剂在水中会形成亲水基团向外、疏水基团向内的胶束而达到去污效果
B.电视和电脑的液晶显示器使用的液晶材料属于晶体,能体现晶体的各向异性
C.干冰升华可吸收大量热,可作制冷剂
D.2022年春节部分地方燃放的“烟花”应用了某些金属原子的电子跃迁
7.《本草纲目拾遗》记载:“石髓出泉州安溪长潭石罅间,接骨如神。”石髓的主要成分为碳酸钙,下列说法正确的是
A.的空间结构为三角锥形
B.可以对石髓进行X射线衍射来确定其是否为晶体
C.碳酸钙含有非极性共价键
D.中所有原子均不含有孤电子对
8.2021年5月15日,我国火星探测器“天问一号”成功着陆火星。天问一号探测器上使用了重量轻、强度高、刚性好、宽温度范围下尺寸稳定的新型SiC增强铝基复合材料。下列说法错误的是
A.SiC是一种新型硅酸盐材料
B.SiC俗称金刚砂,具有类似金刚石的结构
C.SiC中的碳原子和硅原子通过共价键连接
D.SiC具有优异的高温抗氧化性能
9.铜是生活中比较常见的一种金属,而纳米铜能在空气中自燃,这是因为纳米铜的表面粒子数占总粒子数的比例较大。假设某纳米颗粒的大小和形状如图所示,则这种纳米颗粒的表面粒子数与总粒子数之比是
A.7:11 B.1:2 C.7:8 D.26:27
10.我国用BeO、KBF4等原料制备KBe2BO3F2晶体,在世界上首次实现在177.3nm深紫外激光倍频输出,其晶胞如图所示,下列说法不正确的是
A.构成晶体的非金属元素的电负性由大到小的顺序为F>O>B
B.根据元素周期表中元素所处的位置可推测BeO与Al2O3性质相似
C.阴离子BF的中心原子没有满足8电子稳定结构
D.晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则1mol该晶胞含3molKBe2BO3F2
11.青蒿素(C15H22O5)是治疗疟疾的有效药物,可溶于乙醇和乙醚,其晶胞(长方体,棱长分别为,每个晶胞中含4个青蒿素分子)及分子结构如下图所示。下列说法不正确的是
A.用乙醚提取植物中的青蒿素利用了萃取原理
B.青蒿素分子中碳原子采取和杂化
C.青蒿素晶胞中分子的取向不同
D.青蒿素晶体的密度为
12.以炼铁厂锌灰(主要成分为ZnO,并含少量的CuO、、等)为原料制备氧化锌的主要工艺流程如下:
下列说法不正确的是
A.浸取过程中ZnO转变为的离子方程式为:
B.过滤1所得滤液中大量存在的离子有:、、
C.蒸氨所得用水吸收后可循环至浸取工序循环使用
D.一种ZnO的晶胞结构如图所示,该晶胞中数为2
13.磷锡青铜合金广泛用于仪器仪表中的耐磨零件和抗磁元件等。其晶胞结构如图所示,已知晶胞参数为。下列说法不正确的是
A.磷锡青铜的化学式为
B.该晶胞中与原子等距离且最近的原子有12个
C.三种元素、、在元素周期表中分别处于区、区、区
D.和原子间的最短距离为
14.FeS2具有良好的半导体性能,如图给出了立方FeS2晶胞中的Fe2+和位于晶胞体心的(晶胞中的其他已省略)。下列叙述正确的是
A.Fe2+的最高能层的电子排布式为3d6
B.基态Fe2+共有24种不同空间运动状态的电子
C.FeS2晶胞中距离每个最近的S有8个
D.晶胞中Fe2+位于所形成的正八面体的体心
15.下列关于晶体性质的描述中,正确的是
A.晶体具有物理性质各向同性的特点
B.形成晶体的形态与结晶过程的速率无关
C.用X射线衍射实验可以区分晶体和非晶体
D.具有规则几何外形的固体均为晶体
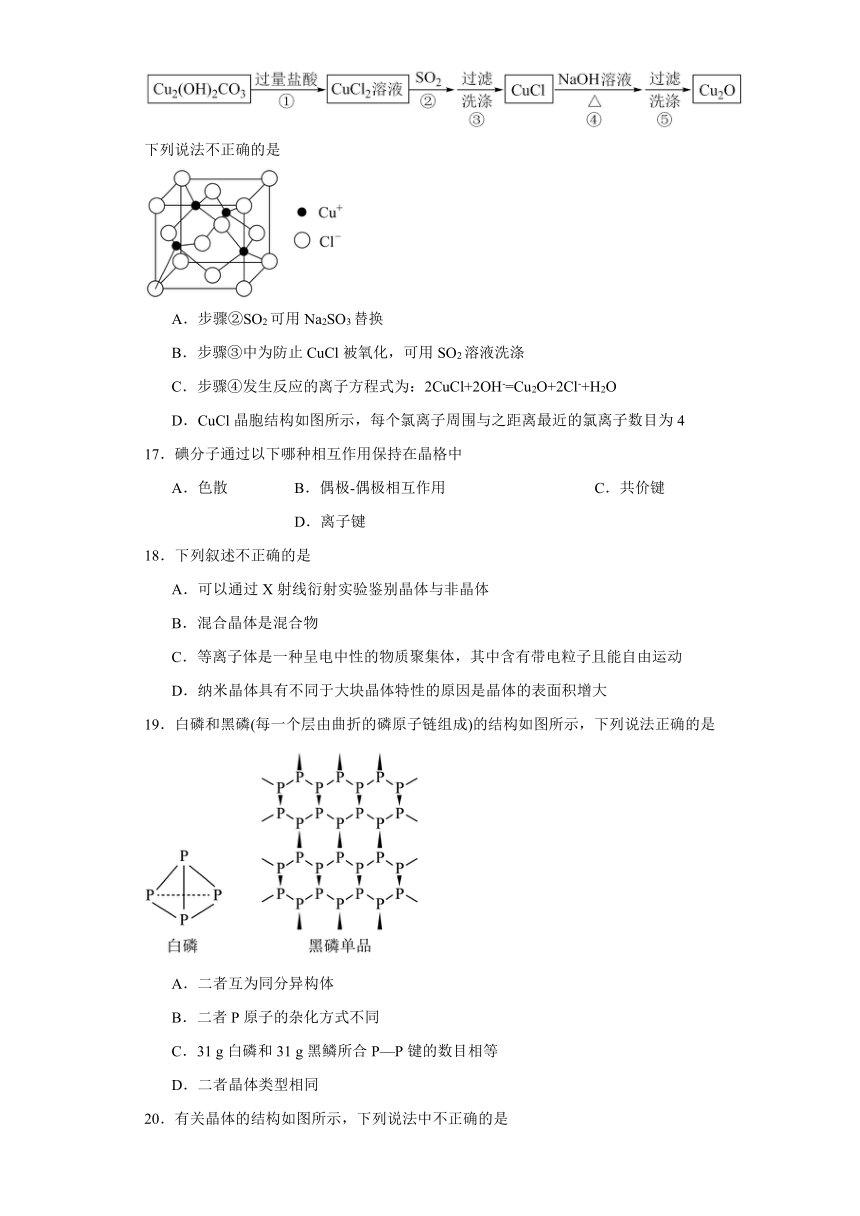
16.Cu及其化合物Cu2O、CuCl等广泛应用于各种工业部门,已知CuCl难溶于水和稀硫酸,Cu2O在酸性条件下发生反应为:Cu2O+2H+=Cu2++Cu+H2O。某研究小组通过如下流程制备氧化亚铜:
下列说法不正确的是
A.步骤②SO2可用Na2SO3替换
B.步骤③中为防止CuCl被氧化,可用SO2溶液洗涤
C.步骤④发生反应的离子方程式为:2CuCl+2OH-=Cu2O+2Cl-+H2O
D.CuCl晶胞结构如图所示,每个氯离子周围与之距离最近的氯离子数目为4
17.碘分子通过以下哪种相互作用保持在晶格中
A.色散 B.偶极-偶极相互作用 C.共价键 D.离子键
18.下列叙述不正确的是
A.可以通过X射线衍射实验鉴别晶体与非晶体
B.混合晶体是混合物
C.等离子体是一种呈电中性的物质聚集体,其中含有带电粒子且能自由运动
D.纳米晶体具有不同于大块晶体特性的原因是晶体的表面积增大
19.白磷和黑磷(每一个层由曲折的磷原子链组成)的结构如图所示,下列说法正确的是
A.二者互为同分异构体
B.二者P原子的杂化方式不同
C.31 g白磷和31 g黑鳞所合P—P键的数目相等
D.二者晶体类型相同
20.有关晶体的结构如图所示,下列说法中不正确的是
A.在金刚石晶体中,碳原子与碳碳键个数的比为1:2
B.该气态团簇分子的分子式为E4F4或F4E4
C.在NaCl晶体中,距Na+最近的Cl-形成正四面体形
D.在CaF2晶体中,每个晶胞平均占有4个Ca
21.超氧化钾被称为“化学氧自救剂”,可用于煤矿井下急救。如图为超氧化钾晶体的一个晶胞。下列有关说法正确的是
A.超氧化钾晶体中只存在离子键
B.超氧化钾的化学式为
C.晶体中的配位数是8
D.位于构成的八面体空隙中
22.金刚石晶胞如图,属于一个金刚石晶胞的碳原子数为
A.18 B.16 C.10 D.8
23.由含硒废料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)制取硒的流程如下:
下列有关说法正确的是
A.“分离”的方法是蒸馏
B.“滤液”中主要存在的阴离子有:SO、SiO
C.“酸化”时发生的离子反应方程式为SeSO+H2O=Se↓+SO2↑+2OH-
D.SiO2晶胞如图所示,1个SiO2晶胞中有16个O原子
24.利用超分子可分离C60和C70。将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法错误的是
A.第二电离能: B.杯酚分子中存在π键
C.杯酚与C60形成氢键 D. C60与金刚石晶体类型不同
25.La和Ni的合金是目前使用最广泛的储氢材料。某La-Ni合金(晶胞为平行六面体)由图甲、图乙两个原子层交替紧密堆积而成,丙是该合金的晶体结构。
下列说法错误的是
A.该晶体可表示为
B.该晶体中1个La原子与6个Ni原子配位
C.该晶体的一个晶胞中Ni原子数为15
D.通过晶体X射线衍射实验可得出晶胞
二、填空题
26.请用四种特殊聚集状态的物质填空:
(1) 中正、负电荷大致相等,总体看来呈准电中性,但此物质具有很好的导电性。
(2) 既具有液体的流动性,又具有晶体的各向异性。
(3) 无固定的熔沸点。
(4) 具有良好的物理、化学特性,完全不同于微米或毫米量级的材料。
27.晶体分为 、 、 、 。区分晶体和非晶体最可靠的科学方法是 。
28.碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为 个。已知石墨的密度为ρg·cm-3,C-C键键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距d为 cm。
试卷第1页,共3页
参考答案:
1.D
【详解】A.两者分别为H、N,能形成分子晶体N2H4、NH3,A错误;
B.两者分别为O、P,能形成分子晶体P2O5,B错误;
C.两者分别为O、N,能形成分子晶体NO、NO2等,C错误;
D.两者分别为C、Si,能形成共价晶体CSi晶体,D正确;
故选D。
2.C
【详解】A.等离子体是由电子、阳离子和电中性粒子(分子或原子)组成的整体上呈电中性的气态物质,故A正确,
B.液晶是介于液态和晶态之间的物质状态,所以液晶和液态是不同的聚集状态,故B正确;
C.等离子体由电子、阳离子和电中性的微粒构成,故C错误;
D.离子液体是一种只由离子组成的液体,其熔点较低,以液态稳定存在,故D正确;
答案选C。
3.C
【分析】得到晶体一般有三条途径:①熔融态物质凝固;②气态物质冷却不经液态直接凝固(凝华);③溶质从溶液中析出。
【详解】A.FeCl3蒸气冷凝得到氯化铁晶体,A不符合题意;
B.熔融态SiO2热液缓慢冷却可以得到SiO2晶体,B不符合题意
C.熔融态物质急速冷却得到玻璃态物质,不属于晶体,C符合题意;
D.硫酸不挥发,所以CuSO4饱和溶液蒸发浓缩后冷却可以得到硫酸晶体,D不符合题意;
综上所述答案为C。
4.D
【详解】晶体具有规则的几何外形、各向异性、自范性等特点且晶体有固定的熔点.,
故选:D。
5.C
【详解】A.根据“C3N4晶体很可能具有比金刚石更大的硬度”可知C3N4晶体与金刚石结构类似,原子间通过共价键形成共价晶体,故A错误;
B.氮原子的半径比碳原子的半径小,所以C-N键的键长比C-C键的键长短,故B错误;
C.氮原子的半径比碳原子的半径小,所以C-N键的键长比C-C键的键长短,故C正确;
D.C3N4晶体中,原子间通过共价键相结合,故D错误;
故选C。
6.B
【详解】A.表面活性剂在水中会形成亲水基团向外、疏水基团向内的胶束,由于油污等污垢是疏水的,全被包裹在胶束内,从而达到去污效果,故A正确;
B.液晶分子的空间排列是不稳定的,属于非晶体,但具有各向异性,故B错误;
C.干冰升华(由固态直接变为气态)时吸收大量热量,因此可以做制冷剂,故C项正确;
D.金属原子受热从基态跃迁到激发态后,电子从高能级轨道跃迁回到低能级轨道时,将能量以光能的形式释放出来,而呈现各种颜色,故D正确;
综上所述,不正确的是B项。
7.B
【详解】A.价层电子对数为3+,则空间构型为平面三角形,A项错误;
B.X射线衍射可以确定晶体,B项正确;
C.CaCO3中存在C与O的极性共价键,C项错误;
D.中C无孤电子对,但O有孤电子对,D项错误;
故选B。
8.A
【详解】A.SiC属于新型陶瓷,不属于硅酸盐材料,故A错误;
B.碳化硅俗称金刚砂,具有类似金刚石的结构,熔沸点高,硬度大,可用于制造耐高温、抗氧化的新型陶瓷,B正确;
C.SiC属于共价化合物,碳原子和硅原子通过共价键连接,C正确;
D.SiC属于原子晶体,故SiC陶瓷具有耐高温、抗腐蚀等优异性能,D正确;
故选A。
9.A
【详解】由该纳米颗粒的大小和形状结构图可知,表面粒子数为8个(顶点)6个(面心)14,而粒子总数为,所以表面粒子数与总粒子数之比为,A正确。
答案选A。
10.C
【详解】A.根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,则构成晶体的非金属元素的电负性由大到小的顺序为F>O>B,故A正确;
B.根据元素周期表中元素所处的位置,Be和Al处于对角线规则,则可推测BeO与Al2O3性质相似,故B正确;
C.阴离子BF的中心原子价层电子对数为,则中心原子满足8电子稳定结构,故C错误;
D.晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则每个晶胞中K+个数为,根据化学式得到1mol该晶胞含3molKBe2BO3F2,故D正确。
综上所述,答案为C。
11.D
【详解】A.用乙醚提取植物中的青蒿素利用了萃取原理,将其从水溶液中提取出来,A正确;
B.青蒿素分子中碳氧双键中的碳原子采取,饱和碳原子采用杂化,B正确;
C.由图可知,以图示晶胞为例,青蒿素晶胞中上面第1、2个分子的取向不同,C正确;
D.晶胞棱长分别为,每个晶胞中含4个青蒿素分子,则密度为,D错误;
故选D。
12.B
【分析】锌灰加入过量氨水、碳酸氢铵浸取后得到、,过滤滤液加入锌还原得到铜单质,过滤滤液蒸氨得到碱式碳酸锌,加热得到氧化锌;
【详解】A.浸取过程中反应物ZnO、、,生成物,离子方程式为:,A正确;
B.与相似,在浸取过程中转变成,所以过滤1所得滤液中不可能有大量的,B错误;
C.溶于水得氨水,可用于“浸取”工序,C正确;
D.根据均摊法,该晶胞中数为,D正确。
答案选B。
13.D
【详解】A.由均摊法可知,晶胞中Cu原子数目= 6×12=3 、 Sn原子数目= 8×18=1 、P原子数目为1,故化学式为 Cu3SnP ,选项A正确;
B.Sn位于晶胞的顶点,Cu位于面心,故晶胞中与Sn原子等距离且最近的Cu原子有12个,选项B正确;
C.三种元素Cu、Sn、P在元素周期表中分别处于ds区、p区、p区,选项C正确;
D.P原子位于体心而Sn位于顶点,Sn和P原子间的最短距离为体对角线长的一半,故距离为 a pm,选项D错误;
答案选D。
14.D
【分析】FeS2晶胞中的Fe2+的个数为:,根据化学式可知晶胞中含有4个,结合晶胞图可知,若每个棱上有1个,立方体心有个,则晶胞中有的个数为,符合化学式FeS2
【详解】A.Fe2+的最高能层的电子排布式为3s23p63d6,A错误;
B.基态Fe2+共有14种不同空间运动状态的电子,B错误;
C.FeS2晶胞中,12个棱上的距离体心相等,则距离每个最近的有12个,C错误;
D.晶胞中周围最近Fe2+在立方体的面心上,有6个,根据配位数与原子个数成反比,则每个Fe2+最近有6个,则Fe2+位于所形成的正八面体的体心,D正确;
故选D。
15.C
【详解】A.由于晶体内部质点排列的有序性,所以晶体的某些物理性质具有各向异性的特点,A错误;
B.晶体的形成都有一定的形成条件,如温度、结晶速率等,B错误;
C.X射线衍射实验能够测出物质的内部结构,根据微粒是否有规则的排列可区分晶体与非晶体,C正确;
D.具有规则几何外形的固体不一定是晶体,如切割成有规则几何外形的玻璃不是晶体,D错误;
故选C。
16.D
【分析】Cu2(OH)2CO3和盐酸反应生成CuCl2、H2O、CO2,CuCl2溶液通入SO2发生氧化还原反应得到CuCl沉淀,过滤、洗涤得CuCl,CuCl加NaOH溶液、加热得到Cu2O,过滤、洗涤得Cu2O。
【详解】A.步骤②SO2的作用是将CuCl2还原为CuCl,Na2SO3中S的价态与二氧化硫中相同,也能将CuCl2还原为CuCl,故步骤②SO2可用Na2SO3替换,A正确;
B.由流程可知CuCl不和二氧化硫反应且二氧化硫具有还原性,步骤③中为防止CuCl被氧化,可用SO2溶液洗涤,B正确;
C.步骤④中CuCl加NaOH溶液、加热得到Cu2O,结合原子守恒、电荷守恒可知反应的离子方程式为2CuCl+2OH-=Cu2O+2Cl-+H2O,C正确;
D.以顶点的氯离子为例,CuCl晶胞中每个氯离子周围与之距离最近的氯离子为面心的氯离子,数目为3××8=12,D错误;
答案选D。
17.C
【解析】略
18.B
【详解】A.构成晶体的粒子在微观空间里呈现周期性的有序排列,晶体的这一结构特征可以通过X-射线衍射图谱反映出来,因此,可以通过X射线衍射实验鉴别晶体与非晶体,故A正确;
B.石墨是混合晶体,石墨属于纯净物,故B错误;
C.等离子体是一种呈电中性的物质聚集体,其中含有带电粒子且能自由运动,使等离子体具有导电性,故C正确;
D.纳米晶体的特殊性质原因之一是它具有很大的比表面积,故D正确;
选B。
19.C
【详解】A.白磷和黑磷是磷元素形成的两种单质,互为同素异形体,A错误;
B.白磷和黑磷的P原子都为杂化,B错误;
C.由图可知,白磷和黑鳞中,每个P原子形成3个P—P键,每个P—P键由2个P原子共用,每个P原子含有的P—P键为,所以31 g白磷和31 g黑鳞所含P—P键的数目都为,C正确;
D.白磷为分子晶体,黑鳞为共价晶体,D错误;
故选C。
20.C
【详解】A.金刚石中每个C原子形成4个共价键,每个共价键被两个碳原子共用,所以每个碳原子具有2个共价键,即碳原子与碳碳键个数的比为1:2,选项A正确;
B.气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,选项B正确;
C.在NaCl晶体中,距Na+最近的Cl-有6个,距Cl-最近的Na+有6个,这6个离子构成一个正八面体,选项C不正确;
D.Ca2+位于晶胞的顶点和面心,根据均摊法,个数为=4,选项D正确;
答案选C。
21.D
【详解】A.超氧化钾晶体中两个氧原子之间存在共价键,A项错误;
B.由晶胞结构可知,位于体心和棱上,位于顶角和面心,则晶胞中含有的个数为,含有的个数为,故晶胞中和的个数比为,超氧化钾的化学式为,B项错误;
C.距离最近的的个数为,C项错误;
D.由晶胞结构可知,位于构成的八面体空隙中,D项正确;
故选:D。
22.D
【详解】从晶胞上看8个顶点各有1个C原子,属于该晶胞的部分相当于只有1个,6个面上相当于有3个,晶胞内部还有4个,故属于该晶胞的碳原子数为8个,答案选D。
23.D
【详解】A.含硒废料中除硫单质外其他物质均不溶于煤油,所以分离的方法应为过滤,A错误;
B.除硫后稀硫酸进行酸溶Fe2O3、CuO、ZnO均与硫酸反应生成相应的盐,Se和SiO2不与硫酸反应,所以滤液中主要存在的阴离子为SO,B错误;
C.酸性溶液中不会生成氢氧根,正确离子方程式应为SeSO+2H+=Se↓+SO2↑+H2O,C错误;
D.据图可知,图中16个O原子全部位于晶胞内部,所以1个SiO2晶胞中有16个O原子,D正确;
综上所述答案为D。
24.C
【详解】A.C和O分别失去一个电子后的价电子排布式为2s22p1和2s22p3,O的2p能级是半充满结构,比较稳定,所以O的第二电离能大于C的第二电离能,A项正确;
B.杯酚分子中含有苯环结构,具有大π键,B项正确;
C.氢键是H与(N、O、F)等电负性大的元素形成的分子间或分子内相互作用力,而C60中只含有C元素,无法形成氢键,C项错误;
D.金刚石是原子晶体,C60为分子晶体,二者晶体类型不同,D项正确;
答案选C。
25.B
【详解】A.该晶体的一个晶胞中在两个底面上各有7个La是在,其中6个在线的角上,1个La面心,根据均摊法计算可得一个晶胞中La原子数为;该晶体的一个晶胞中在两个底面上各有6个Ni,侧面有6个Ni,体心内有6个Ni,根据均摊法计算可得一个晶胞中Ni原子数为;故该晶体中La与Ni的个数比是3:15=1:5,可表示为LaNi5,故A正确;
B.对于1个La来说,同一层周围有6个Ni,还有上下两层各6个,所以,La原子与18个Ni原子配位,故B错误;
C.该晶体的一个晶胞中在两个底面上各有6个Ni,侧面有6个Ni,体心内有6个Ni,根据均摊法计算可得一个晶胞中Ni原子数为,故C正确;
D.X射线衍射可用于确定晶体的结构,故D正确;
故答案选B。
26. 等离子体 液晶 非晶体 纳米材料
【详解】(1)等离子体由离子、电子以及未电离的中性粒子的集合组成,其正、负电荷大致相等,总体看来呈准电中性,但此物质具有很好的导电性;
(2)某些物质在熔融状态或被溶剂溶解之后,尽管失去固态物质的刚性,却获得了液体的易流动性,并保留着部分晶态物质分子的各向异性有序排列,形成一种兼有晶体和液体的部分性质的中间态, 这种由固态向液态转化过程中存在的取向有序流体称为液晶;
(3)非晶体是指组成物质的分子(或原子、离子)不呈空间有规则周期性排列的固体。它没有一定规则的外形,如玻璃、松香、石蜡、塑料等。它的物理性质在各个方向上是相同的,叫"各向同性",它没有固定的熔点;
(4) 纳米级结构材料简称为纳米材料,是指其结构单元的尺寸介于1纳米~100纳米范围之间,具有良好的物理、化学特性,完全不同于微米或毫米量级的材料。
27. 离子晶体 原子晶体 分子晶体 金属晶体 加热熔化
【详解】晶体按其结构粒子和作用力的不同可分为四类,分别是离子晶体、原子晶体、分子晶体、金属晶体。根据晶体有固定熔点,非晶体没有熔点,熔化过程中温度是否变化,区分晶体和非晶体的方法是加热熔化。故答案为:离子晶体、原子晶体、分子晶体、金属晶体;加热熔化。
28. 4
【详解】根据均摊法,石墨晶胞中碳原子分别位于顶点(8个)、棱心(4个)、面心(2个)、内部(1个),所以个数为8×+4×+2×+1=4;晶胞的底面图为 ,则有=r×sin60°,可得a=r,则底面菱形的高为=r,所以底面积为r×r,晶胞的高为2d,所以晶胞的体积为V=r×r×2d=3r2dcm3,晶胞的密度====g cm-3,解得d=cm
一、单选题
1.下列各组基态原子的电子排布式对应的元素中,能构成共价晶体的是
A.1s1和1s22s22p3 B.1s22s22p4和1s22s22p63s23p3
C.1s22s22p4和1s22s22p3 D.1s22s22p2和1s22s22p63s23p2
2.科学研究表明,物质含有许多种聚集状态,下列关于物质聚集状态的描述错误的是
A.等离子体的外观为气态
B.液晶和液态是物质的两种聚集状态
C.等离子体的基本构成粒子只有阴、阳离子
D.离子液体是熔点不高的仅由离子组成的液体物质
3.下列途径不能得到晶体的是
A.FeCl3蒸气冷凝 B.熔融态SiO2热液缓慢冷却
C.熔融态SiO2快速冷却 D.CuSO4饱和溶液蒸发浓缩后冷却
4.下列叙述不属于晶体特点的是
A.有规则的几何外形 B.具有各向异性
C.有自范性 D.没有固定熔点
5.已知晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。于晶体的说法中,正确的是
A.晶体是分子晶体
B.晶体中,C-N键的键长比金刚石中的C-C键的键长要长
C.晶体中,C-N键的键长比金刚石中的C-C键的键长要短
D.晶体中微粒间通过离子键结合
6.化学在生活中有着重要的应用。下列叙述不正确的是
A.肥皂中含有的表面活性剂在水中会形成亲水基团向外、疏水基团向内的胶束而达到去污效果
B.电视和电脑的液晶显示器使用的液晶材料属于晶体,能体现晶体的各向异性
C.干冰升华可吸收大量热,可作制冷剂
D.2022年春节部分地方燃放的“烟花”应用了某些金属原子的电子跃迁
7.《本草纲目拾遗》记载:“石髓出泉州安溪长潭石罅间,接骨如神。”石髓的主要成分为碳酸钙,下列说法正确的是
A.的空间结构为三角锥形
B.可以对石髓进行X射线衍射来确定其是否为晶体
C.碳酸钙含有非极性共价键
D.中所有原子均不含有孤电子对
8.2021年5月15日,我国火星探测器“天问一号”成功着陆火星。天问一号探测器上使用了重量轻、强度高、刚性好、宽温度范围下尺寸稳定的新型SiC增强铝基复合材料。下列说法错误的是
A.SiC是一种新型硅酸盐材料
B.SiC俗称金刚砂,具有类似金刚石的结构
C.SiC中的碳原子和硅原子通过共价键连接
D.SiC具有优异的高温抗氧化性能
9.铜是生活中比较常见的一种金属,而纳米铜能在空气中自燃,这是因为纳米铜的表面粒子数占总粒子数的比例较大。假设某纳米颗粒的大小和形状如图所示,则这种纳米颗粒的表面粒子数与总粒子数之比是
A.7:11 B.1:2 C.7:8 D.26:27
10.我国用BeO、KBF4等原料制备KBe2BO3F2晶体,在世界上首次实现在177.3nm深紫外激光倍频输出,其晶胞如图所示,下列说法不正确的是
A.构成晶体的非金属元素的电负性由大到小的顺序为F>O>B
B.根据元素周期表中元素所处的位置可推测BeO与Al2O3性质相似
C.阴离子BF的中心原子没有满足8电子稳定结构
D.晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则1mol该晶胞含3molKBe2BO3F2
11.青蒿素(C15H22O5)是治疗疟疾的有效药物,可溶于乙醇和乙醚,其晶胞(长方体,棱长分别为,每个晶胞中含4个青蒿素分子)及分子结构如下图所示。下列说法不正确的是
A.用乙醚提取植物中的青蒿素利用了萃取原理
B.青蒿素分子中碳原子采取和杂化
C.青蒿素晶胞中分子的取向不同
D.青蒿素晶体的密度为
12.以炼铁厂锌灰(主要成分为ZnO,并含少量的CuO、、等)为原料制备氧化锌的主要工艺流程如下:
下列说法不正确的是
A.浸取过程中ZnO转变为的离子方程式为:
B.过滤1所得滤液中大量存在的离子有:、、
C.蒸氨所得用水吸收后可循环至浸取工序循环使用
D.一种ZnO的晶胞结构如图所示,该晶胞中数为2
13.磷锡青铜合金广泛用于仪器仪表中的耐磨零件和抗磁元件等。其晶胞结构如图所示,已知晶胞参数为。下列说法不正确的是
A.磷锡青铜的化学式为
B.该晶胞中与原子等距离且最近的原子有12个
C.三种元素、、在元素周期表中分别处于区、区、区
D.和原子间的最短距离为
14.FeS2具有良好的半导体性能,如图给出了立方FeS2晶胞中的Fe2+和位于晶胞体心的(晶胞中的其他已省略)。下列叙述正确的是
A.Fe2+的最高能层的电子排布式为3d6
B.基态Fe2+共有24种不同空间运动状态的电子
C.FeS2晶胞中距离每个最近的S有8个
D.晶胞中Fe2+位于所形成的正八面体的体心
15.下列关于晶体性质的描述中,正确的是
A.晶体具有物理性质各向同性的特点
B.形成晶体的形态与结晶过程的速率无关
C.用X射线衍射实验可以区分晶体和非晶体
D.具有规则几何外形的固体均为晶体
16.Cu及其化合物Cu2O、CuCl等广泛应用于各种工业部门,已知CuCl难溶于水和稀硫酸,Cu2O在酸性条件下发生反应为:Cu2O+2H+=Cu2++Cu+H2O。某研究小组通过如下流程制备氧化亚铜:
下列说法不正确的是
A.步骤②SO2可用Na2SO3替换
B.步骤③中为防止CuCl被氧化,可用SO2溶液洗涤
C.步骤④发生反应的离子方程式为:2CuCl+2OH-=Cu2O+2Cl-+H2O
D.CuCl晶胞结构如图所示,每个氯离子周围与之距离最近的氯离子数目为4
17.碘分子通过以下哪种相互作用保持在晶格中
A.色散 B.偶极-偶极相互作用 C.共价键 D.离子键
18.下列叙述不正确的是
A.可以通过X射线衍射实验鉴别晶体与非晶体
B.混合晶体是混合物
C.等离子体是一种呈电中性的物质聚集体,其中含有带电粒子且能自由运动
D.纳米晶体具有不同于大块晶体特性的原因是晶体的表面积增大
19.白磷和黑磷(每一个层由曲折的磷原子链组成)的结构如图所示,下列说法正确的是
A.二者互为同分异构体
B.二者P原子的杂化方式不同
C.31 g白磷和31 g黑鳞所合P—P键的数目相等
D.二者晶体类型相同
20.有关晶体的结构如图所示,下列说法中不正确的是
A.在金刚石晶体中,碳原子与碳碳键个数的比为1:2
B.该气态团簇分子的分子式为E4F4或F4E4
C.在NaCl晶体中,距Na+最近的Cl-形成正四面体形
D.在CaF2晶体中,每个晶胞平均占有4个Ca
21.超氧化钾被称为“化学氧自救剂”,可用于煤矿井下急救。如图为超氧化钾晶体的一个晶胞。下列有关说法正确的是
A.超氧化钾晶体中只存在离子键
B.超氧化钾的化学式为
C.晶体中的配位数是8
D.位于构成的八面体空隙中
22.金刚石晶胞如图,属于一个金刚石晶胞的碳原子数为
A.18 B.16 C.10 D.8
23.由含硒废料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)制取硒的流程如下:
下列有关说法正确的是
A.“分离”的方法是蒸馏
B.“滤液”中主要存在的阴离子有:SO、SiO
C.“酸化”时发生的离子反应方程式为SeSO+H2O=Se↓+SO2↑+2OH-
D.SiO2晶胞如图所示,1个SiO2晶胞中有16个O原子
24.利用超分子可分离C60和C70。将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法错误的是
A.第二电离能: B.杯酚分子中存在π键
C.杯酚与C60形成氢键 D. C60与金刚石晶体类型不同
25.La和Ni的合金是目前使用最广泛的储氢材料。某La-Ni合金(晶胞为平行六面体)由图甲、图乙两个原子层交替紧密堆积而成,丙是该合金的晶体结构。
下列说法错误的是
A.该晶体可表示为
B.该晶体中1个La原子与6个Ni原子配位
C.该晶体的一个晶胞中Ni原子数为15
D.通过晶体X射线衍射实验可得出晶胞
二、填空题
26.请用四种特殊聚集状态的物质填空:
(1) 中正、负电荷大致相等,总体看来呈准电中性,但此物质具有很好的导电性。
(2) 既具有液体的流动性,又具有晶体的各向异性。
(3) 无固定的熔沸点。
(4) 具有良好的物理、化学特性,完全不同于微米或毫米量级的材料。
27.晶体分为 、 、 、 。区分晶体和非晶体最可靠的科学方法是 。
28.碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为 个。已知石墨的密度为ρg·cm-3,C-C键键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距d为 cm。
试卷第1页,共3页
参考答案:
1.D
【详解】A.两者分别为H、N,能形成分子晶体N2H4、NH3,A错误;
B.两者分别为O、P,能形成分子晶体P2O5,B错误;
C.两者分别为O、N,能形成分子晶体NO、NO2等,C错误;
D.两者分别为C、Si,能形成共价晶体CSi晶体,D正确;
故选D。
2.C
【详解】A.等离子体是由电子、阳离子和电中性粒子(分子或原子)组成的整体上呈电中性的气态物质,故A正确,
B.液晶是介于液态和晶态之间的物质状态,所以液晶和液态是不同的聚集状态,故B正确;
C.等离子体由电子、阳离子和电中性的微粒构成,故C错误;
D.离子液体是一种只由离子组成的液体,其熔点较低,以液态稳定存在,故D正确;
答案选C。
3.C
【分析】得到晶体一般有三条途径:①熔融态物质凝固;②气态物质冷却不经液态直接凝固(凝华);③溶质从溶液中析出。
【详解】A.FeCl3蒸气冷凝得到氯化铁晶体,A不符合题意;
B.熔融态SiO2热液缓慢冷却可以得到SiO2晶体,B不符合题意
C.熔融态物质急速冷却得到玻璃态物质,不属于晶体,C符合题意;
D.硫酸不挥发,所以CuSO4饱和溶液蒸发浓缩后冷却可以得到硫酸晶体,D不符合题意;
综上所述答案为C。
4.D
【详解】晶体具有规则的几何外形、各向异性、自范性等特点且晶体有固定的熔点.,
故选:D。
5.C
【详解】A.根据“C3N4晶体很可能具有比金刚石更大的硬度”可知C3N4晶体与金刚石结构类似,原子间通过共价键形成共价晶体,故A错误;
B.氮原子的半径比碳原子的半径小,所以C-N键的键长比C-C键的键长短,故B错误;
C.氮原子的半径比碳原子的半径小,所以C-N键的键长比C-C键的键长短,故C正确;
D.C3N4晶体中,原子间通过共价键相结合,故D错误;
故选C。
6.B
【详解】A.表面活性剂在水中会形成亲水基团向外、疏水基团向内的胶束,由于油污等污垢是疏水的,全被包裹在胶束内,从而达到去污效果,故A正确;
B.液晶分子的空间排列是不稳定的,属于非晶体,但具有各向异性,故B错误;
C.干冰升华(由固态直接变为气态)时吸收大量热量,因此可以做制冷剂,故C项正确;
D.金属原子受热从基态跃迁到激发态后,电子从高能级轨道跃迁回到低能级轨道时,将能量以光能的形式释放出来,而呈现各种颜色,故D正确;
综上所述,不正确的是B项。
7.B
【详解】A.价层电子对数为3+,则空间构型为平面三角形,A项错误;
B.X射线衍射可以确定晶体,B项正确;
C.CaCO3中存在C与O的极性共价键,C项错误;
D.中C无孤电子对,但O有孤电子对,D项错误;
故选B。
8.A
【详解】A.SiC属于新型陶瓷,不属于硅酸盐材料,故A错误;
B.碳化硅俗称金刚砂,具有类似金刚石的结构,熔沸点高,硬度大,可用于制造耐高温、抗氧化的新型陶瓷,B正确;
C.SiC属于共价化合物,碳原子和硅原子通过共价键连接,C正确;
D.SiC属于原子晶体,故SiC陶瓷具有耐高温、抗腐蚀等优异性能,D正确;
故选A。
9.A
【详解】由该纳米颗粒的大小和形状结构图可知,表面粒子数为8个(顶点)6个(面心)14,而粒子总数为,所以表面粒子数与总粒子数之比为,A正确。
答案选A。
10.C
【详解】A.根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,则构成晶体的非金属元素的电负性由大到小的顺序为F>O>B,故A正确;
B.根据元素周期表中元素所处的位置,Be和Al处于对角线规则,则可推测BeO与Al2O3性质相似,故B正确;
C.阴离子BF的中心原子价层电子对数为,则中心原子满足8电子稳定结构,故C错误;
D.晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则每个晶胞中K+个数为,根据化学式得到1mol该晶胞含3molKBe2BO3F2,故D正确。
综上所述,答案为C。
11.D
【详解】A.用乙醚提取植物中的青蒿素利用了萃取原理,将其从水溶液中提取出来,A正确;
B.青蒿素分子中碳氧双键中的碳原子采取,饱和碳原子采用杂化,B正确;
C.由图可知,以图示晶胞为例,青蒿素晶胞中上面第1、2个分子的取向不同,C正确;
D.晶胞棱长分别为,每个晶胞中含4个青蒿素分子,则密度为,D错误;
故选D。
12.B
【分析】锌灰加入过量氨水、碳酸氢铵浸取后得到、,过滤滤液加入锌还原得到铜单质,过滤滤液蒸氨得到碱式碳酸锌,加热得到氧化锌;
【详解】A.浸取过程中反应物ZnO、、,生成物,离子方程式为:,A正确;
B.与相似,在浸取过程中转变成,所以过滤1所得滤液中不可能有大量的,B错误;
C.溶于水得氨水,可用于“浸取”工序,C正确;
D.根据均摊法,该晶胞中数为,D正确。
答案选B。
13.D
【详解】A.由均摊法可知,晶胞中Cu原子数目= 6×12=3 、 Sn原子数目= 8×18=1 、P原子数目为1,故化学式为 Cu3SnP ,选项A正确;
B.Sn位于晶胞的顶点,Cu位于面心,故晶胞中与Sn原子等距离且最近的Cu原子有12个,选项B正确;
C.三种元素Cu、Sn、P在元素周期表中分别处于ds区、p区、p区,选项C正确;
D.P原子位于体心而Sn位于顶点,Sn和P原子间的最短距离为体对角线长的一半,故距离为 a pm,选项D错误;
答案选D。
14.D
【分析】FeS2晶胞中的Fe2+的个数为:,根据化学式可知晶胞中含有4个,结合晶胞图可知,若每个棱上有1个,立方体心有个,则晶胞中有的个数为,符合化学式FeS2
【详解】A.Fe2+的最高能层的电子排布式为3s23p63d6,A错误;
B.基态Fe2+共有14种不同空间运动状态的电子,B错误;
C.FeS2晶胞中,12个棱上的距离体心相等,则距离每个最近的有12个,C错误;
D.晶胞中周围最近Fe2+在立方体的面心上,有6个,根据配位数与原子个数成反比,则每个Fe2+最近有6个,则Fe2+位于所形成的正八面体的体心,D正确;
故选D。
15.C
【详解】A.由于晶体内部质点排列的有序性,所以晶体的某些物理性质具有各向异性的特点,A错误;
B.晶体的形成都有一定的形成条件,如温度、结晶速率等,B错误;
C.X射线衍射实验能够测出物质的内部结构,根据微粒是否有规则的排列可区分晶体与非晶体,C正确;
D.具有规则几何外形的固体不一定是晶体,如切割成有规则几何外形的玻璃不是晶体,D错误;
故选C。
16.D
【分析】Cu2(OH)2CO3和盐酸反应生成CuCl2、H2O、CO2,CuCl2溶液通入SO2发生氧化还原反应得到CuCl沉淀,过滤、洗涤得CuCl,CuCl加NaOH溶液、加热得到Cu2O,过滤、洗涤得Cu2O。
【详解】A.步骤②SO2的作用是将CuCl2还原为CuCl,Na2SO3中S的价态与二氧化硫中相同,也能将CuCl2还原为CuCl,故步骤②SO2可用Na2SO3替换,A正确;
B.由流程可知CuCl不和二氧化硫反应且二氧化硫具有还原性,步骤③中为防止CuCl被氧化,可用SO2溶液洗涤,B正确;
C.步骤④中CuCl加NaOH溶液、加热得到Cu2O,结合原子守恒、电荷守恒可知反应的离子方程式为2CuCl+2OH-=Cu2O+2Cl-+H2O,C正确;
D.以顶点的氯离子为例,CuCl晶胞中每个氯离子周围与之距离最近的氯离子为面心的氯离子,数目为3××8=12,D错误;
答案选D。
17.C
【解析】略
18.B
【详解】A.构成晶体的粒子在微观空间里呈现周期性的有序排列,晶体的这一结构特征可以通过X-射线衍射图谱反映出来,因此,可以通过X射线衍射实验鉴别晶体与非晶体,故A正确;
B.石墨是混合晶体,石墨属于纯净物,故B错误;
C.等离子体是一种呈电中性的物质聚集体,其中含有带电粒子且能自由运动,使等离子体具有导电性,故C正确;
D.纳米晶体的特殊性质原因之一是它具有很大的比表面积,故D正确;
选B。
19.C
【详解】A.白磷和黑磷是磷元素形成的两种单质,互为同素异形体,A错误;
B.白磷和黑磷的P原子都为杂化,B错误;
C.由图可知,白磷和黑鳞中,每个P原子形成3个P—P键,每个P—P键由2个P原子共用,每个P原子含有的P—P键为,所以31 g白磷和31 g黑鳞所含P—P键的数目都为,C正确;
D.白磷为分子晶体,黑鳞为共价晶体,D错误;
故选C。
20.C
【详解】A.金刚石中每个C原子形成4个共价键,每个共价键被两个碳原子共用,所以每个碳原子具有2个共价键,即碳原子与碳碳键个数的比为1:2,选项A正确;
B.气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,选项B正确;
C.在NaCl晶体中,距Na+最近的Cl-有6个,距Cl-最近的Na+有6个,这6个离子构成一个正八面体,选项C不正确;
D.Ca2+位于晶胞的顶点和面心,根据均摊法,个数为=4,选项D正确;
答案选C。
21.D
【详解】A.超氧化钾晶体中两个氧原子之间存在共价键,A项错误;
B.由晶胞结构可知,位于体心和棱上,位于顶角和面心,则晶胞中含有的个数为,含有的个数为,故晶胞中和的个数比为,超氧化钾的化学式为,B项错误;
C.距离最近的的个数为,C项错误;
D.由晶胞结构可知,位于构成的八面体空隙中,D项正确;
故选:D。
22.D
【详解】从晶胞上看8个顶点各有1个C原子,属于该晶胞的部分相当于只有1个,6个面上相当于有3个,晶胞内部还有4个,故属于该晶胞的碳原子数为8个,答案选D。
23.D
【详解】A.含硒废料中除硫单质外其他物质均不溶于煤油,所以分离的方法应为过滤,A错误;
B.除硫后稀硫酸进行酸溶Fe2O3、CuO、ZnO均与硫酸反应生成相应的盐,Se和SiO2不与硫酸反应,所以滤液中主要存在的阴离子为SO,B错误;
C.酸性溶液中不会生成氢氧根,正确离子方程式应为SeSO+2H+=Se↓+SO2↑+H2O,C错误;
D.据图可知,图中16个O原子全部位于晶胞内部,所以1个SiO2晶胞中有16个O原子,D正确;
综上所述答案为D。
24.C
【详解】A.C和O分别失去一个电子后的价电子排布式为2s22p1和2s22p3,O的2p能级是半充满结构,比较稳定,所以O的第二电离能大于C的第二电离能,A项正确;
B.杯酚分子中含有苯环结构,具有大π键,B项正确;
C.氢键是H与(N、O、F)等电负性大的元素形成的分子间或分子内相互作用力,而C60中只含有C元素,无法形成氢键,C项错误;
D.金刚石是原子晶体,C60为分子晶体,二者晶体类型不同,D项正确;
答案选C。
25.B
【详解】A.该晶体的一个晶胞中在两个底面上各有7个La是在,其中6个在线的角上,1个La面心,根据均摊法计算可得一个晶胞中La原子数为;该晶体的一个晶胞中在两个底面上各有6个Ni,侧面有6个Ni,体心内有6个Ni,根据均摊法计算可得一个晶胞中Ni原子数为;故该晶体中La与Ni的个数比是3:15=1:5,可表示为LaNi5,故A正确;
B.对于1个La来说,同一层周围有6个Ni,还有上下两层各6个,所以,La原子与18个Ni原子配位,故B错误;
C.该晶体的一个晶胞中在两个底面上各有6个Ni,侧面有6个Ni,体心内有6个Ni,根据均摊法计算可得一个晶胞中Ni原子数为,故C正确;
D.X射线衍射可用于确定晶体的结构,故D正确;
故答案选B。
26. 等离子体 液晶 非晶体 纳米材料
【详解】(1)等离子体由离子、电子以及未电离的中性粒子的集合组成,其正、负电荷大致相等,总体看来呈准电中性,但此物质具有很好的导电性;
(2)某些物质在熔融状态或被溶剂溶解之后,尽管失去固态物质的刚性,却获得了液体的易流动性,并保留着部分晶态物质分子的各向异性有序排列,形成一种兼有晶体和液体的部分性质的中间态, 这种由固态向液态转化过程中存在的取向有序流体称为液晶;
(3)非晶体是指组成物质的分子(或原子、离子)不呈空间有规则周期性排列的固体。它没有一定规则的外形,如玻璃、松香、石蜡、塑料等。它的物理性质在各个方向上是相同的,叫"各向同性",它没有固定的熔点;
(4) 纳米级结构材料简称为纳米材料,是指其结构单元的尺寸介于1纳米~100纳米范围之间,具有良好的物理、化学特性,完全不同于微米或毫米量级的材料。
27. 离子晶体 原子晶体 分子晶体 金属晶体 加热熔化
【详解】晶体按其结构粒子和作用力的不同可分为四类,分别是离子晶体、原子晶体、分子晶体、金属晶体。根据晶体有固定熔点,非晶体没有熔点,熔化过程中温度是否变化,区分晶体和非晶体的方法是加热熔化。故答案为:离子晶体、原子晶体、分子晶体、金属晶体;加热熔化。
28. 4
【详解】根据均摊法,石墨晶胞中碳原子分别位于顶点(8个)、棱心(4个)、面心(2个)、内部(1个),所以个数为8×+4×+2×+1=4;晶胞的底面图为 ,则有=r×sin60°,可得a=r,则底面菱形的高为=r,所以底面积为r×r,晶胞的高为2d,所以晶胞的体积为V=r×r×2d=3r2dcm3,晶胞的密度====g cm-3,解得d=cm
