2.1 化学反应速率 习题课课件(共19张PPT)
文档属性
| 名称 | 2.1 化学反应速率 习题课课件(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 362.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 08:50:55 | ||
图片预览




文档简介
(共19张PPT)
化学反应速率(习题课)
高中化学
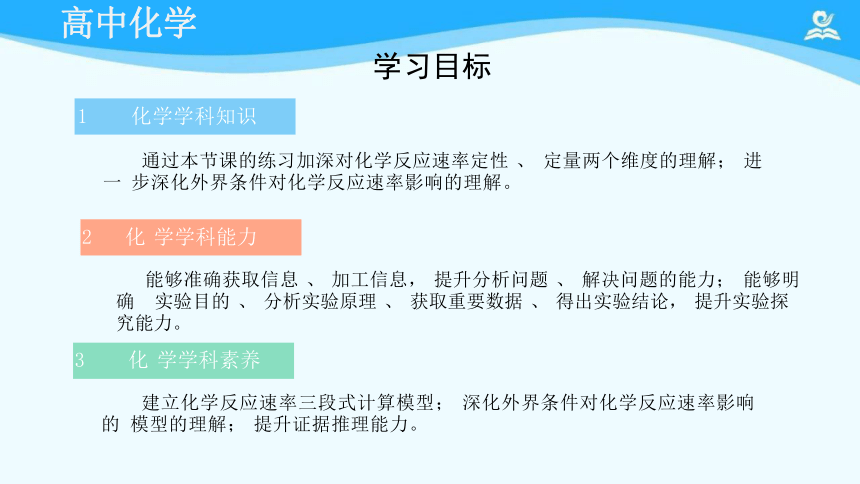
学习目标
能够准确获取信息 、 加工信息, 提升分析问题 、 解决问题的能力; 能够明确 实验目的 、 分析实验原理 、 获取重要数据 、 得出实验结论, 提升实验探究能力。
建立化学反应速率三段式计算模型; 深化外界条件对化学反应速率影响的 模型的理解; 提升证据推理能力。
通过本节课的练习加深对化学反应速率定性 、 定量两个维度的理解; 进 一 步深化外界条件对化学反应速率影响的理解。
3 化 学学科素养
2 化 学学科能力
1 化学学科知识
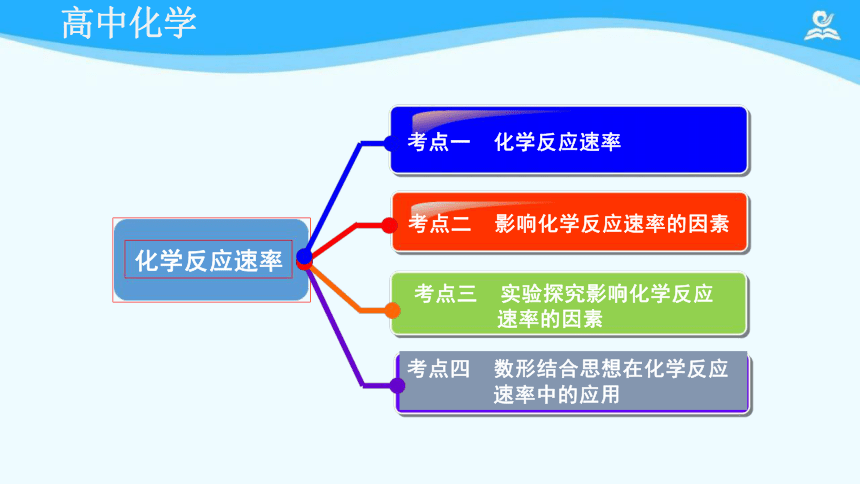
考点一 化学反应速率
考点三 实验探究影响化学反应 速率的因素
考点四 数形结合思想在化学反应
速率中的应用
考点二 影响化学反应速率的因素
化学反应速率
高中化学
高中化学
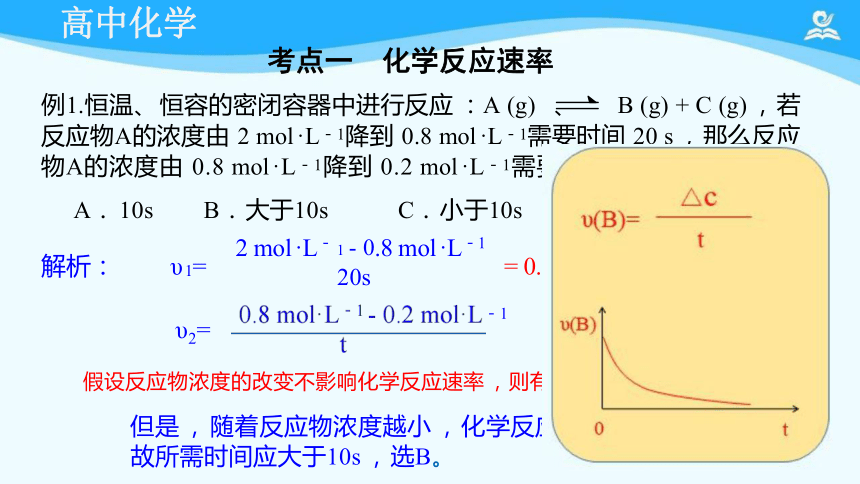
考点一 化学反应速率
例1.恒温、 恒容的密闭容器中进行反应 :A (g) 、 B (g) + C (g) , 若
反应物A的浓度由 2 mol ·L-1降到 0.8 mol ·L-1需要时间 20 s , 那么反应 物A的浓度由 0.8 mol ·L-1降到 0.2 mol ·L-1需要时间为( )
A. 10s B. 大于10s C. 小于10s D. 无法确定
解析: υ 1= 2 mol ·L- .8 mol ·L-1 = 0.06 mol ·L-1 · s-1
υ2= -1
假设反应物浓度的改变不影响化学反应速率 ,则有:υ 1=υ2, t = 10s,
但是 , 随着反应物浓度越小 , 化学反应速率应逐渐变慢,
故所需时间应大于10s , 选B。
20s
1 - 0
高中化学
例2.将4 mol A气体和2 mol B气体在 2 L的容器中混合 , 并在一定
条件下发生如下反应: 2A(g)+B(g) 、 2C(g) , 若经2 s后测得C的浓度 为0.6 mol ·L-1 , 现有下列几种说法:
①用物质A表示的反应速率为0.3 mol ·L-1 · s-1
②2 s时物质A的转化率为70%
③2 s时物质B的浓度为0.7 mol ·L-1
④ 2 s时体系的压强为原来压强的2/3
其中正确的是( )
A . ①③ B . ①④ C . ②③ D . ③④
高中化学
例2.将4 mol A气体和2 mol B气体在 2 L的容器中混合 , 并在一定
条件下发生如下反应: 2A(g)+B(g) 2C(g) , 若经2 s后测得C的浓度
为0.6 mol ·L-1 , 现有下列几种说法:
①用物质A表示的反应速率为0.3 mol ·L-1 · s-1 ②2 s时物质A的转化率为70%
③2 s时物质B的浓度为0.7 mol ·L-1
④2 s时体系的压强为原来压强的2/3
2x
2
=30%
1.各数据的 单位应一致; 2.假设系数 为1的物质 变化量为x。
0
+ 2x
2x =0.6 mol ·L-1
速率之比等于方程式的计量系数值比!
起始:
变化: 2s:
x= 0.3mol ·L-1
2
-2 x
2-2 x
2A(g) + B(g)
1
-x
1 -x
2C(g)
高中化学
自主练习一
NH3和纯净的O2在一定条件下发生反应:
4NH3(g)+3O2(g) 、 2N2(g)+6H2O(g)
现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,
4 min后,测得生成的H2O占混合气体体积的40% ,则此段时间内
v(N2) = 。
高中化学
解析: 4NH3(g) +3O2(g) 2N2(g) + 6H2O(g)
起始量(mol 4 3 0 0
变化量(mol 4x 3x 2x 6x
4 min量(mol 4-4x 3-3x 2x 6x
6x
据题意,则有: =0.4
(4-4x )+(3-3x) +2x +6x
解得:x =0.5
v(N2) = 2×0.5÷2 = 0.125 mol ·L -1 ·min -1
4
高中化学
速率计算思维模型
对于较为复杂的关于反应速率的题目,采用以下步骤和模板计算
例如 : 反应 mA + nB 服3 pC 起始浓度(mol ·L- 1) a b c
转化浓度(mol ·L- 1) x
某时刻浓度(mol ·L- 1) a-x b-nx c+px
找出各物质的起始量、 变化量、 某时刻量
写出有关反应 的化学方程式
根据已知条件 列方程式计算
m m
高中化学
考点二 影响化学反应速率的因素
例3. 反应 C(s) + H2O(g) 、 CO(g) + H2(g) , 在一可变容积的密
闭容器中进行 , 下列条件的改变对其反应速率几乎没有影响的是
(AC )
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变 , 充入N2使体系压强增大
D.保持压强不变 , 充入N2使体系体积增大
高中化学
例4. 100 mL浓度为2 mol ·L-1的盐酸溶液跟过量的锌片反应 , 为减慢反
应速率 , 又不影响生成H2的总量 , 可采用的方法有(C )
A.加适量6 mol ·L-1HCl溶液
B.加数滴CuCl2溶液
C.加适量CH3COONa固体
D.加适量NaNO3溶液
H+ + CH3COO- = CH3COOH
① 起始a、 c两容器的反应速率大小关系为υa υc;
② 反应一段时间后a、 c中速率大小关系为υa υc ;
③ 如起始在a、 c两容器中通入同量的N2,
则此时三容器起始压强为Pa Pb Pc;
起始反应速率关系为υa υb υc。
塞 , a、b两容器为定容容器 , 起始向三容器中都加入相同量的SO2和 O2使三容器压强相等 ,一定条件下发生2SO2+O2 、 2SO3的反应。
自主练习二
相同体积的a、b、 c三密闭容器 , 其中c容器有一活
高中化学
如下图所示,
解析: ⑴起始时a、 c两容器物质浓度相等 , 故υ相等;
⑵ a、 c进行的是分子数减少 , 气体体积缩小的反应 , c容器体积将减小, 浓度大 , 故υ快;
⑶ a、b、 c中充入N2 , c体积增大 , 浓度减小 , 故υ减慢。
O2使三容器压强相等 , 一定条件下发生2SO2+O2
① 起始a、 c两容器的反应速率大小关系为υa = υc;
② 反应一段时间后a、 c中速率大小关系为υa < υc ;
自主练习二
相同体积的a、b、 c三密闭容器 , 其中c容器有一活
③ 如起始在a、 c两容器中通入同量的N2,
则此时三容器起始压强为Pa > Pb = Pc;
塞 , a、b两容器为定容容器 , 起始向三容器中都加入相同量的SO2和
高中化学
如下图所示,
起始反应速率关系为υa = υb > υc。
、 2SO3的反应。
高中化学
考点三 实验探究影响化学反应速率的因素
例5. 等质量的铁与过量的盐酸在不同的实验条件下进行反应 ,测得 在不同时间(t)内产生气体体积(V)的数据如图所示。 下列说法中一定 不正确的是 ( C )
组别 曲线 c(HCl)/mol·L-1 反应温度/℃
铁的状态
1 a 30
粉末状
2 b 2.5 30 粉末状
3 c 2.5 块状
4 d 2.5 30 块状
A.第4组实验的反应速率最慢
B.第1组实验中盐酸的浓度大于2.5 mol ·L-1
C.第2、 3组实验的目的是探究温度对反应速率的影响 D.第3组实验的反应温度高于30 ℃
A. 在0~50 min之间 ,pH=2和pH=7
时R的降解百分率相等
B. 溶液酸性越强 , R的降解速率越小
C. R的起始浓度越小 , 降解速率越大 D. 在20~25 min之间 , pH= 10时R的 平均降解速率为0.04 mol ·L-1 ·min-1
高中化学
例6. 一定条件下 , 溶液的酸碱性对TiO2光催化染料R降解反应 的影响如下图所示。 下列判断正确的是 ( )
高中化学
实验探究和控制变量法
影响化学反应速率的因素有多种 , 在探究相关规律时 , 需要控制其
他条件不变 , 只改变某一个条件 , 探究这一条件对反应速率的影响。
变量探究实验因为能够考查同学们对于图表的观察、 分析以及处理
实验数据归纳得出合理结论的能力 , 因而是考查的热点。
解答此类题时 , 要认真审题 , 清楚实验目的 , 弄清要探究的外界条
件有哪些。 然后分析题给图表 ,确定一个变化的量 , 弄清在其他几个量 不变的情况下 , 这个变化量对实验结果的影响 , 进而总结出规律。 然后 再确定另一个变量 , 重新进行相关分析。
(1)催化剂能加快化学反应速率的原因是 。
(2)实验①和②的目的是 。
实验时由于没有观察到明显现象而无法得出结论。
为了达到实验目的 , 你对原实验方案的改进是 。
(3)实验③、 ④、 ⑤中 ,测得生成氧气的体积随时间变化的关系如右图。
分析上图能够得出的实验结论是
编号 反应物
催化剂
① 10 mL 2% H2O2溶液
无
② 10 mL 5% H2O2溶液
无
③ 10 mL 5% H2O2溶液
1 mL 0.1 mol ·L-1 FeCl3溶液
④ 10 mL 5% H2O2溶液+少量HCl溶液
1 mL 0.1 mol ·L-1 FeCl3溶液
⑤ 10 mL 5% H2O2溶液+少量NaOH溶液
1 mL 0.1 mol ·L-1 FeCl3溶液
某实验小组以H2O2分解为例 , 研究浓度、 催化剂、 溶液酸碱性对反应速率的 影响。 在常温下按照如下方案完成实验。
高中化学
自主练习三
某实验小组以H2O2分解为例 , 研究浓度、 催化剂、 溶液酸碱性对反应速率的 影响。 在常温下按照如下方案完成实验。
(1)催化剂能加快化学反应速率的原因是 降低了活化能 。
(2)实验①和②的目的是 探究浓度对反应速率的影响 。
实验时由于没有观察到明显现象而无法得出结论。 资料显示 ,通常条件下
H2O2稳定 ,不易分解。 为了达到实验目的 , 你对原实验方案的改进是 。
向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)
(3)实验③、 ④、 ⑤中 ,测得生成氧气的体积随时间变化的关系如右图。 分析上图能够得出的实验结论是
碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。
高中化学
自主练习三
感谢同学们收看!
高中化学
化学反应速率(习题课)
高中化学
学习目标
能够准确获取信息 、 加工信息, 提升分析问题 、 解决问题的能力; 能够明确 实验目的 、 分析实验原理 、 获取重要数据 、 得出实验结论, 提升实验探究能力。
建立化学反应速率三段式计算模型; 深化外界条件对化学反应速率影响的 模型的理解; 提升证据推理能力。
通过本节课的练习加深对化学反应速率定性 、 定量两个维度的理解; 进 一 步深化外界条件对化学反应速率影响的理解。
3 化 学学科素养
2 化 学学科能力
1 化学学科知识
考点一 化学反应速率
考点三 实验探究影响化学反应 速率的因素
考点四 数形结合思想在化学反应
速率中的应用
考点二 影响化学反应速率的因素
化学反应速率
高中化学
高中化学
考点一 化学反应速率
例1.恒温、 恒容的密闭容器中进行反应 :A (g) 、 B (g) + C (g) , 若
反应物A的浓度由 2 mol ·L-1降到 0.8 mol ·L-1需要时间 20 s , 那么反应 物A的浓度由 0.8 mol ·L-1降到 0.2 mol ·L-1需要时间为( )
A. 10s B. 大于10s C. 小于10s D. 无法确定
解析: υ 1= 2 mol ·L- .8 mol ·L-1 = 0.06 mol ·L-1 · s-1
υ2= -1
假设反应物浓度的改变不影响化学反应速率 ,则有:υ 1=υ2, t = 10s,
但是 , 随着反应物浓度越小 , 化学反应速率应逐渐变慢,
故所需时间应大于10s , 选B。
20s
1 - 0
高中化学
例2.将4 mol A气体和2 mol B气体在 2 L的容器中混合 , 并在一定
条件下发生如下反应: 2A(g)+B(g) 、 2C(g) , 若经2 s后测得C的浓度 为0.6 mol ·L-1 , 现有下列几种说法:
①用物质A表示的反应速率为0.3 mol ·L-1 · s-1
②2 s时物质A的转化率为70%
③2 s时物质B的浓度为0.7 mol ·L-1
④ 2 s时体系的压强为原来压强的2/3
其中正确的是( )
A . ①③ B . ①④ C . ②③ D . ③④
高中化学
例2.将4 mol A气体和2 mol B气体在 2 L的容器中混合 , 并在一定
条件下发生如下反应: 2A(g)+B(g) 2C(g) , 若经2 s后测得C的浓度
为0.6 mol ·L-1 , 现有下列几种说法:
①用物质A表示的反应速率为0.3 mol ·L-1 · s-1 ②2 s时物质A的转化率为70%
③2 s时物质B的浓度为0.7 mol ·L-1
④2 s时体系的压强为原来压强的2/3
2x
2
=30%
1.各数据的 单位应一致; 2.假设系数 为1的物质 变化量为x。
0
+ 2x
2x =0.6 mol ·L-1
速率之比等于方程式的计量系数值比!
起始:
变化: 2s:
x= 0.3mol ·L-1
2
-2 x
2-2 x
2A(g) + B(g)
1
-x
1 -x
2C(g)
高中化学
自主练习一
NH3和纯净的O2在一定条件下发生反应:
4NH3(g)+3O2(g) 、 2N2(g)+6H2O(g)
现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,
4 min后,测得生成的H2O占混合气体体积的40% ,则此段时间内
v(N2) = 。
高中化学
解析: 4NH3(g) +3O2(g) 2N2(g) + 6H2O(g)
起始量(mol 4 3 0 0
变化量(mol 4x 3x 2x 6x
4 min量(mol 4-4x 3-3x 2x 6x
6x
据题意,则有: =0.4
(4-4x )+(3-3x) +2x +6x
解得:x =0.5
v(N2) = 2×0.5÷2 = 0.125 mol ·L -1 ·min -1
4
高中化学
速率计算思维模型
对于较为复杂的关于反应速率的题目,采用以下步骤和模板计算
例如 : 反应 mA + nB 服3 pC 起始浓度(mol ·L- 1) a b c
转化浓度(mol ·L- 1) x
某时刻浓度(mol ·L- 1) a-x b-nx c+px
找出各物质的起始量、 变化量、 某时刻量
写出有关反应 的化学方程式
根据已知条件 列方程式计算
m m
高中化学
考点二 影响化学反应速率的因素
例3. 反应 C(s) + H2O(g) 、 CO(g) + H2(g) , 在一可变容积的密
闭容器中进行 , 下列条件的改变对其反应速率几乎没有影响的是
(AC )
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变 , 充入N2使体系压强增大
D.保持压强不变 , 充入N2使体系体积增大
高中化学
例4. 100 mL浓度为2 mol ·L-1的盐酸溶液跟过量的锌片反应 , 为减慢反
应速率 , 又不影响生成H2的总量 , 可采用的方法有(C )
A.加适量6 mol ·L-1HCl溶液
B.加数滴CuCl2溶液
C.加适量CH3COONa固体
D.加适量NaNO3溶液
H+ + CH3COO- = CH3COOH
① 起始a、 c两容器的反应速率大小关系为υa υc;
② 反应一段时间后a、 c中速率大小关系为υa υc ;
③ 如起始在a、 c两容器中通入同量的N2,
则此时三容器起始压强为Pa Pb Pc;
起始反应速率关系为υa υb υc。
塞 , a、b两容器为定容容器 , 起始向三容器中都加入相同量的SO2和 O2使三容器压强相等 ,一定条件下发生2SO2+O2 、 2SO3的反应。
自主练习二
相同体积的a、b、 c三密闭容器 , 其中c容器有一活
高中化学
如下图所示,
解析: ⑴起始时a、 c两容器物质浓度相等 , 故υ相等;
⑵ a、 c进行的是分子数减少 , 气体体积缩小的反应 , c容器体积将减小, 浓度大 , 故υ快;
⑶ a、b、 c中充入N2 , c体积增大 , 浓度减小 , 故υ减慢。
O2使三容器压强相等 , 一定条件下发生2SO2+O2
① 起始a、 c两容器的反应速率大小关系为υa = υc;
② 反应一段时间后a、 c中速率大小关系为υa < υc ;
自主练习二
相同体积的a、b、 c三密闭容器 , 其中c容器有一活
③ 如起始在a、 c两容器中通入同量的N2,
则此时三容器起始压强为Pa > Pb = Pc;
塞 , a、b两容器为定容容器 , 起始向三容器中都加入相同量的SO2和
高中化学
如下图所示,
起始反应速率关系为υa = υb > υc。
、 2SO3的反应。
高中化学
考点三 实验探究影响化学反应速率的因素
例5. 等质量的铁与过量的盐酸在不同的实验条件下进行反应 ,测得 在不同时间(t)内产生气体体积(V)的数据如图所示。 下列说法中一定 不正确的是 ( C )
组别 曲线 c(HCl)/mol·L-1 反应温度/℃
铁的状态
1 a 30
粉末状
2 b 2.5 30 粉末状
3 c 2.5 块状
4 d 2.5 30 块状
A.第4组实验的反应速率最慢
B.第1组实验中盐酸的浓度大于2.5 mol ·L-1
C.第2、 3组实验的目的是探究温度对反应速率的影响 D.第3组实验的反应温度高于30 ℃
A. 在0~50 min之间 ,pH=2和pH=7
时R的降解百分率相等
B. 溶液酸性越强 , R的降解速率越小
C. R的起始浓度越小 , 降解速率越大 D. 在20~25 min之间 , pH= 10时R的 平均降解速率为0.04 mol ·L-1 ·min-1
高中化学
例6. 一定条件下 , 溶液的酸碱性对TiO2光催化染料R降解反应 的影响如下图所示。 下列判断正确的是 ( )
高中化学
实验探究和控制变量法
影响化学反应速率的因素有多种 , 在探究相关规律时 , 需要控制其
他条件不变 , 只改变某一个条件 , 探究这一条件对反应速率的影响。
变量探究实验因为能够考查同学们对于图表的观察、 分析以及处理
实验数据归纳得出合理结论的能力 , 因而是考查的热点。
解答此类题时 , 要认真审题 , 清楚实验目的 , 弄清要探究的外界条
件有哪些。 然后分析题给图表 ,确定一个变化的量 , 弄清在其他几个量 不变的情况下 , 这个变化量对实验结果的影响 , 进而总结出规律。 然后 再确定另一个变量 , 重新进行相关分析。
(1)催化剂能加快化学反应速率的原因是 。
(2)实验①和②的目的是 。
实验时由于没有观察到明显现象而无法得出结论。
为了达到实验目的 , 你对原实验方案的改进是 。
(3)实验③、 ④、 ⑤中 ,测得生成氧气的体积随时间变化的关系如右图。
分析上图能够得出的实验结论是
编号 反应物
催化剂
① 10 mL 2% H2O2溶液
无
② 10 mL 5% H2O2溶液
无
③ 10 mL 5% H2O2溶液
1 mL 0.1 mol ·L-1 FeCl3溶液
④ 10 mL 5% H2O2溶液+少量HCl溶液
1 mL 0.1 mol ·L-1 FeCl3溶液
⑤ 10 mL 5% H2O2溶液+少量NaOH溶液
1 mL 0.1 mol ·L-1 FeCl3溶液
某实验小组以H2O2分解为例 , 研究浓度、 催化剂、 溶液酸碱性对反应速率的 影响。 在常温下按照如下方案完成实验。
高中化学
自主练习三
某实验小组以H2O2分解为例 , 研究浓度、 催化剂、 溶液酸碱性对反应速率的 影响。 在常温下按照如下方案完成实验。
(1)催化剂能加快化学反应速率的原因是 降低了活化能 。
(2)实验①和②的目的是 探究浓度对反应速率的影响 。
实验时由于没有观察到明显现象而无法得出结论。 资料显示 ,通常条件下
H2O2稳定 ,不易分解。 为了达到实验目的 , 你对原实验方案的改进是 。
向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)
(3)实验③、 ④、 ⑤中 ,测得生成氧气的体积随时间变化的关系如右图。 分析上图能够得出的实验结论是
碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。
高中化学
自主练习三
感谢同学们收看!
高中化学
