2.2 各类平衡常数的应用 课件(共17张PPT)
文档属性
| 名称 | 2.2 各类平衡常数的应用 课件(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 145.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 08:51:45 | ||
图片预览






文档简介
(共17张PPT)
各类平衡常数的应用
高中化学
学 习 目 标
(1) 通过对化学平衡、电离平衡、水解平衡及难溶电解质的溶解平
衡等各种平衡常数的表达式及表达意义的分析,体会各类平衡常数的价 值和意义;
(2) 通过对典型事例的分析,体会各类平衡常数在实际问题分析过
程中的具体应用;发展“宏观辨识与微观探析 ”的化学学科核心素养, 善于提取问题的主要矛盾,提升系统的分析问题的能力。
C(s)+H2O(g) CO(g)+H2(g)
CH3COOH H+ + CH3COO-
CH3COO-+ H2O CH3COOH + OH-
AgCl(s) Ag+(aq) + Cl-(aq)
平衡常数是表征化学反应或转化过程限度的物理量,
且只与物质的性质和体系温度有关。
高中化学
平衡常数的种类
Kh= c(O O-)OH)
Ksp (AgCl) =c(Ag+) ·c(Cl-)
O
C
c(CH3CO
H-)·c(CH3
K= c( 2)
Ka= c( )
-
)
O
CH3COOH
)·c(CH3CO
c
H
)
H
2O
·c(
(H
O)
c
C
高中化学
平衡常数的意义和应用
(1)依据平衡常数的大小, 判断反应的发生, 及复杂体系中溶液的酸碱性;
(2)依据平衡常数的变化, 判断化学反应或转化过程的热效应;
(3)依据平衡常数, 判断化学反应或转化过程的所处状态, 及改变条件对 化学平衡的影响;
(4)依据平衡常数, 推算平衡状态时体系中各成分的浓度及关系等。
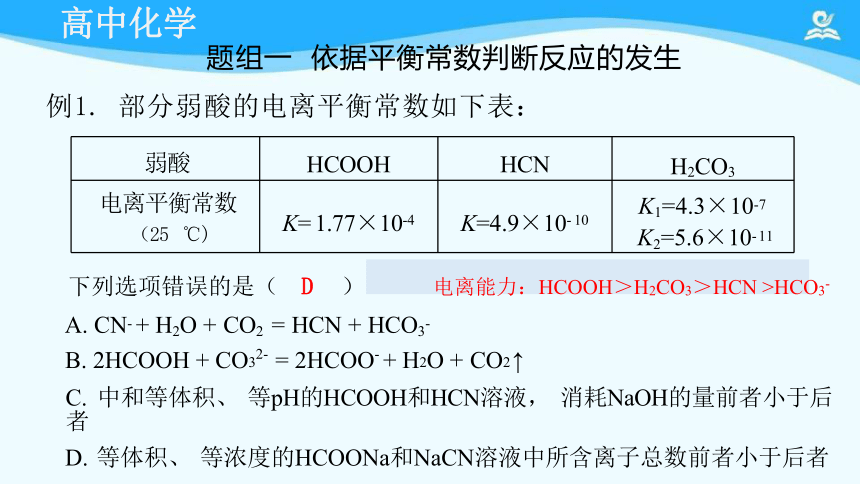
下列选项错误的是( D ) 电离能力:HCOOH>H2CO3>HCN >HCO3- A. CN- + H2O + CO2 = HCN + HCO3-
B. 2HCOOH + CO32- = 2HCOO- + H2O + CO2 ↑
C. 中和等体积、 等pH的HCOOH和HCN溶液, 消耗NaOH的量前者小于后者
D. 等体积、 等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
弱酸 HCOOH HCN
H2CO3
电离平衡常数 (25 ℃) K= 1.77×10-4 K=4.9×10- 10
K1=4.3×10-7 K2=5.6×10- 11
高中化学
题组一 依据平衡常数判断反应的发生
例1. 部分弱酸的电离平衡常数如下表:
高中化学
自 主 训 练
1. 室温时, 已知Ksp (AgCl)=1.80×10- 10, 现将2.2×10- 3 mol ·L-1 的 NaCl和2.0×10- 3 mol ·L-1 AgNO3 等体积混合, 试推算是否有沉淀生 成? 若有沉淀生成, 计算反应后溶液中c(Ag+)的值 。
Qc =c(Cl-) ·c(Ag+)=1.1×10-3 ×1.0×10-3 =1.1×10-6>Ksp(AgCl)
即, 有沉淀生成。
反应后剩余c(Cl-)=1.0×10-4 mol ·L-1
则反应后c(Ag+) = = mol ·L-1 =1.80×10-6 mol ·L-1
Ag+ + Cl- = AgCl ↓
反应消耗: 1.0×10-3 1.0×10-3
反应后剩余c(OH-)=0.1mol ·L-1
Ag+ + Cl- = AgCl ↓
H+ + OH- = H2O
0.1 mol 0.2 mol
反应后溶液中c(H+) = = mol ·L-1 =1. 0×10-13mol ·L-1
水的离子积在 酸碱中和反应 中的应用
溶液1 L 25 ℃
高中化学
pH=13
高中化学
题组二 依据平衡常数判断溶液的酸碱性
例2. 已知常温下,Ka(HCN)=6.2×10- 10, 则常温下, 含等物质的量浓
度的HCN与NaCN的混合溶液显 碱性 (填“ 酸”“碱” 或“ 中”)性, c(CN-) < (填“ > < 或“ =”)c(HCN)。
该溶液中各离子浓度由大到小的顺序为c(Na+)>c(CN- >c(OH-)>c(H+)
Kh (CN-)=K ( N) = - = 1.61×10-5
-
a
10
14
0
0
×1
×1
2
0
.
.
6
1
C
W
H
K
CN- 的水解能力>HCN的电离能力
c(HCN)>c(Na+)>c(CN-)
Kh(CN-) >Ka(HCN)
Ka (HCN)=6.2×10- 10
高中化学
自 主 训 练
2. 磷酸( H3PO4 ) 是三元弱酸, 常温下三级电离常数分别是
Ka1 =7.1×10-3, Ka2 =6.2×10-8, Ka3 =4.5×10-13, 解答下列问题:
(1)常温下同浓度①Na3PO4 、 ②Na2HPO4 、 ③NaH2PO4 的pH由小到大的 顺序是 ③ < ② < ① (填序号)。
(2)常温下 ,NaH2PO4 的水溶液呈 酸 (填“ 酸 ”“碱 ” 或“ 中 ”)性,
用Ka 与Kh 的相对大小, 说明判断理理由 。
Kh (H2PO4- )= c(O -P)O4 ) = = - = 1.41×10- 12 <6.2×10-8
4
-
3
1
0
0
×1
×1
1
0
.
.
7
1
a1
W
K
K
4
3
O
H
P
c(
2
·
H
-)
c(
H
电离能力: H3PO4 >H2PO4- > HPO42- 水解能力: PO43->HPO42- >H2PO4-
高中化学
题组三 利用平衡常数判断离子浓度比值的变化
例3. 已知0.1 mol ·L-1 的醋酸溶液中存在电离平衡:
CH3COOH 、 CH3COO- +H +, 要使溶液中 值增大,
可以采取的措施是( )
①加少量烧碱固体 ②升高温度 ③加 少量冰醋酸
④加水 ⑤加少量醋酸钠固体
A . ①② B . ②③⑤ C . ③④⑤ D . ②④
c(H+)
c(CH3COOH)
n(CH3COOH)
c(CH3COOH)
Ka(CH3COOH)
c(CH3COO-)
n(H+)
c(H+)
=
D
高中化学
自 主 训 练
3. 已知某温度下CH3COOH和NH3 H2O的电离常数相等, 现向10mL浓
度为0. 1 mol L 1 的CH3COOH溶液中滴加相同浓度的氨水 ,在滴加过程
中, 下来说法正确的是 ( D )
A. 水的电离程度始终增大
B. c(NH4+)/c(NH3 H2O)先增大再减小
C. c(CH3COOH)与c(CH3COO )之和始终保持不变
D. 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO )
CH3COOH H+ + CH3COO-
c(NH4+)
c(NH3 H2O)
= Kb(NH3 H2O)
溶质 :CH3COONH4
c(OH-)
化学反应 平衡常数 温度/℃ 500
800
①2H2(g)+CO(g) CH3OH(g) K1 2.5
0. 15
②H2(g)+CO2(g) H2O(g)+CO(g) K2 1.0
2.50
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) K3 2.5
0.375
K1= c 3 ) 示可K2= c ) K K3= c( ) ( O) _ _1_· _
2
H2
(H
c3
·c
2)
H
O
O
(C
H3
c
C
2)
O
(H
H2
c
(
O
O
C
C
(
(
c
c
(H
H)
c2
O
CO)
(CH
(
c
例4. 工业上可利用CO或CO2 来生产燃料甲醇 。 已知制备甲醇的 有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
题组四 平衡常数的综合应用
高中化学
ΔH<0
ΔH>0
化学反应 平衡常数 温度/℃ 500
800
①2H2(g)+CO(g) CH3OH(g) K1 2.5
0. 15
②H2(g)+CO2(g) H2O(g)+CO(g) K2 1.0
2.50
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) K3 2.5
0.375
例4. 工业上可利用CO或CO2 来生产燃料甲醇 。 已知制备甲醇的 有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(2)反应③的ΔH < (填“>” 或“ <”)0。
题组四 平衡常数的综合应用
高中化学
高中化学
化学反应 平衡常数 温度/℃ 500
800
①2H2(g)+CO(g) CH3OH(g) K1 2.5
0. 15
②H2(g)+CO2(g) H2O(g)+CO(g) K2 1.0
2.50
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) K3 2.5
0.375
(3)500 ℃时测得反应③在某时刻H2(g) 、CO2(g) 、CH3OH(g) 、H2O(g)
的浓度(mol ·L- 1)分别为0.8 、0. 1 、0.3 、0. 15, 则此时v正 > v逆
Q = = ≈0.88 < K
故反应正向正向进行
(填“ > = 或“ <”) 。
高中化学
反应②:H2(g)+CO2(g) H2O(g)+CO(g) 500 ℃时, K= 1.0
(4) 500℃时 ,在体积相同的三个密闭容器中, 按表中数据加入 一 定量的 反应物发生反应② 。 以下说法错误的是 ( )
容器 编号 起始时各物质的物质的量/mol CO2 H2 CO
H2O
ⅰ 1 1 0
0
ⅱ 0 0 1
1
ⅲ 0.6 0.6 0.4
0.4
A. 容器ⅰ中反应达平衡时, CO2 的转化率为50%
B. 平衡时, 容器ⅰ中CO2 的转化率与容器ⅱ中CO的转化率之和等于1 C. 平衡时, 三个容器中各种物质的浓度均分别相等
D. 平衡时再向容器ⅰ中加入1mol H2 , H2 和CO2 的转化率均提高
容器ⅲ 起始 0.6 0.6 0.4 0.4
依据平衡常数, 可以判断反应是否达到平衡状态,
可以推算平衡状态时体系中各成分的浓度 、 及反应物转化率,
可以验证等效平衡等问题。
起始
变化 平衡
起始
0 x x 0.5 1 0
x
x
0.5
1
1 x 1-x 0.5 0
1
x
1- x
0.5
0
K= 1.0
=1
x=0.5
设容器容积为1L
高中化学
H2O(g)+CO(g)
H2(g)+CO2(g)
容器ⅰ
容器ⅱ
谢谢同学们的收看!
祝同学们学业进步!
高中化学
各类平衡常数的应用
高中化学
学 习 目 标
(1) 通过对化学平衡、电离平衡、水解平衡及难溶电解质的溶解平
衡等各种平衡常数的表达式及表达意义的分析,体会各类平衡常数的价 值和意义;
(2) 通过对典型事例的分析,体会各类平衡常数在实际问题分析过
程中的具体应用;发展“宏观辨识与微观探析 ”的化学学科核心素养, 善于提取问题的主要矛盾,提升系统的分析问题的能力。
C(s)+H2O(g) CO(g)+H2(g)
CH3COOH H+ + CH3COO-
CH3COO-+ H2O CH3COOH + OH-
AgCl(s) Ag+(aq) + Cl-(aq)
平衡常数是表征化学反应或转化过程限度的物理量,
且只与物质的性质和体系温度有关。
高中化学
平衡常数的种类
Kh= c(O O-)OH)
Ksp (AgCl) =c(Ag+) ·c(Cl-)
O
C
c(CH3CO
H-)·c(CH3
K= c( 2)
Ka= c( )
-
)
O
CH3COOH
)·c(CH3CO
c
H
)
H
2O
·c(
(H
O)
c
C
高中化学
平衡常数的意义和应用
(1)依据平衡常数的大小, 判断反应的发生, 及复杂体系中溶液的酸碱性;
(2)依据平衡常数的变化, 判断化学反应或转化过程的热效应;
(3)依据平衡常数, 判断化学反应或转化过程的所处状态, 及改变条件对 化学平衡的影响;
(4)依据平衡常数, 推算平衡状态时体系中各成分的浓度及关系等。
下列选项错误的是( D ) 电离能力:HCOOH>H2CO3>HCN >HCO3- A. CN- + H2O + CO2 = HCN + HCO3-
B. 2HCOOH + CO32- = 2HCOO- + H2O + CO2 ↑
C. 中和等体积、 等pH的HCOOH和HCN溶液, 消耗NaOH的量前者小于后者
D. 等体积、 等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
弱酸 HCOOH HCN
H2CO3
电离平衡常数 (25 ℃) K= 1.77×10-4 K=4.9×10- 10
K1=4.3×10-7 K2=5.6×10- 11
高中化学
题组一 依据平衡常数判断反应的发生
例1. 部分弱酸的电离平衡常数如下表:
高中化学
自 主 训 练
1. 室温时, 已知Ksp (AgCl)=1.80×10- 10, 现将2.2×10- 3 mol ·L-1 的 NaCl和2.0×10- 3 mol ·L-1 AgNO3 等体积混合, 试推算是否有沉淀生 成? 若有沉淀生成, 计算反应后溶液中c(Ag+)的值 。
Qc =c(Cl-) ·c(Ag+)=1.1×10-3 ×1.0×10-3 =1.1×10-6>Ksp(AgCl)
即, 有沉淀生成。
反应后剩余c(Cl-)=1.0×10-4 mol ·L-1
则反应后c(Ag+) = = mol ·L-1 =1.80×10-6 mol ·L-1
Ag+ + Cl- = AgCl ↓
反应消耗: 1.0×10-3 1.0×10-3
反应后剩余c(OH-)=0.1mol ·L-1
Ag+ + Cl- = AgCl ↓
H+ + OH- = H2O
0.1 mol 0.2 mol
反应后溶液中c(H+) = = mol ·L-1 =1. 0×10-13mol ·L-1
水的离子积在 酸碱中和反应 中的应用
溶液1 L 25 ℃
高中化学
pH=13
高中化学
题组二 依据平衡常数判断溶液的酸碱性
例2. 已知常温下,Ka(HCN)=6.2×10- 10, 则常温下, 含等物质的量浓
度的HCN与NaCN的混合溶液显 碱性 (填“ 酸”“碱” 或“ 中”)性, c(CN-) < (填“ > < 或“ =”)c(HCN)。
该溶液中各离子浓度由大到小的顺序为c(Na+)>c(CN- >c(OH-)>c(H+)
Kh (CN-)=K ( N) = - = 1.61×10-5
-
a
10
14
0
0
×1
×1
2
0
.
.
6
1
C
W
H
K
CN- 的水解能力>HCN的电离能力
c(HCN)>c(Na+)>c(CN-)
Kh(CN-) >Ka(HCN)
Ka (HCN)=6.2×10- 10
高中化学
自 主 训 练
2. 磷酸( H3PO4 ) 是三元弱酸, 常温下三级电离常数分别是
Ka1 =7.1×10-3, Ka2 =6.2×10-8, Ka3 =4.5×10-13, 解答下列问题:
(1)常温下同浓度①Na3PO4 、 ②Na2HPO4 、 ③NaH2PO4 的pH由小到大的 顺序是 ③ < ② < ① (填序号)。
(2)常温下 ,NaH2PO4 的水溶液呈 酸 (填“ 酸 ”“碱 ” 或“ 中 ”)性,
用Ka 与Kh 的相对大小, 说明判断理理由 。
Kh (H2PO4- )= c(O -P)O4 ) = = - = 1.41×10- 12 <6.2×10-8
4
-
3
1
0
0
×1
×1
1
0
.
.
7
1
a1
W
K
K
4
3
O
H
P
c(
2
·
H
-)
c(
H
电离能力: H3PO4 >H2PO4- > HPO42- 水解能力: PO43->HPO42- >H2PO4-
高中化学
题组三 利用平衡常数判断离子浓度比值的变化
例3. 已知0.1 mol ·L-1 的醋酸溶液中存在电离平衡:
CH3COOH 、 CH3COO- +H +, 要使溶液中 值增大,
可以采取的措施是( )
①加少量烧碱固体 ②升高温度 ③加 少量冰醋酸
④加水 ⑤加少量醋酸钠固体
A . ①② B . ②③⑤ C . ③④⑤ D . ②④
c(H+)
c(CH3COOH)
n(CH3COOH)
c(CH3COOH)
Ka(CH3COOH)
c(CH3COO-)
n(H+)
c(H+)
=
D
高中化学
自 主 训 练
3. 已知某温度下CH3COOH和NH3 H2O的电离常数相等, 现向10mL浓
度为0. 1 mol L 1 的CH3COOH溶液中滴加相同浓度的氨水 ,在滴加过程
中, 下来说法正确的是 ( D )
A. 水的电离程度始终增大
B. c(NH4+)/c(NH3 H2O)先增大再减小
C. c(CH3COOH)与c(CH3COO )之和始终保持不变
D. 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO )
CH3COOH H+ + CH3COO-
c(NH4+)
c(NH3 H2O)
= Kb(NH3 H2O)
溶质 :CH3COONH4
c(OH-)
化学反应 平衡常数 温度/℃ 500
800
①2H2(g)+CO(g) CH3OH(g) K1 2.5
0. 15
②H2(g)+CO2(g) H2O(g)+CO(g) K2 1.0
2.50
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) K3 2.5
0.375
K1= c 3 ) 示可K2= c ) K K3= c( ) ( O) _ _1_· _
2
H2
(H
c3
·c
2)
H
O
O
(C
H3
c
C
2)
O
(H
H2
c
(
O
O
C
C
(
(
c
c
(H
H)
c2
O
CO)
(CH
(
c
例4. 工业上可利用CO或CO2 来生产燃料甲醇 。 已知制备甲醇的 有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
题组四 平衡常数的综合应用
高中化学
ΔH<0
ΔH>0
化学反应 平衡常数 温度/℃ 500
800
①2H2(g)+CO(g) CH3OH(g) K1 2.5
0. 15
②H2(g)+CO2(g) H2O(g)+CO(g) K2 1.0
2.50
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) K3 2.5
0.375
例4. 工业上可利用CO或CO2 来生产燃料甲醇 。 已知制备甲醇的 有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(2)反应③的ΔH < (填“>” 或“ <”)0。
题组四 平衡常数的综合应用
高中化学
高中化学
化学反应 平衡常数 温度/℃ 500
800
①2H2(g)+CO(g) CH3OH(g) K1 2.5
0. 15
②H2(g)+CO2(g) H2O(g)+CO(g) K2 1.0
2.50
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) K3 2.5
0.375
(3)500 ℃时测得反应③在某时刻H2(g) 、CO2(g) 、CH3OH(g) 、H2O(g)
的浓度(mol ·L- 1)分别为0.8 、0. 1 、0.3 、0. 15, 则此时v正 > v逆
Q = = ≈0.88 < K
故反应正向正向进行
(填“ > = 或“ <”) 。
高中化学
反应②:H2(g)+CO2(g) H2O(g)+CO(g) 500 ℃时, K= 1.0
(4) 500℃时 ,在体积相同的三个密闭容器中, 按表中数据加入 一 定量的 反应物发生反应② 。 以下说法错误的是 ( )
容器 编号 起始时各物质的物质的量/mol CO2 H2 CO
H2O
ⅰ 1 1 0
0
ⅱ 0 0 1
1
ⅲ 0.6 0.6 0.4
0.4
A. 容器ⅰ中反应达平衡时, CO2 的转化率为50%
B. 平衡时, 容器ⅰ中CO2 的转化率与容器ⅱ中CO的转化率之和等于1 C. 平衡时, 三个容器中各种物质的浓度均分别相等
D. 平衡时再向容器ⅰ中加入1mol H2 , H2 和CO2 的转化率均提高
容器ⅲ 起始 0.6 0.6 0.4 0.4
依据平衡常数, 可以判断反应是否达到平衡状态,
可以推算平衡状态时体系中各成分的浓度 、 及反应物转化率,
可以验证等效平衡等问题。
起始
变化 平衡
起始
0 x x 0.5 1 0
x
x
0.5
1
1 x 1-x 0.5 0
1
x
1- x
0.5
0
K= 1.0
=1
x=0.5
设容器容积为1L
高中化学
H2O(g)+CO(g)
H2(g)+CO2(g)
容器ⅰ
容器ⅱ
谢谢同学们的收看!
祝同学们学业进步!
高中化学
