2.2 化学平衡 习题课课件(共18张PPT)
文档属性
| 名称 | 2.2 化学平衡 习题课课件(共18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 458.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 08:53:29 | ||
图片预览



文档简介
(共18张PPT)
化学平衡习题课
高中化学
学习目标
1.能运用温度、浓度、压强和催化剂等对化学反应速率的影响 规律解释生产、生活、实验室中的实际问题;能认识化学反应 条件的选择和优化,认识化学反应是可以调控的。。
2.能运用化学反应原理多角度、动态地分析化学变化,并解决 综合、陌生的实际问题。
高中化学
题组一 极端假设 , 界定范围 , 突破判断
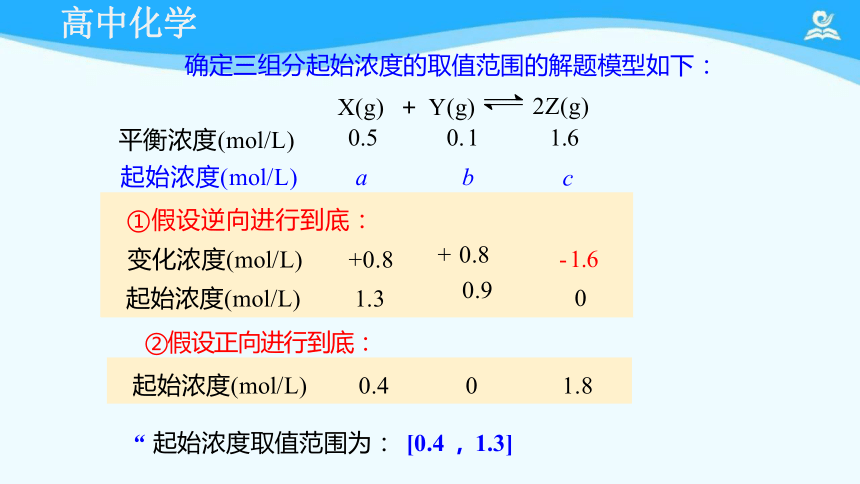
例1. 一定条件下 , 对于可逆反应: X(g) +Y(g) 2Z(g)
达到平衡时 , 经测定 X、 Y、 Z的浓度分别为0.5 mol ·L-1、
0. 1 mol ·L-1、 1.6mol ·L-1 , 若 X、 Y、 Z起始时的浓度分别用
a mol ·L-1 、 b mol ·L-1 、 c mol ·L-1表示 , 请回答:
( 1) a-b= ; (2) a 的取值范围是 。
X(g) + Y(g) 2Z(g)
平衡浓度(mol/L) 0.5 0. 1 1.6
变化浓度(mol/L) x x 2x
起始浓度(mol/L) a b c
高中化学
确定三组分起始浓度的取值范围的解题模型如下:
①假设逆向进行到底:
变化浓度(mol/L) +0.8
起始浓度(mol/L) 1.3
起始浓度(mol/L) 0.4 0 1.8
X(g) + Y(g)
0.5 0. 1
a b
平衡浓度(mol/L)
起始浓度(mol/L)
“ 起始浓度取值范围为: [0.4 , 1.3]
②假设正向进行到底:
2Z(g)
1.6
c
+ 0.8
0.9
- 1.6
0
高中化学
题组二 条件改变对化学平衡移动结果的判断
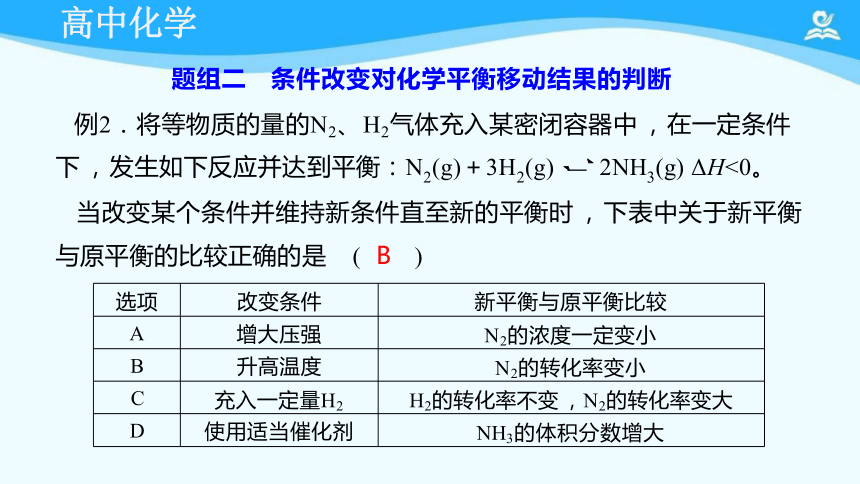
例2.将等物质的量的N2、 H2气体充入某密闭容器中 , 在一定条件
下 , 发生如下反应并达到平衡:N2(g)+3H2(g) 2NH3(g) ΔH<0。
当改变某个条件并维持新条件直至新的平衡时 , 下表中关于新平衡
与原平衡的比较正确的是 ( B )
选项 改变条件
新平衡与原平衡比较
A 增大压强
N2的浓度一定变小
B 升高温度
N2的转化率变小
C 充入一定量H2
H2的转化率不变 ,N2的转化率变大
D 使用适当催化剂
NH3的体积分数增大
高中化学
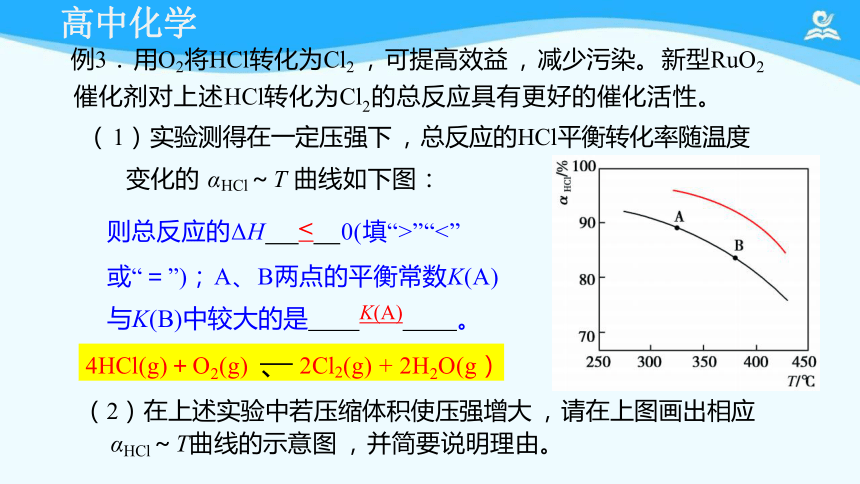
例3. 用O2将HCl转化为Cl2 , 可提高效益 , 减少污染。 新型RuO2
催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
( 1) 实验测得在一定压强下 , 总反应的HCl平衡转化率随温度
变化的 αHCl~T 曲线如下图:
则总反应的ΔH < 0(填“>”“<”
或“=”); A、 B两点的平衡常数K(A)
与K(B)中较大的是 K(A) 。
(2) 在上述实验中若压缩体积使压强增大 , 请在上图画出相应 αHCl~T曲线的示意图 , 并简要说明理由。
4HCl(g)+O2(g) 、 2Cl2(g) + 2H2O(g)
高中化学
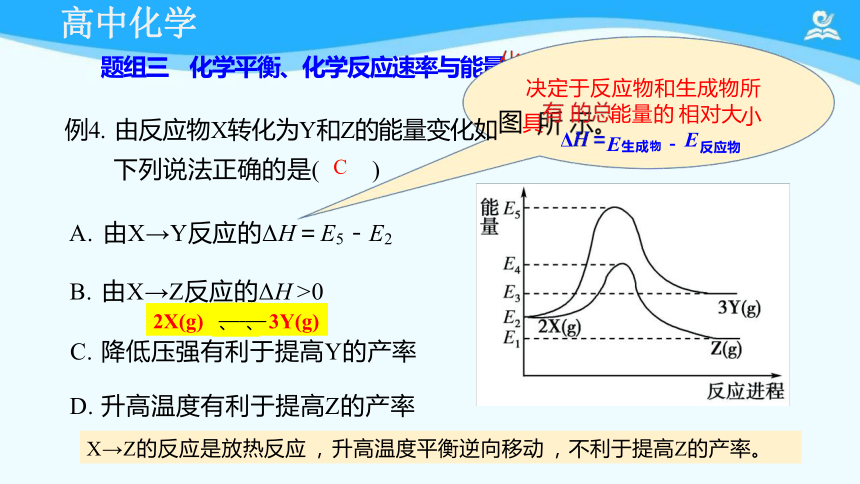
题组三 化学平衡、化学反应速率与能量 学化反综应合中 量变化
下列说法正确的是( C )
A. 由X→Y反应的ΔH=E5-E2
B. 由X→Z反应的ΔH >0
C. 降低压强有利于提高Y的产率
D. 升高温度有利于提高Z的产率
决定于反应物和生成物所
例4. 由反应物X转化为Y和Z的能量变化如图具 Δ 小
反应物
对大
E
相
物-
的
E生成
能量
X→Z的反应是放热反应 , 升高温度平衡逆向移动 ,不利于提高Z的产率。
2X(g) 、 、 3Y(g)
A. 该反应进行到M点放出的热量大于进行
题组三 化学平衡、 化学反应速率与能量变化综合试题
例5 .在恒容密闭容器中通入X并发生反应: 2X(g) Y(g),
温度T1、 T2下 X 的物质的量浓度c(X)随时间 t 变化的曲线如图所示,
下列叙述正确的是( )
比|斜率|
到W点放出的热量
B. T2下 ,在0~t1时间内 , υ(Y) =
mol ·L- 1 ·min- 1
C. M点的正反应速率v(正)大于N点的逆反应速率υ(逆)
速率快→T1高
温度高 ,反应物浓度大
→不利于平衡正动
→反应放热
D. M点时再加入一定量X , 平衡后X的转化率减小
高中化学
高中化学
题组三 化学平衡、 化学反应速率与能量变化综合试题
例5.在恒容密闭容器中通入X并发生反应 :2X(g) 、 Y(g) , ΔH<0
温度T1、 T2下 X 的物质的量浓度c(X)随时间 t变化的曲线如图所示,
下列叙述正确的是( )
A. 该反应进行到M点放出的热量大于进行
到W点放出的热量
B. T2下 ,在0~t1时间内 , υ(Y) =
mol ·L- 1 ·min- 1
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量X , 平衡后X的转化率减小
高
0
比较M点正反应速率和N点逆反应速率
比较M点逆反应速率和N点逆反应速率
M点(温度高/X浓度小) 和 N点(温度低/X浓度大)
M点(温度高/Y浓度大) 和 N点(温度低/Y浓度小)
高中化学
2X(g) 、 Y(g)
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
高中化学
题组三 化学平衡、 化学反应速率与能量变化综合试题
例5 .在恒容密闭容器中通入X并发生反应: 2X(g) Y(g) , ΔH<0
温度T1、 T2下 X 的物质的量浓度c(X)随时间 t 变化的曲线如图所示,
放出的热量大于进行
到W点放出的热量
内 ,υ(Y) =
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量X , 平衡后X的转化率减小
2X(g) Y(g)
下列叙述正确的是( )
2X(g) Y(g)
高
高中化学
例6. 在一个体积为2 L的真空密闭容器中加入0.5 mol CaCO3,
发生反应: CaCO3(s) 、 CaO(s)+CO2(g)
测得c(CO2)随温度的变化关系如下图所示 , 图中A表示CO2的平衡浓度与温度
的关系曲线 , B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变 化曲线。
( 1) T5 ℃时 , 该反应的平衡常数数值为 0.2 。
(2)结合右图说明平衡常数K与温度的变化关系。
(3)说明随温度的升高 , 曲线B向曲线A逼近的原因。
随着温度升高 ,反应速率加快 , 达到平衡所需要的时间变短 , 逐渐衡
高中化学
在一个体积为2 L的真空密闭容器中加入0.5 mol CaCO3 , 发生反应:
CaCO3(s) 、 CaO(s)+CO2(g)
(4)如果该反应的平衡常数K值变大,
该反应 bc (选填字母)。
a. 一定向逆反应方向移动
b. 在平衡移动时正反应速率先增大后减小
c. 一定向正反应方向移动
(5)保持温度、 体积不变 , 充入CO2气体 ,则CaCO3的质量 增大 , CaO的
质量 减小 , CO2的浓度 不变 (填 “增大” “减小”或 “不变”)。
高中化学
题组四 化学反应原理在科研和生产中的应用
例7. 利用“化学蒸气转移法”制备TaS2 晶体 ,发生如下反应:
TaS2(s)+2I2(g) 、 、TaI4(g)+S2(g) ΔH>0 ( I) ①TaS2+2I2 =TaI4+S2
如图所示 ,反应(Ⅰ)在石英真空管中进行 ,先在温度为T2的一端放入未提纯的
TaS2粉末和少量I2(g) , 一段时间后 ,在温度为T1的一端得到了纯净TaS2 晶体。
②TaI4+S2 =TaS2+2I2
则温度T1___ ___T2(填“>”“<”或“=”)。
上述反应体系中循环使用的物质是 I2 。
该反应
1.3×104
在1.3×10
时生产成
ΔH < 0(
产条件控制
kPa左右,
4 kPa下 , C 本增加 , 得
填 “>”或 “<”)。
选择此压强的
O的转化率已较高 , 再增大压强CO转化率提高不大,
不偿失 。
同
高中化学
例8. CO可用于合成甲醇 ,反应方程式为CO(g)+2H2(g) 、 CH3OH(g)。
CO在不同温度下的平衡转化率与压强的关系如图所示。
释了反应进行
在 5题0℃, 个是
件的选择应该
两个角度诠
一个是快慢 工业反应条 入手 , 使生 兼顾设备、 通过及时分 用 , 实现效
产产品 “又快
。成本等问题。
离出产品甲醇,
益最大化。
速(1率)
的(2两)
转化
从这
又多
本例
原料
和平衡从
个实方际面生,
率问题。
两个方面
”理,由同是时
中还可以
再循环利
丁烯是一种重要的化工原料 , 可由丁烷催化脱氢制备。
( 1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
C4H10(g) = C4H8(g)+H2(g) ΔH=+123 kJ ·mol- 1
图(a)是平衡转化率与反应温度及压强的关系图 , x 小于 0. 1 (填 “大于”或 “小于” );
欲使丁烯的平衡产率提高 ,应采取的措施是 AD (填标号)。
A. 升高温度 B. 降低温度 C. 增大压强 D. 降低压强
高中化学
自主练习
高中化学C4H10(g) = C4H8(g)+H2(g) ΔH=+123 kJ ·mol-1
(2) 丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用
是活化催化剂) , 出口气中含有丁烯、 丁烷、 氢气等。 图(b)为丁烯产率与进料气中 n(氢气)/n(丁烷)的关系。 图中曲线呈现先升高后降低的变化趋势 , 其降低的原因 是 氢气是。产物之一 , 随着n(氢气)/n(丁烷)增大 , 逆反应速率增大
(3) 图(c)为反应产率和反应温度的关系曲线 , 副产物主要是高温裂解生成的短
碳链烃类化合物。
丁烯产率在590 ℃之前随温度升高
而增大的原因可能是 温度 高反应速率加快
;
590 ℃之后 , 丁烯产率快速降低的
主要原因可能是 丁烯高。温裂解生成短链烃类
升高温度有利于反应向吸热方向进行
感谢同学们收看!
高中化学
化学平衡习题课
高中化学
学习目标
1.能运用温度、浓度、压强和催化剂等对化学反应速率的影响 规律解释生产、生活、实验室中的实际问题;能认识化学反应 条件的选择和优化,认识化学反应是可以调控的。。
2.能运用化学反应原理多角度、动态地分析化学变化,并解决 综合、陌生的实际问题。
高中化学
题组一 极端假设 , 界定范围 , 突破判断
例1. 一定条件下 , 对于可逆反应: X(g) +Y(g) 2Z(g)
达到平衡时 , 经测定 X、 Y、 Z的浓度分别为0.5 mol ·L-1、
0. 1 mol ·L-1、 1.6mol ·L-1 , 若 X、 Y、 Z起始时的浓度分别用
a mol ·L-1 、 b mol ·L-1 、 c mol ·L-1表示 , 请回答:
( 1) a-b= ; (2) a 的取值范围是 。
X(g) + Y(g) 2Z(g)
平衡浓度(mol/L) 0.5 0. 1 1.6
变化浓度(mol/L) x x 2x
起始浓度(mol/L) a b c
高中化学
确定三组分起始浓度的取值范围的解题模型如下:
①假设逆向进行到底:
变化浓度(mol/L) +0.8
起始浓度(mol/L) 1.3
起始浓度(mol/L) 0.4 0 1.8
X(g) + Y(g)
0.5 0. 1
a b
平衡浓度(mol/L)
起始浓度(mol/L)
“ 起始浓度取值范围为: [0.4 , 1.3]
②假设正向进行到底:
2Z(g)
1.6
c
+ 0.8
0.9
- 1.6
0
高中化学
题组二 条件改变对化学平衡移动结果的判断
例2.将等物质的量的N2、 H2气体充入某密闭容器中 , 在一定条件
下 , 发生如下反应并达到平衡:N2(g)+3H2(g) 2NH3(g) ΔH<0。
当改变某个条件并维持新条件直至新的平衡时 , 下表中关于新平衡
与原平衡的比较正确的是 ( B )
选项 改变条件
新平衡与原平衡比较
A 增大压强
N2的浓度一定变小
B 升高温度
N2的转化率变小
C 充入一定量H2
H2的转化率不变 ,N2的转化率变大
D 使用适当催化剂
NH3的体积分数增大
高中化学
例3. 用O2将HCl转化为Cl2 , 可提高效益 , 减少污染。 新型RuO2
催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
( 1) 实验测得在一定压强下 , 总反应的HCl平衡转化率随温度
变化的 αHCl~T 曲线如下图:
则总反应的ΔH < 0(填“>”“<”
或“=”); A、 B两点的平衡常数K(A)
与K(B)中较大的是 K(A) 。
(2) 在上述实验中若压缩体积使压强增大 , 请在上图画出相应 αHCl~T曲线的示意图 , 并简要说明理由。
4HCl(g)+O2(g) 、 2Cl2(g) + 2H2O(g)
高中化学
题组三 化学平衡、化学反应速率与能量 学化反综应合中 量变化
下列说法正确的是( C )
A. 由X→Y反应的ΔH=E5-E2
B. 由X→Z反应的ΔH >0
C. 降低压强有利于提高Y的产率
D. 升高温度有利于提高Z的产率
决定于反应物和生成物所
例4. 由反应物X转化为Y和Z的能量变化如图具 Δ 小
反应物
对大
E
相
物-
的
E生成
能量
X→Z的反应是放热反应 , 升高温度平衡逆向移动 ,不利于提高Z的产率。
2X(g) 、 、 3Y(g)
A. 该反应进行到M点放出的热量大于进行
题组三 化学平衡、 化学反应速率与能量变化综合试题
例5 .在恒容密闭容器中通入X并发生反应: 2X(g) Y(g),
温度T1、 T2下 X 的物质的量浓度c(X)随时间 t 变化的曲线如图所示,
下列叙述正确的是( )
比|斜率|
到W点放出的热量
B. T2下 ,在0~t1时间内 , υ(Y) =
mol ·L- 1 ·min- 1
C. M点的正反应速率v(正)大于N点的逆反应速率υ(逆)
速率快→T1高
温度高 ,反应物浓度大
→不利于平衡正动
→反应放热
D. M点时再加入一定量X , 平衡后X的转化率减小
高中化学
高中化学
题组三 化学平衡、 化学反应速率与能量变化综合试题
例5.在恒容密闭容器中通入X并发生反应 :2X(g) 、 Y(g) , ΔH<0
温度T1、 T2下 X 的物质的量浓度c(X)随时间 t变化的曲线如图所示,
下列叙述正确的是( )
A. 该反应进行到M点放出的热量大于进行
到W点放出的热量
B. T2下 ,在0~t1时间内 , υ(Y) =
mol ·L- 1 ·min- 1
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量X , 平衡后X的转化率减小
高
0
比较M点正反应速率和N点逆反应速率
比较M点逆反应速率和N点逆反应速率
M点(温度高/X浓度小) 和 N点(温度低/X浓度大)
M点(温度高/Y浓度大) 和 N点(温度低/Y浓度小)
高中化学
2X(g) 、 Y(g)
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
高中化学
题组三 化学平衡、 化学反应速率与能量变化综合试题
例5 .在恒容密闭容器中通入X并发生反应: 2X(g) Y(g) , ΔH<0
温度T1、 T2下 X 的物质的量浓度c(X)随时间 t 变化的曲线如图所示,
放出的热量大于进行
到W点放出的热量
内 ,υ(Y) =
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量X , 平衡后X的转化率减小
2X(g) Y(g)
下列叙述正确的是( )
2X(g) Y(g)
高
高中化学
例6. 在一个体积为2 L的真空密闭容器中加入0.5 mol CaCO3,
发生反应: CaCO3(s) 、 CaO(s)+CO2(g)
测得c(CO2)随温度的变化关系如下图所示 , 图中A表示CO2的平衡浓度与温度
的关系曲线 , B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变 化曲线。
( 1) T5 ℃时 , 该反应的平衡常数数值为 0.2 。
(2)结合右图说明平衡常数K与温度的变化关系。
(3)说明随温度的升高 , 曲线B向曲线A逼近的原因。
随着温度升高 ,反应速率加快 , 达到平衡所需要的时间变短 , 逐渐衡
高中化学
在一个体积为2 L的真空密闭容器中加入0.5 mol CaCO3 , 发生反应:
CaCO3(s) 、 CaO(s)+CO2(g)
(4)如果该反应的平衡常数K值变大,
该反应 bc (选填字母)。
a. 一定向逆反应方向移动
b. 在平衡移动时正反应速率先增大后减小
c. 一定向正反应方向移动
(5)保持温度、 体积不变 , 充入CO2气体 ,则CaCO3的质量 增大 , CaO的
质量 减小 , CO2的浓度 不变 (填 “增大” “减小”或 “不变”)。
高中化学
题组四 化学反应原理在科研和生产中的应用
例7. 利用“化学蒸气转移法”制备TaS2 晶体 ,发生如下反应:
TaS2(s)+2I2(g) 、 、TaI4(g)+S2(g) ΔH>0 ( I) ①TaS2+2I2 =TaI4+S2
如图所示 ,反应(Ⅰ)在石英真空管中进行 ,先在温度为T2的一端放入未提纯的
TaS2粉末和少量I2(g) , 一段时间后 ,在温度为T1的一端得到了纯净TaS2 晶体。
②TaI4+S2 =TaS2+2I2
则温度T1___ ___T2(填“>”“<”或“=”)。
上述反应体系中循环使用的物质是 I2 。
该反应
1.3×104
在1.3×10
时生产成
ΔH < 0(
产条件控制
kPa左右,
4 kPa下 , C 本增加 , 得
填 “>”或 “<”)。
选择此压强的
O的转化率已较高 , 再增大压强CO转化率提高不大,
不偿失 。
同
高中化学
例8. CO可用于合成甲醇 ,反应方程式为CO(g)+2H2(g) 、 CH3OH(g)。
CO在不同温度下的平衡转化率与压强的关系如图所示。
释了反应进行
在 5题0℃, 个是
件的选择应该
两个角度诠
一个是快慢 工业反应条 入手 , 使生 兼顾设备、 通过及时分 用 , 实现效
产产品 “又快
。成本等问题。
离出产品甲醇,
益最大化。
速(1率)
的(2两)
转化
从这
又多
本例
原料
和平衡从
个实方际面生,
率问题。
两个方面
”理,由同是时
中还可以
再循环利
丁烯是一种重要的化工原料 , 可由丁烷催化脱氢制备。
( 1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
C4H10(g) = C4H8(g)+H2(g) ΔH=+123 kJ ·mol- 1
图(a)是平衡转化率与反应温度及压强的关系图 , x 小于 0. 1 (填 “大于”或 “小于” );
欲使丁烯的平衡产率提高 ,应采取的措施是 AD (填标号)。
A. 升高温度 B. 降低温度 C. 增大压强 D. 降低压强
高中化学
自主练习
高中化学C4H10(g) = C4H8(g)+H2(g) ΔH=+123 kJ ·mol-1
(2) 丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用
是活化催化剂) , 出口气中含有丁烯、 丁烷、 氢气等。 图(b)为丁烯产率与进料气中 n(氢气)/n(丁烷)的关系。 图中曲线呈现先升高后降低的变化趋势 , 其降低的原因 是 氢气是。产物之一 , 随着n(氢气)/n(丁烷)增大 , 逆反应速率增大
(3) 图(c)为反应产率和反应温度的关系曲线 , 副产物主要是高温裂解生成的短
碳链烃类化合物。
丁烯产率在590 ℃之前随温度升高
而增大的原因可能是 温度 高反应速率加快
;
590 ℃之后 , 丁烯产率快速降低的
主要原因可能是 丁烯高。温裂解生成短链烃类
升高温度有利于反应向吸热方向进行
感谢同学们收看!
高中化学
