2.2 化学平衡 课件(共24张PPT)
文档属性
| 名称 | 2.2 化学平衡 课件(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 08:54:03 | ||
图片预览




文档简介
(共24张PPT)
化学平衡(第2课时)
高中化学
学习目标
(1)通过外界条件改变对正逆反应速率的影响,
借助图像分析化学平衡移动的本质原因;
(2)通过实验探究,了解浓度、压强、温度对化
学平衡状态的影响,归纳出勒夏特列原理;
(3)能初步解释化工生产中反应条件的选择和优
化。
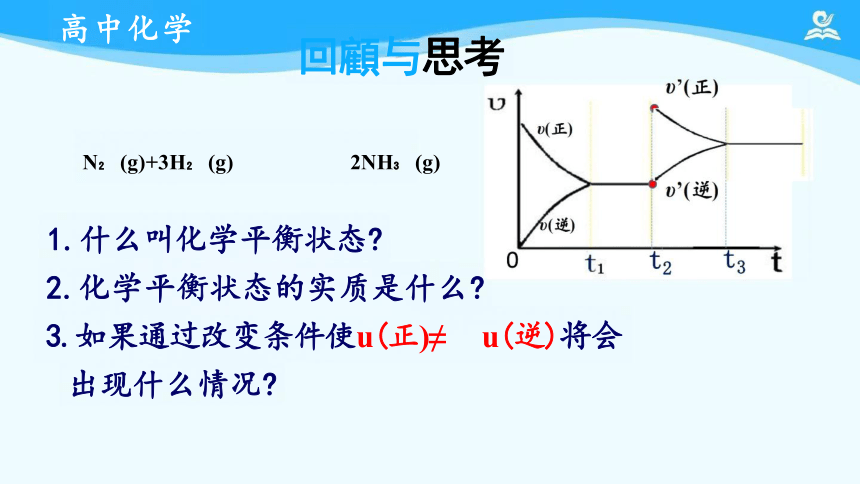
N (g)+3H (g) 2NH (g)
1.什么叫化学平衡状态
2.化学平衡状态的实质是什么
3.如果通过改变条件使u(正)≠ u(逆)将会
出现什么情况
回顧与思考
高中化学
(1)定义:
由于条件的改变,可逆反应由一个平衡状态转变
为另一个平衡状态的过程,称为化学平衡的移动。
【思考】化学平衡移动的本质原因是什么 √(正)≠(逆)
影响化学平衡的因素可能有哪些 T 、c 、P等
高中化学
4、 化学平衡的移动
高中化学
(2)影响化学平衡的因素
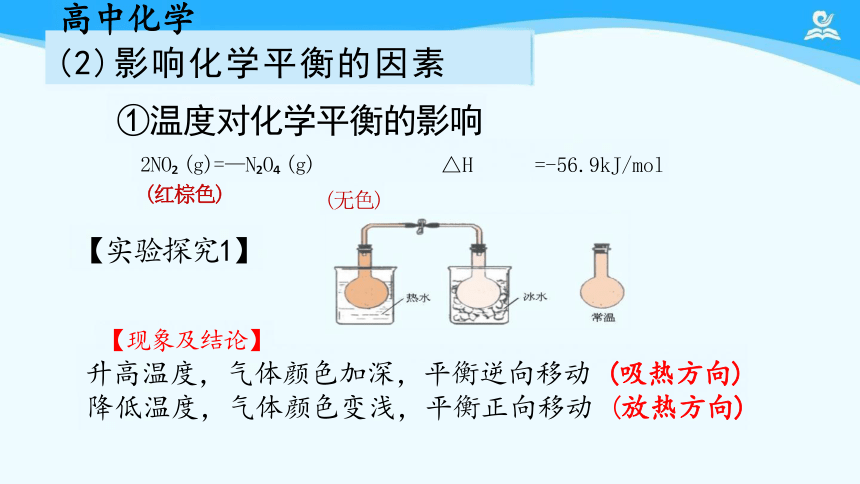
①温度对化学平衡的影响
2NO (g)=—N O (g)
(红棕色)
【实验探究1】
【现象及结论】
升高温度,气体颜色加深,平衡逆向移动 (吸热方向) 降低温度,气体颜色变浅,平衡正向移动 (放热方向)
△H =-56.9kJ/mol
(无色)
结论: 在已达平衡的可逆反应里,当其他
条件不变时,改变温度,平衡会向减 弱这种
改变的方向移动。
(2)影响化学平衡的因素
①温度对化学平衡的影响
高中化学
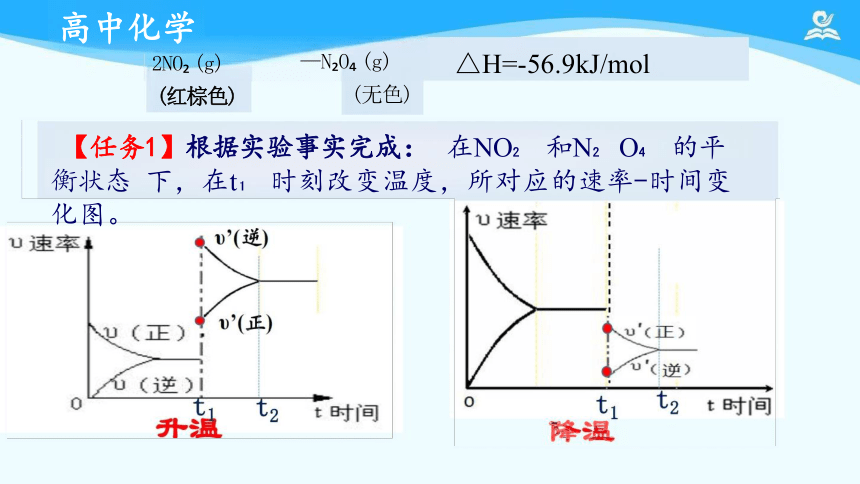
【任务1】根据实验事实完成: 在NO 和N O 的平衡状态 下,在t 时刻改变温度,所对应的速率-时间变化图。
高中化学
2NO (g)
(红棕色)
—N O (g)
(无色)
△H=-56.9kJ/mol
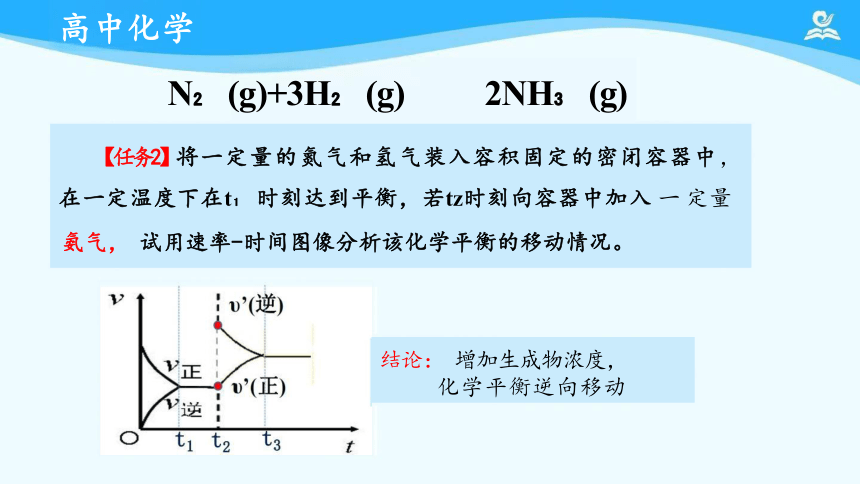
【任务2】将一定量的氮气和氢气装入容积固定的密闭容器中,
在一定温度下在t 时刻达到平衡,若tz时刻向容器中加入 一 定量 氨气, 试用速率-时间图像分析该化学平衡的移动情况。
高中化学
N (g)+3H (g) 2NH (g)
结论: 增加生成物浓度, 化学平衡逆向移动
立 业 兴
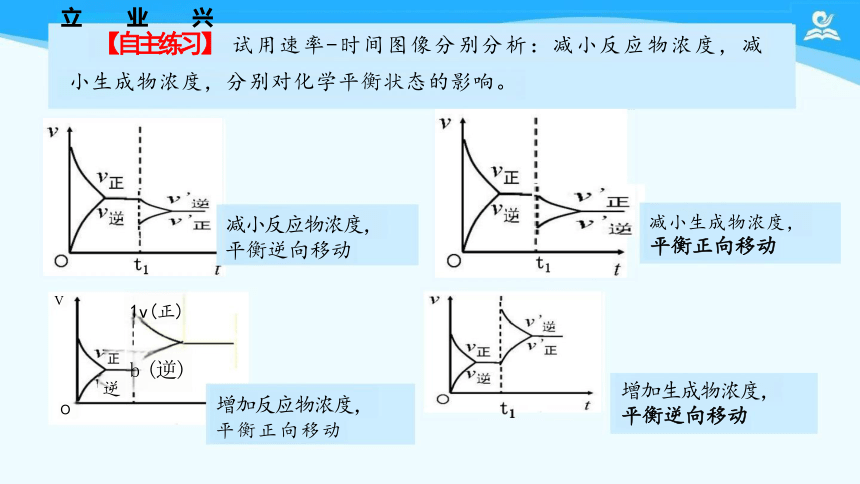
【自主练习】 试用速率-时间图像分别分析:减小反应物浓度,减
小生成物浓度,分别对化学平衡状态的影响。
减小反应物浓度, 平衡逆向移动
增加反应物浓度, 平衡正向移动
增加生成物浓度,
平衡逆向移动
减小生成物浓度,
平衡正向移动
正
逆 O
b (逆)
1v(正)
V
高中化学
(2)影响化学平衡的因素
② 浓度对化学平衡的影响:
结论:
其它条件一定,
改变平衡体系中某物质的浓度,
平衡向减弱这种改变的方向移动。
【思考】如何设计实验验证浓度对化学平衡的影响呢
高中化学
【实验探究2】浓度改变对化学平衡的影响
① 滴加几滴浓硫酸 → 变 橙 色
② 滴加几滴浓氢氧化钠溶液 → 变 黄 色
Cr O -+H O
=2CrO -+2H+
橙色
黄色
【P26教材实验】
高中化学
【思考】 某温度下,可逆反应:
C(s)+H Og) =COg+H (g )达到平衡后,增加
或移去一部分C, 其化学平衡是否会发生移动
结论: 改变固体或纯液体的量, 因浓度不变,
故速率不变,平衡不移动。
【思考】如果是增加某一气体浓度呢
如果是同等倍数的增加平衡体系中所有气体的浓度呢
2NO (g) =N O (g)
红棕色 无色
【思考】
你推测对该平衡体系增大压强,化学平衡是否移
动 如何移动
若要完成此实验,如何操作
高中化学
【实验探究3】压强对化学平衡的影响
红棕色 无色
【操作】迅速将针管内的气体压缩
至原体积的1/2。
【现象】
气体颜色先变深、后变浅,
且比体积变化前颜色深。
高中化学
【实验探究3】压强对化学平衡的影响
2NO (g)==N O (g)
【 实验结论】
(压缩体积)增大压强,该平衡正向移动
2NO (g)=N O (g)
红棕色 无色
【操作】向外拉活塞增大气体体积
【现象】混合气体的颜色先变浅,后逐渐变深,
但比体积变化前颜色浅。
【实验结论】(增大体积)减小压强,该平衡逆向移动
【实验探究3】压强对化学平衡的影响
高中化学
2NO (g)=N O (g)
红棕色 无色
比色皿
滤光E
色度计
改变体积
浓度变化
压强变化
平衡移动
颜色变化
透光率变化
高中化学
【实验探究3】压强对化学平衡的影响
数据采集
高中化学
2NO (g)=N O (g) 红棕色 无色
42-
C
f
g
135 140 145 150
72-
7O -
68-
64
62
60
叁
言
50-
e
高中化学
【实验探究3】压强对化学平衡的影响
2NO (g)=N O (g)
红棕色 无色
结论:
其它条件一定,在有气体参与或有气体生成 的反应体系中,(通过改变容器体积的方法)改变体 系压强,平衡向减弱这种改变的方向移动。
高中化学
2NO (g)=N O (g)
红棕色 无色
【任务3】
根据实验事实,画出在NO 和N O 的平衡状态下, 改变压强,所对应的速率-时间变化图。
减压
【思考1】对于方程式左右两边气体的分子总数相等
的反应,改变压强,化学平衡是否移动呢
(2)影响化学平衡的因素
② 压强对化学平衡的影响:
H (g)+I (g)==2HI(g) 不移动
高中化学
【思考3】 一定温度下,向有活塞的恒压的密闭容器中,充
入不参与反应的气体(如:惰性气体),化学平衡是否移动
呢
移动
【思考2】 一定温度下,向容积固定的密闭容器中,充入不
参与反应的气体(如:惰性气体),化学平衡是否移动呢
不移动
(2)影响化学平衡的因素
③压强对化学平衡的影响
高中化学
④催化剂对平衡的影响
思考:催化剂是否对平衡存在影响 阅读: P2 8
在已达平衡的可逆反应中,当其他条件 不变时,使用催化剂能同等程度地改变u(正) 和u(逆),故不能使化学平衡发生移动。
(2)影响化学平衡的因素
高中化学
高中化学
( 3 ) 平 衡 移 动 原 理 ----勒夏特列原理
对于已达平衡的可逆反应,如果改变影响平衡的 一个条件(如浓度、压强或温度等),平衡将向着能 够减弱这种改变的方向移动。
N (g)+3H (g) 2NH (g)△H<0
选择合适的条件完成工业的合成
【思考】研究平衡移动原理有何意义呢
法.勒夏特勒
谢谢同学们的收看!
祝同学们学业进步!
高中化学
化学平衡(第2课时)
高中化学
学习目标
(1)通过外界条件改变对正逆反应速率的影响,
借助图像分析化学平衡移动的本质原因;
(2)通过实验探究,了解浓度、压强、温度对化
学平衡状态的影响,归纳出勒夏特列原理;
(3)能初步解释化工生产中反应条件的选择和优
化。
N (g)+3H (g) 2NH (g)
1.什么叫化学平衡状态
2.化学平衡状态的实质是什么
3.如果通过改变条件使u(正)≠ u(逆)将会
出现什么情况
回顧与思考
高中化学
(1)定义:
由于条件的改变,可逆反应由一个平衡状态转变
为另一个平衡状态的过程,称为化学平衡的移动。
【思考】化学平衡移动的本质原因是什么 √(正)≠(逆)
影响化学平衡的因素可能有哪些 T 、c 、P等
高中化学
4、 化学平衡的移动
高中化学
(2)影响化学平衡的因素
①温度对化学平衡的影响
2NO (g)=—N O (g)
(红棕色)
【实验探究1】
【现象及结论】
升高温度,气体颜色加深,平衡逆向移动 (吸热方向) 降低温度,气体颜色变浅,平衡正向移动 (放热方向)
△H =-56.9kJ/mol
(无色)
结论: 在已达平衡的可逆反应里,当其他
条件不变时,改变温度,平衡会向减 弱这种
改变的方向移动。
(2)影响化学平衡的因素
①温度对化学平衡的影响
高中化学
【任务1】根据实验事实完成: 在NO 和N O 的平衡状态 下,在t 时刻改变温度,所对应的速率-时间变化图。
高中化学
2NO (g)
(红棕色)
—N O (g)
(无色)
△H=-56.9kJ/mol
【任务2】将一定量的氮气和氢气装入容积固定的密闭容器中,
在一定温度下在t 时刻达到平衡,若tz时刻向容器中加入 一 定量 氨气, 试用速率-时间图像分析该化学平衡的移动情况。
高中化学
N (g)+3H (g) 2NH (g)
结论: 增加生成物浓度, 化学平衡逆向移动
立 业 兴
【自主练习】 试用速率-时间图像分别分析:减小反应物浓度,减
小生成物浓度,分别对化学平衡状态的影响。
减小反应物浓度, 平衡逆向移动
增加反应物浓度, 平衡正向移动
增加生成物浓度,
平衡逆向移动
减小生成物浓度,
平衡正向移动
正
逆 O
b (逆)
1v(正)
V
高中化学
(2)影响化学平衡的因素
② 浓度对化学平衡的影响:
结论:
其它条件一定,
改变平衡体系中某物质的浓度,
平衡向减弱这种改变的方向移动。
【思考】如何设计实验验证浓度对化学平衡的影响呢
高中化学
【实验探究2】浓度改变对化学平衡的影响
① 滴加几滴浓硫酸 → 变 橙 色
② 滴加几滴浓氢氧化钠溶液 → 变 黄 色
Cr O -+H O
=2CrO -+2H+
橙色
黄色
【P26教材实验】
高中化学
【思考】 某温度下,可逆反应:
C(s)+H Og) =COg+H (g )达到平衡后,增加
或移去一部分C, 其化学平衡是否会发生移动
结论: 改变固体或纯液体的量, 因浓度不变,
故速率不变,平衡不移动。
【思考】如果是增加某一气体浓度呢
如果是同等倍数的增加平衡体系中所有气体的浓度呢
2NO (g) =N O (g)
红棕色 无色
【思考】
你推测对该平衡体系增大压强,化学平衡是否移
动 如何移动
若要完成此实验,如何操作
高中化学
【实验探究3】压强对化学平衡的影响
红棕色 无色
【操作】迅速将针管内的气体压缩
至原体积的1/2。
【现象】
气体颜色先变深、后变浅,
且比体积变化前颜色深。
高中化学
【实验探究3】压强对化学平衡的影响
2NO (g)==N O (g)
【 实验结论】
(压缩体积)增大压强,该平衡正向移动
2NO (g)=N O (g)
红棕色 无色
【操作】向外拉活塞增大气体体积
【现象】混合气体的颜色先变浅,后逐渐变深,
但比体积变化前颜色浅。
【实验结论】(增大体积)减小压强,该平衡逆向移动
【实验探究3】压强对化学平衡的影响
高中化学
2NO (g)=N O (g)
红棕色 无色
比色皿
滤光E
色度计
改变体积
浓度变化
压强变化
平衡移动
颜色变化
透光率变化
高中化学
【实验探究3】压强对化学平衡的影响
数据采集
高中化学
2NO (g)=N O (g) 红棕色 无色
42-
C
f
g
135 140 145 150
72-
7O -
68-
64
62
60
叁
言
50-
e
高中化学
【实验探究3】压强对化学平衡的影响
2NO (g)=N O (g)
红棕色 无色
结论:
其它条件一定,在有气体参与或有气体生成 的反应体系中,(通过改变容器体积的方法)改变体 系压强,平衡向减弱这种改变的方向移动。
高中化学
2NO (g)=N O (g)
红棕色 无色
【任务3】
根据实验事实,画出在NO 和N O 的平衡状态下, 改变压强,所对应的速率-时间变化图。
减压
【思考1】对于方程式左右两边气体的分子总数相等
的反应,改变压强,化学平衡是否移动呢
(2)影响化学平衡的因素
② 压强对化学平衡的影响:
H (g)+I (g)==2HI(g) 不移动
高中化学
【思考3】 一定温度下,向有活塞的恒压的密闭容器中,充
入不参与反应的气体(如:惰性气体),化学平衡是否移动
呢
移动
【思考2】 一定温度下,向容积固定的密闭容器中,充入不
参与反应的气体(如:惰性气体),化学平衡是否移动呢
不移动
(2)影响化学平衡的因素
③压强对化学平衡的影响
高中化学
④催化剂对平衡的影响
思考:催化剂是否对平衡存在影响 阅读: P2 8
在已达平衡的可逆反应中,当其他条件 不变时,使用催化剂能同等程度地改变u(正) 和u(逆),故不能使化学平衡发生移动。
(2)影响化学平衡的因素
高中化学
高中化学
( 3 ) 平 衡 移 动 原 理 ----勒夏特列原理
对于已达平衡的可逆反应,如果改变影响平衡的 一个条件(如浓度、压强或温度等),平衡将向着能 够减弱这种改变的方向移动。
N (g)+3H (g) 2NH (g)△H<0
选择合适的条件完成工业的合成
【思考】研究平衡移动原理有何意义呢
法.勒夏特勒
谢谢同学们的收看!
祝同学们学业进步!
高中化学
