2.3 化学反应的方向 课件(共21张PPT)
文档属性
| 名称 | 2.3 化学反应的方向 课件(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 752.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 08:54:38 | ||
图片预览





文档简介
(共21张PPT)
化学反应的方向
高中化学
学习任务与目标
1. 通过了解自发和非自发反应, 认识到化学变化是有方向的。
2. 知道化学反应的方向与反应的焓变和熵变有关, 认识化学变化是可以
在 一 定程度内进行调控的, 能多角度、 动态的分析化学变化, 提升变 化观念与平衡思想。
3. 学会使用焓判据和熵判据综合判断变化的方向性, 解释自然现象, 指
导生产生活, 进 一 步体会化学学科的有用性。
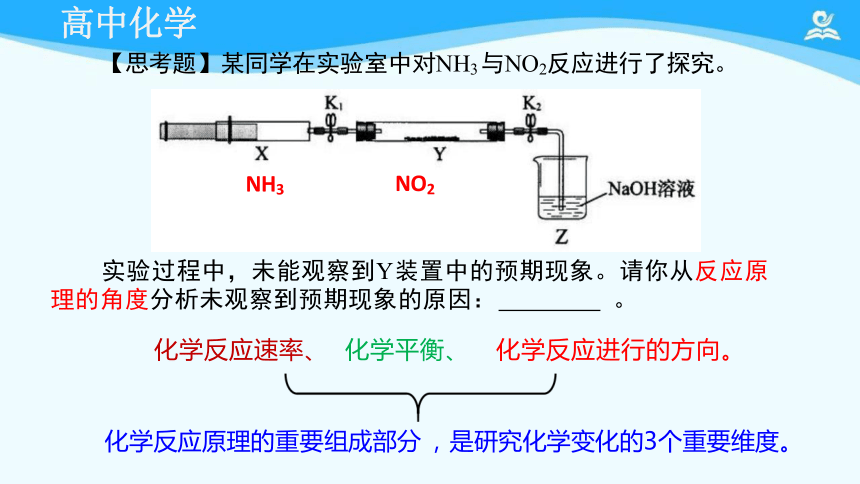
实验过程中,未能观察到Y装置中的预期现象。请你从反应原 理的角度分析未观察到预期现象的原因: 。
化学反应速率、 化学平衡、 化学反应进行的方向。
高中化学
【思考题】某同学在实验室中对NH3 与NO2反应进行了探究。
化学反应原理的重要组成部分 ,是研究化学变化的3个重要维度。
NO2
NH3
水总是自发地由高处往低处流
高中化学
留意自然
高中化学
自发过程: 在一定条件下 ,不需要外力作用就能自动进行的过程
高锰酸钾溶于水
SO2 溶于水
H2 燃烧
高中化学
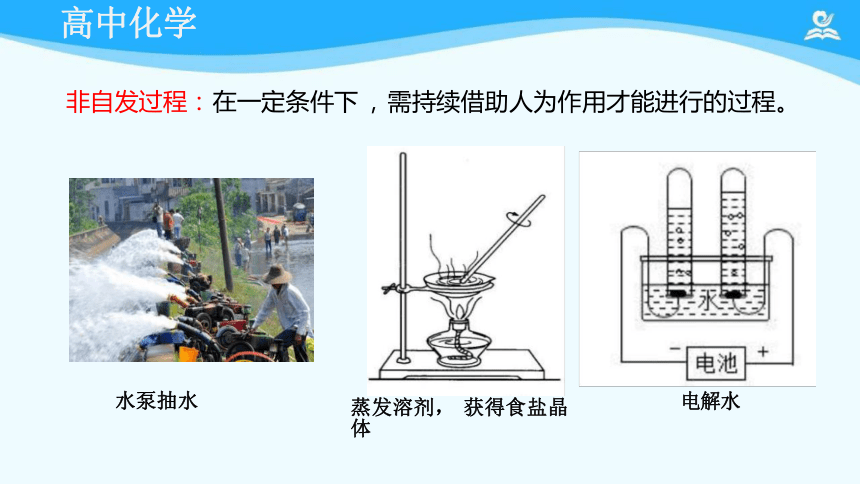
非自发过程: 在一定条件下 , 需持续借助人为作用才能进行的过程。
蒸发溶剂, 获得食盐晶体
水泵抽水
电解水
高中化学
化学反应进行的方向
研究给定化学反应 , 在一定条件下 ,是否能够自发进行。
化学反应能否自发进行, 仅仅依靠实验研究, 付出的代价往
往很大, 有时还可能是徒劳的!
为此, 有必要寻找 一种理论上的判据!
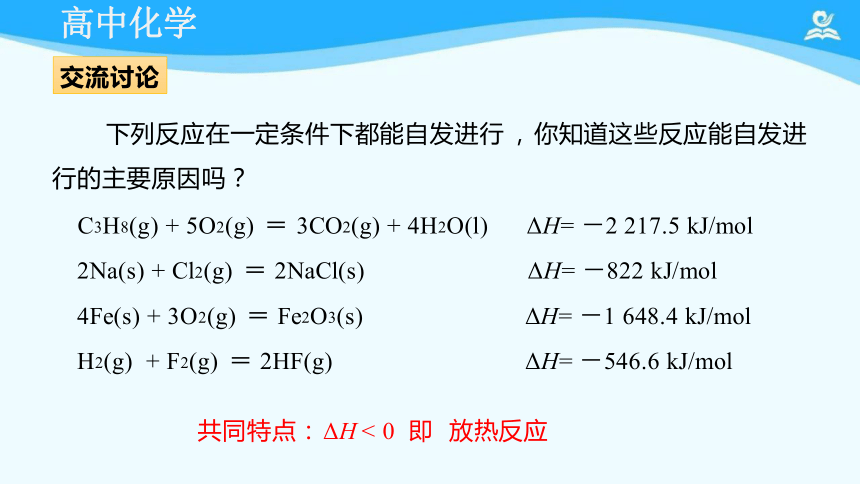
下列反应在一定条件下都能自发进行 , 你知道这些反应能自发进
行的主要原因吗?
C3H8(g) + 5O2(g) = 3CO2(g) + 4H2O(l) ΔH= -2 217.5 kJ/mol
2Na(s) + Cl2(g) = 2NaCl(s) ΔH= -822 kJ/mol
4Fe(s) + 3O2(g) = Fe2O3(s) ΔH= -1 648.4 kJ/mol
H2(g) + F2(g) = 2HF(g) ΔH= -546.6 kJ/mol
共同特点: ΔH < 0 即 放热反应
高中化学
交流讨论
高中化学
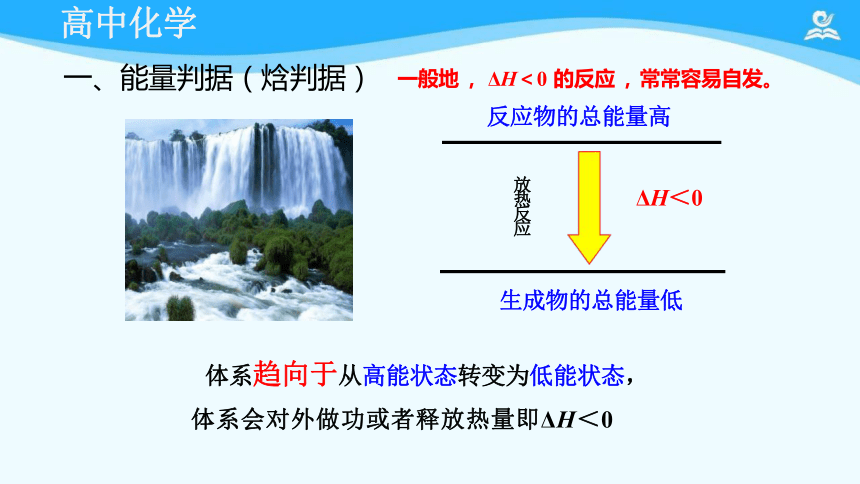
一、能量判据(焓判据) 一般地 , ΔH<0 的反应 , 常常容易自发。
体系趋向于从高能状态转变为低能状态,
体系会对外做功或者释放热量即ΔH<0
反应物的总能量高
生成物的总能量低
放热反应
ΔH<0
结论: ΔH<0 有利于反应自发进行 , 但自发反应不一定都要 ΔH<0
焓变只是反应能否自发进行的 一 个因素, 但不是唯 一 因素。
= 4NO2(g)+O2 (g)
= NH4HCO3(s)+NH3(g)
ΔH= +56.7 kJ/mol
ΔH= +74.9 kJ/mol
是不是所有自发进行的化学反应都是放热的?
2N2O5(g)
(NH4) 2CO3(s)
高中化学
引申思考
人们发现, 自然界中还存在着 一种能够推动体系变化的因素 ——体系有从有序自发的转变成无序的倾向!
硝酸铵溶于水 吸热过程
高中化学
玩过的扑克牌
有 序
混 乱
火柴散落
高中化学
二、熵判据
1. 熵: 用来度量体系混乱程度的物理量。
2. 符号:S 单位: J ·mol-1 ·K-1
3. 体系混乱度越大, 熵值越大。
固体的溶解 、 气体的扩散过程等都是混乱度增加的过程。
等量的同一物质:S (g) > S (l) >S (s)
S(水蒸气): 188.7 J ·mol- 1 ·K- 1
S(水) : 69.9 J ·mol- 1 ·K- 1
S(冰) : 47.9 J ·mol- 1 ·K- 1
高中化学
气体种类及其物质的量的增多是体系熵值变化的主要决定因素
高中化学
高中化学
4. 熵变和熵增原理
(1 ) 熵变(ΔS ): 产生新物质或物质状态和数量有变化就存在熵变。
ΔS =S生成物-S反应物
(2 ) 熵增原理:
在与外界隔离的体系中, 自发过程将导致体系的熵增大。
该原理是用来判断过程方向的 一 个因素 。 熵判据
高中化学
(NH4)2CO3 =2NH3 ↑ + CO2 ↑ + H2O
1. 碳酸铵(NH4)2CO3在室温下就能自发地分解产生氨气。
对其说法中正确的是( A )
A. 其分解是因为生成了易挥发的气体, 使体系的熵增大
B. 其分解是因为外界给予了能量
C. 其分解是吸热反应, 据能量判据能自发分解
D. 碳酸盐都不稳定, 都能自发分解
焓变 熵变 能否自发
① NH3(g)+ HCl(g) = NH4Cl(s) < 0 <0 能
② NH4Cl(s) = NH3(g)+ HCl(g) >0 >0 不能
③ NH4Cl(s) 加热 NH3(g)+ HCl(g) >0 >0 能
反应能否自发还与温度有关!
分析下列过程的焓变、 熵变与反应方向
高中化学
引申思考
高中化学
分析下列过程的焓变、 熵变与反应方向
CaCO3(s) = CaO(s)+CO2(g)
ΔH=+178.2 kJ ·mol-1 吸热
ΔS = +169.6 J ·mol-1 ·K-1 熵增
高温自发, 低温不自发
ΔH >0
ΔH <0
ΔS > 0 T大→ΔG < 0 吸热+熵增 高温自发
放热+熵增→ 自发
ΔG < 0
ΔS<0 吸热+熵减→ 非自发 ΔG > 0
T小→ΔG < 0
放热+熵减
低温自发
高中化学
三、复合判据(自由能判据)
自由能变化 ΔG = ΔH - T · ΔS
自发进行
平衡状态
非自发进行
{
ΔG < 0
ΔG = 0
ΔG > 0
2. 已知反应: 2NO(g)+2CO(g)==N2(g)+2CO2(g), 在298 K、 101 kPa
的条件下, 其ΔH=- 113.0 kJ ·mol-1, ΔS=- 145.3 J ·mol-1 ·K-1。
该 反 应 能 ( 填 “ 能 ” 或 “ 不 能 ” ) 用 于 消 除 汽 车 尾 气 中 的 NO , 理 由 为
该反应 的ΔH-TΔS≈ - 69.7 kJ ·mol-1<0, 说 明该反应在理论上是可行 的, 所 以 能 用 于 消 除汽车尾气中的NO。
ΔG= ΔH-TΔS
=-113.0 kJ ·mol-1 -298 K×(-145.3×10-3 kJ ·mol-1 ·K-1)
≈ - 69.7 kJ ·mol-1 < 0, 故理论上该反应能自发进行。
感谢同学们的收看,
祝同学们学业进步!
高中化学
化学反应的方向
高中化学
学习任务与目标
1. 通过了解自发和非自发反应, 认识到化学变化是有方向的。
2. 知道化学反应的方向与反应的焓变和熵变有关, 认识化学变化是可以
在 一 定程度内进行调控的, 能多角度、 动态的分析化学变化, 提升变 化观念与平衡思想。
3. 学会使用焓判据和熵判据综合判断变化的方向性, 解释自然现象, 指
导生产生活, 进 一 步体会化学学科的有用性。
实验过程中,未能观察到Y装置中的预期现象。请你从反应原 理的角度分析未观察到预期现象的原因: 。
化学反应速率、 化学平衡、 化学反应进行的方向。
高中化学
【思考题】某同学在实验室中对NH3 与NO2反应进行了探究。
化学反应原理的重要组成部分 ,是研究化学变化的3个重要维度。
NO2
NH3
水总是自发地由高处往低处流
高中化学
留意自然
高中化学
自发过程: 在一定条件下 ,不需要外力作用就能自动进行的过程
高锰酸钾溶于水
SO2 溶于水
H2 燃烧
高中化学
非自发过程: 在一定条件下 , 需持续借助人为作用才能进行的过程。
蒸发溶剂, 获得食盐晶体
水泵抽水
电解水
高中化学
化学反应进行的方向
研究给定化学反应 , 在一定条件下 ,是否能够自发进行。
化学反应能否自发进行, 仅仅依靠实验研究, 付出的代价往
往很大, 有时还可能是徒劳的!
为此, 有必要寻找 一种理论上的判据!
下列反应在一定条件下都能自发进行 , 你知道这些反应能自发进
行的主要原因吗?
C3H8(g) + 5O2(g) = 3CO2(g) + 4H2O(l) ΔH= -2 217.5 kJ/mol
2Na(s) + Cl2(g) = 2NaCl(s) ΔH= -822 kJ/mol
4Fe(s) + 3O2(g) = Fe2O3(s) ΔH= -1 648.4 kJ/mol
H2(g) + F2(g) = 2HF(g) ΔH= -546.6 kJ/mol
共同特点: ΔH < 0 即 放热反应
高中化学
交流讨论
高中化学
一、能量判据(焓判据) 一般地 , ΔH<0 的反应 , 常常容易自发。
体系趋向于从高能状态转变为低能状态,
体系会对外做功或者释放热量即ΔH<0
反应物的总能量高
生成物的总能量低
放热反应
ΔH<0
结论: ΔH<0 有利于反应自发进行 , 但自发反应不一定都要 ΔH<0
焓变只是反应能否自发进行的 一 个因素, 但不是唯 一 因素。
= 4NO2(g)+O2 (g)
= NH4HCO3(s)+NH3(g)
ΔH= +56.7 kJ/mol
ΔH= +74.9 kJ/mol
是不是所有自发进行的化学反应都是放热的?
2N2O5(g)
(NH4) 2CO3(s)
高中化学
引申思考
人们发现, 自然界中还存在着 一种能够推动体系变化的因素 ——体系有从有序自发的转变成无序的倾向!
硝酸铵溶于水 吸热过程
高中化学
玩过的扑克牌
有 序
混 乱
火柴散落
高中化学
二、熵判据
1. 熵: 用来度量体系混乱程度的物理量。
2. 符号:S 单位: J ·mol-1 ·K-1
3. 体系混乱度越大, 熵值越大。
固体的溶解 、 气体的扩散过程等都是混乱度增加的过程。
等量的同一物质:S (g) > S (l) >S (s)
S(水蒸气): 188.7 J ·mol- 1 ·K- 1
S(水) : 69.9 J ·mol- 1 ·K- 1
S(冰) : 47.9 J ·mol- 1 ·K- 1
高中化学
气体种类及其物质的量的增多是体系熵值变化的主要决定因素
高中化学
高中化学
4. 熵变和熵增原理
(1 ) 熵变(ΔS ): 产生新物质或物质状态和数量有变化就存在熵变。
ΔS =S生成物-S反应物
(2 ) 熵增原理:
在与外界隔离的体系中, 自发过程将导致体系的熵增大。
该原理是用来判断过程方向的 一 个因素 。 熵判据
高中化学
(NH4)2CO3 =2NH3 ↑ + CO2 ↑ + H2O
1. 碳酸铵(NH4)2CO3在室温下就能自发地分解产生氨气。
对其说法中正确的是( A )
A. 其分解是因为生成了易挥发的气体, 使体系的熵增大
B. 其分解是因为外界给予了能量
C. 其分解是吸热反应, 据能量判据能自发分解
D. 碳酸盐都不稳定, 都能自发分解
焓变 熵变 能否自发
① NH3(g)+ HCl(g) = NH4Cl(s) < 0 <0 能
② NH4Cl(s) = NH3(g)+ HCl(g) >0 >0 不能
③ NH4Cl(s) 加热 NH3(g)+ HCl(g) >0 >0 能
反应能否自发还与温度有关!
分析下列过程的焓变、 熵变与反应方向
高中化学
引申思考
高中化学
分析下列过程的焓变、 熵变与反应方向
CaCO3(s) = CaO(s)+CO2(g)
ΔH=+178.2 kJ ·mol-1 吸热
ΔS = +169.6 J ·mol-1 ·K-1 熵增
高温自发, 低温不自发
ΔH >0
ΔH <0
ΔS > 0 T大→ΔG < 0 吸热+熵增 高温自发
放热+熵增→ 自发
ΔG < 0
ΔS<0 吸热+熵减→ 非自发 ΔG > 0
T小→ΔG < 0
放热+熵减
低温自发
高中化学
三、复合判据(自由能判据)
自由能变化 ΔG = ΔH - T · ΔS
自发进行
平衡状态
非自发进行
{
ΔG < 0
ΔG = 0
ΔG > 0
2. 已知反应: 2NO(g)+2CO(g)==N2(g)+2CO2(g), 在298 K、 101 kPa
的条件下, 其ΔH=- 113.0 kJ ·mol-1, ΔS=- 145.3 J ·mol-1 ·K-1。
该 反 应 能 ( 填 “ 能 ” 或 “ 不 能 ” ) 用 于 消 除 汽 车 尾 气 中 的 NO , 理 由 为
该反应 的ΔH-TΔS≈ - 69.7 kJ ·mol-1<0, 说 明该反应在理论上是可行 的, 所 以 能 用 于 消 除汽车尾气中的NO。
ΔG= ΔH-TΔS
=-113.0 kJ ·mol-1 -298 K×(-145.3×10-3 kJ ·mol-1 ·K-1)
≈ - 69.7 kJ ·mol-1 < 0, 故理论上该反应能自发进行。
感谢同学们的收看,
祝同学们学业进步!
高中化学
