3.2 水的电离和溶液的酸碱性 课件(共18张PPT)
文档属性
| 名称 | 3.2 水的电离和溶液的酸碱性 课件(共18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 473.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 08:55:22 | ||
图片预览






文档简介
(共18张PPT)
水的电离和溶液的酸碱性(三)
高中化学
学习任务与目标
1.在单 一 溶液的基础上, 学会分析酸碱中和时c(H+)的计算, 进
而求得中和后溶液pH 。 体会具体情况具体分析的思考方法,
提高分析问题解决问题能力。
2.建立酸碱混合溶液计算c(H+)的模型, 发展微粒观 、 变化观,
能够在变化中抓住事物的主要矛盾。
3. 能选择实例说明溶液pH的调控在工农业生产和科学研究中的
重要作用。
高中化学
四、 pH计算
3. 混合问题
(1) 两强酸混合
c(H + ) 混= n( )总 = c(H )1 × H )2 × V2
+
+
V
c
V1
V1
总
+
V
H
高中化学
常温下 , 计算下列溶液混合后的pH:
① 1 L pH=2的盐酸与 1 L pH=4 的盐酸
n(H+)混 = 1×10-2 × 1 + 1×10-4 × 1 = 1.01×10-2 mol
c (H + ) 混 = n ( )总 = 1.0 0 1 0 mol / L pH = -lg = -lg(1 10 - 2 ) + lg2
pH = 2 + 0.3
-2
-2
2
1
1
1
1
1
总
+
V
H
ΔpH ≥ 2的两种强酸等体积混合,
可忽略稀溶液中的H+, 看做浓溶液的稀释。
pH混 = pH小 + 0.3
合理近似,
误差1%
lg2 = 0.3
- c(OH- )1 × V1 + c(OH- )2 × V2
1 2
c (H )混 = c ( )
混
+
OH-
K w
回顾思考:
混合碱溶液时, 为什么
不能直接用c(H+)的变化 来计算pH?
四、 pH计算
3. 混合问题
(2) 两强碱混合
温度相关
c(OH )混 = V +V
c(OH - ) =
高中化学
高中化学
常温下 , 计算下列溶液混合后的pH:
② 1 L pH=12 的NaOH溶液与 1 L pH=10 的NaOH溶液
n(OH-)混 = 1×10-2 × 1 + 1×10-4 × 1 = 1.01×10-2 mol
n(OH- ) 1.01 10-2 1 10 -2 合理近似,
V总 1+1 2 误差1%
c( - ) = = 2 10-12 mol/L
2
-lg( 2 10 - 12 ) = -lg10 - 12 - lg2 lg2 = 0.3
pH = 12 - 0.3
总
2
4
10
10
1
1
OH
K w
c(OH- ) 混= 总 = mol / L
c(H + ) 混=
pH =
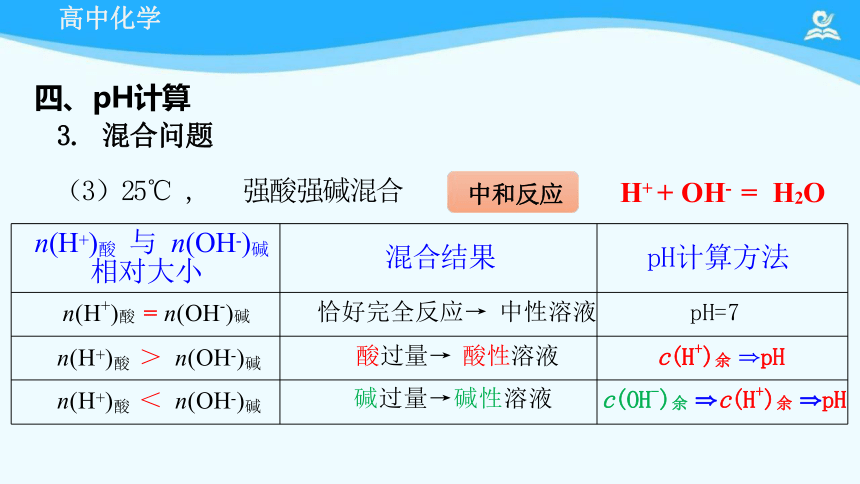
n(H+)酸 与 n(OH-)碱 相对大小 混合结果
pH计算方法
n(H+)酸 = n(OH-)碱 恰好完全反应→ 中性溶液
pH=7
n(H+)酸 > n(OH-)碱 酸过量→ 酸性溶液
c(H+)余 pH
n(H+)酸 < n(OH-)碱 碱过量→碱性溶液
c(OH-)余 c(H+)余 pH
高中化学
四、 pH计算
3. 混合问题
(3)25℃ , 强酸强碱混合
H+ + OH- = H2O
中和反应
高中化学
常温下 , 计算下列溶液混合后的pH:
③ 1 L pH=5 的盐酸与 1 L pH=9 的NaOH溶液
n(H+)酸 = 1×10-5mol = 1×10-5mol = n(OH-)碱
n(H+)酸 = V酸 ×10-pH V碱 ×10-(14-pH) = n(OH-)碱
计算关键
恰好中和 pH=7
常温下 , 计算下列溶液混合后的pH:
④ 1 L pH=5 的盐酸与 1 L pH=11 的NaOH溶液
n(H+)酸 = 1×10-5 mol < 1×10-3 mol = n(OH-)碱
c(OH- )余 = n( )余 = 10-3 mol / L c(H+ ) 余= c( ) = = 2 10-11mol/ L
余
OH-
Kw
1
-
1
O
n(OH-)余 = 1×10-3 - 1×10-5 = 0.99×10-3 mol ≈ 1×10-3 mol
pH = -lg( 2 10 - 11 ) = -lg10 - 11 - lg2
误差1%
lg 2 = 0.3
pH = 11 - 0.3
碱过量 pH>7
高中化学
2
高中化学
⑤ 常温下 ,V1 L pH=5 的盐酸 与 V2 L pH=11 的NaOH溶液 混合后呈中性 , 则V1 : V2 =?
n(H+)酸 = V1 ×10-5 mol = V2 ×10-3 mol = n(OH-)碱
V1 : V2 = 10-5 : 10-3 = 1:100
⑥ 常温下 ,V1 L pH=5 的盐酸 与 V2 L pH=11 的Ba(OH)2 溶液 混合后呈中性 , 则V1 : V2 =? 还是上述结论吗? 为什么?
n(H+)酸 = V1 ×10-5 mol = V2 ×10-3 mol = n(OH-)碱
V1 : V2 = 1:100 pH直接反映 c(H+),
与溶质是几元酸无关。
已知水在25℃和95℃时, 其电离平衡曲线
如图所示:
i. 则25℃时水的电离平衡曲线应为 A 。
(填“A” 或“B” )
ii. 25℃时, 将pH= 9 的NaOH溶液与pH= 4 的H2SO4 溶液混合, 若所得
混合溶液的pH= 7, 则NaOH溶液与H2SO4 溶液的体积比为 10:1 。
练-练
高中化学
① 1 mol/L的盐酸和 1 mol/L的氨水等体积混合后, 溶液呈 酸 性。
n(H+)酸 = n(NH3 . H2O)碱 恰好中和 pH取决于混合后的溶质NH4Cl
② pH= 4 的盐酸和 pH= 10 的氨水等体积混合后, 溶液呈 性。
高中化学
四、 pH计算
3. 混合问题
(4) 强酸弱碱(或弱酸强碱) 混合
n(H+)酸 = n(OH-)碱 pH取决于混合后的溶质 NH3 H2O
NH3 H2O = NH4+ + OH- NH4Cl
看溶质
Kw = c(H+) ·c(OH-)
高中化学
小结
判断溶液
酸碱性
酸性 碱性 c(OH-)
pH = - lg c(H+)
c(H+)
五、 pH应用
1. 利用药物调控pH是辅助治疗的重要手段
人体各种体液都有 一 定的pH, 以保证 正常的生理活动。
当体内的酸
碱平衡失调时,
血液的pH是诊断 疾病的 一 个重要 参数。
高中化学
高中化学
五、 pH应用
2. 农业生产
因土壤的pH影响植物对不同形态养分的 吸收及养分的有效性, 各种作物生长都对土 壤的pH范围有 一 定要求。
生活中, 人们洗发时使用的护发素, 主要 功能也是调节头发的pH使之达到适宜的酸碱度。
高中化学
五、 pH应用
3. 日化用品
4. 在环保领域, 酸性或碱性废水的处理
例如: 酸性废水可通过投加碱性废渣或通过碱性滤料 层过滤使之中和; 碱性废水可通过投加酸性废水或利用烟 道气中和。
高中化学
五、 pH应用
感谢同学们的收看, 祝同学们学习进步!
高中化学
水的电离和溶液的酸碱性(三)
高中化学
学习任务与目标
1.在单 一 溶液的基础上, 学会分析酸碱中和时c(H+)的计算, 进
而求得中和后溶液pH 。 体会具体情况具体分析的思考方法,
提高分析问题解决问题能力。
2.建立酸碱混合溶液计算c(H+)的模型, 发展微粒观 、 变化观,
能够在变化中抓住事物的主要矛盾。
3. 能选择实例说明溶液pH的调控在工农业生产和科学研究中的
重要作用。
高中化学
四、 pH计算
3. 混合问题
(1) 两强酸混合
c(H + ) 混= n( )总 = c(H )1 × H )2 × V2
+
+
V
c
V1
V1
总
+
V
H
高中化学
常温下 , 计算下列溶液混合后的pH:
① 1 L pH=2的盐酸与 1 L pH=4 的盐酸
n(H+)混 = 1×10-2 × 1 + 1×10-4 × 1 = 1.01×10-2 mol
c (H + ) 混 = n ( )总 = 1.0 0 1 0 mol / L pH = -lg = -lg(1 10 - 2 ) + lg2
pH = 2 + 0.3
-2
-2
2
1
1
1
1
1
总
+
V
H
ΔpH ≥ 2的两种强酸等体积混合,
可忽略稀溶液中的H+, 看做浓溶液的稀释。
pH混 = pH小 + 0.3
合理近似,
误差1%
lg2 = 0.3
- c(OH- )1 × V1 + c(OH- )2 × V2
1 2
c (H )混 = c ( )
混
+
OH-
K w
回顾思考:
混合碱溶液时, 为什么
不能直接用c(H+)的变化 来计算pH?
四、 pH计算
3. 混合问题
(2) 两强碱混合
温度相关
c(OH )混 = V +V
c(OH - ) =
高中化学
高中化学
常温下 , 计算下列溶液混合后的pH:
② 1 L pH=12 的NaOH溶液与 1 L pH=10 的NaOH溶液
n(OH-)混 = 1×10-2 × 1 + 1×10-4 × 1 = 1.01×10-2 mol
n(OH- ) 1.01 10-2 1 10 -2 合理近似,
V总 1+1 2 误差1%
c( - ) = = 2 10-12 mol/L
2
-lg( 2 10 - 12 ) = -lg10 - 12 - lg2 lg2 = 0.3
pH = 12 - 0.3
总
2
4
10
10
1
1
OH
K w
c(OH- ) 混= 总 = mol / L
c(H + ) 混=
pH =
n(H+)酸 与 n(OH-)碱 相对大小 混合结果
pH计算方法
n(H+)酸 = n(OH-)碱 恰好完全反应→ 中性溶液
pH=7
n(H+)酸 > n(OH-)碱 酸过量→ 酸性溶液
c(H+)余 pH
n(H+)酸 < n(OH-)碱 碱过量→碱性溶液
c(OH-)余 c(H+)余 pH
高中化学
四、 pH计算
3. 混合问题
(3)25℃ , 强酸强碱混合
H+ + OH- = H2O
中和反应
高中化学
常温下 , 计算下列溶液混合后的pH:
③ 1 L pH=5 的盐酸与 1 L pH=9 的NaOH溶液
n(H+)酸 = 1×10-5mol = 1×10-5mol = n(OH-)碱
n(H+)酸 = V酸 ×10-pH V碱 ×10-(14-pH) = n(OH-)碱
计算关键
恰好中和 pH=7
常温下 , 计算下列溶液混合后的pH:
④ 1 L pH=5 的盐酸与 1 L pH=11 的NaOH溶液
n(H+)酸 = 1×10-5 mol < 1×10-3 mol = n(OH-)碱
c(OH- )余 = n( )余 = 10-3 mol / L c(H+ ) 余= c( ) = = 2 10-11mol/ L
余
OH-
Kw
1
-
1
O
n(OH-)余 = 1×10-3 - 1×10-5 = 0.99×10-3 mol ≈ 1×10-3 mol
pH = -lg( 2 10 - 11 ) = -lg10 - 11 - lg2
误差1%
lg 2 = 0.3
pH = 11 - 0.3
碱过量 pH>7
高中化学
2
高中化学
⑤ 常温下 ,V1 L pH=5 的盐酸 与 V2 L pH=11 的NaOH溶液 混合后呈中性 , 则V1 : V2 =?
n(H+)酸 = V1 ×10-5 mol = V2 ×10-3 mol = n(OH-)碱
V1 : V2 = 10-5 : 10-3 = 1:100
⑥ 常温下 ,V1 L pH=5 的盐酸 与 V2 L pH=11 的Ba(OH)2 溶液 混合后呈中性 , 则V1 : V2 =? 还是上述结论吗? 为什么?
n(H+)酸 = V1 ×10-5 mol = V2 ×10-3 mol = n(OH-)碱
V1 : V2 = 1:100 pH直接反映 c(H+),
与溶质是几元酸无关。
已知水在25℃和95℃时, 其电离平衡曲线
如图所示:
i. 则25℃时水的电离平衡曲线应为 A 。
(填“A” 或“B” )
ii. 25℃时, 将pH= 9 的NaOH溶液与pH= 4 的H2SO4 溶液混合, 若所得
混合溶液的pH= 7, 则NaOH溶液与H2SO4 溶液的体积比为 10:1 。
练-练
高中化学
① 1 mol/L的盐酸和 1 mol/L的氨水等体积混合后, 溶液呈 酸 性。
n(H+)酸 = n(NH3 . H2O)碱 恰好中和 pH取决于混合后的溶质NH4Cl
② pH= 4 的盐酸和 pH= 10 的氨水等体积混合后, 溶液呈 性。
高中化学
四、 pH计算
3. 混合问题
(4) 强酸弱碱(或弱酸强碱) 混合
n(H+)酸 = n(OH-)碱 pH取决于混合后的溶质 NH3 H2O
NH3 H2O = NH4+ + OH- NH4Cl
看溶质
Kw = c(H+) ·c(OH-)
高中化学
小结
判断溶液
酸碱性
酸性 碱性 c(OH-)
pH = - lg c(H+)
c(H+)
五、 pH应用
1. 利用药物调控pH是辅助治疗的重要手段
人体各种体液都有 一 定的pH, 以保证 正常的生理活动。
当体内的酸
碱平衡失调时,
血液的pH是诊断 疾病的 一 个重要 参数。
高中化学
高中化学
五、 pH应用
2. 农业生产
因土壤的pH影响植物对不同形态养分的 吸收及养分的有效性, 各种作物生长都对土 壤的pH范围有 一 定要求。
生活中, 人们洗发时使用的护发素, 主要 功能也是调节头发的pH使之达到适宜的酸碱度。
高中化学
五、 pH应用
3. 日化用品
4. 在环保领域, 酸性或碱性废水的处理
例如: 酸性废水可通过投加碱性废渣或通过碱性滤料 层过滤使之中和; 碱性废水可通过投加酸性废水或利用烟 道气中和。
高中化学
五、 pH应用
感谢同学们的收看, 祝同学们学习进步!
高中化学
