3.2 水的电离和溶液的酸碱性 课件(共21张PPT)
文档属性
| 名称 | 3.2 水的电离和溶液的酸碱性 课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 289.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 08:56:29 | ||
图片预览







文档简介
(共21张PPT)
水的电离和溶液的酸碱性(二)
高中化学
学习任务与目标
1.认识溶液的酸碱性及pH, 学会检测溶液pH的方法
2.通过强酸 、 强碱的电离分析, 结合Kw, 利用pH与c(H+)
的换算公式, 能进行单 一 溶液pH的计算。
3.通过对强酸 、 强碱稀释过程的分析, 学会溶液稀释后pH
的计算。
1. 水的电离 H2O H+ + OH-
2. 水的离子积常数 Kw Kw = c(H+) ·c(OH-)
电离过程是吸热, 升高温度, Kw 将增大。
25℃时,Kw = 1×10- 14
同温下, 水中加酸加碱, 抑制水的电离。
25℃时, c(H+)水电离 = c(OH-)水电离 < 1×10-7 mol/L
酸溶液中, 水电离出的 H+相对酸很少, 通常可忽略。
高中化学
一、水的电离
温故知新
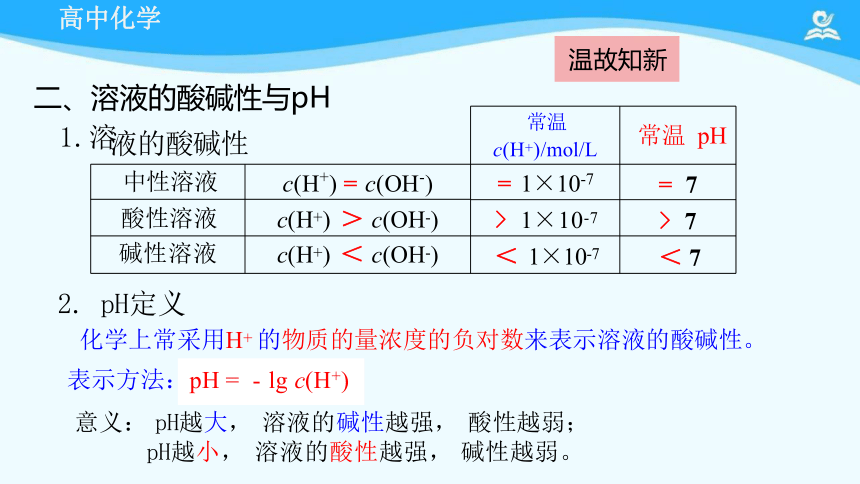
2. pH定义
化学上常采用H+ 的物质的量浓度的负对数来表示溶液的酸碱性。
表示方法:pH = - lg c(H+)
意义: pH越大, 溶液的碱性越强, 酸性越弱;
pH越小, 溶液的酸性越强, 碱性越弱。
液的酸碱性 常温 c(H+)/mol/L
常温 pH
中性溶液 c(H+) = c(OH-) = 1×10-7
= 7
酸性溶液 c(H+) > c(OH-) > 1×10-7
> 7
碱性溶液 c(H+) < c(OH-) < 1×10-7
< 7
温故知新
二、溶液的酸碱性与pH
1.溶
高中化学
高中化学
三、溶液酸碱性的测定方法
1.pH试纸
思考:
能否用广泛pH试纸测出pH=7.1来?
不估读
5.显色后 , 与比色卡 对比 , 读 出pH
4.把溶
液沾在
干燥的
试纸上
3.用洁净 干燥的玻 璃棒蘸取 试液
思考:
如用湿润的
pH试纸检验 待测液, 对 该溶液pH测 定有无影响?
2.放在
表面皿
上
1.撕下一
小截试纸
相当于稀释:
中性不变,
酸碱性偏向中性。
高中化学
高中化学
三、溶液酸碱性的测定方法
2.pH计
先用标准试剂校准;
精度高。
高中化学
四、 pH计算
1.单 一 溶液
(1 ) 酸溶液的pH计算
pH = -lgc(H+)
c(H+) pH
几元酸?
电离程度
c(酸)
高中化学
计算下列溶液的pH:
① 0.01 mol/L的盐酸
c(H+) = c(酸) = 0.01 mol/L pH = -lg 0.01 = -lg (1×10-2) = 2
② 0.05 mol/L的硫酸
c(H+) = n ·c(酸) = 2×0.05 = 0. 1 mol/L pH = 1
③ 0.01 mol/L的醋酸
HAc H+ + Ac-
c(H+) < c(酸) = 0.01 mol/L
思考:
1. 同浓度的盐酸和醋酸,
谁的pH大? 谁的酸性强?
2. 同pH的盐酸和醋酸, 谁的浓度大?
-lg c(H+) > -lg c(酸) = -lg 0.01 pH> 2
高中化学
四、 pH计算
1.单 一 溶液
(2 ) 碱溶液的pH计算
几元碱?
c(碱)
电离程度
Kw = c(H+) ·c(OH-)
pH = -lg c(H+)
c(H+) pH
温度相关
c(OH-)
高中化学
计算下列溶液的pH:
① 温1m下o,l/ . 1N L溶的 aOH溶液
c(OH-) = c(碱) = 0.01 mol/L
② 某温度下 Kw =1×10-13, 0.005 mol/L的Ba(OH)2 溶液 pH = 11
③ 常温下, 0.01 mol/L的氨水 pH < 12
思考: 1. 同浓度的NaOH溶液和氨水, 谁的pH大? 谁的碱性强?
2. 同pH的NaOH溶液和氨水, 谁的浓度大?
= 1 10 -12 mol / L pH = 12
K
w
c(OH - )
1 10 - 14
c(H + ) =
0 .01
=
高中化学
四、 pH计算
2.稀释问题
c(H+)稀 pH稀
酸溶液 稀释倍数
c(H+)原
pH原
思考:
常温稀释强酸的时候, pH最多无限接近7, 不能>7, 为什么?
② 常温下, 取1 mL 上述pH = 5 的盐酸再稀释1000倍
pH = 8pH ≈ 7碱性?!
高中化学
计算下列溶液稀释后的pH:
① 1 mL pH = 2 的盐酸稀释至1 L
c(H+)稀 = c(H+)原 · = 1×10-2 mol/L×10-3 pH = 5
稀
原
V
V
无限稀释时, c(H+)酸 ↓ c(H+)酸 ≈ c(H+)水 水电离出的H+ 不可忽略
c(H+)稀 · V稀 = c(H+)原 · V原
HAc H+ + Ac-
c(H+)稀 = [c(H+)原 +c(H+)新电离] · = (1×10-2 +x) mol/L×10-3
稀
原
V
V
高中化学
计算下列溶液稀释后的pH:
③ 1 mL pH = 2 的醋酸稀释至1 L
pH < 5 2<pH < 5
④ 取上述稀释后的醋酸, 再稀释1000倍 pH ≈ 7
无限稀释时, c(H+)酸 ↓ c(H+)酸 ≈ c(H+)水 水电离出的H+ 不可忽略
c(H+)稀 · V稀 = c(H+)原 · V原 + n(H+)新电离
高中化学
四、 pH计算
2.稀释问题
c(H+)稀 pH稀
酸溶液 稀释倍数
c(H+)原
碱溶液
pH原
高中化学
计算下列溶液稀释后的pH:
① 1 mL pH = 11 的NaOH溶液稀释至1 L
碱性增强?!
c(H+)稀 = c(H+)原 · = 1×10- 11 mol/L×10-3 pH = 14
稀
原
V
V
H2O H+ + OH-
稀释时, c(OH-) ↓ , 平衡右移 。 c(OH-) ↓ , c(H+) ↓ 。(勒夏特列)
碱溶液中, Δc(OH-)水电离相对与Δc(OH-)总 可忽略。
H+ 只来自水的电离, c(H+)原很小, Δc(H+)相对于c(H+)原 不可忽略。
思考:
稀释碱时, 为什么不能直接用c(H+)的变化来计算pH?
高中化学
四、 pH计算
2.稀释问题
温度相关
碱溶液
Kw
c(OH-)原
c(H+)稀
Kw
c(OH-)稀
c(H+)稀 pH稀
稀释倍数
酸溶液 稀释倍数
c(H+)原
稀释倍数
pH稀
pH原
c(H + )稀 = c( - ) = = 1 10-8 mol/L pH = 8
稀
OH
K w
c(OH-)稀 = c(OH-)原 · = 1×10-3 ×10-3 = 1×10-6 mol/L
稀
原
V
V
c(OH- )原 = c( = = 1 10-3 mol / L
原
11
14
-
-
10
10
1
1
H
K
常温下,计算下列溶液稀释后的pH:
① 1 mL pH = 11 的NaOH溶液稀释至1 L
② 取上述稀释后pH = 8 的NaOH溶液再稀释1000倍
c(OH-)稀 · V稀 = c(OH-)原 · V原
高中化学
高中化学
② 取上述稀释后pH = 8 的NaOH溶液再稀释1000倍 pH ≈ 7
③ 1 mL pH = 11 的氨水稀释至1 L c(OH-)稀 · V稀 = c(OH-)原 · V原 + n(OH-)新电离
8<pH < 11
④ 取上述稀释后的氨水再稀释1000倍 pH ≈ 7
思考:
常温稀释碱的时候, pH最多无限接近7, 不能<7, 为什么?
无限稀释时, c(OH-)碱 ↓ c(OH-)碱 ≈ c(OH-)水 水电离出的OH- 不可忽略
高中化学
二、溶液的酸碱性与pH
三、溶液酸碱性的测定方法
四、 pH计算
1.单 一 溶液
2.稀释问题
感谢同学们的收看, 祝同学们学习进步!
高中化学
水的电离和溶液的酸碱性(二)
高中化学
学习任务与目标
1.认识溶液的酸碱性及pH, 学会检测溶液pH的方法
2.通过强酸 、 强碱的电离分析, 结合Kw, 利用pH与c(H+)
的换算公式, 能进行单 一 溶液pH的计算。
3.通过对强酸 、 强碱稀释过程的分析, 学会溶液稀释后pH
的计算。
1. 水的电离 H2O H+ + OH-
2. 水的离子积常数 Kw Kw = c(H+) ·c(OH-)
电离过程是吸热, 升高温度, Kw 将增大。
25℃时,Kw = 1×10- 14
同温下, 水中加酸加碱, 抑制水的电离。
25℃时, c(H+)水电离 = c(OH-)水电离 < 1×10-7 mol/L
酸溶液中, 水电离出的 H+相对酸很少, 通常可忽略。
高中化学
一、水的电离
温故知新
2. pH定义
化学上常采用H+ 的物质的量浓度的负对数来表示溶液的酸碱性。
表示方法:pH = - lg c(H+)
意义: pH越大, 溶液的碱性越强, 酸性越弱;
pH越小, 溶液的酸性越强, 碱性越弱。
液的酸碱性 常温 c(H+)/mol/L
常温 pH
中性溶液 c(H+) = c(OH-) = 1×10-7
= 7
酸性溶液 c(H+) > c(OH-) > 1×10-7
> 7
碱性溶液 c(H+) < c(OH-) < 1×10-7
< 7
温故知新
二、溶液的酸碱性与pH
1.溶
高中化学
高中化学
三、溶液酸碱性的测定方法
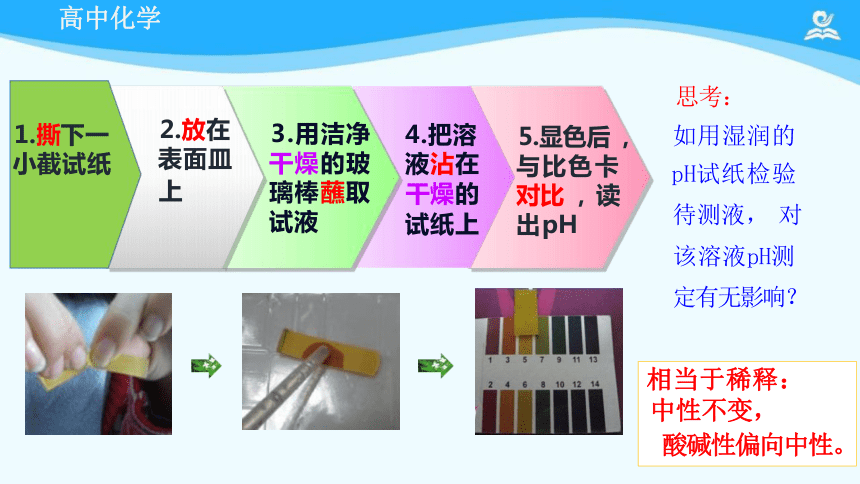
1.pH试纸
思考:
能否用广泛pH试纸测出pH=7.1来?
不估读
5.显色后 , 与比色卡 对比 , 读 出pH
4.把溶
液沾在
干燥的
试纸上
3.用洁净 干燥的玻 璃棒蘸取 试液
思考:
如用湿润的
pH试纸检验 待测液, 对 该溶液pH测 定有无影响?
2.放在
表面皿
上
1.撕下一
小截试纸
相当于稀释:
中性不变,
酸碱性偏向中性。
高中化学
高中化学
三、溶液酸碱性的测定方法
2.pH计
先用标准试剂校准;
精度高。
高中化学
四、 pH计算
1.单 一 溶液
(1 ) 酸溶液的pH计算
pH = -lgc(H+)
c(H+) pH
几元酸?
电离程度
c(酸)
高中化学
计算下列溶液的pH:
① 0.01 mol/L的盐酸
c(H+) = c(酸) = 0.01 mol/L pH = -lg 0.01 = -lg (1×10-2) = 2
② 0.05 mol/L的硫酸
c(H+) = n ·c(酸) = 2×0.05 = 0. 1 mol/L pH = 1
③ 0.01 mol/L的醋酸
HAc H+ + Ac-
c(H+) < c(酸) = 0.01 mol/L
思考:
1. 同浓度的盐酸和醋酸,
谁的pH大? 谁的酸性强?
2. 同pH的盐酸和醋酸, 谁的浓度大?
-lg c(H+) > -lg c(酸) = -lg 0.01 pH> 2
高中化学
四、 pH计算
1.单 一 溶液
(2 ) 碱溶液的pH计算
几元碱?
c(碱)
电离程度
Kw = c(H+) ·c(OH-)
pH = -lg c(H+)
c(H+) pH
温度相关
c(OH-)
高中化学
计算下列溶液的pH:
① 温1m下o,l/ . 1N L溶的 aOH溶液
c(OH-) = c(碱) = 0.01 mol/L
② 某温度下 Kw =1×10-13, 0.005 mol/L的Ba(OH)2 溶液 pH = 11
③ 常温下, 0.01 mol/L的氨水 pH < 12
思考: 1. 同浓度的NaOH溶液和氨水, 谁的pH大? 谁的碱性强?
2. 同pH的NaOH溶液和氨水, 谁的浓度大?
= 1 10 -12 mol / L pH = 12
K
w
c(OH - )
1 10 - 14
c(H + ) =
0 .01
=
高中化学
四、 pH计算
2.稀释问题
c(H+)稀 pH稀
酸溶液 稀释倍数
c(H+)原
pH原
思考:
常温稀释强酸的时候, pH最多无限接近7, 不能>7, 为什么?
② 常温下, 取1 mL 上述pH = 5 的盐酸再稀释1000倍
pH = 8pH ≈ 7碱性?!
高中化学
计算下列溶液稀释后的pH:
① 1 mL pH = 2 的盐酸稀释至1 L
c(H+)稀 = c(H+)原 · = 1×10-2 mol/L×10-3 pH = 5
稀
原
V
V
无限稀释时, c(H+)酸 ↓ c(H+)酸 ≈ c(H+)水 水电离出的H+ 不可忽略
c(H+)稀 · V稀 = c(H+)原 · V原
HAc H+ + Ac-
c(H+)稀 = [c(H+)原 +c(H+)新电离] · = (1×10-2 +x) mol/L×10-3
稀
原
V
V
高中化学
计算下列溶液稀释后的pH:
③ 1 mL pH = 2 的醋酸稀释至1 L
pH < 5 2<pH < 5
④ 取上述稀释后的醋酸, 再稀释1000倍 pH ≈ 7
无限稀释时, c(H+)酸 ↓ c(H+)酸 ≈ c(H+)水 水电离出的H+ 不可忽略
c(H+)稀 · V稀 = c(H+)原 · V原 + n(H+)新电离
高中化学
四、 pH计算
2.稀释问题
c(H+)稀 pH稀
酸溶液 稀释倍数
c(H+)原
碱溶液
pH原
高中化学
计算下列溶液稀释后的pH:
① 1 mL pH = 11 的NaOH溶液稀释至1 L
碱性增强?!
c(H+)稀 = c(H+)原 · = 1×10- 11 mol/L×10-3 pH = 14
稀
原
V
V
H2O H+ + OH-
稀释时, c(OH-) ↓ , 平衡右移 。 c(OH-) ↓ , c(H+) ↓ 。(勒夏特列)
碱溶液中, Δc(OH-)水电离相对与Δc(OH-)总 可忽略。
H+ 只来自水的电离, c(H+)原很小, Δc(H+)相对于c(H+)原 不可忽略。
思考:
稀释碱时, 为什么不能直接用c(H+)的变化来计算pH?
高中化学
四、 pH计算
2.稀释问题
温度相关
碱溶液
Kw
c(OH-)原
c(H+)稀
Kw
c(OH-)稀
c(H+)稀 pH稀
稀释倍数
酸溶液 稀释倍数
c(H+)原
稀释倍数
pH稀
pH原
c(H + )稀 = c( - ) = = 1 10-8 mol/L pH = 8
稀
OH
K w
c(OH-)稀 = c(OH-)原 · = 1×10-3 ×10-3 = 1×10-6 mol/L
稀
原
V
V
c(OH- )原 = c( = = 1 10-3 mol / L
原
11
14
-
-
10
10
1
1
H
K
常温下,计算下列溶液稀释后的pH:
① 1 mL pH = 11 的NaOH溶液稀释至1 L
② 取上述稀释后pH = 8 的NaOH溶液再稀释1000倍
c(OH-)稀 · V稀 = c(OH-)原 · V原
高中化学
高中化学
② 取上述稀释后pH = 8 的NaOH溶液再稀释1000倍 pH ≈ 7
③ 1 mL pH = 11 的氨水稀释至1 L c(OH-)稀 · V稀 = c(OH-)原 · V原 + n(OH-)新电离
8<pH < 11
④ 取上述稀释后的氨水再稀释1000倍 pH ≈ 7
思考:
常温稀释碱的时候, pH最多无限接近7, 不能<7, 为什么?
无限稀释时, c(OH-)碱 ↓ c(OH-)碱 ≈ c(OH-)水 水电离出的OH- 不可忽略
高中化学
二、溶液的酸碱性与pH
三、溶液酸碱性的测定方法
四、 pH计算
1.单 一 溶液
2.稀释问题
感谢同学们的收看, 祝同学们学习进步!
高中化学
