3.2 水的电离和溶液的酸碱性 课件(共25张PPT)
文档属性
| 名称 | 3.2 水的电离和溶液的酸碱性 课件(共25张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 08:57:23 | ||
图片预览







文档简介
(共25张PPT)
水的电离和溶液的酸碱性(二)
学习目标与任务
(1) 能够准确地应用勒夏特列原理分析外界条件对水电离平衡移 动的影响, 能够通过比较c(H+)和c(OH-) 两者的关系, 快速判断溶 液的酸碱性。
(2) 能够利用电离平衡常数, 自我构建水的离子积常数, 并能初步 应用水的离子积常数进行简单计算。
(3) 通过水的电离平衡问题讨论, 加深从平衡角度对水的认识 , 进 一 步发展利用推理和演绎的方法对信息进行加工从而获得结论 的能力。
写出下列物质在水溶液中的电离方程式:
H2SO4 = 2H+ + SO42-
NaOH = Na+ + OH-
H2CO3 H+ + HCO3-
HCO3- H+ + CO32-
NH3 ·H2O NH4+ + OH-
NaHSO4 = Na+ + H+ + SO42-
温故知新
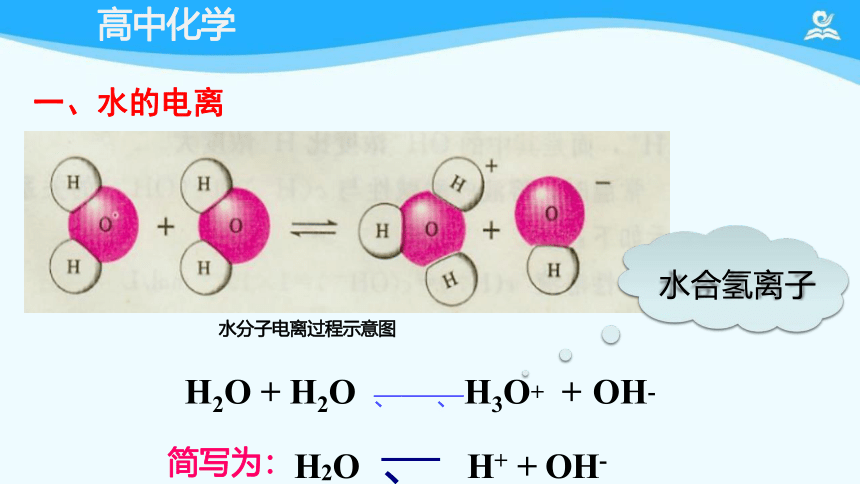
水分子电离过程示意图
H2O + H2O 、 、H3O+ + OH-
简写为:H2O 、 H+ + OH-
水合氢离子
高中化学
一、水的电离
H2O 、 、 H+ + OH-
● 纯水中有哪些微粒
H2O H+ OH-
● 纯水中电离出的H+ 与OH- 物质的量浓度大小有何关系
两者的物质的量浓度相等。
结论 c(H+)水电离=c(OH-)水电离
条件变化 移动方向 c(H+)
c(OH-)
升高温度 正向 增大
增大
向水中加酸加 碱都会 制水
的电离
向水中加盐有可能抑制水的电离, 也
有可能不影响水的电离
水的电离的影响因素
H2O H+ + OH-
H>0
抑
25水℃ 5一.6 o极l纯弱水的中 1解×质10 7 ol水的 离电。
25℃, 水电离的 c(H+)= c(OH-) =1×10-7mol/L
25℃时, KW = = 1×10-14
高中化学
二、水的离子积常数Kw
c(H+) c(OH)
电离 =
K 电离 · c(H2O) = (H) · (OH
c(H2O)
H2O H+ + OH-
KW = K 电离 · c(H2O)
KW =
Kw
常数
= c
K
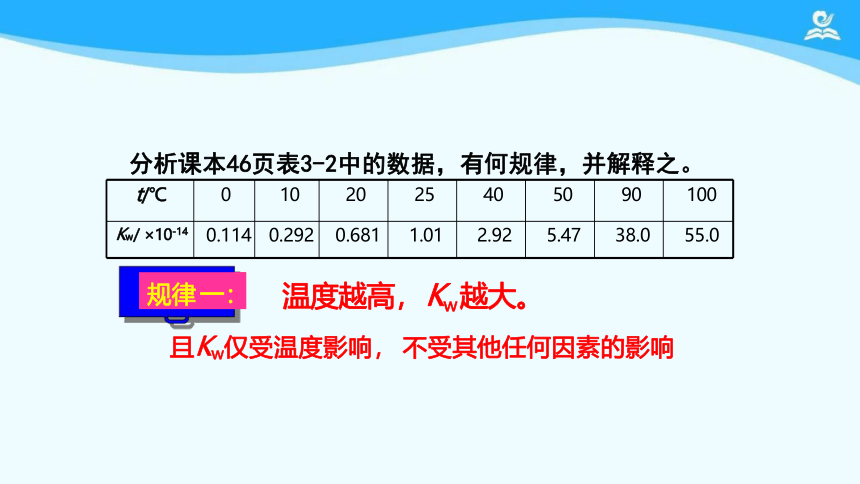
t/℃ 0 10 20 25 40 50 90
100
Kw/ ×10-14 0.114 0.292 0.681 1.01 2.92 5.47 38.0
55.0
规律 一: 温度越高, Kw 越大。
且Kw仅受温度影响, 不受其他任何因素的影响
分析课本46页表3-2中的数据,有何规律,并解释之。
1. 25 ℃时,在水中加入强酸(HCl)后,水的离子积是否发生改变?
2. 25 ℃时,在水中加入强碱(NaOH)后,水的离子积是否发生改变?
KW = c(H+)总 ·c(OH-)总 = 1×10-14
探究一
H2O H+ + OH-
高中化学
c(OH-)总
c(H+)总
高中化学
KW = K 电离 · c(H2O) = c(H+) c·(cO( H-)-)总
规律 一: 温度越高, Kw 越大。
且Kw仅受温度影响, 不受其他任何因素的影响
总
·
Kw = c(H+)总 · c(OH-)总 不仅适于纯水,
也适于任何酸碱盐稀溶液。
任何水溶液中都存在H+ 、 OH-,
因为都存在水的电离平衡
规律二:
规律三:
c水 (H+) = c水 (OH-)
2.25 ℃时,0.01mol/L的盐酸中,水电离出来的c(H+)和酸电离 出来的c(H+)有什么大小关系? 相差很大
1.在酸或碱的溶液中,
水电离出来的c(H+)和c(OH-)是否相等?
水的电离 c酸 (H+) = 0.01mol/L
为何不受影响?
◆
(H+)= 1×10-7 mol/L
(H+)= 0.01mol/L
酸抑制 c水 (H+)<1×10-7 mol/L
探究二
假定二者
互不影响
高中化学
弱电解质
H+ + OH-
相等
c水
c酸
H2O
其H+ 来源于 , c(H+)总 = ; 其OH- 来源于 , c(OH-)总= 。
由水电离出的c水(H+) = ,
c水(OH-)= 。
4. 25 ℃时, 在 0.01 mol/L NaOH溶液中,
由水电离出的c水(H+) = ,
c水(OH-)= 。
3. 25 ℃时, 在 0.01 mol/L 盐酸溶液中:
探究三
HCl H+ + Cl-
c酸(H+) = 0.01 mol/L
H2O H+ + OH-
c水(H+) = c水(OH-) = x
其H+ 来源于 HCl与H2O的电离 ,c(H+)总 = ;
c(H+)总 = c酸(H+) + c水(H+) = 0.01 + x
3. 25 ℃时, 在 0.01 mol/L 盐酸溶液中:
探究三
设为 x
c(H+)总 = c酸(H+) + c水(H+) = 0.01 + x
c(OH-)总 = c水(OH-) = x
Kw = c(H+)总 · c(OH-)总 = 1×10-14
(0.01+x) ·x = 1×10-14
0.01 ·x ≈ 1×10-14 x ≈ 1×10-12
其H+ 来源于 HCl与H2O的电离 ,c(H+)总 = c酸(H+) + c水(H+) ≈ 0.01 mol/L ;
x 相对于0.01很小, ∴ 0.01 + x ≈ 0.01
x 确实很小, 合理忽略
3. 25℃时, 在 0.01 mol/L 盐酸溶液中:
探究三
代入
探究三
其H+ 来源于 HCl与H2O的电离 ,c(H+)总 = 0.01 mol/L ;
其OH- 来源于H2O的电离, c(OH-)总= 1×10-12 mol/L 。
3. 25℃时, 在 0.01mol/L 盐酸溶液中: 水电(H+)
计
c
不
的
略
出
忽
离
c(OH-)总 = Kw ÷ c(H+)总 = 1×10-14 ÷ 0.01 = 1×10-12 mol/L
Kw = c(H+)总 · c(OH-)总 = 1×10-14
探究三
其H+ 来源于 HCl与H2O的电离 ,c(H+)总 = 0.01 mol/L ;
其OH- 来源于H2O的电离, c(OH-)总= 1×10-12 mol/L 。
由 水 电离出的 c水(H+ ) = c(OH-)总 = 1×10-12 mol/L , c水(OH- )= c(OH-)总 = 1×10-12 mol/L 。
H2O H+ + OH-
c水(H+) = c水(OH-)
3. 25℃时, 在 0.01 mol/L 盐酸溶液中: 水电(H+)
计
c
不
的
略
出
忽
离
探究三
其H+ 来源于 HCl与H2O的电离 ,c(H+)总 = 0.01 mol/L ;
其OH- 来源于H2O的电离, c(OH-)总= 1×10-12 mol/L 。
由 水 电离出的 c水(H+ ) = c(OH-)总 = 1×10-12 mol/L , c水(OH- )= c(OH-)总 = 1×10-12 mol/L 。
4. 25 ℃时, 在 0.01 mol/L NaOH溶液中,
由水电离出的 c水(H+ ) = ,
c水(OH-)= 。
3. 25 ℃时, 在 0.01 mol/L 盐酸溶液中: 水电(H+)
计
c
不
的
略
出
忽
离
探究三
其H+ 来源于 HCl与H2O的电离 ,c(H+)总 = 0.01 mol/L ;
其OH- 来源于H2O的电离, c(OH-)总= 1×10-12 mol/L 。
由 水 电离出的 c水(H+) = 1×10-12 mol/ c水(OH-)= 1×10-12 mol/L。
4. 25℃时, 在 0.01 mol/L NaOH溶液中,
由 水 电离出的 c水(H+) = 1×10-12 mol/L, c水(OH-)= 1×10-12 mo /L
3. 25 ℃时, 在 0.01mol/L 盐酸溶液中: 水电(H+)
计
c
不
的
略
出
忽
离
含等浓度H+ 的酸
和
含等浓度OH- 的碱
对水电离的抑制 程度是相同的!
练习
25 ℃时, 浓度均为0.1 mol/L的下列溶液中由水电离的
含等浓度H+ 的酸
和
含浓度OH- 的碱
对水电离的抑制 程度是相同的!
c1(OH-) = 0.2mol/L c2(H+) = 0.1mol/L c3(H+) < 0.1mol/L
① Ba(OH)2
② 盐酸
③ 醋酸
c(H+)由大到小顺序:
③> ② > ①
探究三
5. 25 ℃时,某溶液中由水 电离出的c水 (H+)=1×10-12 mol/L, 则该溶液是酸溶液还是碱溶液?
求出该溶液中的c(H+)总是多少?
答: 可能是酸溶液 、 也可能是碱溶液。
若是酸溶液:c(H+)总 = c水(H+) + c酸(H+) ?
c(OH-)总 = c水(OH-) = c水(H+) = 1×10-12 mol/L
c(H+)总 = Kw ÷ c(OH-)总 = 1×10-14 ÷ 1×10-12 = 0.01 mol/L
若是碱溶液: c(H+)总 = c水(H+)= 1×10-12 mol/L
25℃时,
KW = c(H* c(OH = 1×10-14
当 c(H+)= 1×10-6 mol/L时,
此溶液一定是酸性溶液吗?
判断溶液酸碱性的依据是什么?
探究四
溶液的酸碱性 c(H+)与c(OH-)的关系 常温下:c(H+)
常温下pH
中性溶液 c(H+)=c(OH-) c(H+) =1×10-7mol/L
=7
酸性溶液 c(H+) >c(OH-) c(H+) >1×10-7mol/L
<7
碱性溶液 c(H+) <c(OH-) c(H+) <1×10-7mol/L
>7
pH = - lg c(H+)
Kw = c(H+)总 · c(OH-)总 = 1×10-14
三、溶液酸碱性的判断方法
pH=7溶液是否 一 定为中性?
不 一 定 。 只有常温下pH=7的溶液
才显中性, 100 ℃时pH=7的溶液 显碱性。
100 ℃时Kw= c(H+) ·c(OH- )= 1×10-12 ,
纯水的pH是多少?呈酸性、中性还是碱性?
pH = - lg c(H+) = - lg 1×10-6
拓展延伸
中性
=6
本节小结
高中化学
H+ + OH-
H2O
谢谢同学们的收看! 祝同学们学业进步!
水的电离和溶液的酸碱性(二)
学习目标与任务
(1) 能够准确地应用勒夏特列原理分析外界条件对水电离平衡移 动的影响, 能够通过比较c(H+)和c(OH-) 两者的关系, 快速判断溶 液的酸碱性。
(2) 能够利用电离平衡常数, 自我构建水的离子积常数, 并能初步 应用水的离子积常数进行简单计算。
(3) 通过水的电离平衡问题讨论, 加深从平衡角度对水的认识 , 进 一 步发展利用推理和演绎的方法对信息进行加工从而获得结论 的能力。
写出下列物质在水溶液中的电离方程式:
H2SO4 = 2H+ + SO42-
NaOH = Na+ + OH-
H2CO3 H+ + HCO3-
HCO3- H+ + CO32-
NH3 ·H2O NH4+ + OH-
NaHSO4 = Na+ + H+ + SO42-
温故知新
水分子电离过程示意图
H2O + H2O 、 、H3O+ + OH-
简写为:H2O 、 H+ + OH-
水合氢离子
高中化学
一、水的电离
H2O 、 、 H+ + OH-
● 纯水中有哪些微粒
H2O H+ OH-
● 纯水中电离出的H+ 与OH- 物质的量浓度大小有何关系
两者的物质的量浓度相等。
结论 c(H+)水电离=c(OH-)水电离
条件变化 移动方向 c(H+)
c(OH-)
升高温度 正向 增大
增大
向水中加酸加 碱都会 制水
的电离
向水中加盐有可能抑制水的电离, 也
有可能不影响水的电离
水的电离的影响因素
H2O H+ + OH-
H>0
抑
25水℃ 5一.6 o极l纯弱水的中 1解×质10 7 ol水的 离电。
25℃, 水电离的 c(H+)= c(OH-) =1×10-7mol/L
25℃时, KW = = 1×10-14
高中化学
二、水的离子积常数Kw
c(H+) c(OH)
电离 =
K 电离 · c(H2O) = (H) · (OH
c(H2O)
H2O H+ + OH-
KW = K 电离 · c(H2O)
KW =
Kw
常数
= c
K
t/℃ 0 10 20 25 40 50 90
100
Kw/ ×10-14 0.114 0.292 0.681 1.01 2.92 5.47 38.0
55.0
规律 一: 温度越高, Kw 越大。
且Kw仅受温度影响, 不受其他任何因素的影响
分析课本46页表3-2中的数据,有何规律,并解释之。
1. 25 ℃时,在水中加入强酸(HCl)后,水的离子积是否发生改变?
2. 25 ℃时,在水中加入强碱(NaOH)后,水的离子积是否发生改变?
KW = c(H+)总 ·c(OH-)总 = 1×10-14
探究一
H2O H+ + OH-
高中化学
c(OH-)总
c(H+)总
高中化学
KW = K 电离 · c(H2O) = c(H+) c·(cO( H-)-)总
规律 一: 温度越高, Kw 越大。
且Kw仅受温度影响, 不受其他任何因素的影响
总
·
Kw = c(H+)总 · c(OH-)总 不仅适于纯水,
也适于任何酸碱盐稀溶液。
任何水溶液中都存在H+ 、 OH-,
因为都存在水的电离平衡
规律二:
规律三:
c水 (H+) = c水 (OH-)
2.25 ℃时,0.01mol/L的盐酸中,水电离出来的c(H+)和酸电离 出来的c(H+)有什么大小关系? 相差很大
1.在酸或碱的溶液中,
水电离出来的c(H+)和c(OH-)是否相等?
水的电离 c酸 (H+) = 0.01mol/L
为何不受影响?
◆
(H+)= 1×10-7 mol/L
(H+)= 0.01mol/L
酸抑制 c水 (H+)<1×10-7 mol/L
探究二
假定二者
互不影响
高中化学
弱电解质
H+ + OH-
相等
c水
c酸
H2O
其H+ 来源于 , c(H+)总 = ; 其OH- 来源于 , c(OH-)总= 。
由水电离出的c水(H+) = ,
c水(OH-)= 。
4. 25 ℃时, 在 0.01 mol/L NaOH溶液中,
由水电离出的c水(H+) = ,
c水(OH-)= 。
3. 25 ℃时, 在 0.01 mol/L 盐酸溶液中:
探究三
HCl H+ + Cl-
c酸(H+) = 0.01 mol/L
H2O H+ + OH-
c水(H+) = c水(OH-) = x
其H+ 来源于 HCl与H2O的电离 ,c(H+)总 = ;
c(H+)总 = c酸(H+) + c水(H+) = 0.01 + x
3. 25 ℃时, 在 0.01 mol/L 盐酸溶液中:
探究三
设为 x
c(H+)总 = c酸(H+) + c水(H+) = 0.01 + x
c(OH-)总 = c水(OH-) = x
Kw = c(H+)总 · c(OH-)总 = 1×10-14
(0.01+x) ·x = 1×10-14
0.01 ·x ≈ 1×10-14 x ≈ 1×10-12
其H+ 来源于 HCl与H2O的电离 ,c(H+)总 = c酸(H+) + c水(H+) ≈ 0.01 mol/L ;
x 相对于0.01很小, ∴ 0.01 + x ≈ 0.01
x 确实很小, 合理忽略
3. 25℃时, 在 0.01 mol/L 盐酸溶液中:
探究三
代入
探究三
其H+ 来源于 HCl与H2O的电离 ,c(H+)总 = 0.01 mol/L ;
其OH- 来源于H2O的电离, c(OH-)总= 1×10-12 mol/L 。
3. 25℃时, 在 0.01mol/L 盐酸溶液中: 水电(H+)
计
c
不
的
略
出
忽
离
c(OH-)总 = Kw ÷ c(H+)总 = 1×10-14 ÷ 0.01 = 1×10-12 mol/L
Kw = c(H+)总 · c(OH-)总 = 1×10-14
探究三
其H+ 来源于 HCl与H2O的电离 ,c(H+)总 = 0.01 mol/L ;
其OH- 来源于H2O的电离, c(OH-)总= 1×10-12 mol/L 。
由 水 电离出的 c水(H+ ) = c(OH-)总 = 1×10-12 mol/L , c水(OH- )= c(OH-)总 = 1×10-12 mol/L 。
H2O H+ + OH-
c水(H+) = c水(OH-)
3. 25℃时, 在 0.01 mol/L 盐酸溶液中: 水电(H+)
计
c
不
的
略
出
忽
离
探究三
其H+ 来源于 HCl与H2O的电离 ,c(H+)总 = 0.01 mol/L ;
其OH- 来源于H2O的电离, c(OH-)总= 1×10-12 mol/L 。
由 水 电离出的 c水(H+ ) = c(OH-)总 = 1×10-12 mol/L , c水(OH- )= c(OH-)总 = 1×10-12 mol/L 。
4. 25 ℃时, 在 0.01 mol/L NaOH溶液中,
由水电离出的 c水(H+ ) = ,
c水(OH-)= 。
3. 25 ℃时, 在 0.01 mol/L 盐酸溶液中: 水电(H+)
计
c
不
的
略
出
忽
离
探究三
其H+ 来源于 HCl与H2O的电离 ,c(H+)总 = 0.01 mol/L ;
其OH- 来源于H2O的电离, c(OH-)总= 1×10-12 mol/L 。
由 水 电离出的 c水(H+) = 1×10-12 mol/ c水(OH-)= 1×10-12 mol/L。
4. 25℃时, 在 0.01 mol/L NaOH溶液中,
由 水 电离出的 c水(H+) = 1×10-12 mol/L, c水(OH-)= 1×10-12 mo /L
3. 25 ℃时, 在 0.01mol/L 盐酸溶液中: 水电(H+)
计
c
不
的
略
出
忽
离
含等浓度H+ 的酸
和
含等浓度OH- 的碱
对水电离的抑制 程度是相同的!
练习
25 ℃时, 浓度均为0.1 mol/L的下列溶液中由水电离的
含等浓度H+ 的酸
和
含浓度OH- 的碱
对水电离的抑制 程度是相同的!
c1(OH-) = 0.2mol/L c2(H+) = 0.1mol/L c3(H+) < 0.1mol/L
① Ba(OH)2
② 盐酸
③ 醋酸
c(H+)由大到小顺序:
③> ② > ①
探究三
5. 25 ℃时,某溶液中由水 电离出的c水 (H+)=1×10-12 mol/L, 则该溶液是酸溶液还是碱溶液?
求出该溶液中的c(H+)总是多少?
答: 可能是酸溶液 、 也可能是碱溶液。
若是酸溶液:c(H+)总 = c水(H+) + c酸(H+) ?
c(OH-)总 = c水(OH-) = c水(H+) = 1×10-12 mol/L
c(H+)总 = Kw ÷ c(OH-)总 = 1×10-14 ÷ 1×10-12 = 0.01 mol/L
若是碱溶液: c(H+)总 = c水(H+)= 1×10-12 mol/L
25℃时,
KW = c(H* c(OH = 1×10-14
当 c(H+)= 1×10-6 mol/L时,
此溶液一定是酸性溶液吗?
判断溶液酸碱性的依据是什么?
探究四
溶液的酸碱性 c(H+)与c(OH-)的关系 常温下:c(H+)
常温下pH
中性溶液 c(H+)=c(OH-) c(H+) =1×10-7mol/L
=7
酸性溶液 c(H+) >c(OH-) c(H+) >1×10-7mol/L
<7
碱性溶液 c(H+) <c(OH-) c(H+) <1×10-7mol/L
>7
pH = - lg c(H+)
Kw = c(H+)总 · c(OH-)总 = 1×10-14
三、溶液酸碱性的判断方法
pH=7溶液是否 一 定为中性?
不 一 定 。 只有常温下pH=7的溶液
才显中性, 100 ℃时pH=7的溶液 显碱性。
100 ℃时Kw= c(H+) ·c(OH- )= 1×10-12 ,
纯水的pH是多少?呈酸性、中性还是碱性?
pH = - lg c(H+) = - lg 1×10-6
拓展延伸
中性
=6
本节小结
高中化学
H+ + OH-
H2O
谢谢同学们的收看! 祝同学们学业进步!
