4.2 电解池 课件(共17张PPT)
文档属性
| 名称 | 4.2 电解池 课件(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 333.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 08:58:07 | ||
图片预览





文档简介
(共17张PPT)
电解池(第2课时)
高中化学
学习目标
(1 ) 通过对电解氯化钠溶液的实验观察, 提升证据意识及分
析能力, 加深对电解原理的认识;
(2 ) 通过对不同电极电解氯化钠溶液产物的不同, 建立非惰
性电极的认知模型;
(3 ) 通过氯碱工业和家用消毒液制备的了解, 认识化学对社
会发展的重大贡献。
高中化学
知识回顾
惰性电极电解氯化铜溶液、 硝酸银溶液产物分析
放电顺序: 阳极: Cl->OH->含氧酸根 离子 阴极: Ag+ > Cu2+>H+ >Na+
( 还原性)
(氧化性)
CuCl2 通电 Cu + Cl2 ↑
4Ag + O2 ↑+ 4HNO3
4AgNO3 + 2H2O
通电
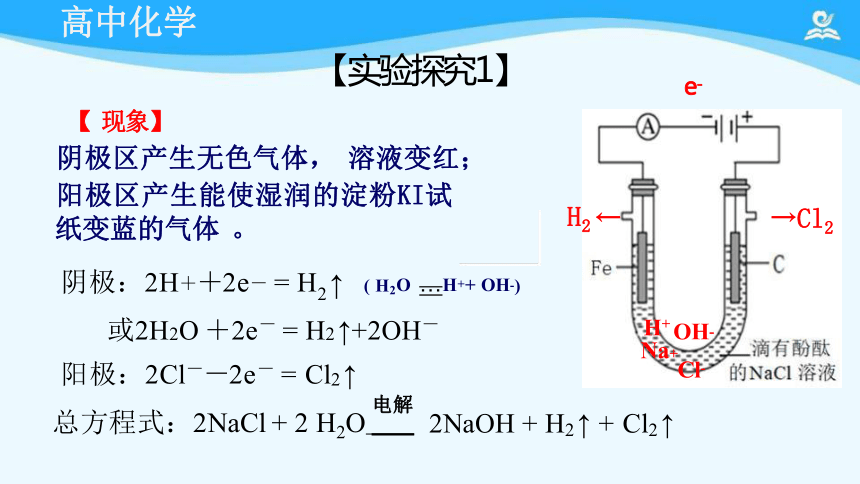
【 现象】
阴极区产生无色气体, 溶液变红;
阳极区产生能使湿润的淀粉KI试
纸变蓝的气体 。
阴极:2H++2e- = H2 ↑ ( H2O …H++ OH-)
高中化学
【实验探究1】
阳极:2Cl--2e- = Cl2 ↑
总方程式:2NaCl + 2 H2O 电解
Na+
Cl-
2NaOH + H2 ↑ + Cl2 ↑
或2H2O +2e- = H2 ↑+2OH- H+ OH-
H2 ← →Cl2
e-
【现象】
电源反接后, 铁钉表面没有气泡; 铁钉附近溶 液红色逐渐变浅, 溶液中产生近白色絮状物且逐 渐沉入U型管的底部, 后来絮状物的颜色中会夹杂 有浅绿和黄色, 长时间放置后颜色逐渐加深。
【 思考】
在实验1进行 一段时间后, 将铁钉改 为与电源的正极连接 、 碳棒连接电源的 负极, 将会出现什么现象呢?
高中化学
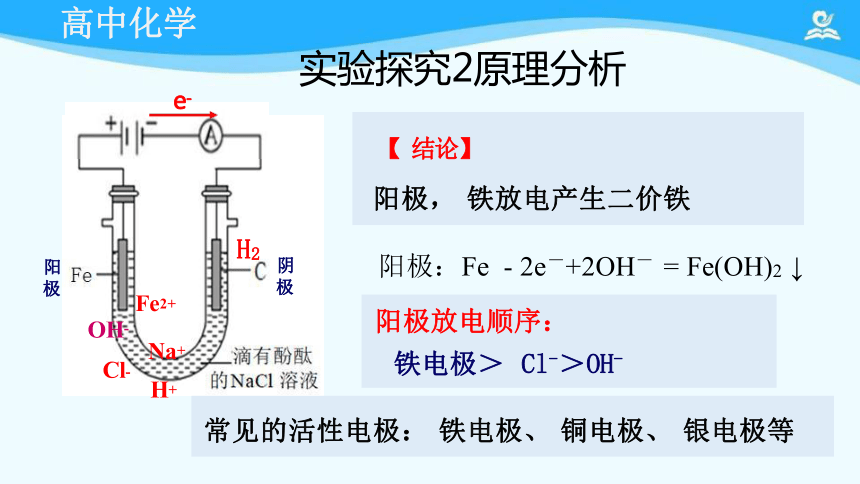
【实验探究2】
阴 极
OH-
Na+
Cl-
H+
阳极:Fe - 2e-+2OH- = Fe(OH)2 ↓
阳极放电顺序:
铁电极> Cl->OH-
高中化学
实验探究2原理分析
e-
【 结论】
阳极, 铁放电产生二价铁
常见的活性电极: 铁电极、 铜电极、 银电极等
H2
Fe2+
阳 极
实验分析
例1. 某小组同学用9V的电压, 用铜做阳极电解2 mol/L 的 H2SO4 溶液。
(1)很快就观察到C电极上产生大量气泡 ,铜电极逐渐变 暗, 5min后铜电极附近溶液颜色开始变蓝且颜色逐渐加
深 。 试用电极方程式解释溶液变蓝的原因:
阳极:Cu - 2e-= Cu2+
(2)2h后 ,C电极上不再产生气泡且有红色物质附着, 试
解释整个过程中阴极现象不同的原因:
阴极:①2H++2e- = H2 ↑ ②Cu2++ 2e-= Cu
氧化性:Cu2+>H+
H2
Cu2+
高中化学
能力提升
例2. 某小组同学用9V的电压, 用铜做阳 极电解2 mol/L氯化钠溶液。
实验开始后, 观察到铜电极逐渐变暗,
10min后阳极附近溶液中有白色沉淀析出 , 经检验该白色物质为CuCl(难溶) 。 试用电极 方程式解释CuCl的形成原因:
阳极:Cu - e-+ Cl- = CuCl ↓
高中化学
①看电源—确定电子流动方向
②看两极材料—确定电极是否参与反应
③看溶液中的离子—确定何种离子放电
电解池的分析思路
④关注溶液环境—确定其它反应
高中化学
阴极
极
阳
e-
e-
高中化学 【实验探究3】
用1.5V的电压, 用铁做电极电解饱和氯化钠溶液, 试用电解原理
解释产生现象的可能原因:
【 结论】
①阳极铁放电产生二价铁, 阴极被保护;
②氧化产物的存在形式和变化与环境有关。
阳极 :Fe - 2e- = Fe2+
阴极:2H2O +2e- = H2 ↑+2OH-
溶液中 :Fe2+ +2OH- = Fe(OH)2 ↓
连接电源后的0时刻
5分钟后的铁钉
10秒钟
5分钟
2分钟
且较长时间不变色
总反应式:Fe + 2 H2O 电解2Fe(OH) 2 + H2 ↑
【对比】 用以下装置制备氢氧化亚铁的优劣:
氢氧化亚铁的制备
图3
溶液中产生白色沉淀,
高中化学
图2
图1
【对比 】利用以下装置制备氢气、 氯气和烧碱的优劣: 2NaCl + 2 H2O 电解 2NaOH + H2 ↑ + Cl2 ↑
【思考】工业上如何完成三种物质的制备呢?
H 和Cl 难以 收集, 且二者相遇会 发生反应; 产物NaOH和Cl2接触会 反应生成NaClO和NaCl。
H 和Cl 可以收集。
NaOH和Cl2依然会因接触而反应。
方案讨论
高中化学
H2
图1
Cl2
OH-
图2
阳离子交换膜
H2O(含少量NaOH)
Cl — H2O H Na+ OH —
+
阳 极 金属钛网
阴 极 碳钢网
氯碱工业
高中化学
NaCl溶液
阳极室
NaOH溶液
精制饱和
淡盐水
极 室
Cl2
阴
-
H2
+
高中化学
二、 电解原理的应用
1、 氯碱工业
【任务】
请在右图相应位置分别标示出两个
进料 口和四个产品出 口 的对应物质;
请在离子交换膜上标示出离子的迁
移方向。
【 思考】你认为该电解槽最核心的部件是什么? 其价值是什么?
利用电解氯化钠溶液的原理, 设计 一 个简易装 置直接制备有效成分为NaClO的家用84消毒液。
Fe
Cl2
C
高中化学
【任务】
能力提升
工业上通过控制阳极区溶液的
pH在9~10之间, 可以直接制得NaClO 为有效成分的家用84消毒液, 试写出 阳极的电极方程式:
阳极:Cl- - 2e-+ 2OH- = ClO- + H2O
OH—
高中化学
原理分析
谢谢同学们的收看!
祝同学们学业进步!
高中化学
电解池(第2课时)
高中化学
学习目标
(1 ) 通过对电解氯化钠溶液的实验观察, 提升证据意识及分
析能力, 加深对电解原理的认识;
(2 ) 通过对不同电极电解氯化钠溶液产物的不同, 建立非惰
性电极的认知模型;
(3 ) 通过氯碱工业和家用消毒液制备的了解, 认识化学对社
会发展的重大贡献。
高中化学
知识回顾
惰性电极电解氯化铜溶液、 硝酸银溶液产物分析
放电顺序: 阳极: Cl->OH->含氧酸根 离子 阴极: Ag+ > Cu2+>H+ >Na+
( 还原性)
(氧化性)
CuCl2 通电 Cu + Cl2 ↑
4Ag + O2 ↑+ 4HNO3
4AgNO3 + 2H2O
通电
【 现象】
阴极区产生无色气体, 溶液变红;
阳极区产生能使湿润的淀粉KI试
纸变蓝的气体 。
阴极:2H++2e- = H2 ↑ ( H2O …H++ OH-)
高中化学
【实验探究1】
阳极:2Cl--2e- = Cl2 ↑
总方程式:2NaCl + 2 H2O 电解
Na+
Cl-
2NaOH + H2 ↑ + Cl2 ↑
或2H2O +2e- = H2 ↑+2OH- H+ OH-
H2 ← →Cl2
e-
【现象】
电源反接后, 铁钉表面没有气泡; 铁钉附近溶 液红色逐渐变浅, 溶液中产生近白色絮状物且逐 渐沉入U型管的底部, 后来絮状物的颜色中会夹杂 有浅绿和黄色, 长时间放置后颜色逐渐加深。
【 思考】
在实验1进行 一段时间后, 将铁钉改 为与电源的正极连接 、 碳棒连接电源的 负极, 将会出现什么现象呢?
高中化学
【实验探究2】
阴 极
OH-
Na+
Cl-
H+
阳极:Fe - 2e-+2OH- = Fe(OH)2 ↓
阳极放电顺序:
铁电极> Cl->OH-
高中化学
实验探究2原理分析
e-
【 结论】
阳极, 铁放电产生二价铁
常见的活性电极: 铁电极、 铜电极、 银电极等
H2
Fe2+
阳 极
实验分析
例1. 某小组同学用9V的电压, 用铜做阳极电解2 mol/L 的 H2SO4 溶液。
(1)很快就观察到C电极上产生大量气泡 ,铜电极逐渐变 暗, 5min后铜电极附近溶液颜色开始变蓝且颜色逐渐加
深 。 试用电极方程式解释溶液变蓝的原因:
阳极:Cu - 2e-= Cu2+
(2)2h后 ,C电极上不再产生气泡且有红色物质附着, 试
解释整个过程中阴极现象不同的原因:
阴极:①2H++2e- = H2 ↑ ②Cu2++ 2e-= Cu
氧化性:Cu2+>H+
H2
Cu2+
高中化学
能力提升
例2. 某小组同学用9V的电压, 用铜做阳 极电解2 mol/L氯化钠溶液。
实验开始后, 观察到铜电极逐渐变暗,
10min后阳极附近溶液中有白色沉淀析出 , 经检验该白色物质为CuCl(难溶) 。 试用电极 方程式解释CuCl的形成原因:
阳极:Cu - e-+ Cl- = CuCl ↓
高中化学
①看电源—确定电子流动方向
②看两极材料—确定电极是否参与反应
③看溶液中的离子—确定何种离子放电
电解池的分析思路
④关注溶液环境—确定其它反应
高中化学
阴极
极
阳
e-
e-
高中化学 【实验探究3】
用1.5V的电压, 用铁做电极电解饱和氯化钠溶液, 试用电解原理
解释产生现象的可能原因:
【 结论】
①阳极铁放电产生二价铁, 阴极被保护;
②氧化产物的存在形式和变化与环境有关。
阳极 :Fe - 2e- = Fe2+
阴极:2H2O +2e- = H2 ↑+2OH-
溶液中 :Fe2+ +2OH- = Fe(OH)2 ↓
连接电源后的0时刻
5分钟后的铁钉
10秒钟
5分钟
2分钟
且较长时间不变色
总反应式:Fe + 2 H2O 电解2Fe(OH) 2 + H2 ↑
【对比】 用以下装置制备氢氧化亚铁的优劣:
氢氧化亚铁的制备
图3
溶液中产生白色沉淀,
高中化学
图2
图1
【对比 】利用以下装置制备氢气、 氯气和烧碱的优劣: 2NaCl + 2 H2O 电解 2NaOH + H2 ↑ + Cl2 ↑
【思考】工业上如何完成三种物质的制备呢?
H 和Cl 难以 收集, 且二者相遇会 发生反应; 产物NaOH和Cl2接触会 反应生成NaClO和NaCl。
H 和Cl 可以收集。
NaOH和Cl2依然会因接触而反应。
方案讨论
高中化学
H2
图1
Cl2
OH-
图2
阳离子交换膜
H2O(含少量NaOH)
Cl — H2O H Na+ OH —
+
阳 极 金属钛网
阴 极 碳钢网
氯碱工业
高中化学
NaCl溶液
阳极室
NaOH溶液
精制饱和
淡盐水
极 室
Cl2
阴
-
H2
+
高中化学
二、 电解原理的应用
1、 氯碱工业
【任务】
请在右图相应位置分别标示出两个
进料 口和四个产品出 口 的对应物质;
请在离子交换膜上标示出离子的迁
移方向。
【 思考】你认为该电解槽最核心的部件是什么? 其价值是什么?
利用电解氯化钠溶液的原理, 设计 一 个简易装 置直接制备有效成分为NaClO的家用84消毒液。
Fe
Cl2
C
高中化学
【任务】
能力提升
工业上通过控制阳极区溶液的
pH在9~10之间, 可以直接制得NaClO 为有效成分的家用84消毒液, 试写出 阳极的电极方程式:
阳极:Cl- - 2e-+ 2OH- = ClO- + H2O
OH—
高中化学
原理分析
谢谢同学们的收看!
祝同学们学业进步!
高中化学
