4.2 电解池 课件(共23张PPT)
文档属性
| 名称 | 4.2 电解池 课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 962.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 08:58:59 | ||
图片预览







文档简介
(共23张PPT)
电解池(一)
.
高中化学
学习目标与任务
1.通过复习电解水的实验, 了解自发反应的条件, 进 一 步
体会物质变化是有条件的;
2.通过学习电解水、 电解氯化铜溶液的过程, 理解电解池
的基本原理, 以及通电过程中体系中微粒的行为, 学会从 微观粒子的动作与变化, 解释宏观物质及其变化现象;
3.通过学习电解硫酸铜的方法及原理, 体会化学在生产生
活中的重要作用, 提升利用学科知识参与理解实际问题的 热情。
高中化学
〖复习回顾〗判断下列装置哪些构成原电池?
酒精溶液
⑴电子导体
⑵离子导体
⑶形成闭合回路
前提:
自发进行的氧化还原反应
形成条件
G
CuCl2溶液
CuCl2溶液
Cu
Cu
Zn
Zn
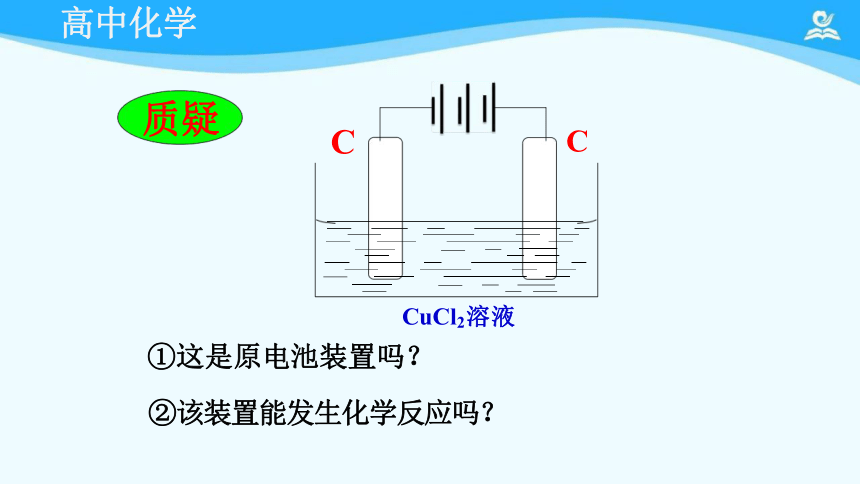
C
C
①这是原电池装置吗?
②该装置能发生化学反应吗?
质疑
高中化学
CuCl2溶液
C
C
高中化学
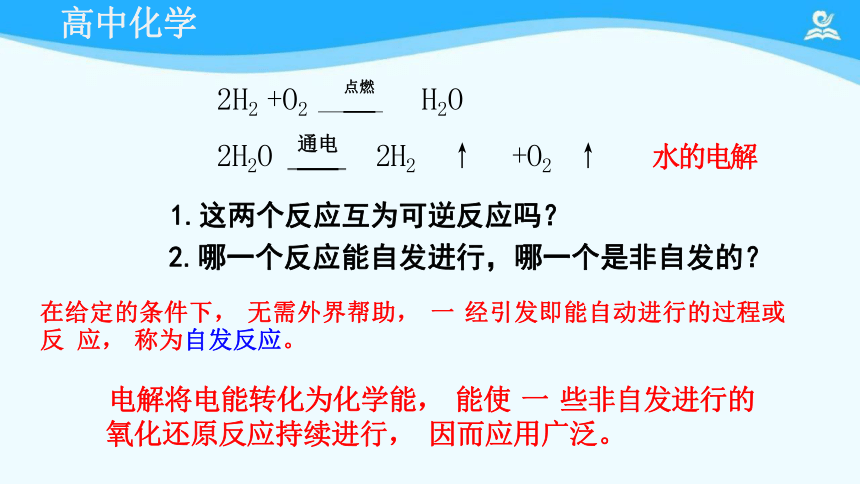
2H2 +O2 点燃 H2O
2H2O 通电 2H2 ↑ +O2 ↑ 水的电解
1.这两个反应互为可逆反应吗?
2.哪一个反应能自发进行,哪一个是非自发的?
在给定的条件下, 无需外界帮助, 一 经引发即能自动进行的过程或反 应, 称为自发反应。
电解将电能转化为化学能, 能使 一 些非自发进行的
氧化还原反应持续进行, 因而应用广泛。
电解
电解水 :2 H2O 2 H2 + O2
+
接电源
正极
氧 气
阳极
氢
气
阴极
—
接电源
负极
高中化学
2.在接通电源时, 哪极电势高, 微粒如何运动?
H+ 向负极移动 、 OH- 向正极移动。
3.H2 是怎么产生的? O2 又会是如何产生的?
高中化学
原理分析
1. 纯水中有哪些微粒?
H+ 、 OH- 、H2O
H2O H+ + OH-
OH- → O2 ↑
4OH- - 4e- =O2 ↑ + 2H2O (发生氧化反应- 阳极)
实质 H+ → H2 ↑
2H+ + 2e- = H2 ↑ (发生还原反应- 阴极)
①这是原电池装置吗?
②该装置能发生化学反应吗?
质疑
高中化学
CuCl2溶液
C
C
阳离子: Cu2+ 、 H+ 阴离子: Cl- 、 OH- 分子: H2O
思考2: 在通电时这些微粒各向什么区移动?
Cu2+ 、 H+ 向阴极区移动; Cl- 、 OH- 向阳极区移动
思考3: 猜想在通电时在阳极和阴极各会发生什么样的
电极反应? 产物可能是哪些?
阴极区(得电子): Cu2+→Cu H+ →H2 ↑
阳极区(失电子): Cl- →Cl2 ↑ OH- →O2 ↑
高中化学
向氯化铜溶液中通入直流电
A:理论先行
思考1: 氯化铜溶液中含有哪些微粒
CuCl2 = Cu2++2Cl-
H2O H+ + OH-
实验现象 产物验证
产物确定
有红色固体析出
铜
有气泡逸出 使淀粉碘化钾试纸变蓝
氯气
O2 Cl2
如何检验
【实验4-2】用惰性电极(碳棒)电解氯化铜溶液
B:实践检验
CuCl2溶液
C
C
C C
电源
负极
【实验4-2】用惰性电极(碳棒)电解氯化铜溶液
电源
正极
阳极
总反应式:2Cl- + Cu2+
阴极
e-
2Cl- - 2e- Cl2 ↑
高中化学
e-
Cl2 ↑ +Cu
Cu2+ + 2e- Cu
CuCl2 溶液
C:结论
通电
电解氯化铜溶液微观模拟
实验分析:
高中化学
一、电解原理
1.电解:
使直流电通过电解质溶液而在阴 、 阳两极引起氧化还原反应的过程。
2.电解池(电解槽):电能转变为化学能的装置。
3.构成电解池的条件:
C C
②两个电极
③电解质溶液或熔融电解质; CuCl2 溶液
④形成闭合回路。
阴极: 与电源负极相连
阳极: 与电源正极相连
①直流电源;
高中化学
练习 ①③⑤ ⑥⑦
分析下图,哪个是原电池,哪个是电解池。
电子从外加电源的负极流出,
流到电解池的阴极, 再从阳极流回电源正极。
(注: 电子只在外电路导线中定向移动, 不能从溶液中移动)
高中化学
一、电解原理:
4.电子的流向:
e- - e
阴极离 子 导 电 阳极
C负极 正极C
-----
电解池
电源
高中化学
一、电解原理:
5.离子定向移动的方向:
阳离子向阴极移动,
阴离子向阳极移动.
【 思考】
电解质溶液导电的实质是什么?
6.电极反应:
阳氧化 、 阴还原
阳极
离
子 导 电
阴极
电势高
阴离子
阳离子
电势低
e-
e-
高中化学
一、电解原理:
6.电极反应式的书写
阳离子移向阴极放电:
阴极: Cu2+ + 2e- = Cu
阴离子移向阳极放电: 氧化反应 阳极: 2Cl- - 2e- = Cl2 ↑
离子在两极
得失电子
的过程叫放电。
【 思考】
为什么Cu2+ 、 Cl- 放电, 而不是H+、 OH- ?
【 思考】
什么叫放电?
还原反应
总反应式:2Cl- + Cu2+
Cl2 ↑ +Cu
通电
阳极: 还原性: Cl->OH->含氧酸根, Cl- 先放电
阴离子失电子→ 失电子能力强的先放电→ 还原性强的先放电
阴极: 氧化性: Cu2+>H+, Cu2+先放电
阳离子得电子→ 得电子能力强的先放电→ 氧化性强的先放电
高中化学
【 思考】
为什么Cu2+ 、 Cl-放电, 而不是H+ 、 OH- ?
一、电解原理:
7.放电顺序(惰性电极)
高中化学
【 思考】电解氯化铜溶液时,溶液中Cu2+和Cl-放电基本完毕后,
电解过程是否也就停止了呢?
溶液中Cu2+和Cl— 放电完毕后, 原溶液变为纯水, 此时, 在纯水中存 在H+ 和OH—, H+在阴极放电, OH— 在阳极放电, 实际上是电解水的过 程, 所以:
阴极:4H+ + 4e— = 2H2 ↑
阳极:4OH— -4e— =2H2O + O2 ↑
总反应:2H2O电
高中化学
小结:分析电解反应(用惰性电极时)的一般思路:
明确溶液中存在哪些离子
"
阴阳两极附近有哪些离子
根据氧化性 、 还原性强弱
判断反应的离子先后,
最后分析得出产物
还原性: Cl->OH->含氧酸根
氧化性: Cu2+>H+
电解池
原电池
能量转换 电能转化为化学能
化学能转化为电能
离子的迁移 方向 阴离子向阳极迁移 阳离子向阴极迁移
阴离子向负极迁移
阳离子向正极迁移
发生氧化反 应的电极 阳极(接电源正极)
负极
发生还原反 应的电极 阴极(接电源负极)
正极
反应能否自发 不自发
自发
相同点 (从原理分析)
小结:
原电池
与
电解池
的
比较:
都是氧化还原反应
高中化学
(1)AgNO3溶液
阳极: 4OH- - 4e- = 2H2O + O2 ↑ ( H2O H++ OH-)
阴极: 4Ag+ + 4e- = 4Ag↓
总反应式: 4Ag+ + 2H2O 电4Ag ↓ + O2 ↑+ 4H+
(2)CuSO4溶液:
阳极: 4OH- - 4e- = 2H2O + O2 ↑ ( H2O H++ OH-)
阴极: 2Cu2+ + 4e- = 2Cu
高中化学
练习:
以石墨作电极,电解下列溶液,写出电极反应及电解总反应式。
溶液中哪些微粒
阳极区有哪些离子 阴极区有哪些离子 哪个离子先放电
谢谢同学们的收看! 祝同学们学业进步!
高中化学
电解池(一)
.
高中化学
学习目标与任务
1.通过复习电解水的实验, 了解自发反应的条件, 进 一 步
体会物质变化是有条件的;
2.通过学习电解水、 电解氯化铜溶液的过程, 理解电解池
的基本原理, 以及通电过程中体系中微粒的行为, 学会从 微观粒子的动作与变化, 解释宏观物质及其变化现象;
3.通过学习电解硫酸铜的方法及原理, 体会化学在生产生
活中的重要作用, 提升利用学科知识参与理解实际问题的 热情。
高中化学
〖复习回顾〗判断下列装置哪些构成原电池?
酒精溶液
⑴电子导体
⑵离子导体
⑶形成闭合回路
前提:
自发进行的氧化还原反应
形成条件
G
CuCl2溶液
CuCl2溶液
Cu
Cu
Zn
Zn
C
C
①这是原电池装置吗?
②该装置能发生化学反应吗?
质疑
高中化学
CuCl2溶液
C
C
高中化学
2H2 +O2 点燃 H2O
2H2O 通电 2H2 ↑ +O2 ↑ 水的电解
1.这两个反应互为可逆反应吗?
2.哪一个反应能自发进行,哪一个是非自发的?
在给定的条件下, 无需外界帮助, 一 经引发即能自动进行的过程或反 应, 称为自发反应。
电解将电能转化为化学能, 能使 一 些非自发进行的
氧化还原反应持续进行, 因而应用广泛。
电解
电解水 :2 H2O 2 H2 + O2
+
接电源
正极
氧 气
阳极
氢
气
阴极
—
接电源
负极
高中化学
2.在接通电源时, 哪极电势高, 微粒如何运动?
H+ 向负极移动 、 OH- 向正极移动。
3.H2 是怎么产生的? O2 又会是如何产生的?
高中化学
原理分析
1. 纯水中有哪些微粒?
H+ 、 OH- 、H2O
H2O H+ + OH-
OH- → O2 ↑
4OH- - 4e- =O2 ↑ + 2H2O (发生氧化反应- 阳极)
实质 H+ → H2 ↑
2H+ + 2e- = H2 ↑ (发生还原反应- 阴极)
①这是原电池装置吗?
②该装置能发生化学反应吗?
质疑
高中化学
CuCl2溶液
C
C
阳离子: Cu2+ 、 H+ 阴离子: Cl- 、 OH- 分子: H2O
思考2: 在通电时这些微粒各向什么区移动?
Cu2+ 、 H+ 向阴极区移动; Cl- 、 OH- 向阳极区移动
思考3: 猜想在通电时在阳极和阴极各会发生什么样的
电极反应? 产物可能是哪些?
阴极区(得电子): Cu2+→Cu H+ →H2 ↑
阳极区(失电子): Cl- →Cl2 ↑ OH- →O2 ↑
高中化学
向氯化铜溶液中通入直流电
A:理论先行
思考1: 氯化铜溶液中含有哪些微粒
CuCl2 = Cu2++2Cl-
H2O H+ + OH-
实验现象 产物验证
产物确定
有红色固体析出
铜
有气泡逸出 使淀粉碘化钾试纸变蓝
氯气
O2 Cl2
如何检验
【实验4-2】用惰性电极(碳棒)电解氯化铜溶液
B:实践检验
CuCl2溶液
C
C
C C
电源
负极
【实验4-2】用惰性电极(碳棒)电解氯化铜溶液
电源
正极
阳极
总反应式:2Cl- + Cu2+
阴极
e-
2Cl- - 2e- Cl2 ↑
高中化学
e-
Cl2 ↑ +Cu
Cu2+ + 2e- Cu
CuCl2 溶液
C:结论
通电
电解氯化铜溶液微观模拟
实验分析:
高中化学
一、电解原理
1.电解:
使直流电通过电解质溶液而在阴 、 阳两极引起氧化还原反应的过程。
2.电解池(电解槽):电能转变为化学能的装置。
3.构成电解池的条件:
C C
②两个电极
③电解质溶液或熔融电解质; CuCl2 溶液
④形成闭合回路。
阴极: 与电源负极相连
阳极: 与电源正极相连
①直流电源;
高中化学
练习 ①③⑤ ⑥⑦
分析下图,哪个是原电池,哪个是电解池。
电子从外加电源的负极流出,
流到电解池的阴极, 再从阳极流回电源正极。
(注: 电子只在外电路导线中定向移动, 不能从溶液中移动)
高中化学
一、电解原理:
4.电子的流向:
e- - e
阴极离 子 导 电 阳极
C负极 正极C
-----
电解池
电源
高中化学
一、电解原理:
5.离子定向移动的方向:
阳离子向阴极移动,
阴离子向阳极移动.
【 思考】
电解质溶液导电的实质是什么?
6.电极反应:
阳氧化 、 阴还原
阳极
离
子 导 电
阴极
电势高
阴离子
阳离子
电势低
e-
e-
高中化学
一、电解原理:
6.电极反应式的书写
阳离子移向阴极放电:
阴极: Cu2+ + 2e- = Cu
阴离子移向阳极放电: 氧化反应 阳极: 2Cl- - 2e- = Cl2 ↑
离子在两极
得失电子
的过程叫放电。
【 思考】
为什么Cu2+ 、 Cl- 放电, 而不是H+、 OH- ?
【 思考】
什么叫放电?
还原反应
总反应式:2Cl- + Cu2+
Cl2 ↑ +Cu
通电
阳极: 还原性: Cl->OH->含氧酸根, Cl- 先放电
阴离子失电子→ 失电子能力强的先放电→ 还原性强的先放电
阴极: 氧化性: Cu2+>H+, Cu2+先放电
阳离子得电子→ 得电子能力强的先放电→ 氧化性强的先放电
高中化学
【 思考】
为什么Cu2+ 、 Cl-放电, 而不是H+ 、 OH- ?
一、电解原理:
7.放电顺序(惰性电极)
高中化学
【 思考】电解氯化铜溶液时,溶液中Cu2+和Cl-放电基本完毕后,
电解过程是否也就停止了呢?
溶液中Cu2+和Cl— 放电完毕后, 原溶液变为纯水, 此时, 在纯水中存 在H+ 和OH—, H+在阴极放电, OH— 在阳极放电, 实际上是电解水的过 程, 所以:
阴极:4H+ + 4e— = 2H2 ↑
阳极:4OH— -4e— =2H2O + O2 ↑
总反应:2H2O电
高中化学
小结:分析电解反应(用惰性电极时)的一般思路:
明确溶液中存在哪些离子
"
阴阳两极附近有哪些离子
根据氧化性 、 还原性强弱
判断反应的离子先后,
最后分析得出产物
还原性: Cl->OH->含氧酸根
氧化性: Cu2+>H+
电解池
原电池
能量转换 电能转化为化学能
化学能转化为电能
离子的迁移 方向 阴离子向阳极迁移 阳离子向阴极迁移
阴离子向负极迁移
阳离子向正极迁移
发生氧化反 应的电极 阳极(接电源正极)
负极
发生还原反 应的电极 阴极(接电源负极)
正极
反应能否自发 不自发
自发
相同点 (从原理分析)
小结:
原电池
与
电解池
的
比较:
都是氧化还原反应
高中化学
(1)AgNO3溶液
阳极: 4OH- - 4e- = 2H2O + O2 ↑ ( H2O H++ OH-)
阴极: 4Ag+ + 4e- = 4Ag↓
总反应式: 4Ag+ + 2H2O 电4Ag ↓ + O2 ↑+ 4H+
(2)CuSO4溶液:
阳极: 4OH- - 4e- = 2H2O + O2 ↑ ( H2O H++ OH-)
阴极: 2Cu2+ + 4e- = 2Cu
高中化学
练习:
以石墨作电极,电解下列溶液,写出电极反应及电解总反应式。
溶液中哪些微粒
阳极区有哪些离子 阴极区有哪些离子 哪个离子先放电
谢谢同学们的收看! 祝同学们学业进步!
高中化学
