4.2 电解池 课件(共29张PPT)
文档属性
| 名称 | 4.2 电解池 课件(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 08:59:24 | ||
图片预览





文档简介
(共29张PPT)
电解池(三)
.
高中化学
学习目标与任务
1.通过各种电解池原理应用的学习, 能用化学语言描述电
解过程, 提升根据微观结构预测宏观变化的能力;
2.通过对电解池放电规律的总结, 完善电解规律的认识,
建立分析预测电解过程的思考模型, 发展分类研究物质变
化特征规律的意识;
3.通过了解电解精炼 、 电镀 、 电冶金等电解池原理在生产
生活中的应用, 体会化学技术与社会生活的关系, 提升利 用学科知识参与理解实际问题的热情。
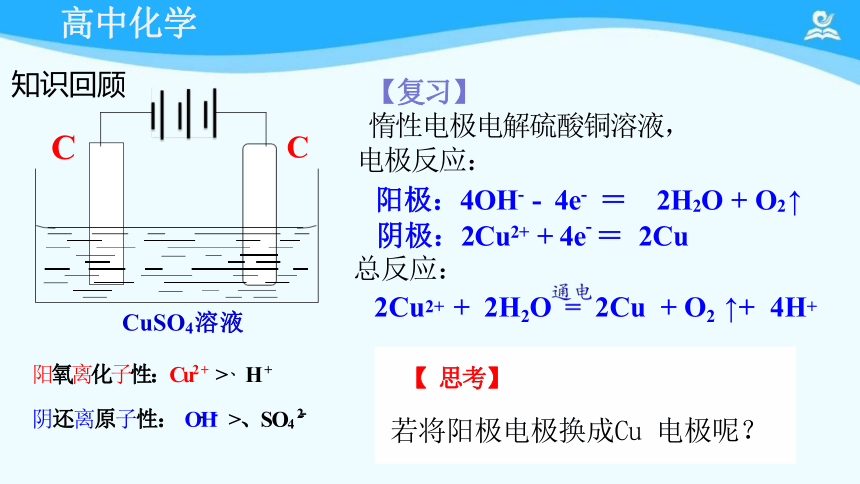
阳极:4OH- - 4e- = 2H2O + O2 ↑
阴极:2Cu2+ + 4e- = 2Cu
总反应:
2Cu2+ + 2H2O 2Cu + O2 ↑+ 4H+
【 思考】
若将阳极电极换成Cu 电极呢?
【复习】
惰性电极电解硫酸铜溶液,
电极反应:
CuSO4溶液
阳氧离化子性:Cu2+ >、H+
阴还离原子性: OH >、SO42
-
-
知识回顾
C
高中化学
C
【 思考】
若将阳极电极换成Cu 电极呢?
电极反应:
阳极: Cu - 2e- = Cu2+
阴极: Cu2+ + 2e- = Cu
【 思考】
实际现象是什么?
可以有什么应用呢?
CuSO4溶液
氧化性: Cu2+ > H+
还原性: uH->>O O-4>2-
知识回顾
C
高中化学
SO42-
Cu
电镀是利用电解原理在某些金属表面
镀上 一 薄层其他金属或合金的过程。
电镀可以使金属更加美观耐用, 增
强防锈抗腐能力。
三、电解原理的应用
2. 电镀
高中化学
高中化学
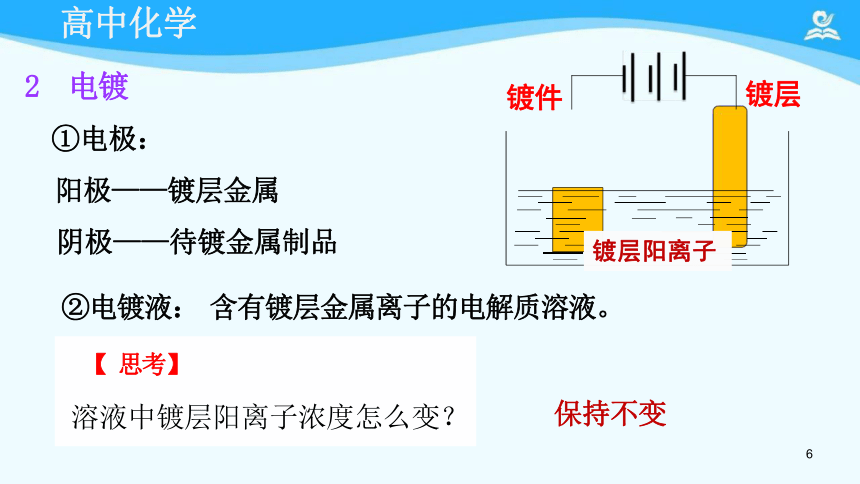
2 电镀
①电极:
阳极——镀层金属
阴极——待镀金属制品
【 思考】
溶液中镀层阳离子浓度怎么变?
②电镀液: 含有镀层金属离子的电解质溶液。
镀层阳离子
保持不变
镀件
镀层
6
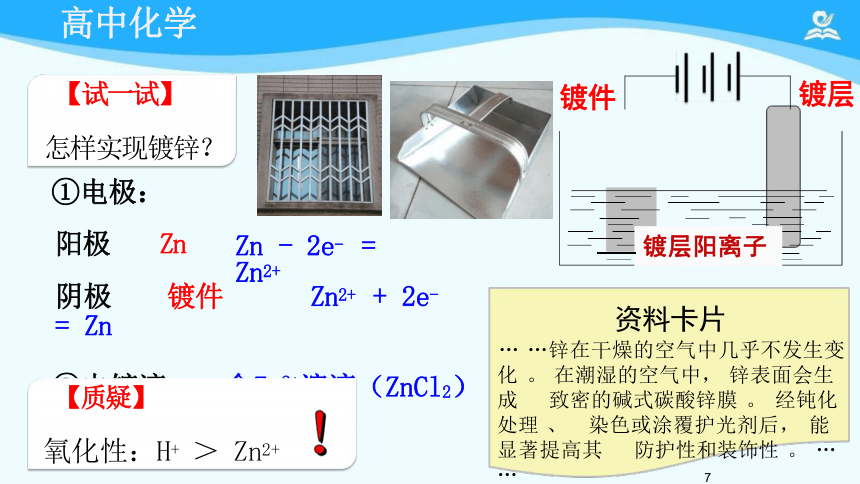
资料卡片
… …锌在干燥的空气中几乎不发生变 化 。 在潮湿的空气中, 锌表面会生成 致密的碱式碳酸锌膜 。 经钝化处理 、 染色或涂覆护光剂后, 能显著提高其 防护性和装饰性 。 … … 7
高中化学
【试一试】
怎样实现镀锌?
①电极:
阳极 Zn
阴极 镀件 Zn2+ + 2e- = Zn
②电镀液: 含Zn2+溶液(ZnCl2)
【质疑】
氧化性:H+ > Zn2+
镀层阳离子
Zn - 2e- = Zn2+
镀件
镀层
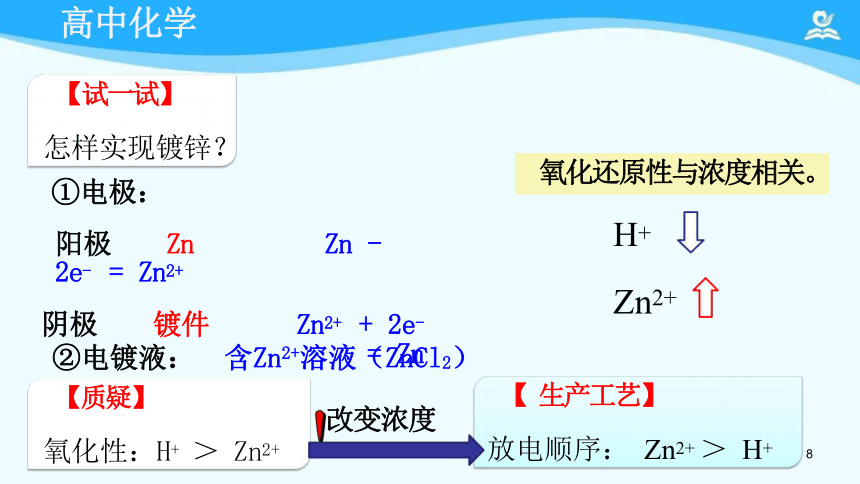
【试一试】
怎样实现镀锌?
①电极:
阳极 Zn Zn - 2e- = Zn2+
阴极 镀件 Zn2+ + 2e- = Zn
【 生产工艺】
放电顺序: Zn2+ > H+
【质疑】
氧化性:H+ > Zn2+
②电镀液: 含Zn2+溶液(ZnCl2)
氧化还原性与浓度相关。
H+
Zn2+
高中化学
改变浓度
8
高中化学
三、电解原理的应用
1. 氯碱工业
2. 电镀
3. 粗铜的电解精炼
4. 电冶金
高中化学
三、电解原理的应用
3. 粗铜的电解精炼
一般火法冶炼得到的粗铜中含有多 种杂质(如锌 、 铁、 镍 、 银 、 金等)
这种粗铜的导电性远不能满足
电气工业的要求, 如果用以制电 线会大大降低电线的导电能力。
因此必须利用电解的方法精炼粗铜。
目标产品
精铜
Cu
( >99.96%)
原料
粗铜
Cu
Zn 、 Fe 、Ni
Ag、Au
2. 粗铜的电解精炼
高中化学
在哪个电极获得?
放在哪个电极?
电解
电解质溶液?
高中化学
2. 粗铜的电解精炼
阴极
阳极
精铜
粗铜
e-
e-
高中化学
阴极: Cu2+ + 2e- = Cu
Zn - 2e- = Zn2+ Zn
Fe - 2e- = Fe2+ Fe
Ni - 2e- = Ni2+ Ni
Cu - 2e- = Cu2+ Cu
Ag
电解质: 含Cu2+( Cu SO4)
阳极:
Cu( Zn 、 Fe 、Ni 、Ag 、Au)
放电顺序?
阴极
精铜
Cu
Cu
Cu
Cu
Zn
Cu
Au
M - ne- = Mn+
阳极
粗铜
SO42-
Cu2+
Cu2+
Cu2+
Cu2+
Fe2+
Zn2+
Ni2+
阳极泥
Ag
Fe
Cu
Cu
Ag
e-
e-
Au
OH-
思考:
电解完后,CuSO4溶 液的浓度有何变化?
溶液中铜离子浓度略微 降低, 引入Zn2+ 、 Fe2+ 等离子
阴极
精铜
Cu
Cu
Cu
Cu
粗铜
Zn
Cu
高中化学
阳极
SO42-
OH-
Cu2+
Cu2+
Cu2+
Fe2+
Cu2+
Ni2+
Zn2+
Au
Fe
Ag
Cu
Cu
Ag
e-
e-
精铜
CuSO4 溶液
2. 电解精炼
(1 ) 原理 电解
(2 ) 目的 精炼提纯
(3 ) 装置
高中化学
三、电解原理的应用
阴极
阳极
粗铜
e-
e-
阳极:
Zn Zn - 2e- = Zn2+ Fe Fe - 2e- = Fe2+ Ni Ni - 2e- = Ni2+ Cu Cu -2e- = Cu2+ Ag Ag - e- = Ag+ Au 阳极泥
阴极: Ag+ + e- → Ag
高中化学
练习:银的电解精炼
放在哪个电极? 在哪个电极获得?
电解质溶液?
原料
粗银
Ag
Zn 、Fe、
Ni 、Cu
Au
目标产品
纯银
Ag
( >99.8%)
粗银 含杂质(Zn Fe Ni Cu Au 等)
电解
高中化学
三、电解原理的应用
1. 氯碱工业
2. 电镀
3. 粗铜的电解精炼
4. 电冶金
电解池 电解精炼池
电镀池
定义 将电能转变成化学能 的装置。 应用电解原理将不纯 的金属提纯的装置。
应用电解原理在某些 金属表面镀上 一层其 它金属的装置。
形成 条件 ①两电极接直流电源 ②电极插入电解质溶液 ③形成闭合回路 ①不纯金属接电源正极 纯的金属接电源负极 ②电解质溶液须待提纯 金属的离子
①镀层金属接电源正极 待镀金属接电源负极
②电镀液须含有镀层金 属的离子
电极 名称 阳极: 电源正极相连 阴极: 电源负极相连 阳极: 不纯金属; 阴极: 纯金属
阳极 :镀层金属;
阴极 :镀件
电极 反应 阳极: 氧化反应 阴极: 还原反应
电解池、电解精炼池、电镀池的比较
高中化学
18
高中化学
四、电解模型的归纳分类
阴极 阳离子得电子, 被还原, 比较阳离子氧化性
Ag+>Hg2+>Fe3+>Cu2+>H+
>Pb2+ > Sn2+ >Fe2+>Zn2+
>H+ > Al3+>Mg2+>Na+>Ca2+>K+
金属越不活泼的对应阳离子氧化性越强, 越容 易得电子 。 金属活动顺序的反顺序
水溶液中不可能放电
阳极放电优先考虑电极材料:
若阳极材料为活泼金属, 则阳极放电溶解;
若为惰性材料, 则溶液中的阴离子放电
金属 > S2- > I- > Br- > Cl-> OH- > 最高价含氧酸根 > F-
水溶液中不可能放电
除Pt 、Au外
阳极: 失电子, 被氧化, 比较还原性
高中化学
(Pt 、Au 、 石墨 、 钛等) 为什么?
无论是惰性电极还是活性电极都不参与电极反应,
发生反应的是溶液中的阳离子。
①活性材料作电极: 金属电极→ 阳离子, 进入溶液
②用惰性电极: 溶液阴离子按顺序放电
高中化学
总结:
阴极
阳极
21
高中化学
电解规律(惰性电极)小结
Ⅰ Ⅱ
阳极: S2- > I- > Br- > Cl- > OH- > 最高价含氧酸根 > F-
阴极:Ag+>Fe3+>Cu2+ > H+> Fe2+>Zn2+>( H+ ) >Al3+>Mg2+>Na+
Ⅲ Ⅳ
Ⅰ与Ⅲ区: 电解本身型 如CuCl2 、 HCl
Ⅰ与Ⅳ区: 放氢生碱型 如NaCl 、 ZnCl2
Ⅱ与Ⅲ区: 放氧生酸型 如CuSO4 、AgNO3
Ⅱ与Ⅳ区: 电解水型 如Na2SO4 、 H2SO4 、 NaOH
实例 电极反应 溶液浓度 溶液pH
复原
Na2SO4 阳极: 4OH- - 4e- = 2H2O + O2 ↑ 阴极: 4H ++ 4e- = 2H2 ↑ 2H2O 电解 2H2 ↑ + O2 ↑ 变大 不变
加H2O
2. 电解水型
(活泼金属的最高价含氧酸盐、
强碱 、 最高价含氧酸)
【 思考】
比单纯电解水
速度快还是慢?
高中化学
Na2SO4 溶液
氧
气
氢
气
阴极
阳极
电解水溶液的反应原理及变化规律。
除了电解水溶液外, 有 一 类物质在何状态下也能发生电离?
是否也能发生电解?
我们学习过这 一 类电解吗? 请举几例。
高中化学
24
高中化学
三、电解原理的应用
1. 氯碱工业
2. 粗铜的电解精炼
3. 电镀
4. 电冶金
高中化学
三、电解原理的应用
4. 电冶金
由于电解是最强有力的氧化还原手段,所以电解法是冶炼金属的一种重 要的方法。对于冶炼像Na 、Ca 、Mg 、Al这样活泼的金属,电解法几乎 是唯一可行的工业方法。
制取金属钠 电解熔融状态的氯化钠。
阳极: 2Cl - -2e- = Cl2 ↑
阴极: 2Na+ + 2e- = 2Na
总反应:2NaCl(熔融) 通 电 2Na + Cl2 ↑
制取金属铝 电解熔融状态的氧化铝。
阳极: 6O 2- -12e- = 3O2 ↑
阴极: 4Al 3+ + 12e- = 4Al
总反应: 2Al2O3 (熔融) 冰通晶电石 4Al + 3O2 ↑
冰晶石—— 助熔剂
(Na3AlF6 六氟合铝酸钠)
工业上为什么用电解熔融氧化铝的 AlCl3 为分子晶体,
方法冶炼铝而不用AlCl3
。
,
不能被电解
态下不电离
不导电
在熔融
高中化学
【 思考】
阳极C
/电解质
熔融
态铝
— 钢壳
耐火
材料
阴极C
28
冶炼铝设备图
高中化学
钢导电棒
烟罩
谢谢同学们的收看! 祝同学们学业进步!
高中化学
电解池(三)
.
高中化学
学习目标与任务
1.通过各种电解池原理应用的学习, 能用化学语言描述电
解过程, 提升根据微观结构预测宏观变化的能力;
2.通过对电解池放电规律的总结, 完善电解规律的认识,
建立分析预测电解过程的思考模型, 发展分类研究物质变
化特征规律的意识;
3.通过了解电解精炼 、 电镀 、 电冶金等电解池原理在生产
生活中的应用, 体会化学技术与社会生活的关系, 提升利 用学科知识参与理解实际问题的热情。
阳极:4OH- - 4e- = 2H2O + O2 ↑
阴极:2Cu2+ + 4e- = 2Cu
总反应:
2Cu2+ + 2H2O 2Cu + O2 ↑+ 4H+
【 思考】
若将阳极电极换成Cu 电极呢?
【复习】
惰性电极电解硫酸铜溶液,
电极反应:
CuSO4溶液
阳氧离化子性:Cu2+ >、H+
阴还离原子性: OH >、SO42
-
-
知识回顾
C
高中化学
C
【 思考】
若将阳极电极换成Cu 电极呢?
电极反应:
阳极: Cu - 2e- = Cu2+
阴极: Cu2+ + 2e- = Cu
【 思考】
实际现象是什么?
可以有什么应用呢?
CuSO4溶液
氧化性: Cu2+ > H+
还原性: uH->>O O-4>2-
知识回顾
C
高中化学
SO42-
Cu
电镀是利用电解原理在某些金属表面
镀上 一 薄层其他金属或合金的过程。
电镀可以使金属更加美观耐用, 增
强防锈抗腐能力。
三、电解原理的应用
2. 电镀
高中化学
高中化学
2 电镀
①电极:
阳极——镀层金属
阴极——待镀金属制品
【 思考】
溶液中镀层阳离子浓度怎么变?
②电镀液: 含有镀层金属离子的电解质溶液。
镀层阳离子
保持不变
镀件
镀层
6
资料卡片
… …锌在干燥的空气中几乎不发生变 化 。 在潮湿的空气中, 锌表面会生成 致密的碱式碳酸锌膜 。 经钝化处理 、 染色或涂覆护光剂后, 能显著提高其 防护性和装饰性 。 … … 7
高中化学
【试一试】
怎样实现镀锌?
①电极:
阳极 Zn
阴极 镀件 Zn2+ + 2e- = Zn
②电镀液: 含Zn2+溶液(ZnCl2)
【质疑】
氧化性:H+ > Zn2+
镀层阳离子
Zn - 2e- = Zn2+
镀件
镀层
【试一试】
怎样实现镀锌?
①电极:
阳极 Zn Zn - 2e- = Zn2+
阴极 镀件 Zn2+ + 2e- = Zn
【 生产工艺】
放电顺序: Zn2+ > H+
【质疑】
氧化性:H+ > Zn2+
②电镀液: 含Zn2+溶液(ZnCl2)
氧化还原性与浓度相关。
H+
Zn2+
高中化学
改变浓度
8
高中化学
三、电解原理的应用
1. 氯碱工业
2. 电镀
3. 粗铜的电解精炼
4. 电冶金
高中化学
三、电解原理的应用
3. 粗铜的电解精炼
一般火法冶炼得到的粗铜中含有多 种杂质(如锌 、 铁、 镍 、 银 、 金等)
这种粗铜的导电性远不能满足
电气工业的要求, 如果用以制电 线会大大降低电线的导电能力。
因此必须利用电解的方法精炼粗铜。
目标产品
精铜
Cu
( >99.96%)
原料
粗铜
Cu
Zn 、 Fe 、Ni
Ag、Au
2. 粗铜的电解精炼
高中化学
在哪个电极获得?
放在哪个电极?
电解
电解质溶液?
高中化学
2. 粗铜的电解精炼
阴极
阳极
精铜
粗铜
e-
e-
高中化学
阴极: Cu2+ + 2e- = Cu
Zn - 2e- = Zn2+ Zn
Fe - 2e- = Fe2+ Fe
Ni - 2e- = Ni2+ Ni
Cu - 2e- = Cu2+ Cu
Ag
电解质: 含Cu2+( Cu SO4)
阳极:
Cu( Zn 、 Fe 、Ni 、Ag 、Au)
放电顺序?
阴极
精铜
Cu
Cu
Cu
Cu
Zn
Cu
Au
M - ne- = Mn+
阳极
粗铜
SO42-
Cu2+
Cu2+
Cu2+
Cu2+
Fe2+
Zn2+
Ni2+
阳极泥
Ag
Fe
Cu
Cu
Ag
e-
e-
Au
OH-
思考:
电解完后,CuSO4溶 液的浓度有何变化?
溶液中铜离子浓度略微 降低, 引入Zn2+ 、 Fe2+ 等离子
阴极
精铜
Cu
Cu
Cu
Cu
粗铜
Zn
Cu
高中化学
阳极
SO42-
OH-
Cu2+
Cu2+
Cu2+
Fe2+
Cu2+
Ni2+
Zn2+
Au
Fe
Ag
Cu
Cu
Ag
e-
e-
精铜
CuSO4 溶液
2. 电解精炼
(1 ) 原理 电解
(2 ) 目的 精炼提纯
(3 ) 装置
高中化学
三、电解原理的应用
阴极
阳极
粗铜
e-
e-
阳极:
Zn Zn - 2e- = Zn2+ Fe Fe - 2e- = Fe2+ Ni Ni - 2e- = Ni2+ Cu Cu -2e- = Cu2+ Ag Ag - e- = Ag+ Au 阳极泥
阴极: Ag+ + e- → Ag
高中化学
练习:银的电解精炼
放在哪个电极? 在哪个电极获得?
电解质溶液?
原料
粗银
Ag
Zn 、Fe、
Ni 、Cu
Au
目标产品
纯银
Ag
( >99.8%)
粗银 含杂质(Zn Fe Ni Cu Au 等)
电解
高中化学
三、电解原理的应用
1. 氯碱工业
2. 电镀
3. 粗铜的电解精炼
4. 电冶金
电解池 电解精炼池
电镀池
定义 将电能转变成化学能 的装置。 应用电解原理将不纯 的金属提纯的装置。
应用电解原理在某些 金属表面镀上 一层其 它金属的装置。
形成 条件 ①两电极接直流电源 ②电极插入电解质溶液 ③形成闭合回路 ①不纯金属接电源正极 纯的金属接电源负极 ②电解质溶液须待提纯 金属的离子
①镀层金属接电源正极 待镀金属接电源负极
②电镀液须含有镀层金 属的离子
电极 名称 阳极: 电源正极相连 阴极: 电源负极相连 阳极: 不纯金属; 阴极: 纯金属
阳极 :镀层金属;
阴极 :镀件
电极 反应 阳极: 氧化反应 阴极: 还原反应
电解池、电解精炼池、电镀池的比较
高中化学
18
高中化学
四、电解模型的归纳分类
阴极 阳离子得电子, 被还原, 比较阳离子氧化性
Ag+>Hg2+>Fe3+>Cu2+>H+
>Pb2+ > Sn2+ >Fe2+>Zn2+
>H+ > Al3+>Mg2+>Na+>Ca2+>K+
金属越不活泼的对应阳离子氧化性越强, 越容 易得电子 。 金属活动顺序的反顺序
水溶液中不可能放电
阳极放电优先考虑电极材料:
若阳极材料为活泼金属, 则阳极放电溶解;
若为惰性材料, 则溶液中的阴离子放电
金属 > S2- > I- > Br- > Cl-> OH- > 最高价含氧酸根 > F-
水溶液中不可能放电
除Pt 、Au外
阳极: 失电子, 被氧化, 比较还原性
高中化学
(Pt 、Au 、 石墨 、 钛等) 为什么?
无论是惰性电极还是活性电极都不参与电极反应,
发生反应的是溶液中的阳离子。
①活性材料作电极: 金属电极→ 阳离子, 进入溶液
②用惰性电极: 溶液阴离子按顺序放电
高中化学
总结:
阴极
阳极
21
高中化学
电解规律(惰性电极)小结
Ⅰ Ⅱ
阳极: S2- > I- > Br- > Cl- > OH- > 最高价含氧酸根 > F-
阴极:Ag+>Fe3+>Cu2+ > H+> Fe2+>Zn2+>( H+ ) >Al3+>Mg2+>Na+
Ⅲ Ⅳ
Ⅰ与Ⅲ区: 电解本身型 如CuCl2 、 HCl
Ⅰ与Ⅳ区: 放氢生碱型 如NaCl 、 ZnCl2
Ⅱ与Ⅲ区: 放氧生酸型 如CuSO4 、AgNO3
Ⅱ与Ⅳ区: 电解水型 如Na2SO4 、 H2SO4 、 NaOH
实例 电极反应 溶液浓度 溶液pH
复原
Na2SO4 阳极: 4OH- - 4e- = 2H2O + O2 ↑ 阴极: 4H ++ 4e- = 2H2 ↑ 2H2O 电解 2H2 ↑ + O2 ↑ 变大 不变
加H2O
2. 电解水型
(活泼金属的最高价含氧酸盐、
强碱 、 最高价含氧酸)
【 思考】
比单纯电解水
速度快还是慢?
高中化学
Na2SO4 溶液
氧
气
氢
气
阴极
阳极
电解水溶液的反应原理及变化规律。
除了电解水溶液外, 有 一 类物质在何状态下也能发生电离?
是否也能发生电解?
我们学习过这 一 类电解吗? 请举几例。
高中化学
24
高中化学
三、电解原理的应用
1. 氯碱工业
2. 粗铜的电解精炼
3. 电镀
4. 电冶金
高中化学
三、电解原理的应用
4. 电冶金
由于电解是最强有力的氧化还原手段,所以电解法是冶炼金属的一种重 要的方法。对于冶炼像Na 、Ca 、Mg 、Al这样活泼的金属,电解法几乎 是唯一可行的工业方法。
制取金属钠 电解熔融状态的氯化钠。
阳极: 2Cl - -2e- = Cl2 ↑
阴极: 2Na+ + 2e- = 2Na
总反应:2NaCl(熔融) 通 电 2Na + Cl2 ↑
制取金属铝 电解熔融状态的氧化铝。
阳极: 6O 2- -12e- = 3O2 ↑
阴极: 4Al 3+ + 12e- = 4Al
总反应: 2Al2O3 (熔融) 冰通晶电石 4Al + 3O2 ↑
冰晶石—— 助熔剂
(Na3AlF6 六氟合铝酸钠)
工业上为什么用电解熔融氧化铝的 AlCl3 为分子晶体,
方法冶炼铝而不用AlCl3
。
,
不能被电解
态下不电离
不导电
在熔融
高中化学
【 思考】
阳极C
/电解质
熔融
态铝
— 钢壳
耐火
材料
阴极C
28
冶炼铝设备图
高中化学
钢导电棒
烟罩
谢谢同学们的收看! 祝同学们学业进步!
高中化学
