4.3 金属的腐蚀与防护 课件(共22张PPT)
文档属性
| 名称 | 4.3 金属的腐蚀与防护 课件(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
金属的腐蚀与防护
高中化学
学习目标
1. 能简要说明金属发生电化学腐蚀的原理,认识金属腐蚀的
危害,能列举防止金属腐蚀的主要措施。
2. 理解钢铁吸氧腐蚀和析氢腐蚀发生的条件及原理,会书写 电极反应式和总反应式。
3.切实感受金属及合金在生产、生活中的重要作用,形成科学 利用资源的正确思想。
高中化学
金属的腐蚀在生活中 非常普遍
地球上,腐蚀无处不在,它被称作金属的癌症。
为了提高公众对腐蚀的重视程度,世界腐蚀组织把每年的
4月24日,定为“世界腐蚀日”。
高 等 学 般 教 制
金属电化学
腐蚀与防护
张 宝 宏 丛 文 博 杨 萍 编
化 学 事 些 露 版 私
Principles of
Electrochemistry of Corrosion
腐蚀电化学原理
第 三 版
曹楚南、练者
C**+****
高中化学
这些伟大成就中就凝结着我国腐蚀研究工作者的心血!
高中化学
高中化学
一 、金属的腐蚀
1、 什么是金属腐蚀
指金属或合金与周围接触到的气体或液体进行化学反应而
是金属本身失去电子变成阳离子的过程(发生氧化反应)。
M-ne-=Mn+
2、 金属腐蚀的本质是什么
腐蚀损耗的过程。
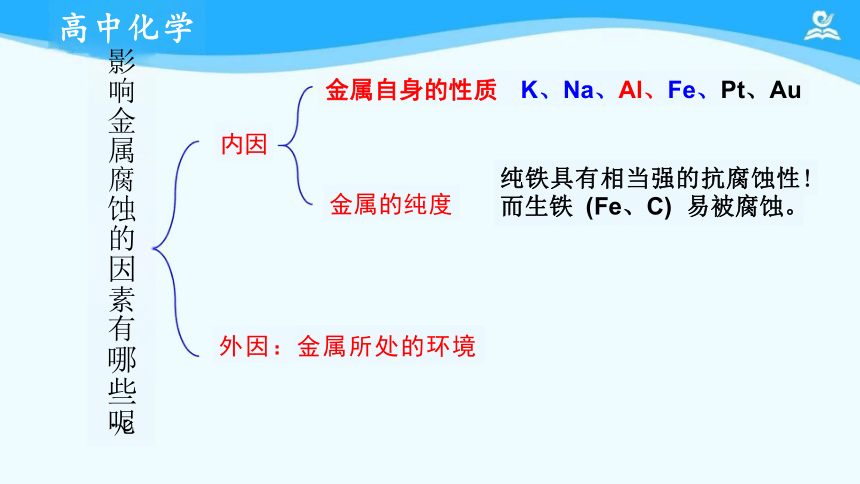
金属自身的性质 K、Na、Al、Fe、Pt、Au
内因
纯铁具有相当强的抗腐蚀性! 而生铁 (Fe、C) 易被腐蚀。
影响金属腐蚀的因素有哪些呢
外因:金属所处的环境
高中化学
金属的纯度
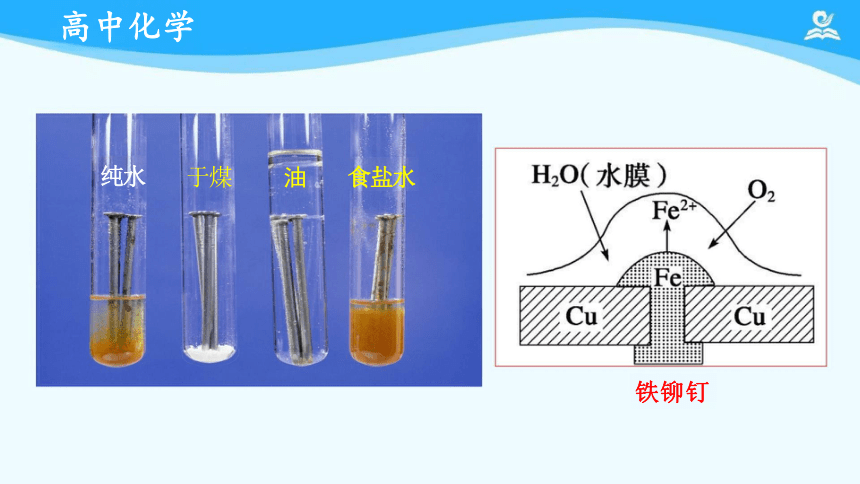
纯水 于煤 油 食盐水
高中化学
铁铆钉
化 学 腐 蚀
电化学腐蚀
条件 金属跟接触到的干燥气体(如SO 、 Cl 、O 等)或非电解质溶液(石油) 等直 。
不纯金属或合金
F 6 初 E 次法 位 础
现象
本质
影响 因素 与 有关
联系 两者往往同时发生 ,电化学腐蚀更普遍
高中化学
3、 金属腐蚀的类型一根据与金属接触的介质不同
4Fe(OH) +O +2H O=4Fe(OH)
Fe ++2OH-=Fe(OH) J
O +2H O+4e-=4OH-
Fe-2e-=Fe2+
高中化学
钢铁的吸氧腐蚀
高中化学
实验探究
将酸洗除锈的铁钉,用饱和食盐水浸泡后放在如图所示的装置中,
几分钟后观察导管中水柱的变化
结论:
说明装置中有气体参加反应
实验现象:
几分钟后,装置中的 导管中水柱上升
高中化学
实验探究
滴加铁氰化钾
滴加酚酞
指针偏转
高中化学
实验探究
H,
Fe
Fe、e-
e
Fe + 稀盐酸 (H+)
H++2e-=H ↑
钢铁的析氢腐蚀
Q
e
电脑
压强传感器
一定pH 数据采集器 的醋酸溶液
高中化学
实验探究
在什么条件下,钢铁发生吸氧腐蚀或析氢腐蚀呢
铁和炭粉
电化学腐蚀 析氢腐蚀
吸氧腐蚀
条件 水膜呈较强酸性
水膜呈弱酸性或呈中性
电 极 反 应 负极(Fe) Fe-2e-=Fe2+
2Fe-4e-=2Fe +
正极(C) 2H++2e=H ↑
O +4e+2H O=4OH-
总反应 进一步反应 Fe+2H+=Fe ++H ↑
2Fe+2H O+O =2Fe(OH)
4Fe(OH) +2H O+0 =4Fe(OH) Fe O ·nH 0 联系 通常两种腐蚀同时存在,但以吸氧腐蚀为主
高中化学
吸氧腐蚀的利用
市场上出售的“热敷袋”其中的成分主要是铁粉、
碳粉、木屑和少量氯化钠、水等,热敷袋用塑料袋密封,
使用时从袋中取出轻轻揉搓就会放出热量,用完后袋内有
大量铁锈生成。
(1)热敷袋放出的热是来自Fe与氧气的反应
(2)碳粉和氯化钠的作用分别是: 。
(3)写出有关的电极反应式和化学方程式: 。
NaCl溶于水,形成电解质溶液, C 与 Fe 、NaCl 溶液构成原电池,加速Fe的氧化。
斯全身
可贴
暖宝字
取暖片
n
E 组并读果性
高中化学
高中化学
二 、金属的防护
1、 原理 防止金属失电子
2、 方法
在金属表面覆盖保护层。如油漆、油脂等,电镀Zn、Cr 等易氧
化形成致密的氧化物薄膜作保护层。
改变金属内部的组织结构, 制成合金(如不锈钢)。
电化学防护
(1)牺牲阳极的阴极保护法
形成原电池,让被保护金属做 正极,活泼金属做负极。
海水
Zn2+
锌板
(牺牲阳极)
钢 间 门( 被 保 护 阴 极)
高中化学
0000100
O
⊙
0 0
海水
辅助阳极
(石墨)
将被保护金属作为电解池 的阴极,另一导电物质作为 阳极,在外加直流电的作用 下使阴极得到保护。
(2)外加电流的阴极保护法
钢 间 门( 被 保 护 阴 极)
高中化学
0010
… 0
① 00
00
0
0
0
下列各情况,在其中Fe片腐蚀由快到慢的顺序是:
(5)>(2)>(1)>(3)>(4)
O
Fe
海 水
(5)
Fe Fe Sn Fe Zn Fe Cu
高中化学
海 水 (3)
海 水
(4)
海 水 (1)
海 水 (2)
高中化学
课堂小结
被氧化
金属
防止
氧 化
金属的防护
化学腐蚀 金属的腐蚀 电化学腐蚀
原电池正极
电解池阴极
改变结构
加保护层
析氢腐蚀
吸氧腐蚀
电化学防护
感谢同学们收看!
高中化学
金属的腐蚀与防护
高中化学
学习目标
1. 能简要说明金属发生电化学腐蚀的原理,认识金属腐蚀的
危害,能列举防止金属腐蚀的主要措施。
2. 理解钢铁吸氧腐蚀和析氢腐蚀发生的条件及原理,会书写 电极反应式和总反应式。
3.切实感受金属及合金在生产、生活中的重要作用,形成科学 利用资源的正确思想。
高中化学
金属的腐蚀在生活中 非常普遍
地球上,腐蚀无处不在,它被称作金属的癌症。
为了提高公众对腐蚀的重视程度,世界腐蚀组织把每年的
4月24日,定为“世界腐蚀日”。
高 等 学 般 教 制
金属电化学
腐蚀与防护
张 宝 宏 丛 文 博 杨 萍 编
化 学 事 些 露 版 私
Principles of
Electrochemistry of Corrosion
腐蚀电化学原理
第 三 版
曹楚南、练者
C**+****
高中化学
这些伟大成就中就凝结着我国腐蚀研究工作者的心血!
高中化学
高中化学
一 、金属的腐蚀
1、 什么是金属腐蚀
指金属或合金与周围接触到的气体或液体进行化学反应而
是金属本身失去电子变成阳离子的过程(发生氧化反应)。
M-ne-=Mn+
2、 金属腐蚀的本质是什么
腐蚀损耗的过程。
金属自身的性质 K、Na、Al、Fe、Pt、Au
内因
纯铁具有相当强的抗腐蚀性! 而生铁 (Fe、C) 易被腐蚀。
影响金属腐蚀的因素有哪些呢
外因:金属所处的环境
高中化学
金属的纯度
纯水 于煤 油 食盐水
高中化学
铁铆钉
化 学 腐 蚀
电化学腐蚀
条件 金属跟接触到的干燥气体(如SO 、 Cl 、O 等)或非电解质溶液(石油) 等直 。
不纯金属或合金
F 6 初 E 次法 位 础
现象
本质
影响 因素 与 有关
联系 两者往往同时发生 ,电化学腐蚀更普遍
高中化学
3、 金属腐蚀的类型一根据与金属接触的介质不同
4Fe(OH) +O +2H O=4Fe(OH)
Fe ++2OH-=Fe(OH) J
O +2H O+4e-=4OH-
Fe-2e-=Fe2+
高中化学
钢铁的吸氧腐蚀
高中化学
实验探究
将酸洗除锈的铁钉,用饱和食盐水浸泡后放在如图所示的装置中,
几分钟后观察导管中水柱的变化
结论:
说明装置中有气体参加反应
实验现象:
几分钟后,装置中的 导管中水柱上升
高中化学
实验探究
滴加铁氰化钾
滴加酚酞
指针偏转
高中化学
实验探究
H,
Fe
Fe、e-
e
Fe + 稀盐酸 (H+)
H++2e-=H ↑
钢铁的析氢腐蚀
Q
e
电脑
压强传感器
一定pH 数据采集器 的醋酸溶液
高中化学
实验探究
在什么条件下,钢铁发生吸氧腐蚀或析氢腐蚀呢
铁和炭粉
电化学腐蚀 析氢腐蚀
吸氧腐蚀
条件 水膜呈较强酸性
水膜呈弱酸性或呈中性
电 极 反 应 负极(Fe) Fe-2e-=Fe2+
2Fe-4e-=2Fe +
正极(C) 2H++2e=H ↑
O +4e+2H O=4OH-
总反应 进一步反应 Fe+2H+=Fe ++H ↑
2Fe+2H O+O =2Fe(OH)
4Fe(OH) +2H O+0 =4Fe(OH) Fe O ·nH 0 联系 通常两种腐蚀同时存在,但以吸氧腐蚀为主
高中化学
吸氧腐蚀的利用
市场上出售的“热敷袋”其中的成分主要是铁粉、
碳粉、木屑和少量氯化钠、水等,热敷袋用塑料袋密封,
使用时从袋中取出轻轻揉搓就会放出热量,用完后袋内有
大量铁锈生成。
(1)热敷袋放出的热是来自Fe与氧气的反应
(2)碳粉和氯化钠的作用分别是: 。
(3)写出有关的电极反应式和化学方程式: 。
NaCl溶于水,形成电解质溶液, C 与 Fe 、NaCl 溶液构成原电池,加速Fe的氧化。
斯全身
可贴
暖宝字
取暖片
n
E 组并读果性
高中化学
高中化学
二 、金属的防护
1、 原理 防止金属失电子
2、 方法
在金属表面覆盖保护层。如油漆、油脂等,电镀Zn、Cr 等易氧
化形成致密的氧化物薄膜作保护层。
改变金属内部的组织结构, 制成合金(如不锈钢)。
电化学防护
(1)牺牲阳极的阴极保护法
形成原电池,让被保护金属做 正极,活泼金属做负极。
海水
Zn2+
锌板
(牺牲阳极)
钢 间 门( 被 保 护 阴 极)
高中化学
0000100
O
⊙
0 0
海水
辅助阳极
(石墨)
将被保护金属作为电解池 的阴极,另一导电物质作为 阳极,在外加直流电的作用 下使阴极得到保护。
(2)外加电流的阴极保护法
钢 间 门( 被 保 护 阴 极)
高中化学
0010
… 0
① 00
00
0
0
0
下列各情况,在其中Fe片腐蚀由快到慢的顺序是:
(5)>(2)>(1)>(3)>(4)
O
Fe
海 水
(5)
Fe Fe Sn Fe Zn Fe Cu
高中化学
海 水 (3)
海 水
(4)
海 水 (1)
海 水 (2)
高中化学
课堂小结
被氧化
金属
防止
氧 化
金属的防护
化学腐蚀 金属的腐蚀 电化学腐蚀
原电池正极
电解池阴极
改变结构
加保护层
析氢腐蚀
吸氧腐蚀
电化学防护
感谢同学们收看!
高中化学
