电化学专题复习课件(共19张PPT)
图片预览



文档简介
(共19张PPT)
电化学专题(二)
高中化学
学习任务与目标
1.通过对盐桥原理的分析, 形成宏观现象和微观原理相结合的认知角度,
将盐桥化为选择性透过的离子交换膜, 深化对电化学原理的理解和认识;
2.通过对不同类型的选择性透过膜在具体情况下的应用, 提升对于选择性
透过膜的模型认知;
3.认识化学能与电能相互转化的实际意义及其重要应用, 了解电化学在生
产生活中的重要作用, 体会化学学科的有用性。
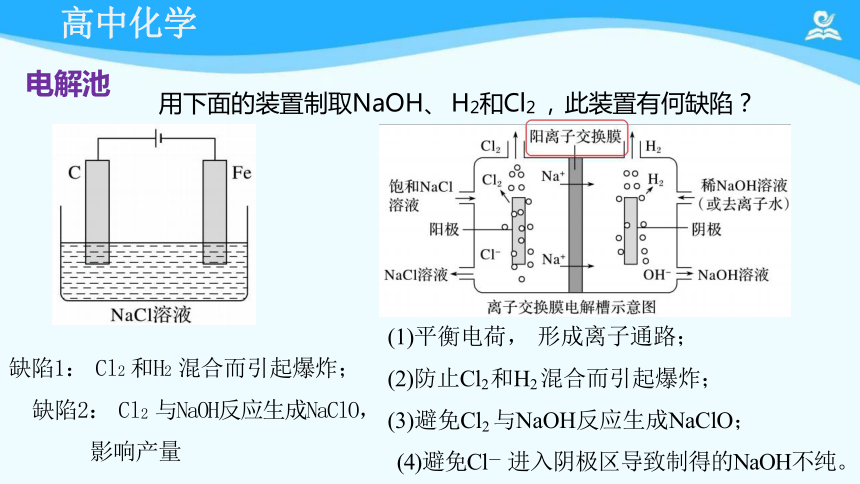
(1)平衡电荷, 形成离子通路;
(2)防止Cl2 和H2 混合而引起爆炸;
(3)避免Cl2 与NaOH反应生成NaClO;
(4)避免Cl- 进入阴极区导致制得的NaOH不纯。
缺陷1: Cl2 和H2 混合而引起爆炸;
缺陷2: Cl2 与NaOH反应生成NaClO,
影响产量
用下面的装置制取NaOH、 H2和Cl2 , 此装置有何缺陷?
高中化学
电解池
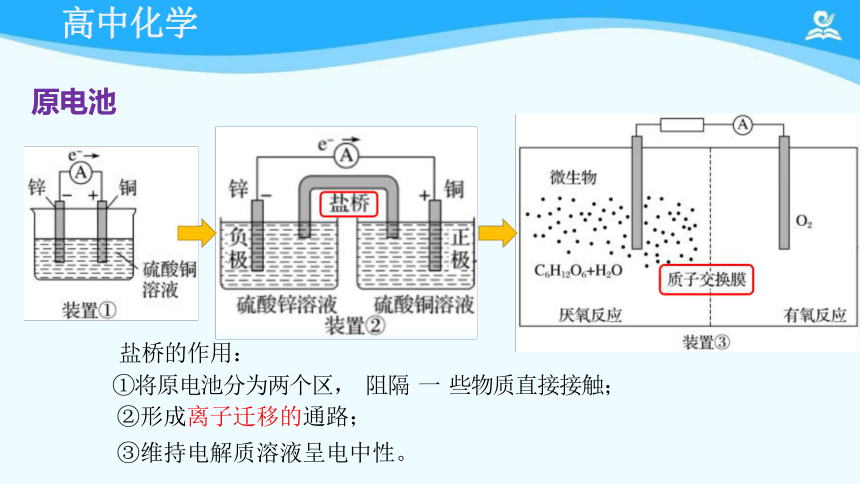
盐桥的作用:
①将原电池分为两个区, 阻隔 一 些物质直接接触;
②形成离子迁移的通路;
③维持电解质溶液呈电中性。
高中化学
原电池
高中化学
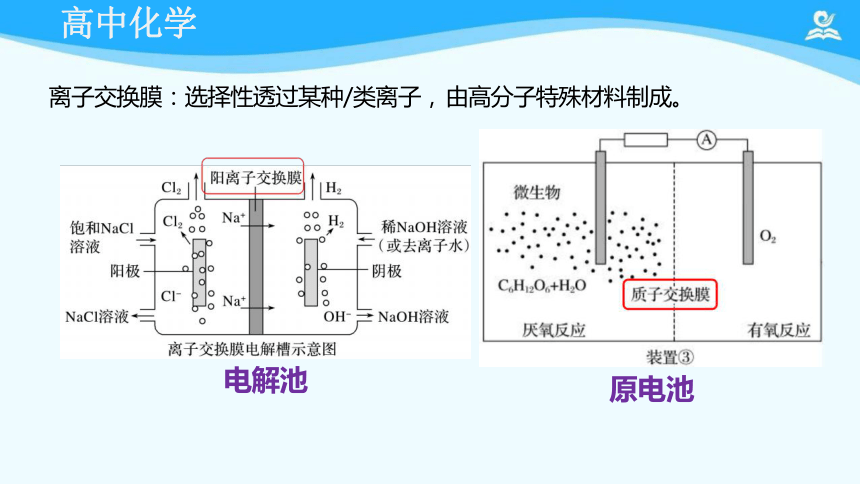
离子交换膜:选择性透过某种/类离子, 由高分子特殊材料制成。
原电池
电解池
高中化学
离子交换膜:选择性透过某种/类离子, 由高分子特殊材料制成。
分类 - 阴离子交换膜: 只允许阴离子通过
隔离: 阻止两极区物质接触, 防止发生化学反应
选择性通过离子: 平衡电荷和离子浓度、 形成离子通路
质 子交换膜: 只允许H+ 通过
选择依据 离子的定向移动
分离提纯: 海水淡化等
物质制备: 氯碱工业等
燃料电池等
阳离子交换膜: 只允许阳离子通过
作用
应用
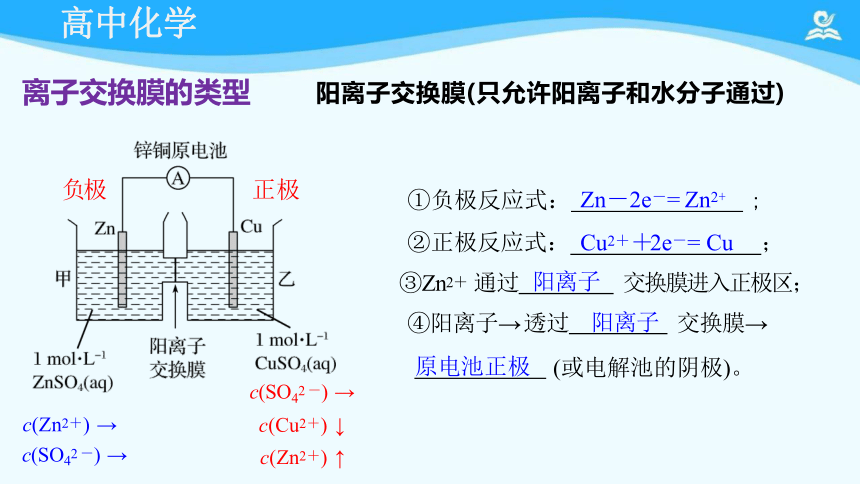
①负极反应式: Zn-2e-= Zn2+ ;
②正极反应式: Cu2++2e-= Cu ;
③Zn2+ 通过 阳离子 交换膜进入正极区;
④阳离子→ 透过 阳离子 交换膜→
原电池正极 (或电解池的阴极)。
高中化学
离子交换膜的类型
阳离子交换膜(只允许阳离子和水分子通过)
c(SO42 -) →
c(Cu2+) ↓
c(Zn2+) ↑
c(Zn2+) →
c(SO42 -) →
负极
正极
①负极反应式: Zn-2e-= Zn2+ ;
②正极反应式: Cu2++2e-= Cu ;
③SO42 - 通过 阴离子交换膜进入负极区;
④阴离子→ 透过 阴离子 交换膜→
原电池负极 (或电解池的阳极)。
高中化学
离子交换膜的类型
阴离子交换膜(只允许阴离子和水分子通过)
c(SO42 -) ↓
c(Cu2+) ↓
c(Zn2+) ↑
c(SO42 -) ↑
阴
负极
正极
高中化学
离子交换膜的类型 阴离子交换膜(只允许阴离子和水分子通过)
以Pt为电极电解淀粉-KI溶液, 中间用阴离子交换膜隔开
①阴极反应式: 2H2O+2e- = H2 ↑+2OH- ; ②阳极反应式: 2I- -2e- = I2 ;
③阴极产生的OH- 移向 阳极 与阳极产物反应:
3I2+6OH-= IO +5I-+3H2O ;
④阴离子→ 透过 阴离子 交换膜
→ 电解池 阳极 (或原电池的负极 )。
3
-
淀粉-KI溶液
溶液不变蓝
OH-
阴极
阳极
高中化学
离子交换膜的类型 质子交换膜(只允许H+和水分子通过)
在微生物作用下电解有机废水(含CH3COOH), 可获得清洁能源H2
①阴极反应式: 2H++2e-= H2 ↑ ;
②阳极反应式:
CH3COOH-8e-+2H2O = 2CO2 ↑+8H+ ;
③阳极产生的H+ 通过质子交换膜移向 阴极 ;
④H+ → 透过质子交换膜→ 电解池阴极 。
H+
正极: 3O2+12e-+12H+ =6H2O
A.该装置能实现化学能1 0%转化为电能
B. 电子移动方向为:a极→b极→质子交×换膜→a极
a 电极的电极反应式为:
CH3OCH3+3H2O - 12e- = 2CO2+12H+
D. 当b电极消耗22. L O2 时, 质子交换膜有
4 mol H+ 通过
高中化学
离子交换膜在原电池中的应用
二 甲醚(CH3OCH3)燃料电池的工作原理如图, 有关叙述正确的是
高中化学
随着各地“ 限牌” 政策的推出, 电动汽车成为汽车族的“ 新宠” 。 某电动汽车使用的
是钴酸锂(LiCoO2)电池, 其工作原理如图所示, 电解质为 一种能传导Li+ 的高分
子材料, 隔膜只允许Li+ 通过, 电池反应式为Lix C6+Li1-x CoO2 C6+LiCoO2。
A.放电时, 正极锂的化合价未发生改变
B. 充电时Li+ 移动方向: 右室→ 左室√
C.放电时负极的电极反应式:
Lix C6-xe-= C6+xLi+ √
D. 充电时阳极的电极反应式:
Li1-x CoO2+xLi++xe-= LiCoO2 ×
+1 -x 0
下列说法不正确的是
√
√
负极
Li+
离子交换膜在电解池中的应用 类型一 “单膜”电解池
利用LiOH和钴氧化物可制备锂离子电池正极材料 。 可用电解LiCl溶液制备
LiOH, 装置如下图所示 。 下列说法中正确的是
A. 电极B连接电源正×极
A极区电解液为LiCl溶液
C. 阳×极反应式为2H2O+2e- = H2 ↑+2OH-
D.每生成1 mol H2, 有1 ol Li+ 通过该离子 交换膜
阴极
Li+
OH-
2Cl- -2e- = Cl2 ↑
高中化学
LiCl溶液
A. 电极a 为粗铜, 电极b为精铜 ×
B 乙 膜为过滤膜, 可阻止阳极泥及漂浮物杂质进入阴极区
C甲 膜为阴离子交换膜, 可阻止杂质阳离子进入阴极区
普通电解精炼铜的方法所制备的铜中仍含杂质, 利用下面的双膜(阴离子交换
膜和过滤膜)电解装置可制备高纯度的Cu 。 下列有关叙述中正确的是
高中化学
离子交换膜在电解池中的应用
当 , 可生成32 g 精铜 √
Cu
时
-
电
2
o
Cu2
通过
:
中
极
路
阴
电
类型二 “双膜”电解池
阴极 阳极
下列叙述不正确的是 O2
A. 膜a 、 膜c分别是阴离子交换膜 、 阳离子交换膜
C. 阳极的电极反应式为2H2O -4e- = 4H++O2 ↑
D.该装置工作时, 电路中每转移0.2 mol电子,
两极共生成气体3.36 L(标准状况) HNO3
高中化学
用电渗析法可将含硝酸钠的废水再生为硝酸和氢氧化钠, 其装置如下图所示。
. 阳极室 、 阴极室的产品分别是氢氧化钠 、硝酸
阳极: 2H2O -4e- = 4H++O2 ↑
阴极: 4H2O+4e- = 4OH-+2H2 ↑
H + NO3 -
Na+ OH-
NaOH
H2
电渗析
将含AnBm 的废水再生为HnB和A(OH)m
A为氢前金属,
Bn - 为最高价含氧酸根离子。
高中化学
离子交换膜在电解池中的应用
H3PO2 也可用电渗析法制备。
“ 四室电渗析法” 工作原理如图所示
①写出阳极的电极反应式:
2H2O -4e-= 4H+ +O2 ↑ 。
②分析产品室可得到H3PO2 的原因:
阳极
O2
↑
H2PO2 -
Na+
H2PO 穿过阴膜扩散至产品室 ,二者反应生成 H3PO2
。
___________________________________________________
2
-
阳极室的H+ 穿过阳膜扩散至产品室, 原料室的
类型三 “多膜”电解池
高中化学
H2
↑
阴极
H +
高中化学
③早期采用“ 三室电渗析法” 制备H3PO2: 将“ 四室电渗析法” 中阳极室的稀硫
酸用H3PO2 稀溶液代替, 并撤去阳极室与产品室之间的阳膜, 从而合并了阳
其缺点是产品中混有 PO43- 杂质。
该杂质产生的原因是:
H2PO 或 H3PO2 被氧化
。
_______________________
2
-
极室与产品室。
感谢同学们的收看, 祝同学们学习进步!
高中化学
电化学专题(二)
高中化学
学习任务与目标
1.通过对盐桥原理的分析, 形成宏观现象和微观原理相结合的认知角度,
将盐桥化为选择性透过的离子交换膜, 深化对电化学原理的理解和认识;
2.通过对不同类型的选择性透过膜在具体情况下的应用, 提升对于选择性
透过膜的模型认知;
3.认识化学能与电能相互转化的实际意义及其重要应用, 了解电化学在生
产生活中的重要作用, 体会化学学科的有用性。
(1)平衡电荷, 形成离子通路;
(2)防止Cl2 和H2 混合而引起爆炸;
(3)避免Cl2 与NaOH反应生成NaClO;
(4)避免Cl- 进入阴极区导致制得的NaOH不纯。
缺陷1: Cl2 和H2 混合而引起爆炸;
缺陷2: Cl2 与NaOH反应生成NaClO,
影响产量
用下面的装置制取NaOH、 H2和Cl2 , 此装置有何缺陷?
高中化学
电解池
盐桥的作用:
①将原电池分为两个区, 阻隔 一 些物质直接接触;
②形成离子迁移的通路;
③维持电解质溶液呈电中性。
高中化学
原电池
高中化学
离子交换膜:选择性透过某种/类离子, 由高分子特殊材料制成。
原电池
电解池
高中化学
离子交换膜:选择性透过某种/类离子, 由高分子特殊材料制成。
分类 - 阴离子交换膜: 只允许阴离子通过
隔离: 阻止两极区物质接触, 防止发生化学反应
选择性通过离子: 平衡电荷和离子浓度、 形成离子通路
质 子交换膜: 只允许H+ 通过
选择依据 离子的定向移动
分离提纯: 海水淡化等
物质制备: 氯碱工业等
燃料电池等
阳离子交换膜: 只允许阳离子通过
作用
应用
①负极反应式: Zn-2e-= Zn2+ ;
②正极反应式: Cu2++2e-= Cu ;
③Zn2+ 通过 阳离子 交换膜进入正极区;
④阳离子→ 透过 阳离子 交换膜→
原电池正极 (或电解池的阴极)。
高中化学
离子交换膜的类型
阳离子交换膜(只允许阳离子和水分子通过)
c(SO42 -) →
c(Cu2+) ↓
c(Zn2+) ↑
c(Zn2+) →
c(SO42 -) →
负极
正极
①负极反应式: Zn-2e-= Zn2+ ;
②正极反应式: Cu2++2e-= Cu ;
③SO42 - 通过 阴离子交换膜进入负极区;
④阴离子→ 透过 阴离子 交换膜→
原电池负极 (或电解池的阳极)。
高中化学
离子交换膜的类型
阴离子交换膜(只允许阴离子和水分子通过)
c(SO42 -) ↓
c(Cu2+) ↓
c(Zn2+) ↑
c(SO42 -) ↑
阴
负极
正极
高中化学
离子交换膜的类型 阴离子交换膜(只允许阴离子和水分子通过)
以Pt为电极电解淀粉-KI溶液, 中间用阴离子交换膜隔开
①阴极反应式: 2H2O+2e- = H2 ↑+2OH- ; ②阳极反应式: 2I- -2e- = I2 ;
③阴极产生的OH- 移向 阳极 与阳极产物反应:
3I2+6OH-= IO +5I-+3H2O ;
④阴离子→ 透过 阴离子 交换膜
→ 电解池 阳极 (或原电池的负极 )。
3
-
淀粉-KI溶液
溶液不变蓝
OH-
阴极
阳极
高中化学
离子交换膜的类型 质子交换膜(只允许H+和水分子通过)
在微生物作用下电解有机废水(含CH3COOH), 可获得清洁能源H2
①阴极反应式: 2H++2e-= H2 ↑ ;
②阳极反应式:
CH3COOH-8e-+2H2O = 2CO2 ↑+8H+ ;
③阳极产生的H+ 通过质子交换膜移向 阴极 ;
④H+ → 透过质子交换膜→ 电解池阴极 。
H+
正极: 3O2+12e-+12H+ =6H2O
A.该装置能实现化学能1 0%转化为电能
B. 电子移动方向为:a极→b极→质子交×换膜→a极
a 电极的电极反应式为:
CH3OCH3+3H2O - 12e- = 2CO2+12H+
D. 当b电极消耗22. L O2 时, 质子交换膜有
4 mol H+ 通过
高中化学
离子交换膜在原电池中的应用
二 甲醚(CH3OCH3)燃料电池的工作原理如图, 有关叙述正确的是
高中化学
随着各地“ 限牌” 政策的推出, 电动汽车成为汽车族的“ 新宠” 。 某电动汽车使用的
是钴酸锂(LiCoO2)电池, 其工作原理如图所示, 电解质为 一种能传导Li+ 的高分
子材料, 隔膜只允许Li+ 通过, 电池反应式为Lix C6+Li1-x CoO2 C6+LiCoO2。
A.放电时, 正极锂的化合价未发生改变
B. 充电时Li+ 移动方向: 右室→ 左室√
C.放电时负极的电极反应式:
Lix C6-xe-= C6+xLi+ √
D. 充电时阳极的电极反应式:
Li1-x CoO2+xLi++xe-= LiCoO2 ×
+1 -x 0
下列说法不正确的是
√
√
负极
Li+
离子交换膜在电解池中的应用 类型一 “单膜”电解池
利用LiOH和钴氧化物可制备锂离子电池正极材料 。 可用电解LiCl溶液制备
LiOH, 装置如下图所示 。 下列说法中正确的是
A. 电极B连接电源正×极
A极区电解液为LiCl溶液
C. 阳×极反应式为2H2O+2e- = H2 ↑+2OH-
D.每生成1 mol H2, 有1 ol Li+ 通过该离子 交换膜
阴极
Li+
OH-
2Cl- -2e- = Cl2 ↑
高中化学
LiCl溶液
A. 电极a 为粗铜, 电极b为精铜 ×
B 乙 膜为过滤膜, 可阻止阳极泥及漂浮物杂质进入阴极区
C甲 膜为阴离子交换膜, 可阻止杂质阳离子进入阴极区
普通电解精炼铜的方法所制备的铜中仍含杂质, 利用下面的双膜(阴离子交换
膜和过滤膜)电解装置可制备高纯度的Cu 。 下列有关叙述中正确的是
高中化学
离子交换膜在电解池中的应用
当 , 可生成32 g 精铜 √
Cu
时
-
电
2
o
Cu2
通过
:
中
极
路
阴
电
类型二 “双膜”电解池
阴极 阳极
下列叙述不正确的是 O2
A. 膜a 、 膜c分别是阴离子交换膜 、 阳离子交换膜
C. 阳极的电极反应式为2H2O -4e- = 4H++O2 ↑
D.该装置工作时, 电路中每转移0.2 mol电子,
两极共生成气体3.36 L(标准状况) HNO3
高中化学
用电渗析法可将含硝酸钠的废水再生为硝酸和氢氧化钠, 其装置如下图所示。
. 阳极室 、 阴极室的产品分别是氢氧化钠 、硝酸
阳极: 2H2O -4e- = 4H++O2 ↑
阴极: 4H2O+4e- = 4OH-+2H2 ↑
H + NO3 -
Na+ OH-
NaOH
H2
电渗析
将含AnBm 的废水再生为HnB和A(OH)m
A为氢前金属,
Bn - 为最高价含氧酸根离子。
高中化学
离子交换膜在电解池中的应用
H3PO2 也可用电渗析法制备。
“ 四室电渗析法” 工作原理如图所示
①写出阳极的电极反应式:
2H2O -4e-= 4H+ +O2 ↑ 。
②分析产品室可得到H3PO2 的原因:
阳极
O2
↑
H2PO2 -
Na+
H2PO 穿过阴膜扩散至产品室 ,二者反应生成 H3PO2
。
___________________________________________________
2
-
阳极室的H+ 穿过阳膜扩散至产品室, 原料室的
类型三 “多膜”电解池
高中化学
H2
↑
阴极
H +
高中化学
③早期采用“ 三室电渗析法” 制备H3PO2: 将“ 四室电渗析法” 中阳极室的稀硫
酸用H3PO2 稀溶液代替, 并撤去阳极室与产品室之间的阳膜, 从而合并了阳
其缺点是产品中混有 PO43- 杂质。
该杂质产生的原因是:
H2PO 或 H3PO2 被氧化
。
_______________________
2
-
极室与产品室。
感谢同学们的收看, 祝同学们学习进步!
高中化学
同课章节目录
