电化学专题课件(共19张PPT)
图片预览





文档简介
(共18张PPT)
电化学专题(一)
高中化学
学习任务与目标
1.通过对原电池和电解池原理的梳理, 深化对电化学原理的理解和认识;
2.通过练习不同电极、 不同电解质溶液 、 不同浓度等条件下电极反应式
的书写, 深化对电化学原理的微观认知和宏观认识, 提高化学语言表 达的规范性;
3.通过了解电化学原理在生产生活中 、 高科技领域的具体应用, 体会化
学学科的有用性。
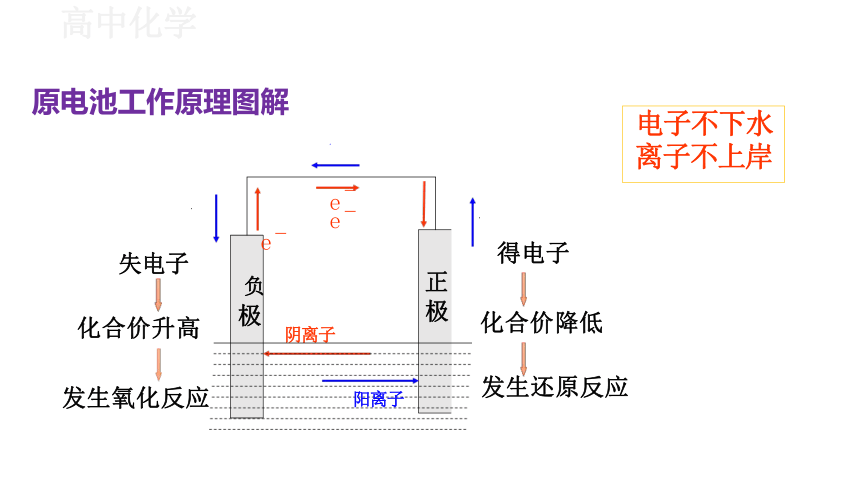
Ⅰ
失电子
化合价升高
发生氧化反应
Ⅰ
得电子
化合价降低
发生还原反应
负
极
阴离子
正
极
阳离子
原电池工作原理图解
Ⅰ
电子不下水
离子不上岸
e- e-
e-
高中化学
高中化学
原电池电极反应式书写
(一)辨析介质
1.按要求书写不同“ 介质” 下甲醇燃料电 池的电极反应式。
(1)酸性介质, 如H2SO4 溶液: 2CH3OH+3O2 = 2CO2+4H2O 负极: 2CH3OH- 12e-+2H2O = 2CO2+12H+ 。
正极: 3O2+12e-+12H+ = 6H2O 。
2CO2+4OH- = 2CO32-+2H2O
(2)碱性介质, 如KOH溶液:2CH3OH+3O2+4OH- = 2CO32-+6H2O 负极: 2CH3OH- 12e-+16OH- = 2CO32-+8H2O 。
正极: 3O2+12e-+6H2O = 12OH- 。
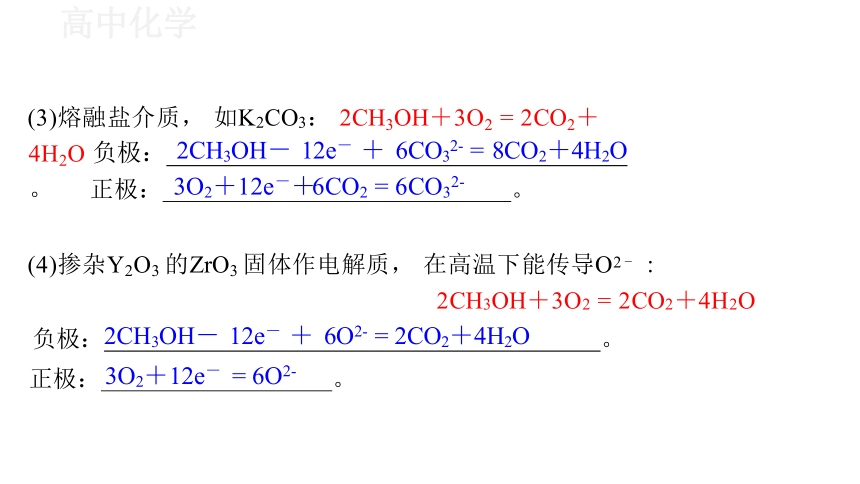
(4)掺杂Y2O3 的ZrO3 固体作电解质, 在高温下能传导O2 - :
2CH3OH+3O2 = 2CO2+4H2O
负极:2CH3OH- 12e- + 6O2- = 2CO2+4H2O 。
正极: 3O2+12e- = 6O2- 。
(3)熔融盐介质, 如K2CO3: 2CH3OH+3O2 = 2CO2+4H2O 负极: 2CH3OH- 12e- + 6CO32- = 8CO2+4H2O 。 正极: 3O2+12e-+6CO2 = 6CO32- 。
高中化学
(二)辨析电极
1. 仅有一电极材料参加反应
负极: Zn-2e- = Zn2+
正极: 2H+ + 2e- = H2
总反应: Zn + 2H+ = Zn2+ + H2
负极: 2Fe-4e- = 2Fe2+
正极: O2 + 4e- + 2H2O = 4OH-
总反应: 2Fe + O2 + 2H2O = 2Fe(OH)2
高中化学
高中化学
2. 两电极材料均参加反应
2.我国科学家发明的水溶液锂电池为电动汽车发展扫除了障碍, 装置原理如
图所示, 其中固体薄膜只允许Li+ 通过 。锂离子电池的总反应为
xLi + Li1-xMn2O4 LiMn2O4 。 下列有关说法错误的是( )
充电
放电
A.放电时,Li+ 穿过固体薄膜进入水溶液
B.放电时, 正极反应为
Li1-xMn2O4+xLi++xe- = LiMn2O4
C. 充电时, 电极b为阳极, 发生氧化反应
D.该电池的缺点是存在副反应
2Li+2H2O = 2LiOH+H2 ↑
负极:
xLi - xe- = xLi+
√
高中化学
3. 两电极材料均不参加反应
3.将燃煤产生的二 氧化碳回收利用, 可达到低碳排放的目的 。 下图是通过人
工光合作用, 以CO2 和H2O为原料制备HCOOH和O2 的原理示意图。
总反应:2CO2+2H2O = 2HCOOH + O2
电极b作 正 极,
表面发生的电极反应为
CO2 +2e- +2H+ = H COOH。
高中化学
(三)电解质浓度变化
注意溶液中的离子浓度的差异会形成原电池
4. 浓差电池中的电动势是由于电池中存在浓度差而产生的 。 某浓差电池的
原理如图所示, 该电池从浓缩海水中提取LiCl的同时又获得了电能。
X为 正 极,
两级电势差产生的原因:
渗 透压,Li+ 向 浓度低 的 一 端 迁移
Y极反应式为2Cl- +2e- = Cl2。
Li+ 浓度高
Li+ 浓度低
Li+
,
高中化学
图解电解池工作原理(惰性电极)
失电子
化合价升高
发生氧化反应
得电子
化合价降低
发生还原反应
阴离子
阳离子
e- e-
阳
极
阴
极
高中化学
书写电解池的电极反应式
(1) 一看电极材料:
若是金属(金 、 铂除外)作阳极, 金属 一 定被氧化。
(注意: 一般情况下, 铁失去电子被氧化为Fe2+)
(2)二看电解质是否参与电极反应:
对于碱性电解质, 常用OH- 和H2O来配平电荷与原子数;
对于酸性电解质, 常用H+ 和H2O来配平电荷与原子数。
(3)三看电解物质状态:
若是熔融金属氧化物或盐, 一般就是金属冶炼。
高中化学
(一)辨析电极
5. 以等质量的铂棒和铜棒作电极, 电解硫酸铜溶液, 通电 一段时间后, 其中 一 极
阳极 材料 电极反应
阴极
材料
阳极 阴极 Cu Cu -2e- = Cu2+ Cu2++2e- = Cu
Pt
Pt 4 OH- -4e- = 2H2O+ O2 +2++2 e--==C2uCu
Cu
阳极: 活性电极→电极本身失电子而溶解 , 溶液中的阴离子不放电。
惰性电极→阳极不参加反应 , 溶液中的阴离子放电。
增加质量为“ g, 此时两极的质量差为:√① “ g 2“ g ③
A.① B√.①②
增加“ g
增加“ g
减少“ g
不变
C.①②③ D.④
④ 无法判断
g
电解过程中 ,铜电极上有H2 产生
B. 电解 一 定时间后, 石墨电极上有铜析出
C. 整个电解过程中,H+ 的浓度不断减小 D. 电解初期, 总反应方程式为:
Cu+H2 SO4 电解 CuSO4+H2 ↑
高中化学
辨析介质和浓度
6. 某同学按图所示的装置进行电解实验 。 下列说法错误的是
阳极:Cu-2e- =Cu2+
阴极:2H++2e- =H2 ↑ Cu2++2e- =Cu
稀H2 SO4
石墨
Cu
高中化学
(二)电解质浓度变化
注意溶液中的离子浓度的改变会引起离子放电顺序的改变
7. 用下面的装置电解 一 定浓度的NaCl溶液, 一段时间后, 阳极可能产生什
阳极:2Cl- -2e- =Cl2
Na+ 阳极:4OH- -4e- =2H2O+O2 ↑
石墨 石墨
阴极:2H++2e- =H2 ↑
阴极:4H++4e- =2H2 ↑
- 电源 +
么气体 。 为什么?
OH-
8.在100 mL H2 SO4 和CuSO4 的混合液中, 用石墨作电极进行电解, 两极上均
收集到2.24 L气体(标准状况), 则原混合液中 ,Cu2+ 的物质的量浓度为( )
A. 1 mol/L B.2 mol/L C. 3 mol/L D.4 mol/L
阳极:4OH- -4e- = 2H2O+O2 ↑
失0.4 mol 0. 1 mol
阴极: 先Cu2++2e- = Cu, 然后2H++2e- = H2 ↑
高中化学
0. 1 mol 得0.2 mol
得0.2 mol
0. 1 mol
意图如下, 电解总反应: 2Cu+H2O Cu2O+H2
A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0. 1 mol电子转移时, 有0. 1 mol Cu2O生成。
高中化学
(三)辨析介质
注意溶液的pH改变会引起产物的改变
√
阳极:2Cu+H2O -2e- =Cu2O+2H+
阴极:2H++2e- =H2 ↑
稀H2 SO4
9.Cu2O是 一种半导体材料, 基于绿色化学理念设计的制取 Cu2O的电解池示
下列说法正确的是
电解
石墨
石墨
H2O
Cu
Cu
高中化学
(四)其他条件: 如电压
10. 用FeCl3 酸性溶液脱除H2 S后的废液, 通过控制电压电解得以再生。
某同学使用石墨电极, 在不同电压( x) 下电解pH= 1的0. 1 mol/L FeCl2 溶液,
研究废液再生机理, 记录( a 、b 、c代表电压值):
序号 电压/V 阳极现象
检验阳极产物
Ⅰ x≥a 电极附近出现黄色, 有气泡产生
有Fe3+ 、 有Cl2
Ⅱ a>x≥b 电极附近出现黄色, 无气泡产生
有Fe3+ 、 无Cl2
Ⅲ b>x>0 无明显现象
无Fe3+ 、 无Cl2
Ⅰ中Fe3+产生的原因:
可能是Cl-在阳极放电, 生成的Cl2 将Fe2+氧化:
还可能是Fe2+在阳极放电, 原因是Fe2+具有还原性. 阳极:2Fe2+ -2e- =2Fe3+
阳极:2Cl- -2e- =Cl2 Cl2 +2Fe2+ =2Cl-+2Fe3+ .
高中化学
Ⅱ中虽未检验处Cl2,但Cl-在阳极是否放电仍需进 一 步验证。
电解pH= 1的NaCl溶液做对照试验, 记录如下:
序号 电压/V 阳极现象
检验阳极产物
Ⅱ a>x≥b 电极附近出现黄色, 无气泡产生
有Fe3+ 、 无Cl2
Ⅳ a>x≥c 无明显变化
有Cl2
Ⅴ c>x≥b 无明显变化
无Cl2
阳极:2Cl- -2e- =Cl2
2Fe2+ -2e- =2Fe3+
a
阳极:2Fe2+ -2e- =2Fe3+
电压/V
b
c
电化学专题(一)
高中化学
学习任务与目标
1.通过对原电池和电解池原理的梳理, 深化对电化学原理的理解和认识;
2.通过练习不同电极、 不同电解质溶液 、 不同浓度等条件下电极反应式
的书写, 深化对电化学原理的微观认知和宏观认识, 提高化学语言表 达的规范性;
3.通过了解电化学原理在生产生活中 、 高科技领域的具体应用, 体会化
学学科的有用性。
Ⅰ
失电子
化合价升高
发生氧化反应
Ⅰ
得电子
化合价降低
发生还原反应
负
极
阴离子
正
极
阳离子
原电池工作原理图解
Ⅰ
电子不下水
离子不上岸
e- e-
e-
高中化学
高中化学
原电池电极反应式书写
(一)辨析介质
1.按要求书写不同“ 介质” 下甲醇燃料电 池的电极反应式。
(1)酸性介质, 如H2SO4 溶液: 2CH3OH+3O2 = 2CO2+4H2O 负极: 2CH3OH- 12e-+2H2O = 2CO2+12H+ 。
正极: 3O2+12e-+12H+ = 6H2O 。
2CO2+4OH- = 2CO32-+2H2O
(2)碱性介质, 如KOH溶液:2CH3OH+3O2+4OH- = 2CO32-+6H2O 负极: 2CH3OH- 12e-+16OH- = 2CO32-+8H2O 。
正极: 3O2+12e-+6H2O = 12OH- 。
(4)掺杂Y2O3 的ZrO3 固体作电解质, 在高温下能传导O2 - :
2CH3OH+3O2 = 2CO2+4H2O
负极:2CH3OH- 12e- + 6O2- = 2CO2+4H2O 。
正极: 3O2+12e- = 6O2- 。
(3)熔融盐介质, 如K2CO3: 2CH3OH+3O2 = 2CO2+4H2O 负极: 2CH3OH- 12e- + 6CO32- = 8CO2+4H2O 。 正极: 3O2+12e-+6CO2 = 6CO32- 。
高中化学
(二)辨析电极
1. 仅有一电极材料参加反应
负极: Zn-2e- = Zn2+
正极: 2H+ + 2e- = H2
总反应: Zn + 2H+ = Zn2+ + H2
负极: 2Fe-4e- = 2Fe2+
正极: O2 + 4e- + 2H2O = 4OH-
总反应: 2Fe + O2 + 2H2O = 2Fe(OH)2
高中化学
高中化学
2. 两电极材料均参加反应
2.我国科学家发明的水溶液锂电池为电动汽车发展扫除了障碍, 装置原理如
图所示, 其中固体薄膜只允许Li+ 通过 。锂离子电池的总反应为
xLi + Li1-xMn2O4 LiMn2O4 。 下列有关说法错误的是( )
充电
放电
A.放电时,Li+ 穿过固体薄膜进入水溶液
B.放电时, 正极反应为
Li1-xMn2O4+xLi++xe- = LiMn2O4
C. 充电时, 电极b为阳极, 发生氧化反应
D.该电池的缺点是存在副反应
2Li+2H2O = 2LiOH+H2 ↑
负极:
xLi - xe- = xLi+
√
高中化学
3. 两电极材料均不参加反应
3.将燃煤产生的二 氧化碳回收利用, 可达到低碳排放的目的 。 下图是通过人
工光合作用, 以CO2 和H2O为原料制备HCOOH和O2 的原理示意图。
总反应:2CO2+2H2O = 2HCOOH + O2
电极b作 正 极,
表面发生的电极反应为
CO2 +2e- +2H+ = H COOH。
高中化学
(三)电解质浓度变化
注意溶液中的离子浓度的差异会形成原电池
4. 浓差电池中的电动势是由于电池中存在浓度差而产生的 。 某浓差电池的
原理如图所示, 该电池从浓缩海水中提取LiCl的同时又获得了电能。
X为 正 极,
两级电势差产生的原因:
渗 透压,Li+ 向 浓度低 的 一 端 迁移
Y极反应式为2Cl- +2e- = Cl2。
Li+ 浓度高
Li+ 浓度低
Li+
,
高中化学
图解电解池工作原理(惰性电极)
失电子
化合价升高
发生氧化反应
得电子
化合价降低
发生还原反应
阴离子
阳离子
e- e-
阳
极
阴
极
高中化学
书写电解池的电极反应式
(1) 一看电极材料:
若是金属(金 、 铂除外)作阳极, 金属 一 定被氧化。
(注意: 一般情况下, 铁失去电子被氧化为Fe2+)
(2)二看电解质是否参与电极反应:
对于碱性电解质, 常用OH- 和H2O来配平电荷与原子数;
对于酸性电解质, 常用H+ 和H2O来配平电荷与原子数。
(3)三看电解物质状态:
若是熔融金属氧化物或盐, 一般就是金属冶炼。
高中化学
(一)辨析电极
5. 以等质量的铂棒和铜棒作电极, 电解硫酸铜溶液, 通电 一段时间后, 其中 一 极
阳极 材料 电极反应
阴极
材料
阳极 阴极 Cu Cu -2e- = Cu2+ Cu2++2e- = Cu
Pt
Pt 4 OH- -4e- = 2H2O+ O2 +2++2 e--==C2uCu
Cu
阳极: 活性电极→电极本身失电子而溶解 , 溶液中的阴离子不放电。
惰性电极→阳极不参加反应 , 溶液中的阴离子放电。
增加质量为“ g, 此时两极的质量差为:√① “ g 2“ g ③
A.① B√.①②
增加“ g
增加“ g
减少“ g
不变
C.①②③ D.④
④ 无法判断
g
电解过程中 ,铜电极上有H2 产生
B. 电解 一 定时间后, 石墨电极上有铜析出
C. 整个电解过程中,H+ 的浓度不断减小 D. 电解初期, 总反应方程式为:
Cu+H2 SO4 电解 CuSO4+H2 ↑
高中化学
辨析介质和浓度
6. 某同学按图所示的装置进行电解实验 。 下列说法错误的是
阳极:Cu-2e- =Cu2+
阴极:2H++2e- =H2 ↑ Cu2++2e- =Cu
稀H2 SO4
石墨
Cu
高中化学
(二)电解质浓度变化
注意溶液中的离子浓度的改变会引起离子放电顺序的改变
7. 用下面的装置电解 一 定浓度的NaCl溶液, 一段时间后, 阳极可能产生什
阳极:2Cl- -2e- =Cl2
Na+ 阳极:4OH- -4e- =2H2O+O2 ↑
石墨 石墨
阴极:2H++2e- =H2 ↑
阴极:4H++4e- =2H2 ↑
- 电源 +
么气体 。 为什么?
OH-
8.在100 mL H2 SO4 和CuSO4 的混合液中, 用石墨作电极进行电解, 两极上均
收集到2.24 L气体(标准状况), 则原混合液中 ,Cu2+ 的物质的量浓度为( )
A. 1 mol/L B.2 mol/L C. 3 mol/L D.4 mol/L
阳极:4OH- -4e- = 2H2O+O2 ↑
失0.4 mol 0. 1 mol
阴极: 先Cu2++2e- = Cu, 然后2H++2e- = H2 ↑
高中化学
0. 1 mol 得0.2 mol
得0.2 mol
0. 1 mol
意图如下, 电解总反应: 2Cu+H2O Cu2O+H2
A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0. 1 mol电子转移时, 有0. 1 mol Cu2O生成。
高中化学
(三)辨析介质
注意溶液的pH改变会引起产物的改变
√
阳极:2Cu+H2O -2e- =Cu2O+2H+
阴极:2H++2e- =H2 ↑
稀H2 SO4
9.Cu2O是 一种半导体材料, 基于绿色化学理念设计的制取 Cu2O的电解池示
下列说法正确的是
电解
石墨
石墨
H2O
Cu
Cu
高中化学
(四)其他条件: 如电压
10. 用FeCl3 酸性溶液脱除H2 S后的废液, 通过控制电压电解得以再生。
某同学使用石墨电极, 在不同电压( x) 下电解pH= 1的0. 1 mol/L FeCl2 溶液,
研究废液再生机理, 记录( a 、b 、c代表电压值):
序号 电压/V 阳极现象
检验阳极产物
Ⅰ x≥a 电极附近出现黄色, 有气泡产生
有Fe3+ 、 有Cl2
Ⅱ a>x≥b 电极附近出现黄色, 无气泡产生
有Fe3+ 、 无Cl2
Ⅲ b>x>0 无明显现象
无Fe3+ 、 无Cl2
Ⅰ中Fe3+产生的原因:
可能是Cl-在阳极放电, 生成的Cl2 将Fe2+氧化:
还可能是Fe2+在阳极放电, 原因是Fe2+具有还原性. 阳极:2Fe2+ -2e- =2Fe3+
阳极:2Cl- -2e- =Cl2 Cl2 +2Fe2+ =2Cl-+2Fe3+ .
高中化学
Ⅱ中虽未检验处Cl2,但Cl-在阳极是否放电仍需进 一 步验证。
电解pH= 1的NaCl溶液做对照试验, 记录如下:
序号 电压/V 阳极现象
检验阳极产物
Ⅱ a>x≥b 电极附近出现黄色, 无气泡产生
有Fe3+ 、 无Cl2
Ⅳ a>x≥c 无明显变化
有Cl2
Ⅴ c>x≥b 无明显变化
无Cl2
阳极:2Cl- -2e- =Cl2
2Fe2+ -2e- =2Fe3+
a
阳极:2Fe2+ -2e- =2Fe3+
电压/V
b
c
同课章节目录
