四川省资阳市乐至中学2023-2024学年高二上学期期中考试化学试题(PDF版含解析)
文档属性
| 名称 | 四川省资阳市乐至中学2023-2024学年高二上学期期中考试化学试题(PDF版含解析) |  | |
| 格式 | |||
| 文件大小 | 974.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 10:59:56 | ||
图片预览




文档简介
乐至中学高 2025 届第三期半期考试
化学 试题
考试时间:75分钟 试题满分: 100分
可能用到的相对原子量: H-1 O-16 Na-23 Cu-64 Cl-35.5
一、单选题(共 15小题,每小题 3分,共 45分。每题只有一个选项符合题意。)
1.下列反应中,属于氧化还原反应且ΔH<0的是( )
A. 葡萄糖在体内缓慢氧化 B. 碳酸氢钠和稀盐酸反应
C. NaOH 溶液与盐酸反应 D.Ba(OH) 2 8H2O 晶体与 NH4Cl 晶体反应
2. 下列问题与盐的水解有关的是
①NH4Cl与 ZnCl2溶液可作焊接金属时的、除锈剂
②NaHCO3与 Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰(主要成分 K2CO3)与铵态氮肥不能混合施用
④实验室中盛放 Na2CO3溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干 CuCl2溶液并灼烧,可以得到 CuO固体
⑥要除去 FeCl3溶液中混有的 Fe2+,可通入氧化剂 Cl2
A.①②③ B.②③④
C.①④⑤ D.①②③④⑤
3.设NA 为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,44.8LNO 与 22.4LO2 混合后的气体中,分子总数小于 2NA
B.0. 1molFeCl3 完全水解,形成 Fe(OH)3 胶体的胶粒数为 0. 1NA
C.pH=2 的 CH3COOH 溶液中,H+ 的数目为 0.01NA
D.1L0. 1mol/L - 2-的NaHCO3溶液中,HCO3 和 CO3 离子数之和等于 0. 1NA
4. 下列关于热化学反应的描述中正确的是
A. 表示甲烷的燃烧热:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ/mol
B. 已知稀盐酸和稀 NaOH 溶液反应的中和热ΔH=-57.3 kJ/mol, 则 H2SO4溶液和
Ba(OH)2溶液反应生成 1mol H2O 时放出 57.3 kJ的热量
C. 已知: N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol; 则 0.5molN2与 1.5molH2在
一定条件 下充分反应,放出热量为 46.2kJ
D. 2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
5. 常温时,下列叙述正确的是
A. 醋酸溶液的 pH=a,将此溶液稀释 10倍后,溶液的 pH=b,则b=a+1
B. 若 100mLpH=1的盐酸与 100mLNaOH溶液混合后,溶液的 pH=7则 NaOH溶液的
pH=13
C. 1.0×10-3 mol L﹣ 1盐酸的 pH=3.0,1.0 10-8mol/L盐酸的 pH=8.0
D. 在滴有酚酞溶液的氨水里,加入 NH4Cl至溶液恰好无色,则此时溶液的 pH<7
第 1 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
6. 下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项 A B C D
强电解质 盐酸 NaCl BaSO4 HNO3
弱电解质 CH3COOH NH3 H3PO4 Fe(OH)3
C6H12O6(葡萄
非电解质 CO2 C2H5OH H2O
糖)
A. A B. B C. C D. D
7.根据下列实验操作和现象所得出的结论正确的是( )
选项 实验操作和现象 结论
A 相同条件下,分别测量 0.1mol L﹣1 ﹣和 0.01mol L 1醋 醋酸浓度越大,电离程
酸溶液的导电性,前者的导电性强 度越大
B ﹣常温下,分别测定浓度均为 0.1mol L 1NaF和 NaClO 酸性:HF<HClO
溶液的 pH,后者的 pH大
C 向 0.1mol L﹣ 1H O ﹣2 2溶液中滴加 0.1mol L 1KMnO4 H2O2具有还原性
溶液,溶液褪色
D 向 2mL0.1mol L﹣ 1AgNO3溶液中,先滴加 3滴 0.1mol Ks(p AgI)<Ks(p AgCl)
L﹣ 1NaCl溶液,有白色沉淀生成,再滴加 5滴 0.1mol
L﹣ 1KI溶液,出现黄色沉淀
8.下列离子方程式正确的是( )
2- 2- -
A. S 水解反应的离子方程式:S +H2O H2S+2OH
B. 用氯化铁溶液刻蚀铜电路板:2Fe3+ +3Cu=2Fe +3Cu2+
C. 向 NaClO - 2-溶液通入少量 SO2:SO2+H2O+2ClO =SO3 +2HClO
2- + - 2+
D. 向硫酸氢钠溶液中滴加氢氧化钡溶液至中性:SO4 +2H +2OH +Ba =BaSO4↓+2H2O
9.如图所示是一种酸性燃料电池酒精检测仪,具有自
动吹气流量侦测与控制的功能,非常适合进行现场酒精检
测,下列说法不正确的是( )
A.电流由 O2所在的铂电极经外电路流向另-电极
B.该电池的负极反应式为:
CH3CH2OH+3H2O-12e-=2CO2↑+12H+
C.O2所在的铂电极处发生还原反应
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
第 2 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
10.已知 CuS、PbS、HgS的溶度积分别为 1.3x10-36、9.0x10-29、6.4x10-23.下列
推断不正确的是( )
A.向含 Pb2+、Cu2+、Hg2+的浓度均为 0.010 mol L﹣1的溶液中通入硫化氢气体,产生
沉淀的顺序依次为 PbS、CuS、HgS
B.在硫化铅悬浊液中滴几滴硝酸铜溶液,会生成硫化铜
C.在含 Hg2+ ﹣ ﹣、Cu2+、Pb2+的溶液中滴加硫化钠溶液,当 c(S2 )=0.001 mol L 1时三
种金属离子都完全沉淀
D.硫化钠可以作为处理废水中含上述金属离子的沉淀剂
-
11.在不同温度下,水溶液中c H 与 c OH 有如图所
示关系。下列说法正确的是( )
A. d 点 对 应 的 溶 液 中 若 只 含 有 Na2CO3 , 则 存 在
+ > 2- > - -c(Na ) c(CO3 ) c(OH )> c(HCO3 )>
+
c(H )
3+ + - -
B. a 点对应的溶液中可能大量存在:Fe 、Na 、Cl 、NO3
C. c 点 PH=6,该水溶液呈酸性
+ 2+ - -
D. b 点对应的溶液中可能大量存在:K 、Fe 、NO3 、I
12.羰基硫(COS)是一种粮食熏蒸剂,能防止某些
害虫和真菌的危害。在 1L 的密闭容器中,通入等物质的
量 CO 与 H2S , 发 生 如 下 反 应 并 达 到 平 衡 :
CO(g)+H2S(g) COS(g)+H2(g)在不同温度下达到化学平
衡时,H2S 的转化率如图所示。下列说法正确的是( )
A. H 0
B. 增大 c(CO),V 正增大,平衡正向移动
C. 若将容器体积压缩至 0.5L,H2S的转化率增大
D. 选择合适的催化剂既能提高反应速率,也能提高 COS的平衡产率
13. K2Cr2O7溶液中存在 2CrO2-4 (黄色) + 2H+ Cr O2-2 7 (橙色) + H O的平衡。下列
说法正确的是( )
A.平衡时,溶液的颜色保持不变 B.平衡时 2v Cr O2 2 2 7 v CrO4
C.平衡时Cr O2-2 7 和CrO2-4 的浓度相同 D.加酸调节体系的 pH=2,则溶液显黄色
14.甲酸常被用于橡胶、医药等工业。在一定条件下可分解生成 CO 和 H2O。在
有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是
第 3 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
A.途径一与途径二甲酸平衡转化率相同
B.ΔH1=ΔH2<0
C.途径二 H+参与反应,通过改变反应途径,降低反应的活化能,加快反应速率
D.途径二反应的快慢由生成 的速率决定
15.室温下,向 10.00 mL 0.1000 mol/LNaHCO3溶液中滴加 0.1000 mol/L 的盐酸,
溶液的 pH 随加入的盐酸的体积 V 变化的曲线如图所示(已知室温下 H2CO3的电离平
衡常数: K a1 5 10
7 ;K 11a2 5 10 。忽略混合时溶液体积和温度的变化,无 CO2逸
出)。下列说法不正确的是( )
A. a - -点时,反应 HCO3 +H2O H2CO3+OH ,反应达平衡状态时,平衡常数 K=2×10-8
B. b点溶液中的全部溶质为 NaHCO3、NaCl和 H2CO3
- 2-
C. d 点溶液中存在:c(HCO3 )+c(H2CO3)+c(CO3 )=0.1 mol/L
+
D. c 点溶液中,c(Na )> - - + -c(HCO3 )>c(Cl )>c(H )>c(OH )
二、非选择题:本题共包括 4 道大题,共 55 分
16.(15分) 三氧化钼(MoO3)是石油工业中常用的催化剂,也是瓷轴药的颜料,
该物质常使用辉钼矿(主要成分为MoS2)通过一定条件来制备。回答下列相关问题:
(1)已知:①MoS2(s) Mo(s)+S2(g) H1
②S2(g)+2O2(g) 2SO2(g) H2
③2Mo(s)+3O2(g) 2MoO3(s) H3
则 2MoS2(s)+7O2(g) 2MoO3(s)+4SO2(g)的 H=___________(用含 H1、 H2、 H3的代
数式表示)。
(2)若在恒温恒容条件下,仅发生反应MoS2(s) Mo(s)+S2(g)
①下列说法正确的是___________(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时 S2(g)的浓度为 1.4mol L-1,充入一定量的 S2(g),反应再次达到平衡,S2(g)
浓度___________(填“>”“<”或“=”)1.4mol L-1。
第 4 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
(3)在 2L 恒容密闭容器中充入 1.0molS2(g)和 1.5molO2(g),若仅发生反应:
S2(g)+2O2(g) 2SO2(g),5min后反应达到平衡,此时容器压强为起始时的 80%,则 0~
5min内,S2(g)的反应速率为___________mol L-1 min-1。
(4) 在 恒 容 密 闭 容 器 中 , 加 入 足 量 的 MoS2 和 O2 , 仅 发 生 反 应 :
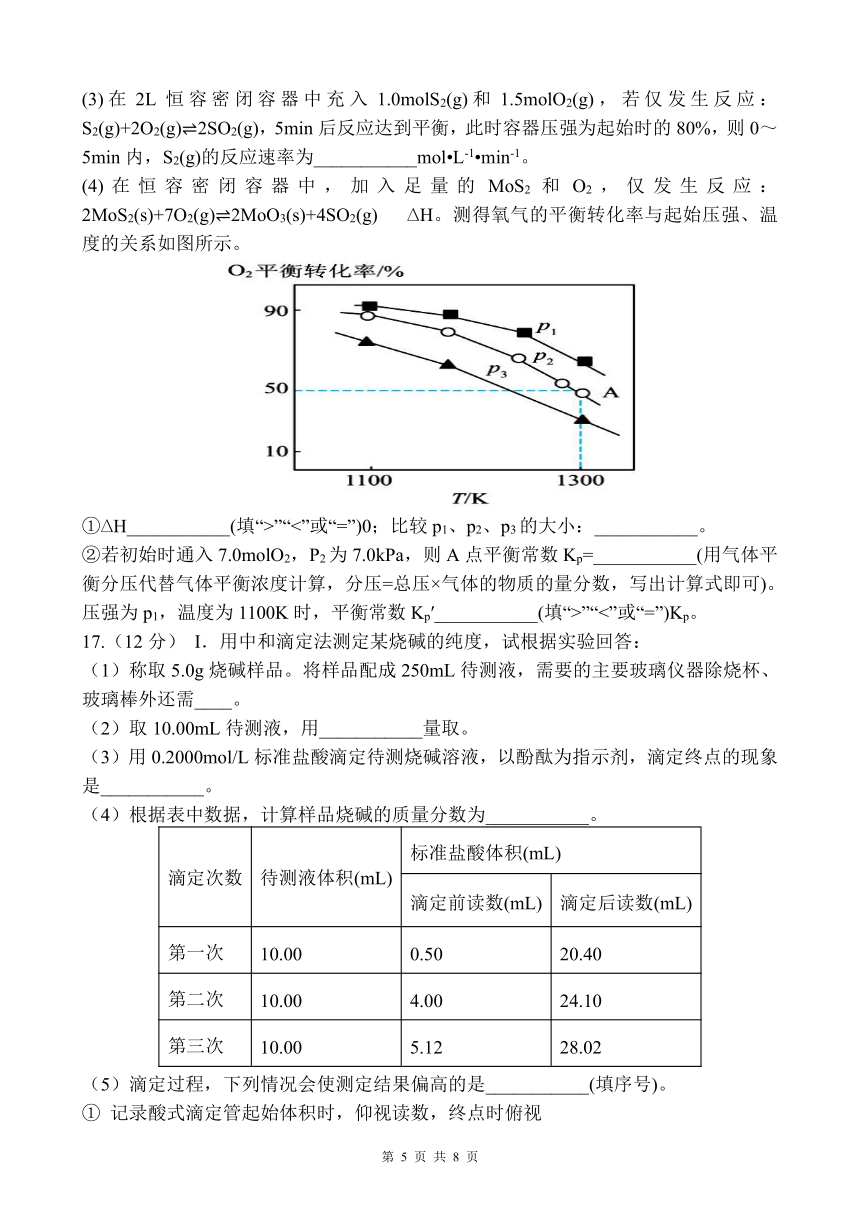
2MoS2(s)+7O2(g) 2MoO3(s)+4SO2(g) H。测得氧气的平衡转化率与起始压强、温
度的关系如图所示。
① H___________(填“>”“<”或“=”)0;比较 p1、p2、p3的大小:___________。
②若初始时通入 7.0molO2,P2为 7.0kPa,则 A点平衡常数 Kp=___________(用气体平
衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
压强为 p1,温度为 1100K时,平衡常数 Kp′___________(填“>”“<”或“=”)Kp。
17.(12分) I.用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取 5.0g烧碱样品。将样品配成 250mL待测液,需要的主要玻璃仪器除烧杯、
玻璃棒外还需____。
(2)取 10.00mL待测液,用___________量取。
(3)用 0.2000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象
是___________。
(4)根据表中数据,计算样品烧碱的质量分数为___________。
标准盐酸体积(mL)
滴定次数 待测液体积(mL)
滴定前读数(mL) 滴定后读数(mL)
第一次 10.00 0.50 20.40
第二次 10.00 4.00 24.10
第三次 10.00 5.12 28.02
(5)滴定过程,下列情况会使测定结果偏高的是___________(填序号)。
① 记录酸式滴定管起始体积时,仰视读数,终点时俯视
第 5 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
② 碱式滴定管水洗后就用来量取待测液
③ 滴定前,酸式滴定管有气泡,滴定后消失
④ 锥形瓶水洗后,未用烧碱溶液润洗
(6)某学习小组用“间接碘量法”测定含有 (M=171g/mol)晶体的试样(不
含能与 发生反应的氧化性杂质)的纯度,过程如下:取 0.36g 试样溶于水,加过量
KI 固体,充分反应,生成白色沉淀,用 0.1000mol/L 标准溶液滴定,到达滴
定终点时,消耗 标准溶液 20.00mL 。已知: ;
;试样中 的质量分数为___________%
18.(14分) 电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
弱酸 CH3COOH HCN H2CO3
-5 Ka1=5.0 10
-7
电离常数(25℃) Ka=1.8 10 K -10a=4.3 10 K =5.6 10-11a2
① 0.1mol L-1 NaCN -溶液和 0.1mol L-1 NaHCO3溶液中,c CN- _______ c HCO3 (填“>”“<”
或“=”)。
②常温下,浓度相同的三种溶液:A.CH3COONa B. NaCN C.Na2CO3,其 PH
由大到小的顺序是_______(填编号)。
③将少量CO2通入 NaCN溶液,反应的离子方程式是_______。
(2)已知 25℃氯水溶液中Cl2 aq 、HClO和ClO-分别所占分数 α 随 pH变化的关系如图
所示。由图可知该温度下 HClO的电离常数值为_______。
(3)已知:常温下 NH3 H2O NH4++OH- K =1.8 10-5b
H2Y H++HY- Ka1=5.4×10-2
HY- H+ +Y2- Ka2=5.4×10-5
则 NH4 2 Y溶液的 pH_______7(填“>”“<”或“=”)。
第 6 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
(4)已知 25℃时 KSP(Fe(OH)3)=8.0×10-38,此温度下若在实验室中配制
100mL0.01mol/LFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入盐酸
调节 PH 至 (lg2=0.3)。
(5)NO -2 尾气常用 NaOH溶液吸收,生成NaNO3和NaNO2。已知NO2 的水解常数
K =2 10-11 mol L-1h ,常温下某NaNO2和HNO2混合溶液的 pH为 5,则混合溶液中 c NO -2 和
c HNO2 的比值为_______。
19.(14 分)高品质 可用于生产锂离子电池正极材料锰酸锂。以软锰矿与黄铁矿
为主要原料采用“两矿一步浸出法”制备高品质 的某工艺流程如图所示:
已知:软锰矿与黄铁矿的主要成分为MnO2、FeS2,还含少量 FeO、Fe2O3、MgO、Al2O3、
SiO2等杂质:
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的 pH 如下:
金属离子
开始沉淀 pH 6.9 1.9 6.6 9.1 3.4
沉淀完全( )的 pH 8.3 3.2 10.1 10.9 4.7
回答下列问题:
(1)“配矿”过程中,将软锰矿与黄铁矿粉碎混匀的目的是___________。
(2)“酸浸”操作中需先后分批加入 H2SO4、H2O2。加入 H2SO4后发生酸浸过程的主要
反应离子方程式为 2FeS2+3MnO2+12H+=2Fe3++3Mn2++4S+6H2O,
2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。
①已知滤渣 1 的主要成分为 S、SiO2等,其附着在矿粉颗粒表面使上述反应受阻,此
时加入 H2O2,利用其迅速分解产生的大量气泡可破除该不利影响,分析导致 H2O2迅速
分解的因素是___________。
②矿粉颗粒表面附着物被破除后,H2O2可继续与 MnO2在酸性条件下反应,产生更多
Mn2+,并伴有气体生成,该反应的离子方程式是___________。
③H2O2除上述作用外,还可以将溶液中未与MnO2反应的 Fe2+转化为 Fe3+,其目的是:
___________。
第 7 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
(3)“调 pH”时调节溶液 pH 范围为 4.7-6.0,此时“滤渣 2”的主要成分为
___________(填化学式)。
(4)“沉锰”步骤发生主要反应的离子方程式为 。
2+ 2+
(5)“用 NH4F 除杂”时,溶液体系中的 Ca 和 Mg 形成氟化物沉淀。若沉淀后
2
-
上层清液中 c(F )=0.05mol/L,则 c Ca ___________ ( KSP(MgF -112)=5.0×10
2
K (CaF )=2.5×10-9 ) c Mg SP 2
第 8 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
乐至中学高 2025 届第三期半期考试
化学试题答案
1【答案】A
2【答案】D
【详解】①NH4Cl与 ZnCl2溶液水解显酸性,可作焊接金属中的除锈剂,与水解有关;②用 NaHCO3
与 Al2(SO4)3两种溶液分别水解呈碱性和酸性,可发生互促水解,可做泡沫灭火剂,与水解有关;
③草木灰水解呈碱性,铵态氮肥水解呈酸性,可发生互促水解,不能混合施用,反之降低肥效,与
水解有关;④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞,因为碳酸钠水解呈碱性,和盐类
水解有关;⑤CuCl2水解生成氢氧化铝和盐酸,加热促进水解,盐酸易挥发,可得到 Cu(OH)2固体,
进而受热分解为 CuO,与水解有关;⑥要除去 FeCl3溶液中混有的 Fe2+,可通入氧化剂 Cl2,是由
于发生了反应:2Fe2++Cl2=2Fe3++2Cl-,与盐类水解无关,综上分析可知,①②③④⑤均与盐类水解
有关,
3【答案】A
4【答案】A
【详解】A.燃烧热为 1mol可燃物完全燃烧生成稳定的化合物所放出的热量,A正确;
B.硫酸与氢氧化钡生成硫酸钡沉淀,则放出的热量大于 57.3kJ,B错误;
C.氨气与氢气的反应有限度,则 0.5molN2放出的热量小于 46.2kJ,C错误;
D.C完全燃烧放出的热量大于不完全燃烧,放热的焓变为负数,则ΔH1<ΔH2,D错误;
5【答案】B
【详解】A.醋酸是弱酸,加水稀释促进醋酸电离,则将 pH=a的醋酸稀释 10倍后,稀释后的溶液
1
中 c(H+)大于原来的 ,所以稀释后溶液 pH值增大值小于 1,所以 b<a+1<7,A错误;
10
B.盐酸与 NaOH 均为强电解质,常温下 pH=1 的盐酸中 c(H+)=0.1mol/L,100mLpH=1 的盐酸与
100mLNaOH 溶液混合后,溶液的 pH=7,则 n(H+)=n(OH-),即 0.1L×0.1mol/L=0.1L×c(NaOH),
c(OH-)=c(NaOH)=0.1mol/L,c(H+)==10-13mol/L,pH=13,所以 NaOH溶液的 pH=13,B正确;
C.常温下,酸溶液的 pH<7,则 1.0×10-8mol L-1盐酸的 pH<7,不可能 pH=8.0,C错误;
D.已知酚酞的变色范围是 8~10,在滴有酚酞溶液的氨水里,加入 NH4Cl溶液恰好无色,说明此
时溶液的 pH<8,但该溶液的 pH可能大于 7,D错误;
6【答案】C
【详解】A.盐酸是混合物,不属于强电解质,故 A错误;
B.NH3是非电解质,NH3 H2O属于弱电解质,故 B错误;
C.BaSO4是强电解质、H3PO4是弱酸属于弱电解质、C2H5OH不能电离出离子属于非电解质,故 C
正确;
D.H2O属于弱电解质,故 D错误;
7【答案】C
8【答案】D
9.【答案】B
1
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
【详解】A. 乙醇燃料电池中,负极上乙醇失电子发生氧化反应,正极上是氧气得电子发生还原反
应,电流由正极流向负极,即从 O2所在的铂电极经外电路流向另一电极,A正确;
B. 该电池的负极上乙醇失电子发生氧化反应,分析装置图可知乙醇在负极失去电子被氧化生成醋
酸,CH3CH2OH-4e-+H2O=4H++CH3COOH,B错误;
C. 乙醇燃料电池中,正极上是氧气得电子的还原反应,O2所在的铂电极处得到电子发生还原反应,
C正确;
D. 根据微处理器通过检测电流大小可以得出电子转移的物质的量,根据电极反应式可以计算出被
测气体中酒精的含量,D正确;
10.【答案】A
【解析】【解答】解:A.CuS、PbS、HgS为相同类型的难溶物,可通过它们的溶度积直接判断溶
解度大小,根据题干信息可知,溶解度最小的、最难溶的为 CuS,溶度积最小、最后生成沉淀的为
HgS,所以产生沉淀的顺序依次为 HgS、CuS、PbS,故 A错误;
B.在硫化铅悬浊液中滴几滴硝酸铜溶液,由于硫化铜的溶度积小于硫化铅,所以硫化铅会转化成
更难溶的硫化铜,故 B正确;
C.在含 Hg2+、Cu2+、Pb2+ ﹣的溶液中滴加硫化钠溶液,当 c(S2 )=0.001 mol L﹣1时,c(Hg2+)=6.4x10
﹣20mol L﹣1、c(Cu2+ ﹣ ﹣ ﹣)=1.3x10 33mol L 1、c(Pb2+)=9.0x10 26mol L﹣1,三种金属离子浓度都小于
1×10﹣5mol/L,所以 Hg2+、Cu2+、Pb2+离子都完全沉淀,故 C正确;
D.氯化钠能够与 Hg2+、Cu2+、Pb2+离子反应生成难溶物 CuS、PbS、HgS,所以硫化钠是处理废水
中含上述金属离子的沉淀剂,故 D正确;
11.【答案】A
12.【答案】B
13【答案】A
14.D
【详解】A.催化剂不改变反应的平衡转化率,途径一与途径二甲酸平衡转化率相同,A项正确;
B.催化剂可以降低活化能,但不改变焓变,图中反应物总能量大于生成物总能量,因此ΔH1=ΔH2<0,
B项正确;
C.根据图示可知途径二中 H+参与了反应,H+的参与改变反应途径,降低了活化能,从而加快反
应速率,C项正确;
D.反应的快慢通常由活化能最大的一步决定,即途径二反应的快慢由生成 的速率决
定,D项错误。
15【答案】C
【详解】A.a点时,对于反应HCO 3 + H2O H2CO3+ OH-,达到平衡状态时,平衡常数
c(H2CO3 ) c(OH
) K 14
K= c(HCO ) =
W =1 10 =2×10-8K ,A正确;3 a1 5 10 7
B.b点时,发生反应 NaHCO3+HCl=NaCl+H2CO3,此时溶液呈中性,则有少量 NaHCO3剩余,所
2
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
以溶液中的全部溶质为 NaHCO3、NaCl和 H2CO3,B正确;
C.d点时,NaHCO3溶液与盐酸溶液的体积相同,含碳微粒的浓度变为原来的二分之一,依据物
料守恒,存在:c(HCO 3 )+ c(H2CO3)+ c(CO2 3 )=0.05mol/L,C不正确;
D.c点时,反应生成的 NaCl、H2CO3与剩余的 NaHCO3物质的量相等,但此时溶液中存在
H2CO3 HCO +H+3 ,从而使溶液呈酸性,c(HCO 3 )>c(Cl-),所以 c(Na+)>c(HCO 3 )>c(Cl-)>c(H+)>
c(OH-),D正确;
16.【答案】15分 (除标注外,每空 2分) (1) H=2 H1+2 H2+ H3 (2) ab = (3).
(7.0MPa 2.0 100%) 4
0.05 mol L-1 min-1 (4)< (1分) P1>P2>P 5.53 >
(7.0MPa 3.5 100%) 7
5.5
(3)设达到平衡时消耗的 S2物质的量为 x,根据三段式可列出:
S2 (g) + 2O2 (g) 2SO2 (g)
初始 1.0mol 1.5mol 0mol
转化 x 2x 2x
平衡 (1mol x) (1.5mol 2x) 2x
在 恒 容 条 件 下 , 起 始 与 平 衡 时 气 体 的 压 强 比 等 于 气 体 的 物 质 的 量 比 , 即
P(平衡) n= (平衡)= 1mol x+1.5mol 2x+2x = 2.5mol x 4
P(起始) n(起始) 1.0mol+1.5mol 2.5mol 5
解得 x 0.5mol
(S ) c n 0.5mol2 0.05mol L
1 min 1
t V t 2L 5min
(4)①根据图知,压强一定时,随着升高温度 O2的转化率下降,说明升高温度平衡逆向移动,而升
高温度平衡向吸热方向移动,因此逆向反应是吸热反应,那么正向反应是放热反应,△H<0;该反
应的正反应是一个反应前后气体体积减小的可逆反应,因此增大压强平衡正向移动,则压强越高,
氧气的转化率越高,故 P1 P2 P3 ;
②已知 A点的 O2的转化率为 50%,转化的氧气为 n(O2 ) 7.0mol 50% 3.5mol,可列出三段式如
下:
2MoS(2 s) + 7O(2 g) = 2MoO(3 s) + 4SO(2 g)
初始 7.0mol 0mol
转化 3.5mol 2.0mol
平衡 3.5mol 2.0mol
反 应 后 气 体 的 总 物 质 的 量 为 : n( 总 )=n(O2)+n(SO2)=3.5mol+2.0mol=5.5mol ,
4 (7.0MPa 2.0 100%) 4P
K (SO2 ) 5.5P 7 3.5 ;该反应△H<0,则温度越高K P 越小,与压强无关,因此
K
P p
Kp。
(O ) (7.0MPa 100%) 72
5.5
17【答案】12分,(每空 2分)(1)250mL容量瓶、胶头流管
(2)碱式滴定管 (或移液管)
(3)滴入最后半滴盐酸,溶液由红色变为无色,且 30s内不恢复
3
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
(4) 80%
(5)③ (6) 95
18. -【答案】14 分 ( 每空 2 分) (1) < C>B>A CN-+CO2+H2O=HCN+ HCO3
(2)10-7.5 (3) < (4) 2.3 (5)50
【详解】(1)①根据表格中数据可知,HCN电离出的 H+小于 H2CO3电离出 H+能力,根据盐类水解
中越弱越水解,即 CN-水解的能力强于HCO-3,因此等浓度的 NaCN溶液和 NaHCO3溶液中,c(CN-)
c(HCO-< 3 ),故答案为:<;
②电离平衡常数越小,酸越弱,因此根据电离平衡常数可知,酸性强弱顺序是 CH3COOH>H2CO3
>HCN>HCO-3,酸越弱,相应的钠盐越容易水解,溶液的 pH越大,则等 pH的 A.CH3COONa、
B.NaCN、C.Na2CO3的物质的量浓度由大到小的顺序为 A>B>C,故答案为:A>B>C;
③HCN的电离平衡常数 Ka=4.3×10-10,H2CO3的电离平衡常数是 Ka1=5.0×10-7、Ka2=5.6×10-11,由此
-
可知电离出 H+能力强弱程度为 H2CO3>HCN>HCO3,所以 NaCN溶液通入少量 CO2的离子方程
- -
式是:CN-+CO2+H2O=HCN+HCO3,故答案为:CN-+CO2+H2O=HCN+HCO3;
(2)结合图示可知,HClO和 ClO-所占分数α=0.5时,溶液的 pH=7.5,则 HClO的电离常数
c H+ c(ClO- )
Ka= =c(H+)=10-7.5,故答案为:10-7.5;
c HClO
K -14
(3)已知:常温下 NH3 H2O NH4++OH-Kb=1.8×10-5 W
10
,Kh(NH4+)= = -10K 1.8×10-5
≈5.6×10 ,
b
K -14
Kh(Y2-)= W =
10 -10
K NH
+ 2-
5.4×10-5
≈1.9×10 ,水解程度 4>Y ,则(NH4)2Y溶液呈酸性,溶液的 pH<7,
a2
故答案为:<;
Ksp 38
(4)要使溶液不产生沉淀,则溶液中 c(OH-)= = 8.0 103 3 mol/L=2×10-12c Fe3+ mol/L,溶液中0.01
POH=12- lg2,故 PH 为:2.3;
10-14
(5)常温下某 NaNO2和 HNO2混合溶液的 pH为 5,该溶液中 c(OH-)= 10
-5 mol/L=10-9mol/L,结合
c HNO2 c(OH- )
- - - -
K NO c(NO ) NO NOh( 2 )= 2 可知 c( 2 ):c(HNO2)=Kh( 2 ):c(OH-)=10-9:2×10-11=50,故答案
为:50。
19.每空 2分, (1)增加接触面,提高反应速率;提高原料利用率
(2) Fe3+或Mn2+或MnO2等作催化剂 MnO2+ H2O2+2H+= Mn2++O2↑+H2O 便于加入氨水调节
溶液 PH时将 Fe3+作转化为 Fe(OH)3除去
(3)Fe(OH)3、Al(OH)3
(4)Mn2++HCO 3 =MnCO3↓+H2O+ CO2↑ (5)50
4
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
化学 试题
考试时间:75分钟 试题满分: 100分
可能用到的相对原子量: H-1 O-16 Na-23 Cu-64 Cl-35.5
一、单选题(共 15小题,每小题 3分,共 45分。每题只有一个选项符合题意。)
1.下列反应中,属于氧化还原反应且ΔH<0的是( )
A. 葡萄糖在体内缓慢氧化 B. 碳酸氢钠和稀盐酸反应
C. NaOH 溶液与盐酸反应 D.Ba(OH) 2 8H2O 晶体与 NH4Cl 晶体反应
2. 下列问题与盐的水解有关的是
①NH4Cl与 ZnCl2溶液可作焊接金属时的、除锈剂
②NaHCO3与 Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰(主要成分 K2CO3)与铵态氮肥不能混合施用
④实验室中盛放 Na2CO3溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干 CuCl2溶液并灼烧,可以得到 CuO固体
⑥要除去 FeCl3溶液中混有的 Fe2+,可通入氧化剂 Cl2
A.①②③ B.②③④
C.①④⑤ D.①②③④⑤
3.设NA 为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,44.8LNO 与 22.4LO2 混合后的气体中,分子总数小于 2NA
B.0. 1molFeCl3 完全水解,形成 Fe(OH)3 胶体的胶粒数为 0. 1NA
C.pH=2 的 CH3COOH 溶液中,H+ 的数目为 0.01NA
D.1L0. 1mol/L - 2-的NaHCO3溶液中,HCO3 和 CO3 离子数之和等于 0. 1NA
4. 下列关于热化学反应的描述中正确的是
A. 表示甲烷的燃烧热:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ/mol
B. 已知稀盐酸和稀 NaOH 溶液反应的中和热ΔH=-57.3 kJ/mol, 则 H2SO4溶液和
Ba(OH)2溶液反应生成 1mol H2O 时放出 57.3 kJ的热量
C. 已知: N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol; 则 0.5molN2与 1.5molH2在
一定条件 下充分反应,放出热量为 46.2kJ
D. 2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
5. 常温时,下列叙述正确的是
A. 醋酸溶液的 pH=a,将此溶液稀释 10倍后,溶液的 pH=b,则b=a+1
B. 若 100mLpH=1的盐酸与 100mLNaOH溶液混合后,溶液的 pH=7则 NaOH溶液的
pH=13
C. 1.0×10-3 mol L﹣ 1盐酸的 pH=3.0,1.0 10-8mol/L盐酸的 pH=8.0
D. 在滴有酚酞溶液的氨水里,加入 NH4Cl至溶液恰好无色,则此时溶液的 pH<7
第 1 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
6. 下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项 A B C D
强电解质 盐酸 NaCl BaSO4 HNO3
弱电解质 CH3COOH NH3 H3PO4 Fe(OH)3
C6H12O6(葡萄
非电解质 CO2 C2H5OH H2O
糖)
A. A B. B C. C D. D
7.根据下列实验操作和现象所得出的结论正确的是( )
选项 实验操作和现象 结论
A 相同条件下,分别测量 0.1mol L﹣1 ﹣和 0.01mol L 1醋 醋酸浓度越大,电离程
酸溶液的导电性,前者的导电性强 度越大
B ﹣常温下,分别测定浓度均为 0.1mol L 1NaF和 NaClO 酸性:HF<HClO
溶液的 pH,后者的 pH大
C 向 0.1mol L﹣ 1H O ﹣2 2溶液中滴加 0.1mol L 1KMnO4 H2O2具有还原性
溶液,溶液褪色
D 向 2mL0.1mol L﹣ 1AgNO3溶液中,先滴加 3滴 0.1mol Ks(p AgI)<Ks(p AgCl)
L﹣ 1NaCl溶液,有白色沉淀生成,再滴加 5滴 0.1mol
L﹣ 1KI溶液,出现黄色沉淀
8.下列离子方程式正确的是( )
2- 2- -
A. S 水解反应的离子方程式:S +H2O H2S+2OH
B. 用氯化铁溶液刻蚀铜电路板:2Fe3+ +3Cu=2Fe +3Cu2+
C. 向 NaClO - 2-溶液通入少量 SO2:SO2+H2O+2ClO =SO3 +2HClO
2- + - 2+
D. 向硫酸氢钠溶液中滴加氢氧化钡溶液至中性:SO4 +2H +2OH +Ba =BaSO4↓+2H2O
9.如图所示是一种酸性燃料电池酒精检测仪,具有自
动吹气流量侦测与控制的功能,非常适合进行现场酒精检
测,下列说法不正确的是( )
A.电流由 O2所在的铂电极经外电路流向另-电极
B.该电池的负极反应式为:
CH3CH2OH+3H2O-12e-=2CO2↑+12H+
C.O2所在的铂电极处发生还原反应
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
第 2 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
10.已知 CuS、PbS、HgS的溶度积分别为 1.3x10-36、9.0x10-29、6.4x10-23.下列
推断不正确的是( )
A.向含 Pb2+、Cu2+、Hg2+的浓度均为 0.010 mol L﹣1的溶液中通入硫化氢气体,产生
沉淀的顺序依次为 PbS、CuS、HgS
B.在硫化铅悬浊液中滴几滴硝酸铜溶液,会生成硫化铜
C.在含 Hg2+ ﹣ ﹣、Cu2+、Pb2+的溶液中滴加硫化钠溶液,当 c(S2 )=0.001 mol L 1时三
种金属离子都完全沉淀
D.硫化钠可以作为处理废水中含上述金属离子的沉淀剂
-
11.在不同温度下,水溶液中c H 与 c OH 有如图所
示关系。下列说法正确的是( )
A. d 点 对 应 的 溶 液 中 若 只 含 有 Na2CO3 , 则 存 在
+ > 2- > - -c(Na ) c(CO3 ) c(OH )> c(HCO3 )>
+
c(H )
3+ + - -
B. a 点对应的溶液中可能大量存在:Fe 、Na 、Cl 、NO3
C. c 点 PH=6,该水溶液呈酸性
+ 2+ - -
D. b 点对应的溶液中可能大量存在:K 、Fe 、NO3 、I
12.羰基硫(COS)是一种粮食熏蒸剂,能防止某些
害虫和真菌的危害。在 1L 的密闭容器中,通入等物质的
量 CO 与 H2S , 发 生 如 下 反 应 并 达 到 平 衡 :
CO(g)+H2S(g) COS(g)+H2(g)在不同温度下达到化学平
衡时,H2S 的转化率如图所示。下列说法正确的是( )
A. H 0
B. 增大 c(CO),V 正增大,平衡正向移动
C. 若将容器体积压缩至 0.5L,H2S的转化率增大
D. 选择合适的催化剂既能提高反应速率,也能提高 COS的平衡产率
13. K2Cr2O7溶液中存在 2CrO2-4 (黄色) + 2H+ Cr O2-2 7 (橙色) + H O的平衡。下列
说法正确的是( )
A.平衡时,溶液的颜色保持不变 B.平衡时 2v Cr O2 2 2 7 v CrO4
C.平衡时Cr O2-2 7 和CrO2-4 的浓度相同 D.加酸调节体系的 pH=2,则溶液显黄色
14.甲酸常被用于橡胶、医药等工业。在一定条件下可分解生成 CO 和 H2O。在
有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是
第 3 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
A.途径一与途径二甲酸平衡转化率相同
B.ΔH1=ΔH2<0
C.途径二 H+参与反应,通过改变反应途径,降低反应的活化能,加快反应速率
D.途径二反应的快慢由生成 的速率决定
15.室温下,向 10.00 mL 0.1000 mol/LNaHCO3溶液中滴加 0.1000 mol/L 的盐酸,
溶液的 pH 随加入的盐酸的体积 V 变化的曲线如图所示(已知室温下 H2CO3的电离平
衡常数: K a1 5 10
7 ;K 11a2 5 10 。忽略混合时溶液体积和温度的变化,无 CO2逸
出)。下列说法不正确的是( )
A. a - -点时,反应 HCO3 +H2O H2CO3+OH ,反应达平衡状态时,平衡常数 K=2×10-8
B. b点溶液中的全部溶质为 NaHCO3、NaCl和 H2CO3
- 2-
C. d 点溶液中存在:c(HCO3 )+c(H2CO3)+c(CO3 )=0.1 mol/L
+
D. c 点溶液中,c(Na )> - - + -c(HCO3 )>c(Cl )>c(H )>c(OH )
二、非选择题:本题共包括 4 道大题,共 55 分
16.(15分) 三氧化钼(MoO3)是石油工业中常用的催化剂,也是瓷轴药的颜料,
该物质常使用辉钼矿(主要成分为MoS2)通过一定条件来制备。回答下列相关问题:
(1)已知:①MoS2(s) Mo(s)+S2(g) H1
②S2(g)+2O2(g) 2SO2(g) H2
③2Mo(s)+3O2(g) 2MoO3(s) H3
则 2MoS2(s)+7O2(g) 2MoO3(s)+4SO2(g)的 H=___________(用含 H1、 H2、 H3的代
数式表示)。
(2)若在恒温恒容条件下,仅发生反应MoS2(s) Mo(s)+S2(g)
①下列说法正确的是___________(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时 S2(g)的浓度为 1.4mol L-1,充入一定量的 S2(g),反应再次达到平衡,S2(g)
浓度___________(填“>”“<”或“=”)1.4mol L-1。
第 4 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
(3)在 2L 恒容密闭容器中充入 1.0molS2(g)和 1.5molO2(g),若仅发生反应:
S2(g)+2O2(g) 2SO2(g),5min后反应达到平衡,此时容器压强为起始时的 80%,则 0~
5min内,S2(g)的反应速率为___________mol L-1 min-1。
(4) 在 恒 容 密 闭 容 器 中 , 加 入 足 量 的 MoS2 和 O2 , 仅 发 生 反 应 :
2MoS2(s)+7O2(g) 2MoO3(s)+4SO2(g) H。测得氧气的平衡转化率与起始压强、温
度的关系如图所示。
① H___________(填“>”“<”或“=”)0;比较 p1、p2、p3的大小:___________。
②若初始时通入 7.0molO2,P2为 7.0kPa,则 A点平衡常数 Kp=___________(用气体平
衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
压强为 p1,温度为 1100K时,平衡常数 Kp′___________(填“>”“<”或“=”)Kp。
17.(12分) I.用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取 5.0g烧碱样品。将样品配成 250mL待测液,需要的主要玻璃仪器除烧杯、
玻璃棒外还需____。
(2)取 10.00mL待测液,用___________量取。
(3)用 0.2000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象
是___________。
(4)根据表中数据,计算样品烧碱的质量分数为___________。
标准盐酸体积(mL)
滴定次数 待测液体积(mL)
滴定前读数(mL) 滴定后读数(mL)
第一次 10.00 0.50 20.40
第二次 10.00 4.00 24.10
第三次 10.00 5.12 28.02
(5)滴定过程,下列情况会使测定结果偏高的是___________(填序号)。
① 记录酸式滴定管起始体积时,仰视读数,终点时俯视
第 5 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
② 碱式滴定管水洗后就用来量取待测液
③ 滴定前,酸式滴定管有气泡,滴定后消失
④ 锥形瓶水洗后,未用烧碱溶液润洗
(6)某学习小组用“间接碘量法”测定含有 (M=171g/mol)晶体的试样(不
含能与 发生反应的氧化性杂质)的纯度,过程如下:取 0.36g 试样溶于水,加过量
KI 固体,充分反应,生成白色沉淀,用 0.1000mol/L 标准溶液滴定,到达滴
定终点时,消耗 标准溶液 20.00mL 。已知: ;
;试样中 的质量分数为___________%
18.(14分) 电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
弱酸 CH3COOH HCN H2CO3
-5 Ka1=5.0 10
-7
电离常数(25℃) Ka=1.8 10 K -10a=4.3 10 K =5.6 10-11a2
① 0.1mol L-1 NaCN -溶液和 0.1mol L-1 NaHCO3溶液中,c CN- _______ c HCO3 (填“>”“<”
或“=”)。
②常温下,浓度相同的三种溶液:A.CH3COONa B. NaCN C.Na2CO3,其 PH
由大到小的顺序是_______(填编号)。
③将少量CO2通入 NaCN溶液,反应的离子方程式是_______。
(2)已知 25℃氯水溶液中Cl2 aq 、HClO和ClO-分别所占分数 α 随 pH变化的关系如图
所示。由图可知该温度下 HClO的电离常数值为_______。
(3)已知:常温下 NH3 H2O NH4++OH- K =1.8 10-5b
H2Y H++HY- Ka1=5.4×10-2
HY- H+ +Y2- Ka2=5.4×10-5
则 NH4 2 Y溶液的 pH_______7(填“>”“<”或“=”)。
第 6 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
(4)已知 25℃时 KSP(Fe(OH)3)=8.0×10-38,此温度下若在实验室中配制
100mL0.01mol/LFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入盐酸
调节 PH 至 (lg2=0.3)。
(5)NO -2 尾气常用 NaOH溶液吸收,生成NaNO3和NaNO2。已知NO2 的水解常数
K =2 10-11 mol L-1h ,常温下某NaNO2和HNO2混合溶液的 pH为 5,则混合溶液中 c NO -2 和
c HNO2 的比值为_______。
19.(14 分)高品质 可用于生产锂离子电池正极材料锰酸锂。以软锰矿与黄铁矿
为主要原料采用“两矿一步浸出法”制备高品质 的某工艺流程如图所示:
已知:软锰矿与黄铁矿的主要成分为MnO2、FeS2,还含少量 FeO、Fe2O3、MgO、Al2O3、
SiO2等杂质:
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的 pH 如下:
金属离子
开始沉淀 pH 6.9 1.9 6.6 9.1 3.4
沉淀完全( )的 pH 8.3 3.2 10.1 10.9 4.7
回答下列问题:
(1)“配矿”过程中,将软锰矿与黄铁矿粉碎混匀的目的是___________。
(2)“酸浸”操作中需先后分批加入 H2SO4、H2O2。加入 H2SO4后发生酸浸过程的主要
反应离子方程式为 2FeS2+3MnO2+12H+=2Fe3++3Mn2++4S+6H2O,
2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。
①已知滤渣 1 的主要成分为 S、SiO2等,其附着在矿粉颗粒表面使上述反应受阻,此
时加入 H2O2,利用其迅速分解产生的大量气泡可破除该不利影响,分析导致 H2O2迅速
分解的因素是___________。
②矿粉颗粒表面附着物被破除后,H2O2可继续与 MnO2在酸性条件下反应,产生更多
Mn2+,并伴有气体生成,该反应的离子方程式是___________。
③H2O2除上述作用外,还可以将溶液中未与MnO2反应的 Fe2+转化为 Fe3+,其目的是:
___________。
第 7 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
(3)“调 pH”时调节溶液 pH 范围为 4.7-6.0,此时“滤渣 2”的主要成分为
___________(填化学式)。
(4)“沉锰”步骤发生主要反应的离子方程式为 。
2+ 2+
(5)“用 NH4F 除杂”时,溶液体系中的 Ca 和 Mg 形成氟化物沉淀。若沉淀后
2
-
上层清液中 c(F )=0.05mol/L,则 c Ca ___________ ( KSP(MgF -112)=5.0×10
2
K (CaF )=2.5×10-9 ) c Mg SP 2
第 8 页 共 8 页
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
乐至中学高 2025 届第三期半期考试
化学试题答案
1【答案】A
2【答案】D
【详解】①NH4Cl与 ZnCl2溶液水解显酸性,可作焊接金属中的除锈剂,与水解有关;②用 NaHCO3
与 Al2(SO4)3两种溶液分别水解呈碱性和酸性,可发生互促水解,可做泡沫灭火剂,与水解有关;
③草木灰水解呈碱性,铵态氮肥水解呈酸性,可发生互促水解,不能混合施用,反之降低肥效,与
水解有关;④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞,因为碳酸钠水解呈碱性,和盐类
水解有关;⑤CuCl2水解生成氢氧化铝和盐酸,加热促进水解,盐酸易挥发,可得到 Cu(OH)2固体,
进而受热分解为 CuO,与水解有关;⑥要除去 FeCl3溶液中混有的 Fe2+,可通入氧化剂 Cl2,是由
于发生了反应:2Fe2++Cl2=2Fe3++2Cl-,与盐类水解无关,综上分析可知,①②③④⑤均与盐类水解
有关,
3【答案】A
4【答案】A
【详解】A.燃烧热为 1mol可燃物完全燃烧生成稳定的化合物所放出的热量,A正确;
B.硫酸与氢氧化钡生成硫酸钡沉淀,则放出的热量大于 57.3kJ,B错误;
C.氨气与氢气的反应有限度,则 0.5molN2放出的热量小于 46.2kJ,C错误;
D.C完全燃烧放出的热量大于不完全燃烧,放热的焓变为负数,则ΔH1<ΔH2,D错误;
5【答案】B
【详解】A.醋酸是弱酸,加水稀释促进醋酸电离,则将 pH=a的醋酸稀释 10倍后,稀释后的溶液
1
中 c(H+)大于原来的 ,所以稀释后溶液 pH值增大值小于 1,所以 b<a+1<7,A错误;
10
B.盐酸与 NaOH 均为强电解质,常温下 pH=1 的盐酸中 c(H+)=0.1mol/L,100mLpH=1 的盐酸与
100mLNaOH 溶液混合后,溶液的 pH=7,则 n(H+)=n(OH-),即 0.1L×0.1mol/L=0.1L×c(NaOH),
c(OH-)=c(NaOH)=0.1mol/L,c(H+)==10-13mol/L,pH=13,所以 NaOH溶液的 pH=13,B正确;
C.常温下,酸溶液的 pH<7,则 1.0×10-8mol L-1盐酸的 pH<7,不可能 pH=8.0,C错误;
D.已知酚酞的变色范围是 8~10,在滴有酚酞溶液的氨水里,加入 NH4Cl溶液恰好无色,说明此
时溶液的 pH<8,但该溶液的 pH可能大于 7,D错误;
6【答案】C
【详解】A.盐酸是混合物,不属于强电解质,故 A错误;
B.NH3是非电解质,NH3 H2O属于弱电解质,故 B错误;
C.BaSO4是强电解质、H3PO4是弱酸属于弱电解质、C2H5OH不能电离出离子属于非电解质,故 C
正确;
D.H2O属于弱电解质,故 D错误;
7【答案】C
8【答案】D
9.【答案】B
1
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
【详解】A. 乙醇燃料电池中,负极上乙醇失电子发生氧化反应,正极上是氧气得电子发生还原反
应,电流由正极流向负极,即从 O2所在的铂电极经外电路流向另一电极,A正确;
B. 该电池的负极上乙醇失电子发生氧化反应,分析装置图可知乙醇在负极失去电子被氧化生成醋
酸,CH3CH2OH-4e-+H2O=4H++CH3COOH,B错误;
C. 乙醇燃料电池中,正极上是氧气得电子的还原反应,O2所在的铂电极处得到电子发生还原反应,
C正确;
D. 根据微处理器通过检测电流大小可以得出电子转移的物质的量,根据电极反应式可以计算出被
测气体中酒精的含量,D正确;
10.【答案】A
【解析】【解答】解:A.CuS、PbS、HgS为相同类型的难溶物,可通过它们的溶度积直接判断溶
解度大小,根据题干信息可知,溶解度最小的、最难溶的为 CuS,溶度积最小、最后生成沉淀的为
HgS,所以产生沉淀的顺序依次为 HgS、CuS、PbS,故 A错误;
B.在硫化铅悬浊液中滴几滴硝酸铜溶液,由于硫化铜的溶度积小于硫化铅,所以硫化铅会转化成
更难溶的硫化铜,故 B正确;
C.在含 Hg2+、Cu2+、Pb2+ ﹣的溶液中滴加硫化钠溶液,当 c(S2 )=0.001 mol L﹣1时,c(Hg2+)=6.4x10
﹣20mol L﹣1、c(Cu2+ ﹣ ﹣ ﹣)=1.3x10 33mol L 1、c(Pb2+)=9.0x10 26mol L﹣1,三种金属离子浓度都小于
1×10﹣5mol/L,所以 Hg2+、Cu2+、Pb2+离子都完全沉淀,故 C正确;
D.氯化钠能够与 Hg2+、Cu2+、Pb2+离子反应生成难溶物 CuS、PbS、HgS,所以硫化钠是处理废水
中含上述金属离子的沉淀剂,故 D正确;
11.【答案】A
12.【答案】B
13【答案】A
14.D
【详解】A.催化剂不改变反应的平衡转化率,途径一与途径二甲酸平衡转化率相同,A项正确;
B.催化剂可以降低活化能,但不改变焓变,图中反应物总能量大于生成物总能量,因此ΔH1=ΔH2<0,
B项正确;
C.根据图示可知途径二中 H+参与了反应,H+的参与改变反应途径,降低了活化能,从而加快反
应速率,C项正确;
D.反应的快慢通常由活化能最大的一步决定,即途径二反应的快慢由生成 的速率决
定,D项错误。
15【答案】C
【详解】A.a点时,对于反应HCO 3 + H2O H2CO3+ OH-,达到平衡状态时,平衡常数
c(H2CO3 ) c(OH
) K 14
K= c(HCO ) =
W =1 10 =2×10-8K ,A正确;3 a1 5 10 7
B.b点时,发生反应 NaHCO3+HCl=NaCl+H2CO3,此时溶液呈中性,则有少量 NaHCO3剩余,所
2
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
以溶液中的全部溶质为 NaHCO3、NaCl和 H2CO3,B正确;
C.d点时,NaHCO3溶液与盐酸溶液的体积相同,含碳微粒的浓度变为原来的二分之一,依据物
料守恒,存在:c(HCO 3 )+ c(H2CO3)+ c(CO2 3 )=0.05mol/L,C不正确;
D.c点时,反应生成的 NaCl、H2CO3与剩余的 NaHCO3物质的量相等,但此时溶液中存在
H2CO3 HCO +H+3 ,从而使溶液呈酸性,c(HCO 3 )>c(Cl-),所以 c(Na+)>c(HCO 3 )>c(Cl-)>c(H+)>
c(OH-),D正确;
16.【答案】15分 (除标注外,每空 2分) (1) H=2 H1+2 H2+ H3 (2) ab = (3).
(7.0MPa 2.0 100%) 4
0.05 mol L-1 min-1 (4)< (1分) P1>P2>P 5.53 >
(7.0MPa 3.5 100%) 7
5.5
(3)设达到平衡时消耗的 S2物质的量为 x,根据三段式可列出:
S2 (g) + 2O2 (g) 2SO2 (g)
初始 1.0mol 1.5mol 0mol
转化 x 2x 2x
平衡 (1mol x) (1.5mol 2x) 2x
在 恒 容 条 件 下 , 起 始 与 平 衡 时 气 体 的 压 强 比 等 于 气 体 的 物 质 的 量 比 , 即
P(平衡) n= (平衡)= 1mol x+1.5mol 2x+2x = 2.5mol x 4
P(起始) n(起始) 1.0mol+1.5mol 2.5mol 5
解得 x 0.5mol
(S ) c n 0.5mol2 0.05mol L
1 min 1
t V t 2L 5min
(4)①根据图知,压强一定时,随着升高温度 O2的转化率下降,说明升高温度平衡逆向移动,而升
高温度平衡向吸热方向移动,因此逆向反应是吸热反应,那么正向反应是放热反应,△H<0;该反
应的正反应是一个反应前后气体体积减小的可逆反应,因此增大压强平衡正向移动,则压强越高,
氧气的转化率越高,故 P1 P2 P3 ;
②已知 A点的 O2的转化率为 50%,转化的氧气为 n(O2 ) 7.0mol 50% 3.5mol,可列出三段式如
下:
2MoS(2 s) + 7O(2 g) = 2MoO(3 s) + 4SO(2 g)
初始 7.0mol 0mol
转化 3.5mol 2.0mol
平衡 3.5mol 2.0mol
反 应 后 气 体 的 总 物 质 的 量 为 : n( 总 )=n(O2)+n(SO2)=3.5mol+2.0mol=5.5mol ,
4 (7.0MPa 2.0 100%) 4P
K (SO2 ) 5.5P 7 3.5 ;该反应△H<0,则温度越高K P 越小,与压强无关,因此
K
P p
Kp。
(O ) (7.0MPa 100%) 72
5.5
17【答案】12分,(每空 2分)(1)250mL容量瓶、胶头流管
(2)碱式滴定管 (或移液管)
(3)滴入最后半滴盐酸,溶液由红色变为无色,且 30s内不恢复
3
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
(4) 80%
(5)③ (6) 95
18. -【答案】14 分 ( 每空 2 分) (1) < C>B>A CN-+CO2+H2O=HCN+ HCO3
(2)10-7.5 (3) < (4) 2.3 (5)50
【详解】(1)①根据表格中数据可知,HCN电离出的 H+小于 H2CO3电离出 H+能力,根据盐类水解
中越弱越水解,即 CN-水解的能力强于HCO-3,因此等浓度的 NaCN溶液和 NaHCO3溶液中,c(CN-)
c(HCO-< 3 ),故答案为:<;
②电离平衡常数越小,酸越弱,因此根据电离平衡常数可知,酸性强弱顺序是 CH3COOH>H2CO3
>HCN>HCO-3,酸越弱,相应的钠盐越容易水解,溶液的 pH越大,则等 pH的 A.CH3COONa、
B.NaCN、C.Na2CO3的物质的量浓度由大到小的顺序为 A>B>C,故答案为:A>B>C;
③HCN的电离平衡常数 Ka=4.3×10-10,H2CO3的电离平衡常数是 Ka1=5.0×10-7、Ka2=5.6×10-11,由此
-
可知电离出 H+能力强弱程度为 H2CO3>HCN>HCO3,所以 NaCN溶液通入少量 CO2的离子方程
- -
式是:CN-+CO2+H2O=HCN+HCO3,故答案为:CN-+CO2+H2O=HCN+HCO3;
(2)结合图示可知,HClO和 ClO-所占分数α=0.5时,溶液的 pH=7.5,则 HClO的电离常数
c H+ c(ClO- )
Ka= =c(H+)=10-7.5,故答案为:10-7.5;
c HClO
K -14
(3)已知:常温下 NH3 H2O NH4++OH-Kb=1.8×10-5 W
10
,Kh(NH4+)= = -10K 1.8×10-5
≈5.6×10 ,
b
K -14
Kh(Y2-)= W =
10 -10
K NH
+ 2-
5.4×10-5
≈1.9×10 ,水解程度 4>Y ,则(NH4)2Y溶液呈酸性,溶液的 pH<7,
a2
故答案为:<;
Ksp 38
(4)要使溶液不产生沉淀,则溶液中 c(OH-)= = 8.0 103 3 mol/L=2×10-12c Fe3+ mol/L,溶液中0.01
POH=12- lg2,故 PH 为:2.3;
10-14
(5)常温下某 NaNO2和 HNO2混合溶液的 pH为 5,该溶液中 c(OH-)= 10
-5 mol/L=10-9mol/L,结合
c HNO2 c(OH- )
- - - -
K NO c(NO ) NO NOh( 2 )= 2 可知 c( 2 ):c(HNO2)=Kh( 2 ):c(OH-)=10-9:2×10-11=50,故答案
为:50。
19.每空 2分, (1)增加接触面,提高反应速率;提高原料利用率
(2) Fe3+或Mn2+或MnO2等作催化剂 MnO2+ H2O2+2H+= Mn2++O2↑+H2O 便于加入氨水调节
溶液 PH时将 Fe3+作转化为 Fe(OH)3除去
(3)Fe(OH)3、Al(OH)3
(4)Mn2++HCO 3 =MnCO3↓+H2O+ CO2↑ (5)50
4
{#{QQABYQSEogAgAhAAABhCAQVaCEOQkAGACAoOAFAIsAAAgANABAA=}#}
同课章节目录
