广东省东莞市东莞外国语学校2023-2024学年高二上学期11月期中考试化学试题(PDF版含答案)
文档属性
| 名称 | 广东省东莞市东莞外国语学校2023-2024学年高二上学期11月期中考试化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 685.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 22:00:03 | ||
图片预览

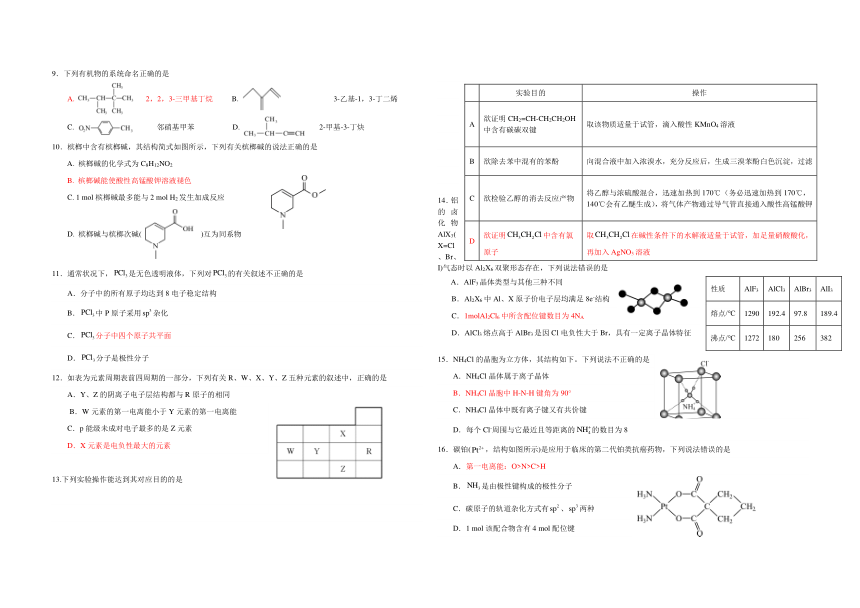
文档简介
东莞外国语学校 2023-2024 学年第一学期 4. 下列说法正确的是
A. 第 24 届冬奥会中的“战袍”利用微信程序调控石墨烯片加热保暖,石墨烯和碳纳米管互为同分异构体
高二第二次段考化学试题
B. 煤的干馏、煤的气化、煤的液化,均属于化学变化
C. 石油减压蒸馏可以获得乙烯
D. 碳纤维材料操纵棒是宇航员的手臂“延长器”,碳纤维属于有机高分子材料
注意事项: 5.下列说法正确的是
1、 本试卷分选择题和非选择题两部分。 A.CH2Cl2 分子的空间结构为正四面体形
2、 试卷满分 100 分,考试时间 75 分钟。 B.H2O 分子中氧原子的杂化轨道类型为 sp
2,分子的空间结构为 V 形
C.CO2 分子中碳原子的杂化轨道类型为 sp,分子的空间结构为直线形
一、选择题(本题包括 16 小题,共 44 分。其中 1-10 小题,每小题 2 分,共 20 分。
D.SO2
-
3 的空间结构为平面三角形
11-16 小题,每小题 4 分,共 24 分。每小题只有一个选项符合题意)
6. 利用下列装置(夹持装置略)进行实验,不能达到相应实验目的的是
1.下列说法正确的是
A.激光的产生、LED 灯发光都与电子跃迁有关
B.2d 能级最多容纳 10 个电子
C.电子从激发态跃迁到基态时可形成吸收光谱
D.3d 原子轨道的能量一定大于 4s 原子轨道的能量
2.下列描述原子结构的化学用语正确的是
A. 装置甲:乙醇在浓硫酸的作用下,快速加热到170℃制取乙烯
A.碳原子结构示意图: B. 装置乙:苯与溴在FeBr3 催化下制备溴苯并验证有HBr 生成
B.基态铜原子( 29Cu )的价层电子排布式:3d
94s2 C. 装置丙:用乙酸乙酯萃取溴水中的溴,分液时从上口倒出有机层
C.氧原子核外能量最高的电子云的形状: D. 装置丁:用电石 (CaC2 )与水反应制取乙炔并验证乙炔具有还原性
7. γ-崖柏素具天然活性,有酚的通性,结构如图。关于 γ-崖柏素的说法错误的是
D.碳原子核外电子的轨道表示式:
3. 洋川芎内酯 J 具有抗炎镇痛的功效,其结构简式如图所示。下列有关洋川芎内酯 J 的说法错误的是 A.可与溴水发生取代反应 B.可与
NaHCO3溶液反应
A. 分子式为C12H18O
C.分子中的碳原子不可能全部共平面 D.该分子中不存在手性碳原子
4
8.下列说法正确的是
B. 含有羟基、碳碳双键、酮羰基、醚键四种官能团
A.键的极性: N- H 键>O- H 键>F-H 键 B.热稳定性: HF>H2O>NH3
C. 能使溴水褪色
D. 能与酸性高锰酸钾溶液发生反应
C.强度:氢键>化学键>范德华力 D.沸点:
{#{QQABCQaAogigQAAAARhCEQEoCAEQkBAACCoOQAAEsAAAwAFABAA=}#}
9.下列有机物的系统命名正确的是
实验目的 操作
A. 2,2,3-三甲基丁烷 B. 3-乙基-1,3-丁二烯
欲证明 CH2=CH-CH2CH2OH
C. 邻硝基甲苯 D. 2-甲基-3-丁炔 A 取该物质适量于试管,滴入酸性 KMnO4 溶液 中含有碳碳双键
10.槟榔中含有槟榔碱,其结构简式如图所示,下列有关槟榔碱的说法正确的是
A. 槟榔碱的化学式为 C H NO B 欲除去苯中混有的苯酚 向混合液中加入浓溴水,充分反应后,生成三溴苯酚白色沉淀,过滤 8 12 2
B. 槟榔碱能使酸性高锰酸钾溶液褪色
将乙醇与浓硫酸混合,迅速加热到 170℃(务必迅速加热到 170℃,
C. 1 mol 槟榔碱最多能与 2 mol H2 发生加成反应 14.铝 C 欲检验乙醇的消去反应产物 140℃会有乙醚生成),将气体产物通过导气管直接通入酸性高锰酸钾
的 卤
化 物
D. 槟榔碱与槟榔次碱( )互为同系物 AlX3( 欲证明CH3CH2Cl中含有氯 取CH3CH2Cl在碱性条件下的水解液适量于试管,加足量硝酸酸化,
D
X=Cl
原子 再加入 AgNO3 溶液
、Br、
I)气态时以 Al2X6 双聚形态存在,下列说法错误的是
11.通常状况下,PCl3是无色透明液体,下列对PCl3的有关叙述不正确的是
A.AlF3 晶体类型与其他三种不同
性质 AlF3 AlCl3 AlBr3 AlI3
A.分子中的所有原子均达到 8 电子稳定结构
B.Al2X6 中 Al、X 原子价电子层均满足 8e-结构
B.PCl3中 P 原子采用 sp
3 杂化 C.1molAl Cl 中所含配位键数目为 4N 熔点/℃ 1290 192.4 97.8 189.4 2 6 A
C.PCl 分子中四个原子共平面 D.AlCl3 熔点高于 AlBr3 是因 Cl 电负性大于 Br,具有一定离子晶体特征 3 沸点/℃ 1272 180 256 382
D.PCl3分子是极性分子 15.NH4Cl 的晶胞为立方体,其结构如下。下列说法不正确的是
12.如表为元素周期表前四周期的一部分,下列有关 R、W、X、Y、Z 五种元素的叙述中,正确的是 A.NH4Cl 晶体属于离子晶体
A.Y、Z 的阴离子电子层结构都与 R 原子的相同 B.NH4Cl 晶胞中 H-N-H 键角为 90°
B.W 元素的第一电离能小于 Y 元素的第一电离能 C.NH4Cl 晶体中既有离子键又有共价键
C.p 能级未成对电子最多的是 Z 元素 +D.每个 Cl-周围与它最近且等距离的 NH4 的数目为 8
D.X 元素是电负性最大的元素
16.碳铂( Pt2+,结构如图所示)是应用于临床的第二代铂类抗癌药物,下列说法错误的是
A.第一电离能:O>N>C>H
13.下列实验操作能达到其对应目的的是
B.NH3是由极性键构成的极性分子
C.碳原子的轨道杂化方式有 sp2 、sp3 两种
D.1 mol 该配合物含有 4 mol 配位键
{#{QQABCQaAogigQAAAARhCEQEoCAEQkBAACCoOQAAEsAAAwAFABAA=}#}
二、非选择题(本题共 4 小题,共 56 分)
17(8 分).按要求填空: 19(16 分).如图是苯和溴的取代反应的实验装置图,其中 A 为具支试管改制成的反应容器,在其下端开了一个
( ) +1 Mn2 基态的电子排布式可表示为________,Mn 在元素周期表中的位置为________,属于_________区。 小孔,塞好石棉绒,再加入少量的铁屑粉。填写下列空白:
(2)NO -3 的空间构型是______________(用文字表述),N 原子的轨道杂化方式为________________。
(3)Cu+在酸性溶液中不稳定,可发生歧化反应生成 Cu2+和 Cu。但 CuO 在高温下会分解成 Cu2O,试从结构
角度解释高温下 CuO 为何会生成 Cu2O 的原因: 。
(4)某同学所画的电子轨道表示式为: 违背了 (填原理或规
则名称)
18(15 分).按要求回答下列问题:
(1)热稳定性:CH________SiH4; 沸点:CH4________SiH4(填“大于”或“小于”)。
(2)实验室用 K [Fe(CN) ]检验 Fe2+3 6 ,[Fe(CN)6]3-中σ键、 π键数目之比为________。
(3)抗坏血酸的分子结构如图所示,推测抗坏血酸在水中的溶解性 ________(填“难”或“易”)溶于水; (1)向反应容器 A 中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出 A 中发生反应的有机化学反应方
程式(有机化合物写结构简式):_______________。
(4)单质铜及镍都是由 键形成的晶体: (2)要证明 A 中发生的是取代反应,而不是加成反应,试管 C 中苯的作用是_______________。反应开始后,
元素铜与镍的第二电离能分别为:ICu=1958kJ/mol,INi=1753kJ/mol, 观察 D 和 E 两支试管,看到的现象分别是_______________、_______________。
第二电离能 ICu>INi的原因是 。 (3)反应 2~3min 后,在 B 中的氢氧化钠溶液中可观察到的现象是_______________、_______________,写出
(5)Al 的卤化物的熔点如下: 抗坏血酸 可能发生的离子反应方程式__________________________________、
_______________________________________。
AlCl3 AlBr3 AlI3
(4)苯是一种重要的化工原料,以下是用苯作为原料制备某些化合物的转化关系图:
熔点/K 256.8 304 413
表中卤化物熔点差异的原因是___________________________________。
(6)化合物 AlN 是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。
3
①若AlN的晶胞边长为 a pm(1cm=1010pm),则晶体的密度为________ g/cm (用 N 请回答下列问题: A
①反应 I、II 反应类型分别是___________、___________。
表示阿伏加德罗常数 AlN 的相对分子质量为 41)。
②反应 III 中有机产物的结构简式为___________。
②立方 AlN 和 BN 均为共价晶体,结构相似,BN 的熔点高于 AlN 的原因是
。
{#{QQABCQaAogigQAAAARhCEQEoCAEQkBAACCoOQAAEsAAAwAFABAA=}#}
(2) 有机物 的系统命名是 ,
(5)苯的同系物中,有的侧链能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下:
将其在催化剂存在下完全氢化,所得烷烃的系统命名是 。
( R 、R'表示烷基或氢原子) (3)下图是某一有机物的红外光谱图,该有机物的相对分子质量为 74,则其结构简式
为 。
现有苯的同系物甲和乙,分子式都是C10H14。甲不能被酸性高锰酸钾溶液氧化为芳香酸,甲的结构简式
是 。
20(17 分)I.乙烯是重要的有机化工原料,其产量是衡量国家石油化工水平发展的标志。以乙烯和淀粉为原料可
以实现下列转化:
(1)乙烯的电子式___________。
(2)反应⑥的反应类型为___________。
(3)写出反应③的化学方程式:_________________________________________________________________。
(4)丙烯( CH2 =CHCH3 )与乙烯具有相似的化学性质。
①聚丙烯的结构简式为___________;②在一定条件下丙烯与 H2O 的加成产物可能为___________。
II . (1)某有机物的结构简式为 ,该有机物中含氧官能团有: 、 、
、 。(写官能团名称)
{#{QQABCQaAogigQAAAARhCEQEoCAEQkBAACCoOQAAEsAAAwAFABAA=}#}
20.(17 分)
参考答案 I.(1) (1 分) (2)氧化反应 (1 分)
一、选择题
浓硫酸
1-5ACBBC 6-10BBBAB 11-16CDDCBA (3)CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O (2 分)
二、非选择题
17.(8 分)
(4) ①. (1 分) ②. CH3CH(OH)CH3 CH3CH2CH2OH(2 分)
(1)1s22s22p63s23p63d5 (1 分)第四周期 第 VIIB 族 (1 分)d 区(1 分)
(2)平面三角形(1 分)sp2 杂化 (1 分)
(3)Cu+3d 轨道上电子全充满,其结构更为稳定(2 分) II.. 醚键 羟基 硝基 羰基 (4 分) 5,6-二甲基-3-乙基-1-庚炔(2 分)
(4)泡利不相容原理或泡利原理(1 分) CH CH OCH CH
2,3-二甲基-5-乙基庚烷 (2 分) 3 2 2 3 (2 分)
18(15 分)
(1)大于;小于(2 分); (2) 1:1 (2 分); (3)易 (1 分);
(4)金属(2 分);第二电离能,意味着铜失去的是全充满更稳定的 3d10电子,镍失去的是 4s 轨道上的电子
(2 分);
(5) AlCl3 、AlBr3 、AlI3均为分子晶体,随着相对分子质量增大,分子间作用力增强,熔点升高(2 分);
1.64 1032
(6)① 3 (2 分); ②B 原子半径更小,B-N 键键长更小,键能更大 (2 分)。 a NA
19.(16 分)
(1) (催化剂最好写成 FeBr3)(2 分)
(2)吸收溴化氢气体中混有的Br2 蒸气(1 分);D 试管中溶液变红(1 分);
E 试管中产生浅黄色沉淀(1 分)
(3)生成红褐色沉淀,液体分层底层出现油状液体(2 分)
Fe3+ + 3OH- =Fe(OH)3 (2 分) Br +2OH- 2 = Br- + BrO- +H2O(2 分)
(4)① 取代反应 氧化反应 (2 分)
② (1 分) (5) (2 分)
{#{QQABCQaAogigQAAAARhCEQEoCAEQkBAACCoOQAAEsAAAwAFABAA=}#}
A. 第 24 届冬奥会中的“战袍”利用微信程序调控石墨烯片加热保暖,石墨烯和碳纳米管互为同分异构体
高二第二次段考化学试题
B. 煤的干馏、煤的气化、煤的液化,均属于化学变化
C. 石油减压蒸馏可以获得乙烯
D. 碳纤维材料操纵棒是宇航员的手臂“延长器”,碳纤维属于有机高分子材料
注意事项: 5.下列说法正确的是
1、 本试卷分选择题和非选择题两部分。 A.CH2Cl2 分子的空间结构为正四面体形
2、 试卷满分 100 分,考试时间 75 分钟。 B.H2O 分子中氧原子的杂化轨道类型为 sp
2,分子的空间结构为 V 形
C.CO2 分子中碳原子的杂化轨道类型为 sp,分子的空间结构为直线形
一、选择题(本题包括 16 小题,共 44 分。其中 1-10 小题,每小题 2 分,共 20 分。
D.SO2
-
3 的空间结构为平面三角形
11-16 小题,每小题 4 分,共 24 分。每小题只有一个选项符合题意)
6. 利用下列装置(夹持装置略)进行实验,不能达到相应实验目的的是
1.下列说法正确的是
A.激光的产生、LED 灯发光都与电子跃迁有关
B.2d 能级最多容纳 10 个电子
C.电子从激发态跃迁到基态时可形成吸收光谱
D.3d 原子轨道的能量一定大于 4s 原子轨道的能量
2.下列描述原子结构的化学用语正确的是
A. 装置甲:乙醇在浓硫酸的作用下,快速加热到170℃制取乙烯
A.碳原子结构示意图: B. 装置乙:苯与溴在FeBr3 催化下制备溴苯并验证有HBr 生成
B.基态铜原子( 29Cu )的价层电子排布式:3d
94s2 C. 装置丙:用乙酸乙酯萃取溴水中的溴,分液时从上口倒出有机层
C.氧原子核外能量最高的电子云的形状: D. 装置丁:用电石 (CaC2 )与水反应制取乙炔并验证乙炔具有还原性
7. γ-崖柏素具天然活性,有酚的通性,结构如图。关于 γ-崖柏素的说法错误的是
D.碳原子核外电子的轨道表示式:
3. 洋川芎内酯 J 具有抗炎镇痛的功效,其结构简式如图所示。下列有关洋川芎内酯 J 的说法错误的是 A.可与溴水发生取代反应 B.可与
NaHCO3溶液反应
A. 分子式为C12H18O
C.分子中的碳原子不可能全部共平面 D.该分子中不存在手性碳原子
4
8.下列说法正确的是
B. 含有羟基、碳碳双键、酮羰基、醚键四种官能团
A.键的极性: N- H 键>O- H 键>F-H 键 B.热稳定性: HF>H2O>NH3
C. 能使溴水褪色
D. 能与酸性高锰酸钾溶液发生反应
C.强度:氢键>化学键>范德华力 D.沸点:
{#{QQABCQaAogigQAAAARhCEQEoCAEQkBAACCoOQAAEsAAAwAFABAA=}#}
9.下列有机物的系统命名正确的是
实验目的 操作
A. 2,2,3-三甲基丁烷 B. 3-乙基-1,3-丁二烯
欲证明 CH2=CH-CH2CH2OH
C. 邻硝基甲苯 D. 2-甲基-3-丁炔 A 取该物质适量于试管,滴入酸性 KMnO4 溶液 中含有碳碳双键
10.槟榔中含有槟榔碱,其结构简式如图所示,下列有关槟榔碱的说法正确的是
A. 槟榔碱的化学式为 C H NO B 欲除去苯中混有的苯酚 向混合液中加入浓溴水,充分反应后,生成三溴苯酚白色沉淀,过滤 8 12 2
B. 槟榔碱能使酸性高锰酸钾溶液褪色
将乙醇与浓硫酸混合,迅速加热到 170℃(务必迅速加热到 170℃,
C. 1 mol 槟榔碱最多能与 2 mol H2 发生加成反应 14.铝 C 欲检验乙醇的消去反应产物 140℃会有乙醚生成),将气体产物通过导气管直接通入酸性高锰酸钾
的 卤
化 物
D. 槟榔碱与槟榔次碱( )互为同系物 AlX3( 欲证明CH3CH2Cl中含有氯 取CH3CH2Cl在碱性条件下的水解液适量于试管,加足量硝酸酸化,
D
X=Cl
原子 再加入 AgNO3 溶液
、Br、
I)气态时以 Al2X6 双聚形态存在,下列说法错误的是
11.通常状况下,PCl3是无色透明液体,下列对PCl3的有关叙述不正确的是
A.AlF3 晶体类型与其他三种不同
性质 AlF3 AlCl3 AlBr3 AlI3
A.分子中的所有原子均达到 8 电子稳定结构
B.Al2X6 中 Al、X 原子价电子层均满足 8e-结构
B.PCl3中 P 原子采用 sp
3 杂化 C.1molAl Cl 中所含配位键数目为 4N 熔点/℃ 1290 192.4 97.8 189.4 2 6 A
C.PCl 分子中四个原子共平面 D.AlCl3 熔点高于 AlBr3 是因 Cl 电负性大于 Br,具有一定离子晶体特征 3 沸点/℃ 1272 180 256 382
D.PCl3分子是极性分子 15.NH4Cl 的晶胞为立方体,其结构如下。下列说法不正确的是
12.如表为元素周期表前四周期的一部分,下列有关 R、W、X、Y、Z 五种元素的叙述中,正确的是 A.NH4Cl 晶体属于离子晶体
A.Y、Z 的阴离子电子层结构都与 R 原子的相同 B.NH4Cl 晶胞中 H-N-H 键角为 90°
B.W 元素的第一电离能小于 Y 元素的第一电离能 C.NH4Cl 晶体中既有离子键又有共价键
C.p 能级未成对电子最多的是 Z 元素 +D.每个 Cl-周围与它最近且等距离的 NH4 的数目为 8
D.X 元素是电负性最大的元素
16.碳铂( Pt2+,结构如图所示)是应用于临床的第二代铂类抗癌药物,下列说法错误的是
A.第一电离能:O>N>C>H
13.下列实验操作能达到其对应目的的是
B.NH3是由极性键构成的极性分子
C.碳原子的轨道杂化方式有 sp2 、sp3 两种
D.1 mol 该配合物含有 4 mol 配位键
{#{QQABCQaAogigQAAAARhCEQEoCAEQkBAACCoOQAAEsAAAwAFABAA=}#}
二、非选择题(本题共 4 小题,共 56 分)
17(8 分).按要求填空: 19(16 分).如图是苯和溴的取代反应的实验装置图,其中 A 为具支试管改制成的反应容器,在其下端开了一个
( ) +1 Mn2 基态的电子排布式可表示为________,Mn 在元素周期表中的位置为________,属于_________区。 小孔,塞好石棉绒,再加入少量的铁屑粉。填写下列空白:
(2)NO -3 的空间构型是______________(用文字表述),N 原子的轨道杂化方式为________________。
(3)Cu+在酸性溶液中不稳定,可发生歧化反应生成 Cu2+和 Cu。但 CuO 在高温下会分解成 Cu2O,试从结构
角度解释高温下 CuO 为何会生成 Cu2O 的原因: 。
(4)某同学所画的电子轨道表示式为: 违背了 (填原理或规
则名称)
18(15 分).按要求回答下列问题:
(1)热稳定性:CH________SiH4; 沸点:CH4________SiH4(填“大于”或“小于”)。
(2)实验室用 K [Fe(CN) ]检验 Fe2+3 6 ,[Fe(CN)6]3-中σ键、 π键数目之比为________。
(3)抗坏血酸的分子结构如图所示,推测抗坏血酸在水中的溶解性 ________(填“难”或“易”)溶于水; (1)向反应容器 A 中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出 A 中发生反应的有机化学反应方
程式(有机化合物写结构简式):_______________。
(4)单质铜及镍都是由 键形成的晶体: (2)要证明 A 中发生的是取代反应,而不是加成反应,试管 C 中苯的作用是_______________。反应开始后,
元素铜与镍的第二电离能分别为:ICu=1958kJ/mol,INi=1753kJ/mol, 观察 D 和 E 两支试管,看到的现象分别是_______________、_______________。
第二电离能 ICu>INi的原因是 。 (3)反应 2~3min 后,在 B 中的氢氧化钠溶液中可观察到的现象是_______________、_______________,写出
(5)Al 的卤化物的熔点如下: 抗坏血酸 可能发生的离子反应方程式__________________________________、
_______________________________________。
AlCl3 AlBr3 AlI3
(4)苯是一种重要的化工原料,以下是用苯作为原料制备某些化合物的转化关系图:
熔点/K 256.8 304 413
表中卤化物熔点差异的原因是___________________________________。
(6)化合物 AlN 是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。
3
①若AlN的晶胞边长为 a pm(1cm=1010pm),则晶体的密度为________ g/cm (用 N 请回答下列问题: A
①反应 I、II 反应类型分别是___________、___________。
表示阿伏加德罗常数 AlN 的相对分子质量为 41)。
②反应 III 中有机产物的结构简式为___________。
②立方 AlN 和 BN 均为共价晶体,结构相似,BN 的熔点高于 AlN 的原因是
。
{#{QQABCQaAogigQAAAARhCEQEoCAEQkBAACCoOQAAEsAAAwAFABAA=}#}
(2) 有机物 的系统命名是 ,
(5)苯的同系物中,有的侧链能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下:
将其在催化剂存在下完全氢化,所得烷烃的系统命名是 。
( R 、R'表示烷基或氢原子) (3)下图是某一有机物的红外光谱图,该有机物的相对分子质量为 74,则其结构简式
为 。
现有苯的同系物甲和乙,分子式都是C10H14。甲不能被酸性高锰酸钾溶液氧化为芳香酸,甲的结构简式
是 。
20(17 分)I.乙烯是重要的有机化工原料,其产量是衡量国家石油化工水平发展的标志。以乙烯和淀粉为原料可
以实现下列转化:
(1)乙烯的电子式___________。
(2)反应⑥的反应类型为___________。
(3)写出反应③的化学方程式:_________________________________________________________________。
(4)丙烯( CH2 =CHCH3 )与乙烯具有相似的化学性质。
①聚丙烯的结构简式为___________;②在一定条件下丙烯与 H2O 的加成产物可能为___________。
II . (1)某有机物的结构简式为 ,该有机物中含氧官能团有: 、 、
、 。(写官能团名称)
{#{QQABCQaAogigQAAAARhCEQEoCAEQkBAACCoOQAAEsAAAwAFABAA=}#}
20.(17 分)
参考答案 I.(1) (1 分) (2)氧化反应 (1 分)
一、选择题
浓硫酸
1-5ACBBC 6-10BBBAB 11-16CDDCBA (3)CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O (2 分)
二、非选择题
17.(8 分)
(4) ①. (1 分) ②. CH3CH(OH)CH3 CH3CH2CH2OH(2 分)
(1)1s22s22p63s23p63d5 (1 分)第四周期 第 VIIB 族 (1 分)d 区(1 分)
(2)平面三角形(1 分)sp2 杂化 (1 分)
(3)Cu+3d 轨道上电子全充满,其结构更为稳定(2 分) II.. 醚键 羟基 硝基 羰基 (4 分) 5,6-二甲基-3-乙基-1-庚炔(2 分)
(4)泡利不相容原理或泡利原理(1 分) CH CH OCH CH
2,3-二甲基-5-乙基庚烷 (2 分) 3 2 2 3 (2 分)
18(15 分)
(1)大于;小于(2 分); (2) 1:1 (2 分); (3)易 (1 分);
(4)金属(2 分);第二电离能,意味着铜失去的是全充满更稳定的 3d10电子,镍失去的是 4s 轨道上的电子
(2 分);
(5) AlCl3 、AlBr3 、AlI3均为分子晶体,随着相对分子质量增大,分子间作用力增强,熔点升高(2 分);
1.64 1032
(6)① 3 (2 分); ②B 原子半径更小,B-N 键键长更小,键能更大 (2 分)。 a NA
19.(16 分)
(1) (催化剂最好写成 FeBr3)(2 分)
(2)吸收溴化氢气体中混有的Br2 蒸气(1 分);D 试管中溶液变红(1 分);
E 试管中产生浅黄色沉淀(1 分)
(3)生成红褐色沉淀,液体分层底层出现油状液体(2 分)
Fe3+ + 3OH- =Fe(OH)3 (2 分) Br +2OH- 2 = Br- + BrO- +H2O(2 分)
(4)① 取代反应 氧化反应 (2 分)
② (1 分) (5) (2 分)
{#{QQABCQaAogigQAAAARhCEQEoCAEQkBAACCoOQAAEsAAAwAFABAA=}#}
同课章节目录
