第1章 化学反应与能量转化 测试题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第1章 化学反应与能量转化 测试题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 311.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-01 23:23:22 | ||
图片预览




文档简介
第1章 化学反应与能量转化 测试题
一、单选题
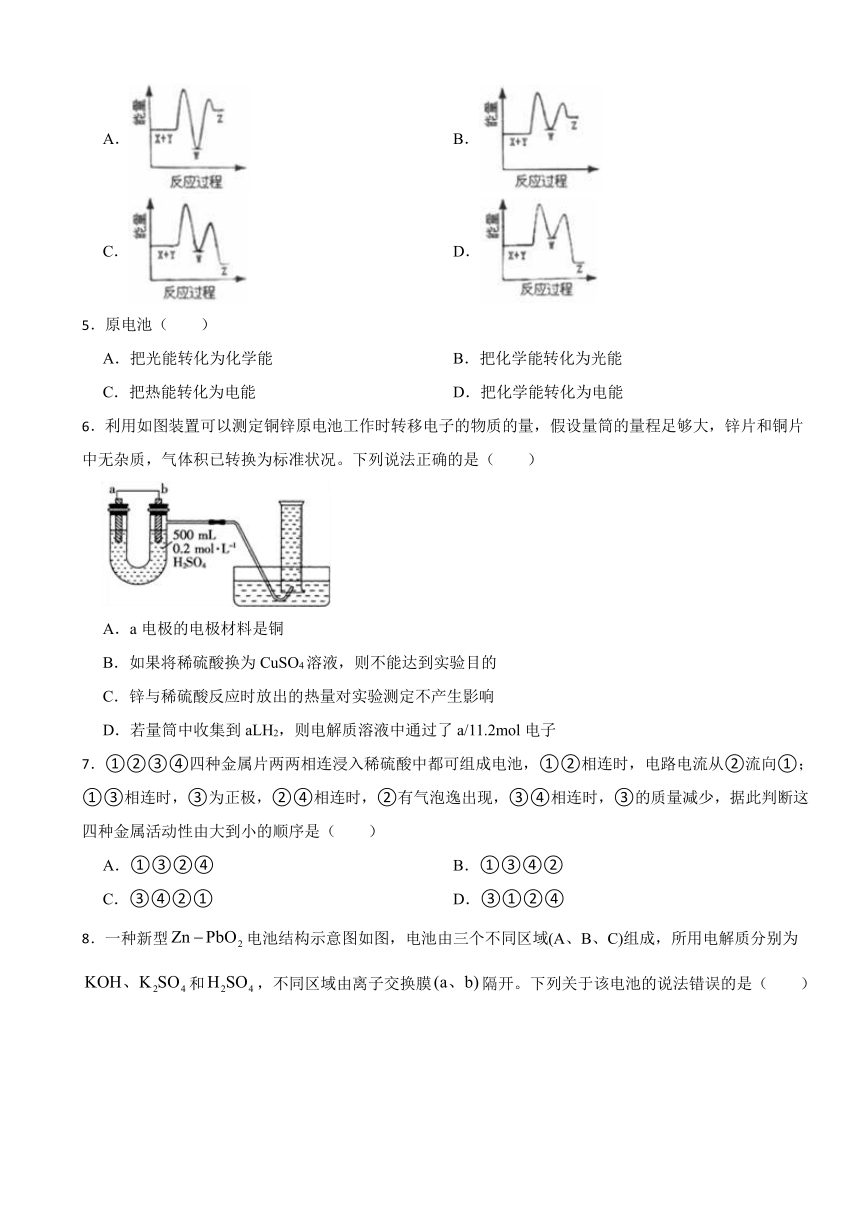
1.氨—空气燃料电池的结构如图所示。关于该电池的工作原理,下列说法正确的是( )
A.b极发生氧化反应
B.O2-由b极移向a极
C.a极的电极反应:2NH3+3O2-+6e-=N2+3H2O
D.理论上消耗2molNH3,同时消耗33.6LO2
2.为了研究化学反应的能量变化情况,某同学设计了如图所示装置。当向盛有试剂甲的试管中滴加试剂乙时,U形管中液面呈现出左高右低的现象,则试剂甲、乙的组合是( )
A.甲:镁条乙:盐酸 B.甲:碳酸氢钠乙:盐酸
C.甲:氢氧化钡乙:硫酸 D.甲:二氧化锰乙:双氧水
3.下列能源组合中,均属于新能源的一组是( )
①天然气;②煤;③沼气能;④石油;⑤太阳能;⑥生物质能;⑦风能;⑧氢能.
A.①②③④ B.①⑤⑥⑦⑧
C.③④⑤⑥⑦⑧ D.③⑤⑥⑦⑧
4.反应X+Y→Z(△H>0)分两步进行:①X+Y→W(△H<0),②W→Z(△H>0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
A. B.
C. D.
5.原电池( )
A.把光能转化为化学能 B.把化学能转化为光能
C.把热能转化为电能 D.把化学能转化为电能
6.利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体积已转换为标准状况。下列说法正确的是( )
A.a电极的电极材料是铜
B.如果将稀硫酸换为CuSO4溶液,则不能达到实验目的
C.锌与稀硫酸反应时放出的热量对实验测定不产生影响
D.若量筒中收集到aLH2,则电解质溶液中通过了a/11.2mol电子
7.①②③④四种金属片两两相连浸入稀硫酸中都可组成电池,①②相连时,电路电流从②流向①;①③相连时,③为正极,②④相连时,②有气泡逸出现,③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是( )
A.①③②④ B.①③④②
C.③④②① D.③①②④
8.一种新型电池结构示意图如图,电池由三个不同区域(A、B、C)组成,所用电解质分别为和,不同区域由离子交换膜隔开。下列关于该电池的说法错误的是( )
A.为电池的负极,发生氧化反应
B.a为阴离子交换膜,b为阳离子交换膜
C.电极反应:
D.电池工作过程中,区域A、B、C溶液分别减小、不变、增大
9.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)→2HCl(g)+Q1
H2(g)+Br2(g)→2HBr(g)+Q2 根据上述反应做出的判断正确的是( )
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1mol HCl(g)放出Q1热量
D.等物质的量时,Br2(g)具有的能量低于Br2(l)
10.有X、Y、Z、W四种金属元素,其中只有Z的单质不能与稀硫酸反应,将X、Y的单质用导线连接起来浸入稀硫酸中,X的单质所在电极上产生大量气泡;X元素的最高价氧化物对应的水化物的碱性比W强,则四种金属元素的单质活泼性由强到弱的顺序是( )
A. B. C. D.
11.科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法正确的是( )
A.过程Ⅰ若通过原电池来实现,阴极电极反应式为
B.过程Ⅱ生成W的反应:
C.过程Ⅲ中LiOH在阳极得电子生成金属锂,该体系中可用金属锂作阳极材料
D.过程Ⅲ中阴极电极反应式为
12.下列反应中,生成物的总能量大于反应物的总能量的是( )
A.氢气在氧气中燃烧 B.焦炭在高温下与水蒸气反应
C.硫在氧气中燃烧 D.铁丝在氧气中燃烧
13.下列反应过程中,能量变化符合如图的是( )
A.Zn与盐酸反应 B.CaO与H2O反应
C.NaOH溶液与盐酸反应 D.消石灰与NH4Cl固体反应
14.铅蓄电池是目前常见的二次电池,其放电时总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列说法中正确的是( )
A.放电时,Pb作为电池的负极发生还原反应
B.放电时,内电路中的H+向Pb电极移动
C.充电时,外接电源的负极需要与Pb电极相连
D.充电时,阳极区附近溶液酸性减弱
15.下列图象分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是( )
A.由图1知,石墨转变为金刚石是吸热反应
B.由图2知,S(g)+O2(g)=SO2(g) ΔH1, S(s)+O2(g)=SO2(g)ΔH2 ,则ΔH1>ΔH2
C.由图3知,白磷比红磷稳定
D.由图4知,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
16.某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是( )
A.正极反应为AgCl +e-=Ag +Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
二、综合题
17.面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景.
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) CH3OH(g)△H1=﹣90kJ mol﹣1
②CO(g)+H2O(g) CO2(g)+H2(g)△H2=﹣41kJ mol﹣1
写出由二氧化碳、氢气制备甲醇的热化学方程式: .
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示.
①p1 p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”,下同),平衡常数 .
(3)已知在T℃时,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol L﹣1,c始(H2O)=1mol L﹣1,某时刻经测定CO的转化率为10%,则该反应 (填“已经”或“没有”)达到平衡,原因是 ,此时刻v正 v逆(填“>”或“<”).
18.某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有大小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5mol L﹣1盐酸、0.55mol L﹣1NaOH溶液,实验尚缺少的玻璃用品是 .
(2)①实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 .
②在大、小烧杯之间填满碎泡沫塑料的作用是 .
(3)他们记录的实验数据如表:
实验用品 溶液温度 中和热
t1 t2 △H
① 50 mL 0.55 mol L﹣1 NaOH溶液 50 mL 0.5 mol L﹣1 HCl溶液 20℃ 23.3℃ kJ/mol
② 50 mL 0.55 mol L﹣1 NaOH溶液 50 mL 0.5 mol L﹣1 HCl溶液 20℃ 23.5℃
已知:反应后溶液的比热容c为4.18kJ ℃﹣1 kg﹣1,各物质的密度均为1g cm﹣3.计算完成上表(保留两位小数).
(4)实验分析
①若用醋酸代替HCl做实验,测得的中和热的数值 (填“偏大”或“偏小”或“无影响”).
②若用60mL 0.5mol L﹣1HCl溶液与50mL 0.55mol L﹣1NaOH溶液完成实验,与上述实验相比,测得反应放出的热量 (填“偏大”或“偏小”或“不变”),中和热 (填“偏大”或“偏小”或“不变”)
19.把煤作为燃料可以通过下列两种途径:
途径I :C(s)+O2(g)=CO2(g) (放热Q1 kJ)
途径II:先制水煤气:C(s)+H2O(g)=CO+ H2(g) (吸热Q2kJ),
再燃烧水煤气:
(1)判断两种途径放热:途径I放出的热量 途径II放出的热量(填“> ” “<”“=”或“不确定”)。
(2)Q1、Q2、Q3的数学关系式为 。由于制取水煤气反应里,生成物所具有的总能量 反应物所具有的总能量(填“> ” “<”“=”或“不确定”)。
(3)简述煤通过途径II作为燃料的意义: (答两点即可)。
(4)乙醇是未来内燃机的首选环保型液体燃料。2.0g 乙醇完全燃烧生成液态水放出59.43 kJ热量,表示乙醇燃烧热的热化学方程式为 。
20.某课外兴趣小组用右图装置进行实验,试回答:
(1)若开始时开关K与a连接,则A电极反应式为 。
(2)若开始时开关K与b连接,这种方法经常用于金属的防护,这种防护措施叫做 ,则A电极反应式为 ;B电极反应式为 。
(3)开关K与b连接,将饱和食盐水换成CuSO4溶液,则A电极反应式为 ,该反应的离子方程式为 ,电解一段时间后(溶液仍然为蓝色),溶液的pH值将 (填“变大”、“变小”、“不变”),若将电解质溶液恢复至原状,应补充 。
21.根据要求回答下列问题:
① 和
② 和
③CH4和CH3CH2CH3
④金刚石和石墨
⑤H、D、T
⑥乙醇(CH3CH2OH)和甲醛(CH3OCH3)
⑦臭氧(O3)和氧气(O2)
⑧ 和
⑨ 和
⑩CuSO4 5H2O与CuSO4 3H2O
(1)这10组物质中,是同素异形体的是 (填序号,下同);是同位素的是 ;是同分异构体的是 ;是同一物质的是 ;是同系物的是
(2)写出支链只有一个乙基且相分子质量最小的烷烃的结构简式 .
(3)一定量的稀硫酸和稀NaOH溶液反应,当生成1molH2O时放出的热量为57.3kJ,则中和热的热化学方程式为 .
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 (填选项字母).
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.2H2(g)+O2(g)=2H2O(l)△H<0
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0.
答案解析部分
1.【答案】B
【解析】【解答】A.b极通入氧气,为燃料电池的正极,发生还原反应,A项不符合题意;
B.根据原电池原理,阴离子向原电池中的负极移动,即O2-由b极移向a极,B项符合题意;
C.根据原电池原理可知,a极为燃料电池的负极,NH3失去电子发生氧化反应,电极反应式为:2NH3+3O2--6e-=N2+3H2O,C项不符合题意;
D.根据原电池原理,该燃料电池的总反应为:4NH3+3O2=2N2+6H2O,可知标准状况下该电池工作时,每消耗4molNH3,同时消耗3molO2。则在标准状况下,理论上消耗2molNH3,同时消耗1.5molO2,即消耗O2,D项中若非标准状况下,则消耗的O2的体积不是33.6L,D项不符合题意;
故答案为:B。
【分析】A、b极发生还原反应;
C、a极为燃料电池的负极,应该失去电子;
D、没有强调标准状态下。
2.【答案】B
【解析】【解答】 U形管中液面呈现出左高右低的现象 ,说明集气瓶中发生的是吸热反应。
A.盐酸与镁条反应为放热反应,放出热量使集气瓶内气体膨胀,压强增大, 会使U形管中液面左低右高,故错误;
B.碳酸氢钠和盐酸反应为吸热反应,吸收热量使集气瓶内气体收缩,压强减小, 会使U形管中液面左高右低的现象,故正确;
C.氢氧化钡和硫酸反应酸碱中和反应,为放热反应,放出热量使集气瓶内气体膨胀,压强增大, 会使U形管中液面左低右高,故错误;
D.二氧化锰催化双氧水分解反应为放热反应,放出热量使集气瓶内气体膨胀,压强增大, 会使U形管中液面左低右高,故错误。
故答案为B。
【分析】 U形管中液面呈现出左高右低的现象 ,说明集气瓶中发生的是吸热反应。
活泼金属与酸,酸碱中和反应,燃烧反应,二氧化锰分解均为放热反应,不符合题意,碳酸氢钠与盐酸反应为吸热反应,符合题意。
3.【答案】D
【解析】【解答】煤、石油、天然气是化石能源,不是新能源,常见新能源有:太阳能、沼气能、地热能、潮汐能、风能、氢能、生物质能等属于未来新能源,所以符合未来新能源标准的是③⑤⑥⑦⑧,所以D选项是符合题意的.
【分析】新能源是指传统能源之外的各种能源形式,如太阳能、地热能、风能、海洋能、生物质能和核聚变能等,据此解答即可。
4.【答案】A
【解析】【解答】X、Y转化为W的反应为放热反应,说明X、Y的总能量高于W的总能量;W转化为Z的反应为吸热反应,则W的能量小于Z;而X、Y转化为Z的反应为吸热反应,说明X、Y的总能小于Z的能量,A符合题意;
故答案为:A
【分析】根据反应的热效应判断反应物和生成物总能量的相对大小,从而确定答案。
5.【答案】D
【解析】【解答】解:原电池是将化学能转变为电能的装置,在负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿大小流向正极,
故选D.
【分析】原电池是将化学能转变为电能的装置,据此分析解答.
6.【答案】B
【解析】【解答】A、由图可知b电极有H2,则b为铜,为正极;a为锌,为负极,故A不符合题意;
B、如果将稀硫酸换为 CuSO4 溶液,则b上铜离子得电子生成铜,无气体生成,则不能达到实验目的,故B符合题意;
C、锌与稀硫酸反应时放出的热量会使气体温度升高膨胀,实验测定产生影响,故C不符合题意;
D、电解质溶液中无电子通过,故D不符合题意;
故答案为:B。
【分析】在原电池中,有两个活泼性不同的电极。其中活泼性较强的做负极,失去电子,发生氧化反应,活泼性较弱的电极做正极,得到电子,化合价降低。电子的流向是从负极到正极,在电解液中,阴离子移向负极,阳离子移向正极。
7.【答案】B
【解析】【解答】①②相连时,外电路电流从②流向①,①为负极,金属性①>②;①③相连时,③为正极,①为负极,金属性①>③;②④相连时,②上有气泡逸出,④为负极,金属性④>②;③④相连时,③的质量减少,③为负极,金属性③>④,金属活动性由大到小的顺序是①③④②,
故答案为B。
【分析】该题考查原电池的形成条件及利用原电池判断金属活泼性的强弱,负极活泼性强而正极活泼性弱,所以重点是掌握正负极判断的方法,主要方法有:①活泼性强的做负极②电子流出的做负极③电流流入的做负极④电极质量减少的做负极⑤电极质量增加或者有气体产生的做正极⑥发生氧化反应的做负极)
8.【答案】B
【解析】【解答】A.由分析可知Zn为电源的负极,反应氧化反应,A项不符合题意;
B.电解质溶解中阳离子移向正极,阴离子移向负极,故a为阳离子交换膜,b为阴离子交换膜,B项符合题意;
C.PbO2电极发生的电极反应式为:,C项不符合题意;
D.电池工作过程中,区域A中OH-被消耗,pH减小;A区域的K+移向B区域,C区域的移向B区域,故B区域pH不变;C区域H+被消耗,pH增大;D项不符合题意;
故答案为:B。
【分析】A、金属单质作为负极,失去电子被氧化;
B、根据离子的移动,阻止哪些离子通过,需要哪些离子通过去判断离子交换膜;
C、根据反应物和生成物的原子守恒和溶液性质判断电极反应式;
D、pH的判断通常是用溶液中H+或者OH-的浓度变化判断。
9.【答案】A
【解析】【解答】A.氯气更活泼,所以反应物总能量高,氯化氢更稳定,所以生成物总能量低,即相对大小差值大,所以放出能量多,应为Q1>Q2,故A正确;
B.两个反应都是放热反应,生成物的总能量低于反应物的总能量,故B错误;
C.由热化学方程式可知,生成2mol氯化氢放出的热量才是Q1,故C错误;
D.物质在气态时具有的能量一般高于液态和固态时,则1molBr2(g)具有的能量高于1molBr2(l)具有的能量,故D错误;
故选A.
【分析】两个反应都是放热反应,生成物的总能量低于反应物的总能量;由热化学方程式可知,生成2mol氯化氢放出的热量才是Q1;物质在气态时具有的能量一般高于液态和固态时,以此解答该题.
10.【答案】B
【解析】【解答】X、Y、Z、W四种金属元素,其中只有Z的单质不能与稀硫酸反应,说明活动性Z最弱;将X、Y的单质用导线连接起来浸入稀硫酸中,X的单质所在电极上产生大量气泡,说明X为正极、Y为负极,活动性Y大于X;金属性越强,最高价氧化物对应得水合物碱性越强,X元素的最高价氧化物对应的水化物的碱性比W强,说明金属性活泼性X大于W;故四种金属元素的单质活泼性由强到弱的顺序是;
故答案为:B。
【分析】利用原电池原理可以比较金属活泼性,活泼金属做负极,相对不活泼的做正极;最高价氧化物对应水化物酸性越强,金属性越强,金属越活泼
11.【答案】B
【解析】【解答】A.过程Ⅰ得到 ,若用原电池来实现,原电池为正、负极,正极上电极反应式为 ,不符合题意;
B.根据流程可知,过程Ⅱ是由 和水反应生成氨气和W,根据质量守恒可推出W为LiOH,反应为 ,符合题意;
C.过程Ⅲ中应该是氢氧化锂转变为锂、氧气和水,应该是电解,LiOH生成金属Li发生还原反应,在阴极发生反应,金属锂可用作阴极材料,不符合题意;
D.过程Ⅲ涉及电解池的阳极电极反应: ,不符合题意;
故答案为:B。
【分析】A.实现此反应,发生还原反应,在正极进行
B.根据质量守恒,反应物和部分生成物,确定另一生成物
C.考查的是水对该反应的影响
D.阳极吸引大量的阴离子,氢氧根在阳极放电
12.【答案】B
【解析】【解答】A、氢气在氧气中燃烧反应是一个放热反应,故A错误;
B、焦炭在高温下与水蒸气反应是一个吸热反应,故B正确;
C、硫在氧气中燃烧反应是一个放热反应,故C错误;
D、铁丝在氧气中燃烧反应是一个放热反应,故D错误.
故选B.
【分析】反应中生成物总能量高于反应物总能量,说明该反应是一个吸热反应,根据常见的吸热反应知识来回答.
13.【答案】D
【解析】【解答】解:A、锌和盐酸反应发生氧化还原反应,反应是放热反应,故A不符合;
B、氧化钙和水反应生成氢氧化钙是化合反应,属于放热反应,故B不符合;
C、酸碱中和反应是放热反应,故C不符合;
D、消石灰与NH4Cl固体反应需要加热才能发生反应生成氨气,属于吸热反应,故D符合;
故选D.
【分析】生成物具有的总能量高于反应物具有的总能量,该反应为吸热反应,常见的吸热反应:C(s)+H2O(g)→CO(g)+H2O; C+CO2→CO的反应,以及KClO3、KMnO4、CaCO3的分解、铵盐和碱的反应等.
14.【答案】C
【解析】【解答】A、放电时,该原电池的负极材料是铅,铅失电子发生氧化反应,A不符合题意;
B、放电时,蓄电池内电路中H+向正极(即PbO2极)移动,B不符合题意;
C、充电时,外接电源的负极与Pb阴极相连,阴极发生的反应是PbSO4+2e-=Pb+SO42-,C符合题意;
D、阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,由电解方程式可知阳极附近电解质溶液的pH逐渐减小,酸性增强,D不符合题意;
故答案为:C
【分析】A.放电时,Pb在负极发生失电子的氧化反应;
B.原电池中,阳离子移向正极;
C.二次电池中,放电过程的负极为充电过程的阴极;
D.根据充电时阳极的电极反应分析;
15.【答案】A
【解析】【解答】A.根据图1知,石墨能量低,因此石墨转变为金刚石是吸热反应,故A符合题意;
B.根据图2知,1mol S(g)具有的能量比1mol S(s)具有的能量高,S(g)+O2(g)=SO2(g) ΔH1, S(s)+O2(g)=SO2(g) ΔH2 ,1mol S(g)燃烧放出的热量多,由于放热焓变为负,放出热量越多,焓变反而越小,因此则ΔH1<ΔH2,故B不符合题意;
C.根据图3知,根据能量越低越稳定,得出红磷比白磷稳定,故C不符合题意;
D.根据图4知,CO2(g)+H2(g) = CO(g)+H2O(g) ΔH>0,则CO(g)+H2O(g) = CO2(g)+H2(g) ΔH<0,故D不符合题意。
故答案为:A。
【分析】A.石墨能量低,因此石墨转变为金刚石是吸热反应;
B.放热焓变为负,放出热量越多,焓变反而越小;
C.根据能量越低越稳定分析;
D.CO(g)+H2O(g) = CO2(g)+H2(g)的ΔH<0。
16.【答案】D
【解析】【解答】A项正确的正极反应式为Cl2+2e-=2Cl-,不符合题意;
B项由于阳离子交换膜只允许阳离子通过,故在左侧溶液中才会有大量白色沉淀生成,不符合题意;
C项若用NaCl溶液代替盐酸,电池总反应不变,不符合题意;
D项当电路中转移0.01 mol e-时,交换膜左侧产生0.01 mol Ag+与盐酸反应产生AgCl沉淀,同时约有0.01 mol H+通过阳离子交换膜转移到右侧溶液中,故左侧溶液共约0.02 mol离子减少,符合题意。
故答案为:D。
【分析】该原电池装置中, AgCl/Ag电极作负极,发生失电子的氧化反应,其电极反应式为:2Ag-2e-=2Ag+;通入Cl2的Pt电极为正极,发生得电子的还原反应,其电极反应式为:Cl2+2e-+2Ag+=2AgCl;据此结合选项进行分析。
17.【答案】(1)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=﹣49kJ mol﹣1
(2)小于;增大;不变
(3)没有;Qc<K;>
【解析】【解答】解:(1)已知式:①CO(g)+2H2(g)═CH3OH(g)△H1=﹣90kJ mol﹣1;②CO(g)+H2O(g)═CO2(g)+H2(g)△H2=﹣41kJ mol﹣1,
根据盖斯定律将①﹣②得:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=﹣49kJ mol﹣1;
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=﹣49kJ mol﹣1;(2)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,CO的转化率增大,根据图象知,p1小于p2,故答案为:小于;②在其它条件不变的情况下,再增加a mol CO和2a mol H2,相当于将2amolCO、4amolH2充入2VL密闭容器中,当反应达到平衡状态时再缩小体积至VL,增大压强,平衡向正反应方向移动,所以CO的转化率增大,
由于反应的温度不变,则平衡常数不变,
故答案为:增大;不变;(3)某时刻经测定CO的转化率为10%,则
CO(g)+ H2O(g) CO2(g)+ H2(g)
起始(mol/L) 1 1 0 0
转化(mol/L) 0.1 0.1 0.1 0.1
某时刻(mol/L) 0.9 0.9 0.1 0.1
Qc= =0.012<0.32,
则没有达到平衡状态,反应向正反应方向移动,v正>v逆,
故答案为:没有;Qc<K;>.
【分析】(1)根据盖斯定律和已知热化学方程式,可知二氧化碳、氢气制备甲醇的热化学方程式可由①﹣②得出;(2)相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;温度不变,则平衡常数不变;(3)根据转化率计算各物质的浓度,进而计算Qc,与平衡常数相比较,可判断反应是否达到平衡状态,并判断反应的方向.
18.【答案】(1)温度计、环形玻璃搅拌棒
(2)否;铜是热的良导体,有热量散失;保温,减少热量散失
(3)﹣56.8
(4)偏小;偏大;不变
【解析】【解答】解:(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,测量过程中用玻璃棒不断搅拌,所以还缺少玻璃用品是温度计、环形玻璃搅拌棒;
故答案为:温度计、环形玻璃搅拌棒;(2)①不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜是热的良导体,热量损失大;
故答案为:否;铜是热的良导体,有热量散失;
②中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是减少实验过程中的热量损失;
故答案为:保温,减少热量散失;(3)2次温度差分别为:3.3℃,3.5℃,第2组数据都有效,温度差平均值=3.4℃,50mL0.55mol L﹣1NaOH和50mL.0.5mol L﹣1HCl质量和为m=100mL×1g/mL=100g,c=4.18J/(g ℃),△T=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g ℃)×100g×3.4℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为 =56.8kJ,即该实验测得的中和热△H=﹣56.8kJ/mol;
故答案为:﹣56.8;(4)①醋酸为弱酸,电离过程为吸热过程,所以醋酸(CH3COOH)代替HCl溶液反应,反应放出的热量偏小;
故答案为:偏小;
②反应放出的热量和所用酸以及碱的量的多少有关,若用60mL 0.5mol L﹣1HCl溶液与50mL 0.55mol L﹣1NaOH溶液完成实验,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL 0.5mol L﹣1HCl溶液与50mL 0.55mol L﹣1NaOH溶液进行实验,测得中和热数值相等;
故答案为:偏大;不变.
【分析】(1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;(2)①金属导热快,热量损失多;
②中和热测定实验成败的关键是保温工作;(3)先判断温度差的有效性,然后求出温度差平均值,再根据Q=m c △T计算反应放出的热量,然后根据△H=﹣ kJ/mol计算出反应热;(4)①弱电解质电离吸热;
②反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
19.【答案】(1)=
(2)Q1= Q3- Q2;>
(3)提高燃料的燃烧效率,减少对环境的污染
(4)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) =-1366.89kJ/mol
【解析】【解答】(1)由盖斯定律可知,反应热只与始终态有关,通过观察可知,两个途径的始终态相同,故两途径放出的热量相等。
(2)途径I的焓变,途径II的焓变,根据盖斯定律, ,则Q1= Q3- Q2;制取水煤气反应为吸热反应,则生成物所具有的总能量大于反应物所具有的总能量。
(3)煤通过途径II作为燃料可以提高燃料的燃烧效率,减少对环境的污染。
(4)乙醇完全燃烧生成二氧化碳和液态水,2.0g 乙醇完全燃烧生成液态水放出59.43 kJ热量,则1mol乙醇完全燃烧生成液态水放出的热量为1366.89kJ,故燃烧热的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) =-1366.89kJ/mol。
【分析】(1)依据盖斯定律,反应热只与始终态有关,通与反应途径无关。
(2)根据盖斯定律计算;吸热反应中生成物所具有的总能量大于反应物所具有的总能量。
(3)提高燃料的燃烧效率。
(4)燃烧热是101kP时,1mol可燃物完全燃烧生成稳定产物时的反应热;
20.【答案】(1)O2 + 4e-+ 2H2O = 4OH-
(2)外加电流的阴极保护法;2Cl- -2e- =Cl2↑;2H++2e-=H2↑
(3)4OH-- 4e- = O2 ↑+2H2O;2Cu2+ + 2H2O 2Cu+O2↑+ 4H+;变小;CuO(或CuCO3)
【解析】【解答】(1)若开始时开关K与a连接,则该装置是原电池,A是正极、B是负极,铁发生类似吸氧腐蚀的原电池反应,A电极反应式为O2 + 4e-+ 2H2O = 4OH-。(2)若开始时开关K与b连接,A电极与电源正极相连接,所以A是阳极,B是阴极,这种方法经常用于金属的防护,这种防护措施叫做外加电流的阴极保护法,此时阳极上是溶液中的阴离子放电,则A电极反应式为2Cl- -2e- =Cl2↑;阴极上是溶液中的氢离子放电,B电极反应式为2H++2e-=H2↑。(3)开关K与b连接,将饱和食盐水换成CuSO4溶液,阳极上是溶液中的氢氧根放电生成氧气,阴极上是铜离子放电生成铜,则A电极反应式为4OH-- 4e- = O2 ↑+2H2O,该反应的离子方程式为2Cu2+ + 2H2O 2Cu+O2↑+ 4H+,因此,溶液的pH值将变小。因为电解质中只损失了铜和氧两种元素,若将电解质溶液恢复至原状,应补充CuO(或CuCO3也可以,其与硫酸反应后可将多余的元素转化为二氧化碳逸出)。
【分析】(1)若开始时开关K与a连接,无电源是原电池,B活泼是负极(2)若开始时开关K与b连接,有电源,是电解池,A电极与电源正极相连接,所以A是阳极,B是阴极,(3) 开关K与b连接,电解池,阳极水提供OH-失电子生成O2,阴极铜离子得电子生成Cu。
21.【答案】(1)④⑦;⑤;②⑥;①⑧⑨;③
(2)
(3) H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol
(4)B
【解析】【解答】解:(1)① 和 名称与结构简式一致,为同一种物质,为2﹣甲基丁烷;② 和 分子式相同C5H12,结构不同,为碳链异构,其名称分别为:2,2﹣二甲基丙烷、2﹣甲基丁烷,互为同分异构体;③CH4和CH3CH2CH3结构相似,都属于烷烃,形成2个CH2原子团,互为同系物;④金刚石和石墨是由碳元素组成的不同单质,互为同素异形体;⑤H、D、T中子数不同,是氢元素的不同核素,互为同位素; ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)分子式相同C2H6O,结构不同,互为同分异构体;⑦臭氧(O3)和氧气(O2)是由氧元素组成的不同单质,互为同素异形体;⑧ 和 名称与结构简式一致,为同一种物质;⑨ 和 名称与结构简式一致,为同一种物质,为2﹣甲基丁烷;⑩CuSO4 5H2O与CuSO4 3H2O都为铜盐,结晶水数量不同,什么都不是;故答案为:④⑦;⑤;②⑥;①⑧⑨;③;(2)烷烃中含有乙基,则乙基至少在3号位,所以只有一个乙基且式量最小的烷烃的结构简式为 ,故答案为: ;(3)中和热指稀的强酸和强碱反应生成1mol水所放出的热量,H2SO4和NaOH反应的中和热是指反应生成1mol水放出57.3kJ的热量,反应的热化学方程式为 H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol,故答案为: H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol;(4)能设计成原电池的反应通常是放热反应,且必须是能自发进行的氧化还原反应,A.该反应是吸热反应,所以不能设计成原电池,故A不选;B.该反应是放热反应且能自发的进行氧化还原反应,所以能设计成原电池,故B选;C.该反应不是氧化还原反应,所以不能设计成原电池,故C不选;故选B.
【分析】(1)同种元素形成的不同单质互为同素异形体;质子数相同质量数(或中子数)不同的原子互称同位素;具有相同分子式而结构不同的化合物互为同分异构体;组成和结构都相同的物质为同一物质,同一物质组成、结构、性质都相同,结构式的形状及物质的聚集状态可能不同;同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团的化合物,官能团数目和种类相等;(2)烷烃中出现乙基,则主链至少含有5个C,据此写出该有机物的结构简式;(3)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量书写中和热的热化学方程式;(4)能设计成原电池的反应通常是放热反应,且必须是能自发进行的氧化还原反应.
一、单选题
1.氨—空气燃料电池的结构如图所示。关于该电池的工作原理,下列说法正确的是( )
A.b极发生氧化反应
B.O2-由b极移向a极
C.a极的电极反应:2NH3+3O2-+6e-=N2+3H2O
D.理论上消耗2molNH3,同时消耗33.6LO2
2.为了研究化学反应的能量变化情况,某同学设计了如图所示装置。当向盛有试剂甲的试管中滴加试剂乙时,U形管中液面呈现出左高右低的现象,则试剂甲、乙的组合是( )
A.甲:镁条乙:盐酸 B.甲:碳酸氢钠乙:盐酸
C.甲:氢氧化钡乙:硫酸 D.甲:二氧化锰乙:双氧水
3.下列能源组合中,均属于新能源的一组是( )
①天然气;②煤;③沼气能;④石油;⑤太阳能;⑥生物质能;⑦风能;⑧氢能.
A.①②③④ B.①⑤⑥⑦⑧
C.③④⑤⑥⑦⑧ D.③⑤⑥⑦⑧
4.反应X+Y→Z(△H>0)分两步进行:①X+Y→W(△H<0),②W→Z(△H>0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
A. B.
C. D.
5.原电池( )
A.把光能转化为化学能 B.把化学能转化为光能
C.把热能转化为电能 D.把化学能转化为电能
6.利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体积已转换为标准状况。下列说法正确的是( )
A.a电极的电极材料是铜
B.如果将稀硫酸换为CuSO4溶液,则不能达到实验目的
C.锌与稀硫酸反应时放出的热量对实验测定不产生影响
D.若量筒中收集到aLH2,则电解质溶液中通过了a/11.2mol电子
7.①②③④四种金属片两两相连浸入稀硫酸中都可组成电池,①②相连时,电路电流从②流向①;①③相连时,③为正极,②④相连时,②有气泡逸出现,③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是( )
A.①③②④ B.①③④②
C.③④②① D.③①②④
8.一种新型电池结构示意图如图,电池由三个不同区域(A、B、C)组成,所用电解质分别为和,不同区域由离子交换膜隔开。下列关于该电池的说法错误的是( )
A.为电池的负极,发生氧化反应
B.a为阴离子交换膜,b为阳离子交换膜
C.电极反应:
D.电池工作过程中,区域A、B、C溶液分别减小、不变、增大
9.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)→2HCl(g)+Q1
H2(g)+Br2(g)→2HBr(g)+Q2 根据上述反应做出的判断正确的是( )
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1mol HCl(g)放出Q1热量
D.等物质的量时,Br2(g)具有的能量低于Br2(l)
10.有X、Y、Z、W四种金属元素,其中只有Z的单质不能与稀硫酸反应,将X、Y的单质用导线连接起来浸入稀硫酸中,X的单质所在电极上产生大量气泡;X元素的最高价氧化物对应的水化物的碱性比W强,则四种金属元素的单质活泼性由强到弱的顺序是( )
A. B. C. D.
11.科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法正确的是( )
A.过程Ⅰ若通过原电池来实现,阴极电极反应式为
B.过程Ⅱ生成W的反应:
C.过程Ⅲ中LiOH在阳极得电子生成金属锂,该体系中可用金属锂作阳极材料
D.过程Ⅲ中阴极电极反应式为
12.下列反应中,生成物的总能量大于反应物的总能量的是( )
A.氢气在氧气中燃烧 B.焦炭在高温下与水蒸气反应
C.硫在氧气中燃烧 D.铁丝在氧气中燃烧
13.下列反应过程中,能量变化符合如图的是( )
A.Zn与盐酸反应 B.CaO与H2O反应
C.NaOH溶液与盐酸反应 D.消石灰与NH4Cl固体反应
14.铅蓄电池是目前常见的二次电池,其放电时总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列说法中正确的是( )
A.放电时,Pb作为电池的负极发生还原反应
B.放电时,内电路中的H+向Pb电极移动
C.充电时,外接电源的负极需要与Pb电极相连
D.充电时,阳极区附近溶液酸性减弱
15.下列图象分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是( )
A.由图1知,石墨转变为金刚石是吸热反应
B.由图2知,S(g)+O2(g)=SO2(g) ΔH1, S(s)+O2(g)=SO2(g)ΔH2 ,则ΔH1>ΔH2
C.由图3知,白磷比红磷稳定
D.由图4知,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
16.某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是( )
A.正极反应为AgCl +e-=Ag +Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
二、综合题
17.面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景.
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) CH3OH(g)△H1=﹣90kJ mol﹣1
②CO(g)+H2O(g) CO2(g)+H2(g)△H2=﹣41kJ mol﹣1
写出由二氧化碳、氢气制备甲醇的热化学方程式: .
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示.
①p1 p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”,下同),平衡常数 .
(3)已知在T℃时,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol L﹣1,c始(H2O)=1mol L﹣1,某时刻经测定CO的转化率为10%,则该反应 (填“已经”或“没有”)达到平衡,原因是 ,此时刻v正 v逆(填“>”或“<”).
18.某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有大小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5mol L﹣1盐酸、0.55mol L﹣1NaOH溶液,实验尚缺少的玻璃用品是 .
(2)①实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 .
②在大、小烧杯之间填满碎泡沫塑料的作用是 .
(3)他们记录的实验数据如表:
实验用品 溶液温度 中和热
t1 t2 △H
① 50 mL 0.55 mol L﹣1 NaOH溶液 50 mL 0.5 mol L﹣1 HCl溶液 20℃ 23.3℃ kJ/mol
② 50 mL 0.55 mol L﹣1 NaOH溶液 50 mL 0.5 mol L﹣1 HCl溶液 20℃ 23.5℃
已知:反应后溶液的比热容c为4.18kJ ℃﹣1 kg﹣1,各物质的密度均为1g cm﹣3.计算完成上表(保留两位小数).
(4)实验分析
①若用醋酸代替HCl做实验,测得的中和热的数值 (填“偏大”或“偏小”或“无影响”).
②若用60mL 0.5mol L﹣1HCl溶液与50mL 0.55mol L﹣1NaOH溶液完成实验,与上述实验相比,测得反应放出的热量 (填“偏大”或“偏小”或“不变”),中和热 (填“偏大”或“偏小”或“不变”)
19.把煤作为燃料可以通过下列两种途径:
途径I :C(s)+O2(g)=CO2(g) (放热Q1 kJ)
途径II:先制水煤气:C(s)+H2O(g)=CO+ H2(g) (吸热Q2kJ),
再燃烧水煤气:
(1)判断两种途径放热:途径I放出的热量 途径II放出的热量(填“> ” “<”“=”或“不确定”)。
(2)Q1、Q2、Q3的数学关系式为 。由于制取水煤气反应里,生成物所具有的总能量 反应物所具有的总能量(填“> ” “<”“=”或“不确定”)。
(3)简述煤通过途径II作为燃料的意义: (答两点即可)。
(4)乙醇是未来内燃机的首选环保型液体燃料。2.0g 乙醇完全燃烧生成液态水放出59.43 kJ热量,表示乙醇燃烧热的热化学方程式为 。
20.某课外兴趣小组用右图装置进行实验,试回答:
(1)若开始时开关K与a连接,则A电极反应式为 。
(2)若开始时开关K与b连接,这种方法经常用于金属的防护,这种防护措施叫做 ,则A电极反应式为 ;B电极反应式为 。
(3)开关K与b连接,将饱和食盐水换成CuSO4溶液,则A电极反应式为 ,该反应的离子方程式为 ,电解一段时间后(溶液仍然为蓝色),溶液的pH值将 (填“变大”、“变小”、“不变”),若将电解质溶液恢复至原状,应补充 。
21.根据要求回答下列问题:
① 和
② 和
③CH4和CH3CH2CH3
④金刚石和石墨
⑤H、D、T
⑥乙醇(CH3CH2OH)和甲醛(CH3OCH3)
⑦臭氧(O3)和氧气(O2)
⑧ 和
⑨ 和
⑩CuSO4 5H2O与CuSO4 3H2O
(1)这10组物质中,是同素异形体的是 (填序号,下同);是同位素的是 ;是同分异构体的是 ;是同一物质的是 ;是同系物的是
(2)写出支链只有一个乙基且相分子质量最小的烷烃的结构简式 .
(3)一定量的稀硫酸和稀NaOH溶液反应,当生成1molH2O时放出的热量为57.3kJ,则中和热的热化学方程式为 .
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 (填选项字母).
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.2H2(g)+O2(g)=2H2O(l)△H<0
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0.
答案解析部分
1.【答案】B
【解析】【解答】A.b极通入氧气,为燃料电池的正极,发生还原反应,A项不符合题意;
B.根据原电池原理,阴离子向原电池中的负极移动,即O2-由b极移向a极,B项符合题意;
C.根据原电池原理可知,a极为燃料电池的负极,NH3失去电子发生氧化反应,电极反应式为:2NH3+3O2--6e-=N2+3H2O,C项不符合题意;
D.根据原电池原理,该燃料电池的总反应为:4NH3+3O2=2N2+6H2O,可知标准状况下该电池工作时,每消耗4molNH3,同时消耗3molO2。则在标准状况下,理论上消耗2molNH3,同时消耗1.5molO2,即消耗O2,D项中若非标准状况下,则消耗的O2的体积不是33.6L,D项不符合题意;
故答案为:B。
【分析】A、b极发生还原反应;
C、a极为燃料电池的负极,应该失去电子;
D、没有强调标准状态下。
2.【答案】B
【解析】【解答】 U形管中液面呈现出左高右低的现象 ,说明集气瓶中发生的是吸热反应。
A.盐酸与镁条反应为放热反应,放出热量使集气瓶内气体膨胀,压强增大, 会使U形管中液面左低右高,故错误;
B.碳酸氢钠和盐酸反应为吸热反应,吸收热量使集气瓶内气体收缩,压强减小, 会使U形管中液面左高右低的现象,故正确;
C.氢氧化钡和硫酸反应酸碱中和反应,为放热反应,放出热量使集气瓶内气体膨胀,压强增大, 会使U形管中液面左低右高,故错误;
D.二氧化锰催化双氧水分解反应为放热反应,放出热量使集气瓶内气体膨胀,压强增大, 会使U形管中液面左低右高,故错误。
故答案为B。
【分析】 U形管中液面呈现出左高右低的现象 ,说明集气瓶中发生的是吸热反应。
活泼金属与酸,酸碱中和反应,燃烧反应,二氧化锰分解均为放热反应,不符合题意,碳酸氢钠与盐酸反应为吸热反应,符合题意。
3.【答案】D
【解析】【解答】煤、石油、天然气是化石能源,不是新能源,常见新能源有:太阳能、沼气能、地热能、潮汐能、风能、氢能、生物质能等属于未来新能源,所以符合未来新能源标准的是③⑤⑥⑦⑧,所以D选项是符合题意的.
【分析】新能源是指传统能源之外的各种能源形式,如太阳能、地热能、风能、海洋能、生物质能和核聚变能等,据此解答即可。
4.【答案】A
【解析】【解答】X、Y转化为W的反应为放热反应,说明X、Y的总能量高于W的总能量;W转化为Z的反应为吸热反应,则W的能量小于Z;而X、Y转化为Z的反应为吸热反应,说明X、Y的总能小于Z的能量,A符合题意;
故答案为:A
【分析】根据反应的热效应判断反应物和生成物总能量的相对大小,从而确定答案。
5.【答案】D
【解析】【解答】解:原电池是将化学能转变为电能的装置,在负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿大小流向正极,
故选D.
【分析】原电池是将化学能转变为电能的装置,据此分析解答.
6.【答案】B
【解析】【解答】A、由图可知b电极有H2,则b为铜,为正极;a为锌,为负极,故A不符合题意;
B、如果将稀硫酸换为 CuSO4 溶液,则b上铜离子得电子生成铜,无气体生成,则不能达到实验目的,故B符合题意;
C、锌与稀硫酸反应时放出的热量会使气体温度升高膨胀,实验测定产生影响,故C不符合题意;
D、电解质溶液中无电子通过,故D不符合题意;
故答案为:B。
【分析】在原电池中,有两个活泼性不同的电极。其中活泼性较强的做负极,失去电子,发生氧化反应,活泼性较弱的电极做正极,得到电子,化合价降低。电子的流向是从负极到正极,在电解液中,阴离子移向负极,阳离子移向正极。
7.【答案】B
【解析】【解答】①②相连时,外电路电流从②流向①,①为负极,金属性①>②;①③相连时,③为正极,①为负极,金属性①>③;②④相连时,②上有气泡逸出,④为负极,金属性④>②;③④相连时,③的质量减少,③为负极,金属性③>④,金属活动性由大到小的顺序是①③④②,
故答案为B。
【分析】该题考查原电池的形成条件及利用原电池判断金属活泼性的强弱,负极活泼性强而正极活泼性弱,所以重点是掌握正负极判断的方法,主要方法有:①活泼性强的做负极②电子流出的做负极③电流流入的做负极④电极质量减少的做负极⑤电极质量增加或者有气体产生的做正极⑥发生氧化反应的做负极)
8.【答案】B
【解析】【解答】A.由分析可知Zn为电源的负极,反应氧化反应,A项不符合题意;
B.电解质溶解中阳离子移向正极,阴离子移向负极,故a为阳离子交换膜,b为阴离子交换膜,B项符合题意;
C.PbO2电极发生的电极反应式为:,C项不符合题意;
D.电池工作过程中,区域A中OH-被消耗,pH减小;A区域的K+移向B区域,C区域的移向B区域,故B区域pH不变;C区域H+被消耗,pH增大;D项不符合题意;
故答案为:B。
【分析】A、金属单质作为负极,失去电子被氧化;
B、根据离子的移动,阻止哪些离子通过,需要哪些离子通过去判断离子交换膜;
C、根据反应物和生成物的原子守恒和溶液性质判断电极反应式;
D、pH的判断通常是用溶液中H+或者OH-的浓度变化判断。
9.【答案】A
【解析】【解答】A.氯气更活泼,所以反应物总能量高,氯化氢更稳定,所以生成物总能量低,即相对大小差值大,所以放出能量多,应为Q1>Q2,故A正确;
B.两个反应都是放热反应,生成物的总能量低于反应物的总能量,故B错误;
C.由热化学方程式可知,生成2mol氯化氢放出的热量才是Q1,故C错误;
D.物质在气态时具有的能量一般高于液态和固态时,则1molBr2(g)具有的能量高于1molBr2(l)具有的能量,故D错误;
故选A.
【分析】两个反应都是放热反应,生成物的总能量低于反应物的总能量;由热化学方程式可知,生成2mol氯化氢放出的热量才是Q1;物质在气态时具有的能量一般高于液态和固态时,以此解答该题.
10.【答案】B
【解析】【解答】X、Y、Z、W四种金属元素,其中只有Z的单质不能与稀硫酸反应,说明活动性Z最弱;将X、Y的单质用导线连接起来浸入稀硫酸中,X的单质所在电极上产生大量气泡,说明X为正极、Y为负极,活动性Y大于X;金属性越强,最高价氧化物对应得水合物碱性越强,X元素的最高价氧化物对应的水化物的碱性比W强,说明金属性活泼性X大于W;故四种金属元素的单质活泼性由强到弱的顺序是;
故答案为:B。
【分析】利用原电池原理可以比较金属活泼性,活泼金属做负极,相对不活泼的做正极;最高价氧化物对应水化物酸性越强,金属性越强,金属越活泼
11.【答案】B
【解析】【解答】A.过程Ⅰ得到 ,若用原电池来实现,原电池为正、负极,正极上电极反应式为 ,不符合题意;
B.根据流程可知,过程Ⅱ是由 和水反应生成氨气和W,根据质量守恒可推出W为LiOH,反应为 ,符合题意;
C.过程Ⅲ中应该是氢氧化锂转变为锂、氧气和水,应该是电解,LiOH生成金属Li发生还原反应,在阴极发生反应,金属锂可用作阴极材料,不符合题意;
D.过程Ⅲ涉及电解池的阳极电极反应: ,不符合题意;
故答案为:B。
【分析】A.实现此反应,发生还原反应,在正极进行
B.根据质量守恒,反应物和部分生成物,确定另一生成物
C.考查的是水对该反应的影响
D.阳极吸引大量的阴离子,氢氧根在阳极放电
12.【答案】B
【解析】【解答】A、氢气在氧气中燃烧反应是一个放热反应,故A错误;
B、焦炭在高温下与水蒸气反应是一个吸热反应,故B正确;
C、硫在氧气中燃烧反应是一个放热反应,故C错误;
D、铁丝在氧气中燃烧反应是一个放热反应,故D错误.
故选B.
【分析】反应中生成物总能量高于反应物总能量,说明该反应是一个吸热反应,根据常见的吸热反应知识来回答.
13.【答案】D
【解析】【解答】解:A、锌和盐酸反应发生氧化还原反应,反应是放热反应,故A不符合;
B、氧化钙和水反应生成氢氧化钙是化合反应,属于放热反应,故B不符合;
C、酸碱中和反应是放热反应,故C不符合;
D、消石灰与NH4Cl固体反应需要加热才能发生反应生成氨气,属于吸热反应,故D符合;
故选D.
【分析】生成物具有的总能量高于反应物具有的总能量,该反应为吸热反应,常见的吸热反应:C(s)+H2O(g)→CO(g)+H2O; C+CO2→CO的反应,以及KClO3、KMnO4、CaCO3的分解、铵盐和碱的反应等.
14.【答案】C
【解析】【解答】A、放电时,该原电池的负极材料是铅,铅失电子发生氧化反应,A不符合题意;
B、放电时,蓄电池内电路中H+向正极(即PbO2极)移动,B不符合题意;
C、充电时,外接电源的负极与Pb阴极相连,阴极发生的反应是PbSO4+2e-=Pb+SO42-,C符合题意;
D、阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,由电解方程式可知阳极附近电解质溶液的pH逐渐减小,酸性增强,D不符合题意;
故答案为:C
【分析】A.放电时,Pb在负极发生失电子的氧化反应;
B.原电池中,阳离子移向正极;
C.二次电池中,放电过程的负极为充电过程的阴极;
D.根据充电时阳极的电极反应分析;
15.【答案】A
【解析】【解答】A.根据图1知,石墨能量低,因此石墨转变为金刚石是吸热反应,故A符合题意;
B.根据图2知,1mol S(g)具有的能量比1mol S(s)具有的能量高,S(g)+O2(g)=SO2(g) ΔH1, S(s)+O2(g)=SO2(g) ΔH2 ,1mol S(g)燃烧放出的热量多,由于放热焓变为负,放出热量越多,焓变反而越小,因此则ΔH1<ΔH2,故B不符合题意;
C.根据图3知,根据能量越低越稳定,得出红磷比白磷稳定,故C不符合题意;
D.根据图4知,CO2(g)+H2(g) = CO(g)+H2O(g) ΔH>0,则CO(g)+H2O(g) = CO2(g)+H2(g) ΔH<0,故D不符合题意。
故答案为:A。
【分析】A.石墨能量低,因此石墨转变为金刚石是吸热反应;
B.放热焓变为负,放出热量越多,焓变反而越小;
C.根据能量越低越稳定分析;
D.CO(g)+H2O(g) = CO2(g)+H2(g)的ΔH<0。
16.【答案】D
【解析】【解答】A项正确的正极反应式为Cl2+2e-=2Cl-,不符合题意;
B项由于阳离子交换膜只允许阳离子通过,故在左侧溶液中才会有大量白色沉淀生成,不符合题意;
C项若用NaCl溶液代替盐酸,电池总反应不变,不符合题意;
D项当电路中转移0.01 mol e-时,交换膜左侧产生0.01 mol Ag+与盐酸反应产生AgCl沉淀,同时约有0.01 mol H+通过阳离子交换膜转移到右侧溶液中,故左侧溶液共约0.02 mol离子减少,符合题意。
故答案为:D。
【分析】该原电池装置中, AgCl/Ag电极作负极,发生失电子的氧化反应,其电极反应式为:2Ag-2e-=2Ag+;通入Cl2的Pt电极为正极,发生得电子的还原反应,其电极反应式为:Cl2+2e-+2Ag+=2AgCl;据此结合选项进行分析。
17.【答案】(1)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=﹣49kJ mol﹣1
(2)小于;增大;不变
(3)没有;Qc<K;>
【解析】【解答】解:(1)已知式:①CO(g)+2H2(g)═CH3OH(g)△H1=﹣90kJ mol﹣1;②CO(g)+H2O(g)═CO2(g)+H2(g)△H2=﹣41kJ mol﹣1,
根据盖斯定律将①﹣②得:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=﹣49kJ mol﹣1;
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=﹣49kJ mol﹣1;(2)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,CO的转化率增大,根据图象知,p1小于p2,故答案为:小于;②在其它条件不变的情况下,再增加a mol CO和2a mol H2,相当于将2amolCO、4amolH2充入2VL密闭容器中,当反应达到平衡状态时再缩小体积至VL,增大压强,平衡向正反应方向移动,所以CO的转化率增大,
由于反应的温度不变,则平衡常数不变,
故答案为:增大;不变;(3)某时刻经测定CO的转化率为10%,则
CO(g)+ H2O(g) CO2(g)+ H2(g)
起始(mol/L) 1 1 0 0
转化(mol/L) 0.1 0.1 0.1 0.1
某时刻(mol/L) 0.9 0.9 0.1 0.1
Qc= =0.012<0.32,
则没有达到平衡状态,反应向正反应方向移动,v正>v逆,
故答案为:没有;Qc<K;>.
【分析】(1)根据盖斯定律和已知热化学方程式,可知二氧化碳、氢气制备甲醇的热化学方程式可由①﹣②得出;(2)相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;温度不变,则平衡常数不变;(3)根据转化率计算各物质的浓度,进而计算Qc,与平衡常数相比较,可判断反应是否达到平衡状态,并判断反应的方向.
18.【答案】(1)温度计、环形玻璃搅拌棒
(2)否;铜是热的良导体,有热量散失;保温,减少热量散失
(3)﹣56.8
(4)偏小;偏大;不变
【解析】【解答】解:(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,测量过程中用玻璃棒不断搅拌,所以还缺少玻璃用品是温度计、环形玻璃搅拌棒;
故答案为:温度计、环形玻璃搅拌棒;(2)①不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜是热的良导体,热量损失大;
故答案为:否;铜是热的良导体,有热量散失;
②中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是减少实验过程中的热量损失;
故答案为:保温,减少热量散失;(3)2次温度差分别为:3.3℃,3.5℃,第2组数据都有效,温度差平均值=3.4℃,50mL0.55mol L﹣1NaOH和50mL.0.5mol L﹣1HCl质量和为m=100mL×1g/mL=100g,c=4.18J/(g ℃),△T=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g ℃)×100g×3.4℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为 =56.8kJ,即该实验测得的中和热△H=﹣56.8kJ/mol;
故答案为:﹣56.8;(4)①醋酸为弱酸,电离过程为吸热过程,所以醋酸(CH3COOH)代替HCl溶液反应,反应放出的热量偏小;
故答案为:偏小;
②反应放出的热量和所用酸以及碱的量的多少有关,若用60mL 0.5mol L﹣1HCl溶液与50mL 0.55mol L﹣1NaOH溶液完成实验,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL 0.5mol L﹣1HCl溶液与50mL 0.55mol L﹣1NaOH溶液进行实验,测得中和热数值相等;
故答案为:偏大;不变.
【分析】(1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;(2)①金属导热快,热量损失多;
②中和热测定实验成败的关键是保温工作;(3)先判断温度差的有效性,然后求出温度差平均值,再根据Q=m c △T计算反应放出的热量,然后根据△H=﹣ kJ/mol计算出反应热;(4)①弱电解质电离吸热;
②反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
19.【答案】(1)=
(2)Q1= Q3- Q2;>
(3)提高燃料的燃烧效率,减少对环境的污染
(4)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) =-1366.89kJ/mol
【解析】【解答】(1)由盖斯定律可知,反应热只与始终态有关,通过观察可知,两个途径的始终态相同,故两途径放出的热量相等。
(2)途径I的焓变,途径II的焓变,根据盖斯定律, ,则Q1= Q3- Q2;制取水煤气反应为吸热反应,则生成物所具有的总能量大于反应物所具有的总能量。
(3)煤通过途径II作为燃料可以提高燃料的燃烧效率,减少对环境的污染。
(4)乙醇完全燃烧生成二氧化碳和液态水,2.0g 乙醇完全燃烧生成液态水放出59.43 kJ热量,则1mol乙醇完全燃烧生成液态水放出的热量为1366.89kJ,故燃烧热的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) =-1366.89kJ/mol。
【分析】(1)依据盖斯定律,反应热只与始终态有关,通与反应途径无关。
(2)根据盖斯定律计算;吸热反应中生成物所具有的总能量大于反应物所具有的总能量。
(3)提高燃料的燃烧效率。
(4)燃烧热是101kP时,1mol可燃物完全燃烧生成稳定产物时的反应热;
20.【答案】(1)O2 + 4e-+ 2H2O = 4OH-
(2)外加电流的阴极保护法;2Cl- -2e- =Cl2↑;2H++2e-=H2↑
(3)4OH-- 4e- = O2 ↑+2H2O;2Cu2+ + 2H2O 2Cu+O2↑+ 4H+;变小;CuO(或CuCO3)
【解析】【解答】(1)若开始时开关K与a连接,则该装置是原电池,A是正极、B是负极,铁发生类似吸氧腐蚀的原电池反应,A电极反应式为O2 + 4e-+ 2H2O = 4OH-。(2)若开始时开关K与b连接,A电极与电源正极相连接,所以A是阳极,B是阴极,这种方法经常用于金属的防护,这种防护措施叫做外加电流的阴极保护法,此时阳极上是溶液中的阴离子放电,则A电极反应式为2Cl- -2e- =Cl2↑;阴极上是溶液中的氢离子放电,B电极反应式为2H++2e-=H2↑。(3)开关K与b连接,将饱和食盐水换成CuSO4溶液,阳极上是溶液中的氢氧根放电生成氧气,阴极上是铜离子放电生成铜,则A电极反应式为4OH-- 4e- = O2 ↑+2H2O,该反应的离子方程式为2Cu2+ + 2H2O 2Cu+O2↑+ 4H+,因此,溶液的pH值将变小。因为电解质中只损失了铜和氧两种元素,若将电解质溶液恢复至原状,应补充CuO(或CuCO3也可以,其与硫酸反应后可将多余的元素转化为二氧化碳逸出)。
【分析】(1)若开始时开关K与a连接,无电源是原电池,B活泼是负极(2)若开始时开关K与b连接,有电源,是电解池,A电极与电源正极相连接,所以A是阳极,B是阴极,(3) 开关K与b连接,电解池,阳极水提供OH-失电子生成O2,阴极铜离子得电子生成Cu。
21.【答案】(1)④⑦;⑤;②⑥;①⑧⑨;③
(2)
(3) H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol
(4)B
【解析】【解答】解:(1)① 和 名称与结构简式一致,为同一种物质,为2﹣甲基丁烷;② 和 分子式相同C5H12,结构不同,为碳链异构,其名称分别为:2,2﹣二甲基丙烷、2﹣甲基丁烷,互为同分异构体;③CH4和CH3CH2CH3结构相似,都属于烷烃,形成2个CH2原子团,互为同系物;④金刚石和石墨是由碳元素组成的不同单质,互为同素异形体;⑤H、D、T中子数不同,是氢元素的不同核素,互为同位素; ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)分子式相同C2H6O,结构不同,互为同分异构体;⑦臭氧(O3)和氧气(O2)是由氧元素组成的不同单质,互为同素异形体;⑧ 和 名称与结构简式一致,为同一种物质;⑨ 和 名称与结构简式一致,为同一种物质,为2﹣甲基丁烷;⑩CuSO4 5H2O与CuSO4 3H2O都为铜盐,结晶水数量不同,什么都不是;故答案为:④⑦;⑤;②⑥;①⑧⑨;③;(2)烷烃中含有乙基,则乙基至少在3号位,所以只有一个乙基且式量最小的烷烃的结构简式为 ,故答案为: ;(3)中和热指稀的强酸和强碱反应生成1mol水所放出的热量,H2SO4和NaOH反应的中和热是指反应生成1mol水放出57.3kJ的热量,反应的热化学方程式为 H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol,故答案为: H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol;(4)能设计成原电池的反应通常是放热反应,且必须是能自发进行的氧化还原反应,A.该反应是吸热反应,所以不能设计成原电池,故A不选;B.该反应是放热反应且能自发的进行氧化还原反应,所以能设计成原电池,故B选;C.该反应不是氧化还原反应,所以不能设计成原电池,故C不选;故选B.
【分析】(1)同种元素形成的不同单质互为同素异形体;质子数相同质量数(或中子数)不同的原子互称同位素;具有相同分子式而结构不同的化合物互为同分异构体;组成和结构都相同的物质为同一物质,同一物质组成、结构、性质都相同,结构式的形状及物质的聚集状态可能不同;同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团的化合物,官能团数目和种类相等;(2)烷烃中出现乙基,则主链至少含有5个C,据此写出该有机物的结构简式;(3)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量书写中和热的热化学方程式;(4)能设计成原电池的反应通常是放热反应,且必须是能自发进行的氧化还原反应.
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
